Darstellung von Schwefel
Werbung

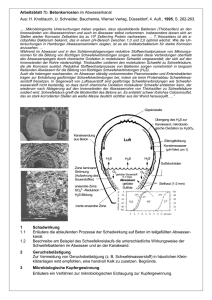
Philipps-Universität-Marburg Fachbereich Chemie Experimentalvortrag im Lehramt (Organik) Leitung: Dr. P. Reiss / Prof. Dr. B. Neumüller Protokollant: Alexander Achenbach Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html Experimentalvortrag zum Thema Schwefel Experimentalvortrag vom 11.07.2007 Alexander Achenbach Auf dem Wehr 23 35037 Marburg E-mail: [email protected] 1 Inhaltsverzeichnis 1. Theoretische Grundlagen ..................................................................................................... 1 1.1 Stellung im Periodensystem und chemisches Verhalten: ............................................... 1 1.2 Zustandsformen: ............................................................................................................. 2 1.3 Vorkommen in der Natur: .............................................................................................. 4 1.4 Gewinnung und Darstellung: ......................................................................................... 6 1.5 Wasserstoffverbindungen: .............................................................................................. 9 1.6 Sulfide: ......................................................................................................................... 11 1.7 Oxide: ........................................................................................................................... 13 1.8 Sauerstoffsäuren: .......................................................................................................... 17 2. Experimenteller Teil ........................................................................................................... 21 2.1 Demonstration 1: Monokline Schwefelkristalle: .......................................................... 21 2.2 Versuch 1: Schmelzen von Schwefel: .......................................................................... 22 2.3 Demonstration 2: Schwefelhaltige Mineralien: ............................................................ 24 2.4 Versuch 2: Darstellung von Schwefel: ......................................................................... 24 2.5 Versuch 3: Darstellung von Schwefelwasserstoff:....................................................... 29 2.6 Versuch 4: Reaktion mit Metallen: .............................................................................. 31 2.7 Versuch 5: Verbrennen von Schwefel: ......................................................................... 33 2.8 Versuch 6: Schwefeldioxid-Springbrunnen: ................................................................ 35 2.9 Demonstration 3: Zuckerkohle: .................................................................................... 37 2.10 Zusatz: Rauchgasentschwefelung (Kalksteinverfahren): ........................................... 39 3. Literaturverzeichnis ............................................................................................................ 42 4. Abbildungsverzeichnis ....................................................................................................... 43 4.1 Schriftliche Ausarbeitung ............................................................................................. 43 4.2 Powerpoint-Präsentation: ............................................................................................. 47 2 1. Theoretische Grundlagen 1.1 Stellung im Periodensystem und chemisches Verhalten: Der Schwefel ist ein Element der VI. Hauptgruppe oder der Gruppe 16 des Periodensystems. Die Elemente dieser Gruppe werden Chalkogene oder auch Erzbildner genannt, weil sie in Verbindung mit vielen Metallen als Rohstoff zu deren Gewinnung weit verbreitet in der Erdkruste vorkommen. chalkos (griech.) = Erz / gennan (griech.) = erzeugen Die Gruppe 16 des Periodensystems umfasst die Elemente Sauerstoff (O), Schwefel (S), Selen (Se), Tellur (Te) und das radioaktive Polonium (Po). Dabei gehört der Schwefel zusammen mit Sauerstoff zu den klassischen Nichtmetallen, während Selen und Tellur bereits Halbleitereigenschaften aufweisen und zu den Halbmetallen gezählt werden. Polonium ist ein Metall. Abb. 1: Stellung des Schwefels im PSE Die Chalkogene besitzen die Valenzelektronenkonfiguration s2p4 und erreichen durch Aufnahme von zwei Elektronen Edelgaskonfiguration. Die Elektronenkonfiguration von Schwefel ist [Ne] 3s2 3p4. Damit befindet sich Schwefel mit der Ordnungszahl 16 eine Periode höher als sein leichteres Homologes, der Sauerstoff. Im Gegensatz zu Sauerstoff können beim Schwefel d-Orbitale zur Bildung zusätzlicher Bindungen herangezogen werden. Diese Schalenerweiterung ermöglicht dem Schwefel auch höhere Koordinationszahlen. 1 1.2 Zustandsformen: Cyclooctaschwefel: Bei Normalbedingungen bildet Schwefel S8-Moleküle. In diesen Molekülen kommt den einzelnen Schwefelatomen sp3-Hybridisierung zu. Aufgrund der tetraedrischen Geometrie dieses Hybridorbitals, dessen einzelne Schenkel theoretisch einen Winkel von 109,47° einschließen, entsteht so ein gewellter 8-Ring mit sogenannter „Kronenform“. Der Winkel zwischen zwei S-Atomen im Ring beträgt in Wirklichkeit allerdings nur 108,0°. Die S-SBindungslänge liegt bei 205 pm. Abb. 2: Cyclooctaschwefel Der feste Zustand: Bei Normaltemperatur kristallisiert Schwefel im orthorhombischen (fälschlicherweise oft nur „rhombisch“) Kristallsystem. Dieser Zustandsform entspricht auch die handelsübliche Schwefelblüte, wie man sie im Labor aufbewahrt. Diese Modifikation ist also bei Normalbedingungen thermodynamisch stabil. Man spricht auch von α-Schwefel, der aus S8Molekülen (s.u.) besteht. Pro Elementarzelle sind in der orthorhombischen Modifikation 16 S8-Moleküle enthalten. Abb. 3: Orthorhombischer Schwefel Abb. 4: Monokliner Schwefel Erhitzt man diese Form des Schwefels, tritt bei 95,6 °C unter Vergrößerung des Volumens endotherme, reversible Umwandlung in eine weitere kristalline Modifikation auf, welche dem monoklinen Kristallsystem folgt. Man spricht von β-Schwefel, der ebenfalls aus S82 Molekülen besteht, diese sind jedoch in anderem Winkel und weniger dicht zueinander angeordnet. Lässt man monoklinen Schwefel auf unter 95,6 °C abkühlen, wandelt er sich innerhalb von Tagen wieder in orthorhombischen Schwefel um. Die nadelförmige äußere Gestalt der Kristalle bleibt allerdings erhalten. Abb. 5: Nadelförmige Kristalle monoklinen Schwefels Definition von Polymorphie: Liegt ein Stoff je nach Zustandsbedingungen (Temperatur und Druck) in unterschiedlichen, festen Zustandsformen vor spricht man von Polymorphie oder polymorphen Modifikationen. Der flüssige Zustand: Bei 119,6 °C schmilzt der monokline Schwefel. Man erhält eine hellgelbe, dünnflüssige Schmelze, den sogenannten -Schwefel. Dieser enthält ebenfalls S8-Ringe. Kühlt man sofort wieder ab, erstarrt die Schmelze wieder bei 119,6 °C zu monoklinem Schwefel. Hält man den Schwefel allerdings einige Stunden knapp über dem Schmelzpunkt und kühlt danach ab, beobachtet man einen Erstarrungspunkt von 114,5 °C. Es ist also eine Gefrierpunktserniedrigung eingetreten, welche auf die Entstehung anderer Moleküle in der Schmelze hindeutet. Neben dem Cyclooctaschwefel entstehen in der Schmelze niedermolekulare, von 8 verschiedene, Ringmoleküle. Diese niedermolekularen Ringe Sn (n = 6, 7, 9, 12 – 30) nennt man -Schwefel. Erhöht man die Temperatur über 120 °C hinaus, bilden sich zunehmend hochmolekulare Schwefelketten Sx oder -Schwefel (x = 103 – 106), wodurch die Schmelze zunehmend viskoser wird und sich die Farbe über rot nach dunkelbraun vertieft. Etwa bei 159,0 °C steigt diese Viskosität sprunghaft an und erreicht bei 243,0 °C ein Maximum. Grund ist die Verschiebung der Gleichgewichte zwischen λ-, π- und μ-Schwefel nach rechts: 3 -Schwefel -Schwefel -Schwefel Abb. 6: Schwefel bei 20 °C / 119°C / 159°C / 444 °C Oberhalb von 243,0 °C verzeichnet man eine Abnahme der Viskosität, welche auf die Abnahme der durchschnittlichen Kettenlänge des -Schwefel-Anteils zurück zu frühren ist. Kühlt man die Schmelze bei einer Temperatur oberhalb des Viskositätsmaximums ab, indem man die Flüssigkeit in kaltes Wasser gießt, erhält man eine unterkühlte Schmelze von zäher, elastischer Konsistenz. Dabei spricht man von „plastischem Schwefel“. Der gasförmige Zustand: Bei 444,6 °C siedet Schwefel. Die gasförmige Phase besteht bei dieser Temperatur zu etwa 90 % aus S6-, S7- und S8-Molekülen. Erhitzt man auf 700 °C, besteht ein erheblicher Anteil des Gases aus S2-Molekülen. Erst bei etwa 2200 °C dominieren Schwefel-Atome. Definition von Allotropie: Treten Elemente innerhalb eines Aggregatzustandes in verschiedenen Molekülsorten auf, spricht man von Allotropie oder „allotropen Modifikationen“. 1.3 Vorkommen in der Natur: Schwefel ist etwa 1000mal seltener als Sauerstoff und macht somit 0,048 Massenprozent der Erdkruste aus. Damit steht der Schwefel auf der Liste der am häufigsten auf der Erde vorkommenden Elemente auf Platz 15. Schwefel kommt in der Natur sowohl in elementarem als auch in gebundenem Zustand vor. Elementarer Schwefel kommt in mächtigen Lagerstätten vor. Diese können oberflächlich gut erreichbar sein, wie es meist in vulkanisch aktiven Gebieten der Fall ist, oder auch in großer Tiefe verborgen liegen. Solche Vorkommen elementaren Schwefels finden sich auf Sizilien, in Louisiana und Texas aber auch in Mexiko 4 (Golf von Mexiko), Peru, Chile als auch in Japan (Hokkaido) und in Polen. Anorganisch gebundener Schwefel findet sich hauptsächlich in den beiden Mineralgruppen der Sulfide und der Sulfate. Die häufigsten Sulfide sind: Eisenkies (Pyrit) FeS2 Kupferkies (Chalkopyrit) CuFeS2 Arsenkies (Arsenopyrit) FeAsS Bleiglanz (Galenit) PbS Kupferglanz (Chalkosin) Cu2S Zinkblende (Sphalerit) ZnS Zinnober (Cinnabarit) HgS Realgar (Rauschrot) As4S4 Auripigment (Rauschgelb) As2S3 Die häufigsten Sulfate: Calciumsulfat (Selenit / Anhydrid) CaSO4 . 2 H2O / CaSO4 Magnesiumsulfat (Bittersalz / Kieserit) MgSO4 . 7 H2O / MgSO4 . H2O Bariumsulfat (Schwerspat) BaSO4 Strontiumsulfat (Cölestin) SrSO4 Natriumsulfat (Glaubersalz) Na2SO4 . 10 H2O Einige der erwähnten Mineralien: Abb. 7: Mineral 1: Pyrit Abb. 8: Mineral 2: Galenit Abb. 9: Mineral 3: Sphalerit 5 Abb. 10: Mineral 4: Realgar Abb. 11: Mineral 5: Baryt Abb. 12: Mineral 6: Cölestin Organisch gebundener Schwefel: Organisch gebundener Schwefel erfüllt auch in der Bioshäre seinen Zweck in Form schwefelhaltiger Aminosäuren. Von den zwanzig existierenden Aminosäuren enthalten zwei Schwefel: Cystein und Methionin. O O OH HS H3C S NH2 NH2 Abb. 13: Cystein OH Abb. 14: Methionin Aufgrund der unersetzbaren Rolle der Aminosäuren für die Biologie sind diese schwefelhaltigen Verbindungen in allen Reichen des Lebendigen vorhanden. Der üble Geruch nach faulen Eiern, der bei der Verwesung von Tierkadavern auftritt rührt z.B. von H2S (Schwefelwasserstoff) oder R-SH (Mercaptanen) her. Schwefel oder Schwefelverbindungen sind aus diesen Gründen auch in allen fossilen Brennstoffen (Kohlen und Erdöl) enthalten, da diese durch Sedimentation organischen Planktons oder Ablagerungen von Wäldern und anschließender Diagenese entstanden sind. 1.4 Gewinnung und Darstellung: In der Technik gewinnt man Schwefel entweder durch Einsatz chemischer Prozesse, wie die Oxidation von Schwefelwasserstoff beziehungsweise die Reduktion von Schwefeldioxid, oder man bedient sich natürlichen Vorkommen elementaren Schwefels. 6 Gewinnung von Naturschwefel: 1990 machte die Gewinnung von Naturschwefel noch einen Anteil von ca. 40 % der Weltproduktion aus. Heute hat diese stark an Bedeutung eingebüßt. Die USA haben die Produktion 2001 wegen Unwirtschaftlichkeit beendet, in Polen war 2003 noch eine Mine in Betrieb. Die Förderung solcher geologischer Vorkommen wird durch das sogenannte FraschVerfahren verwirklicht, welches im Jahre 1900 von dem deutsch-amerikanischen Chemiker Hermann Frasch (1851-1914) entwickelt wurde. Abb. 15: Hermann Frasch Abb. 16: Schema Frasch-Verfahren Beim Frasch-Verfahren werden unterirdische Schwefelvorkommen in regelmäßigen Abstanden angebohrt. Man treibt etwa 25 cm dicke Rohre bis in das schwefelführende Speichergestein, die in ihrem Inneren zwei weitere Rohre von 15 cm und 7,5 cm Durchmesser enthalten. Durch das äußere Rohr presst man unter einem Druck von 25 bar überhitztes Wasser von 155 °C nach unten, während man durch eines der inneren Rohre Pressluft mit einem Druck von 40 bar nach unten schickt. Durch den Einsatz von ca. 12 m3 Wasser wird so etwa 1 t Schwefel geschmolzen und mittels Überdruck nach oben befördert, wo man ihn erstarren lässt oder direkt flüssig weiter befördert. 7 Abb. 17: Frasch-Verfahren Oxidation von Schwefelwasserstoff: In den letzten Jahrzehnten hat die technische Gewinnung von Schwefel aus Schwefelwasserstoff immer mehr an Bedeutung gewonnen. Schwefelwasserstoff fällt in großem Maßstab bei der Aufbereitung von Kohle und Erdöl an. Auch bei der Erdölentschwefelung (siehe unten) fällt Schwefelwasserstoff an, außerdem ist dieser Stoff in Anteilen in Erdgas vorhanden. Das Verfahren in dem Schwefel aus Schwefelwasserstoff gewonnen wird heißt Claus-Prozess. Dabei handelt es sich um ein zweistufiges Verfahren, bei dem zunächst in einer Brennkammer ein Teil des eingesetzten Schwefelwasserstoffs mit Sauerstoff in einer exothermen Reaktion verbrannt wird. Das dabei anfallende gasförmige Schwefeldioxid wird dann in einem Reaktor, unter Verwendung eines Co/Mo-Katalysators, mit dem restlichen Schwefelwasserstoff in einer weniger exothermen Reaktion umgesetzt. Grund der Zerlegung der Gesamtreaktion in zwei Schritte ist die bessere Beherrschbarkeit der freiwerdenden Verbrennungsenthalpie. H2S (g) + 3/2 O2 (g) SO2 (g) + H2O + 518,37 kJ SO2 (g) + 2 H2S (g) 3 3 H2S (g) + 3/2 O2 (g) /8 S8 (s) + 2 H2O (g) + 145,66 kJ 3 /8 S8 (s) + 3 H2O + 664,03 kJ Reduktion von Schwefeldioxid: Schwefeldioxid fällt in großen Mengen z.B. beim Abrösten sulfidischer Erze an, ein Verfahren bei dem das entstandene Schwefeloxid auch zur Produktion von Schwefelsäure weiterverarbeitet werden kann (siehe unten). 8 Elementaren Schwefel kann man erzeugen, indem man Kohlenstoff in Form von Koks einsetzt. Die Stoffe werden zur Reaktion gebracht, indem man Schwefeldioxid in einen Generator einbläst, der zuvor mit Koks beschickt worden ist. Es erfolgt Reduktion zu Schwefeldampf. CO2 (g) + 1/8 S8 (g) SO2 (g) + C (s) 1.5 Wasserstoffverbindungen: Schwefelwasserstoff (Sulfan): Schwefelwasserstoff findet man im Erdöl und Erdgas. Außerdem entweicht es in vulkanisch aktiven Gebieten häufig aus Erdspalten. Beim Schwefelwasserstoff handelt es sich um ein farbloses, sehr giftiges, nach faulen Eiern riechendes, Gas. Abb. 18: Vulkanische Gase Abb. 19: Struktur: Monosulfan Der Schwefel im Molekül ist sp3-hybridisiert, wobei der HSH-Winkel 92,3 ° beträgt. In 1 Liter Wasser lösen sich bei 20 °C 2,61 Liter des Gases. Die Lösung nennt sich dann Schwefelwasserstoffwasser. Der Schmelzpunkt liegt bei –85,6 °C, der Siedepunkt bei –60,3 °C. Flüssiger Schwefelwasserstoff ist wie Wasser ein wichtiges anorganisches Lösungsmittel. In der Technik kann Schwefelwasserstoff aus seinen Elementen synthetisiert werden. Dabei werden die beiden Elemente bei 600 °C an einem Katalysator vorbeigeleitet. H2 (g) + 1/8 S8 (g) H2S (g) + 20,6 kJ 9 Im Labor wird er aus seinen Salzen den Sulfiden dargestellt. Die gängigste Variante ist es, das Gas im Kippschen Apparat frei zu setzten, indem man konzentrierte Salzsäure auf Eisensulfid gibt. FeS (s) + 2 HCl (aq) FeCl2 (s) + H2S (g)↑ Oberhalb von 1000 °C beginnt sich Schwefelwasserstoff thermolytisch in seine Elemente zu zersetzen. Entzündet man das Gas verbrennt es an Luft, je nach Sauerstoffangebot: H2S (g) + 1/2 O2 (g) H2O + 1/8 S8 (g) bzw. H2S (s) + 11/2 O2 (g) H2O + SO2 (g) Schwefelwasserstoff verhält sich in wässriger Lösung wie eine sehr schwache Säure. H2S(aq) H+(aq) + HS-(aq) K1= 1,02 . 10-7 HS-(aq) H+(aq) + S2-(aq) K2= 1,3 . 10-13 Die Dissoziationskonstanten sind mit K1 = 1,02 . 10-7 und K2 = 1,3 . 10-13 sehr klein. Daraus ergibt sich eine Gesamtdissoziation von gerade K = K1 . K2= 1,3 . 10-20. Gemäß dieses SäureBase-Verhaltens bildet Schwefelwasserstoff zwei Reihen von Salzen: Die Hydrogensulfide (saure Sulfide) und die Sulfide. Schwefelwasserstoff wird in der Analyse eingesetzt, um Metall-Kationen in Form ihrer Sulfide nachzuweisen (siehe Sulfide). Polyschwefelwasserstoffe (Polysulfane): Alle Polysulfane weisen bezüglich des Zerfalls zu Monosulfan und Schwefel eine gewisse thermodynamische Instabilität auf. H2Sn H2S + n-1 S Erwähnenswerte Polysulfane sind z.B. der Dischwefelwasserstoff H2S2, der eine farblose Flüssigkeit darstellt, die bei 70,7 °C siedet und die Schleimhäute stark reizt oder der Tetraschwefelwasserstoff H2S4, eine kräftig gelbe Flüssigkeit, die stechend riecht und um –85 °C glasig erstarrt. Alle Polysulfane lösen sich gut in CS2. 10 1.6 Sulfide: Wie bereits erwähnt bildet Schwefelwasserstoff mit dem enthaltenden Sulfid-Ion zwei Reihen von Salzen: Die Hydrogensulfide mit dem Anion HS- und die Sulfide mit dem Anion S2-. Sulfide besonders elektropositiver Metalle wie z.B. Na2S sind ionisch aufgebaute Stoffe, da die Differenz der Elektronegativitäten groß genug ist. Auch mit den meisten Übergangsmetallen bildet Schwefel Sulfide, dabei handelt es sich jedoch um Molekülkristalle, also solche, in denen der kovalente Charakter der Bindungen überwiegt. Viele dieser Metallsulfide sind wichtige Erze, die auch industriell zur Metallproduktion genutzt werden. Ausfällen von Metallsulfiden: Viele Metallsulfide sind schwerlösliche Verbindungen, die bereits aus saurer, Metallkationen enthaltender Lösung durch Einleiten von Schwefelwasserstoff ausgefällt werden können, was man sich in der Analyse zunutze macht. Bei einem pH-Wert von 0 beträgt die Konzentration der Sulfid-Ionen S2- etwa 10-21 mol/L, wenn die Lösung an Schwefelwasserstoff gesättigt ist. Im Kationentrennungsgang der qualitativen Analyse fallen innerhalb der Schwefelwasserstoffgruppe aus: As2S3↓ Sb2S3↓ SnS↓ (gelb) (orange) (braun) HgS↓ PbS↓ Bi2S3↓ CuS↓ CdS↓ (schwarz) (schwarz) (dunkelbraun) (schwarz) (gelb) Besserlösliche Sulfide fallen erst aus ammoniakalkalischer Lösung aus, wenn die S2--Konzentration der an Schwefelwasserstoff gesättigten Lösung wesentlich größer ist: NiS↓ CoS↓ FeS↓ MnS↓ ZnS↓ (schwarz) (schwarz) (schwarz) (rosa) (weiß) 11 Abb.20: Ausgefällte Metallsulfide Schwefel und Metalle: Schwefel reagiert direkt mit vielen Metallen. In diesen exothermen Redoxreaktionen wird das Metall durch den Schwefel oxidiert. Produkte dieser oft unter farbenfroher Feuererscheinung ablaufenden Reaktionen sind Metallsulfide. Interessant ist der Vergleich der Reaktionen verschiedener Metalle mit Schwefel. Während man Reaktionsgemische von beispielsweise Kupfer mit Schwefel recht stark erhitzen muss bis die Reaktion einsetzt, gestaltet sich das Aktivieren der Reaktionen von Zink oder gar Magnesium mit Schwefel sehr leicht durch beispielsweise einen Funken. Abb. 21: Energiediagramm der Metallsulfidbildung Grund dafür ist die Stellung der beteiligten Metalle im Periodensystem und dem damit verbundenen edlen oder unedlen Charakter. Dabei benötigt der Anstoß der Reaktion von Schwefel mit dem relativ edlen Kupfer sehr viel Aktivierungsenergie. Wurde diese aufgebracht, läuft die trotzdem exotherme Reaktion von selbst ab. Reaktionen mit unedleren Metallen wie Zink benötigen hingegen viel weniger Aktivierungsenergie und laufen wegen 12 der größeren, freiwerdenden Energiemenge auch heftiger ab. Hinsichtlich dieser Betrachtung kann man für die Heftigkeit der Reaktionen von Metallen mit Schwefel, schon mittels einfacher experimenteller Beobachtungen, eine Reihe aufstellen: Reaktionsenergie Silber < Kupfer < Eisen < Zink < Magnesium Aktivierungsenergie: Magnesium < Zink < Eisen < Kupfer < Silber Cu (s) + 1/8 S8 (s) CuS (s) + 53,2 kJ Zn (s) + 1/8 S8 (s) ZnS (s) + 201,0 kJ 1.7 Oxide: Schwefel bildet Oxide verschiedener Zusammensetzungen, wobei man zwischen niedermolekularen und hochmolekularen unterscheidet. Die niedermolekularen entsprechen den Zusammensetzungen SOm (m = 1,2,3,4), SnO (n = 2, 5-10) oder SnO2 (n = 2, 7). Hochmolekulare Oxide des Schwefels entsprechen den Zusammensetzungen (SnO)x oder (SO3-4)x. Dabei existieren Oxide, in denen der Schwefel Oxidationsstufen von unter +1 bis +6 erreicht. Wenige Beispiele seinen hier angeführt: Oxidationsstufe Formel Name < +1 S5O Pentaschwefelmonoxid +1 S2O Dischwefelmonoxid +2 SO Schwefelmonoxid +4 SO2 Schwefeldioxid +6 SO3 Schwefeltrioxid +6 SO4 Schwefeltetraoxid Schwefelmonoxid, Schwefeltetraoxid und Dischwefelmonoxid stellen in der Technik lediglich instabile Zwischenprodukte dar. Von großer technischer Bedeutung sind nur Schwefeldioxid und Schwefeltrioxid, die im Folgenden genauer betrachtet werden sollen: 13 Schwefeldioxid: Schwefeldioxid ist ein farbloses, stechend riechendes, giftiges und nicht brennbares, korrodierendes Gas. Schwefeldioxid lässt sich leicht zu einer farblosen Flüssigkeit verdichten, die bei –75,5 °C erstarrt und bei – 10,0 °C siedet. Die Wasserlöslichkeit ist gut. Bei 0 °C lösen sich in 1 Liter Wasser rund 80 Liter Schwefeldioxid, bei 20 °C immerhin noch 40 Liter. Das SO2-Molekül ist gewinkelt und isoelektronisch zu ClO2-. Die Geometrie ergibt sich aus dem VSEPR-Konzept (valence-shell-elektron-pair-repulsion). Dabei beträgt der OSO-Winkel 119,8 ° und entspricht damit der Geometrie eines sp2-hybridisierten Schwefelatoms. Die SOBindungslänge von 143 pm (Berechnung für SO-Einfachbindung = 170 pm) beweist die Existenz von SO-Doppelbindungen. Abb. 22: Lewis-Formel Schwefeldioxid / Bindungen Technisch erhält man Schwefeldioxid am einfachsten durch Verbrennen von Schwefel. Ebenfalls bedeutend ist das Abrösten sulfidischer Erze wie Pyrit. 1 SO2 (g)↑ + 297,03 kJ /8 S8 (s) + O2 (g) 2 FeS2 (s) + 51/2 O2 (g) Fe2O3 (s) + 4 SO2 (g)↑ + 1655 kJ Im Labor erhält man Schwefeldioxid indem man Natriumhydrogensulfit mittels konzentrierter Schwefelsäure entwässert. Da Schwefeldioxid das Anhydrid der schwefeligen Säure darstellt, muss dieser das Wasser entzogen werden. NaHSO3 (s) + H2SO4 (aq/l) „H2SO3“ H2O + SO2 (g)↑ „H2SO3“ + NaHSO4 (s) (Zu schwefeliger Säure siehe: Sauerstoffsäuren) 14 Durch das Vorhandensein schwefelhaltiger Verbindungen in fossilen Brennstoffen (siehe Vorkommen) stellen die Abgase der entsprechenden Verfeuerungsanlagen enorme Umweltbelastungen dar, weil sie das giftige Verbrennungsprodukt Schwefeldioxid in die Luft freisetzen. Trotz verschiedener Maßnahmen, dieses giftige Gas aus den Abgasen zu entfernen, werden in großen Städten Konzentrationen von 0,1 ppm erreicht. Ein Verfahren, welches sich mit der Entschwefelung von Rauchgas (kurz: Rauchgasentschwefelung) beschäftigt ist das sogenannte Kalksteinverfahren. Beim Kalksteinverfahren bläst man in die nach oben strömenden Rauchgase eine fein zerstäubte Suspension aus Wasser und Kalk ein. Dabei bildet sich Hydrogensulfit, welches anschließend mit Luftsauerstoff zu Hydrogensulfat oxidiert wird. Der so gebildete REA-Gips (REA: Rauchgas-Entschwefelungs-Anlage) findet in der Bauindustrie Verwendung. SO2 (g) + H2O HSO3-(aq) + H+(aq) CaCO3 (s) + 2 H+(aq) Ca2+(aq) + H2O + CO2 (g)↑ 2 HSO3-(aq) + O2 (g) 2 HSO4-(aq) 2 HSO4-(aq) + Ca2+(aq) + CaCO3 (s) + 3 H2O 2 CaSO4 . 2 H2O (s)↓ + CO2 (g)↑ Schwefeltrioxid: In gasförmigem Zustand bildet Schwefeltrioxid planare SO3-Moleküle, die weitgehend monomer, jedoch im Gleichgewicht mit dem Trimer (SO3)3, vorliegen. Die OSO-Winkel betragen genau 120 ° und der kurze Abstand zwischen Schwefel- und Sauerstoffatomen weist auf die Existenz von Doppelbindungen hin. Das Schwefelatom im Monomer ist sp2hybridisiert, die kurzen S-O-Bindungslängen von 143 pm sprechen für das Vorliegen von pund d-Doppelbindungen. 15 Abb. 23: Lewis-Formel Schwefeltrioxid / Bindungen Schwefeltrioxid kommt in drei Modifikationen vor. Kühlt man die Gasphase schnell auf unter –80 °C ab, bildet sich die eisartige -SO3, welches bei 16,86 °C schmilzt und bei 44,45 °C siedet. Diese kristalline Modifikation besteht aus gewellten (SO3)3-Molekülen. Die Schwefelatome sind dabei verzerrt tetraedrisch von Sauerstoffatomen umgeben. Bewahrt man Schwefeltrioxid längere Zeit unter 20 °C auf bilden sich die asbestartigen Modifikationen -SO3 und -SO3. Eine Mischung der beiden ist auch im Handel erhältlich und ist an den typischen verfilzten Nadeln erkennbar. -SO3 besteht aus kettenförmigen Molekülen. Die Struktur von -SO3 ist der von -SO3 ähnlich. Schwefeltrioxid stellt das Anhydrid der Schwefelsäure dar und verbindet sich unter starker Wärmeentwicklung und Zischen zu dieser. -SO3 (s) + H2O H2SO4 (l) + 73,69 kJ Außerdem ist Schwefeltrioxid ein starkes Oxidationsmittel und überführt z.B. S8 in SO2 oder H2S in S8. Als starke Lewis-Säure bildet Schwefeltrioxid mit vielen Lewis-Basen Addukte. Seine Löslichkeit ist wegen der heftigen Reaktion (s.o.) in Wasser schlecht. Gut löst es sich hingegen in konzentrierter Schwefelsäure unter Bildung von Oleum. Die Darstellung von Schwefeltrioxid erfolgt durch das Kontaktverfahren. Schwefeltrioxid kann nicht durch direkte Oxidation von Schwefel erzeugt werden, da bereits die Reaktion zu Schwefeldioxid soviel Energie freisetzt, dass das Gleichgewicht der Weiterreaktion von Schwefeldioxid mit Sauerstoff sehr weit auf die Eduktseite verschoben wird. 16 1 /8 S8 (s) + O2 (g) SO2 (g) + 297, 0 kJ SO2 (g) + 1/2 O2 (g) SO3 (g) + 99,0 kJ Wegen der exothermen Reaktion muss die Reaktionstemperatur einerseits so niedrig gewählt werden, dass das Gleichgewicht nicht zu negativ beeinflusst wird, andererseits wird eine gewisse Wärmeenergie zur ausreichenden Reaktionsgeschwindigkeit benötigt. Man führt die Reaktion in der Technik bei ca. 450 °C durch und erhöht die Ausbeute durch Einsatz eines Katalysators. Divanadiumpentaoxid V2O5 (s) erfüllt die Aufgabe mittels seiner sauerstoffübertragenden Wirkung. V2O5 (s) + SO2 (g) V2O4 (s) + SO3 (g) V2O4 (s) + 1/2 O2 (g) V2O5 (s) 1.8 Sauerstoffsäuren: Schwefel bildet drei Sauerstoffsäuren der Formel H2SOn (n = 3, 4, 5), sechs Sauerstoffsäuren der Formel H2S2On (n = 3, 4, 5, 6, 7, 8). Außerdem existieren mehrere Sauerstoffsäuren der Formeln H2SnO3, H2SnO6 und H2SnO3n+1. Die folgende Tabelle gibt einen Überblick: Typus H2SOn Oxidationsstufe Formel Typus Name (Salz) H2S2On Name (Salz) Formel +2 H2SO2 Sulfoxylsäure H2S2O3 (Sulfoxylate) +3 Thioschwefelsäure (Thiosulfate) H2S2O4 Dithionige Säure (Dithionite) +4 H2SO3 Schwefelige Säure H2S2O5 (Sulfite) +5 Dischwefelige Säure (Disulfite) H2S2O6 Dithionsäure (Dithionate) +6 H2SO4 Schwefelsäure (Sulfate) H2S2O7 Dischwefelsäure (Disulfate) 17 +6 H2SO5 Peroxoschwefelsäure H2S2O8 Peroxodischwefelsäure (Peroxosulfate) (Peroxodisulfate) Da in diesem Experimentalvortrag die Anhydride Schwefeldioxid und Schwefeltrioxid behandelt werden sollen im Folgenden die dazugehörigen Säuren, also die schwefelige Säure und vor allem auf die Schwefelsäure eingegangen werden. Schwefelige Säure: Leitet man das Anhydrid der schwefeligen Säure Schwefeldioxid in Wasser reagiert die Lösung sauer. Hypothetisch ist schwefelige Säure H2SO3 entstanden. Allerdings ist es bisher nicht gelungen, diese Säure als reinen Stoff zu isolieren, was den Verdacht erhärtet, dass in wässriger Lösung keine nicht-protolysierte H2SO3 existiert. In 1 L Wasser lösen sich bei 15 °C etwa 45 L Schwefeldioxid. Die Lösung regiert sauer: Erste Protolyse (Gashydrat): SO2 . n H2O HSO3-(aq) + H3O+(aq) + (n-2)H2O KS 1= 10-2 mol/L Abb. 24: Säurewirkung des Gashydrats Die zweite Protolyse geschieht analog zu der von Hydrogensulfat zu Sulfat: HSO3-(aq) + H2O SO32-(aq) + H3O+(aq) KS 2= 10-7 mol/L Von der hypothetisch existierenden schwefeligen Säure leiten sich zwei Reihen von Salzen ab, die Hydrogensulfite mit dem Anion HSO3- und die Sulfite mit dem Anion SO32-. Bei 18 höheren Konzentrationen entsteht Disulft S2O52-, jedoch kann die Dischwefelige Säure ebenfalls nicht als reiner Stoff dargestellt werden. Schwefelsäure: Schwefelsäure ist eine farblose, ölige Flüssigkeit, die bei 10 °C erstarrt und bei 280 °C siedet. Sie gehört zu den wichtigsten großtechnischen Erzeugnissen der Chemieindustrie und wird in großem Maßstab dargestellt. Im Handel ist Schwefelsäure in konzentrierter Form erhältlich. Die Konzentration liegt dann etwa bei 98 %, sie siedet azeotrop bei 338 °C. Übersättigt man Schwefelsäure an Schwefeltrioxid spricht man von rauchender Schwefelsäure oder Oleum. Die Darstellung erfolgt heute nach dem Kontaktverfahren (siehe oben). Das so erhaltene Schwefeltrioxid leitet man in verdünnte Schwefelsäure. Die dabei gebildete Dischwefelsäure reagiert mit Wasser weiter zu zwei Molekülen Schwefelsäure: SO3 (g) + H2SO4 (aq) H2S2O7 (aq) H2S2O7 (aq) + H2O 2 H2SO4 (aq) Bei der Schwefelsäure handelt es sich um eine zweiprotonige Säure. In Wasser deprotoniert sie in zwei Stufen und bildet dabei die Anionen Hydrogensulfat und Sulfat, sie bildet also zwei Reihen von Salzen. Der Protolysegrad ist in beiden Schritten beträchtlich: H2SO4 (aq) + H2O HSO4-(aq) + H3O+(aq) pKs= -3,0 HSO4-(aq) + H2O SO42-(aq) + H3O+(aq) pKs= +1,96 Abb. 25: Das Sulfat-Ion 19 Schwefelsäure enthält das tetraedrisch aufgebaute Sulfat-Ion. In Ihm ist der Schwefel sp3hybridisiert. Des Weiteren sorgen zwei 3d-Orbitale für die Betätigung der beiden Bindungen. Jedoch besitzen alle vier Bindungen eine Länge von 151 pm. Wasserentziehende Wirkung: Konzentrierte Schwefelsäure wirkt verkohlend auf viele organische Stoffe. Sie entzieht der Verbindung die Elemente des Wassers. CmH2nOn m C + n H2 O Abb. 26: Wasserentziehende Wirkung an Saccharose Lässt man Schwefelsäure in Wasser einlaufen bilden sich verschiedene Hydrate der Schwefelsäure. Pro Mol Säure wird dabei die Wärmeenergie von 95,3 kJ frei. Hydrate wie: H2SO4 . 2 H2O = [H3O]2+[SO4]2- oder H2SO4 . 3 H2O = [H3O]+[H5O2]+[SO4]2- 20 2. Experimenteller Teil 2.1 Demonstration 1: Monokline Schwefelkristalle: Chemikalien: Schwefelblüte 30 g R: - S: - Gefahrensymbol: - Geräte: Dreifuss Glasstab Asbestdrahtnetz Tiegelzange Bunsenbrenner Uhrglas 2 Porzellanschalen Versuchsaufbau: Abb. 27: Versuchsaufbau: Monokline Schwefelkristalle Versuchsdurchführung und Beobachtungen: Porzellanschale mit Schwefelpulver füllen, mit einem Uhrglas bedecken (damit er sich nicht entzündet) und auf das Asbestdrahtnetz stellen. Mit dem Brenner wird von unten erhitzt, wenn der Schmelzprozess einsetzt etwas gelinder als zuvor. Die Schmelze soll den Schmelzpunkt von 119,6°C möglichst wenig überschreiten! Solange Schwefel nachgeben, bis die Schale zu 2 /3 mit Schmelze gefüllt ist. Dann lässt man abkühlen (kann mit kaltem Fön beschleunigt 21 werden). Beim Unterschreiten des Schmelzpunktes bilden sich vom Rand her nadelförmige, monokline Kristalle. Diese lässt man nicht bis ganz zur Mitte wachsen. Zuvor sticht man mit dem Glasstab nahe des Rades ein Loch in die Oberflächenkruste und kippt die überschüssige Schmelze in die andere Porzellanschale ab (Abfall)! Entsorgung: Ist der Schwefel wieder erkaltet lässt er sich gut aus runden Porzellanschalen entfernen. Der Brocken kann mit Hammer und Mörser zerkleinert und pulverisiert werden, um ihn wieder zu verwenden. Ansonsten: Abfall für mindergiftige Feststoffe! 2.2 Versuch 1: Schmelzen von Schwefel: Chemikalien: Schwefelblüte 10 g R: - S: - Gefahrensymbol: - Geräte: Reagenzglas (schwer schmelzbar) Tiegelzange Reagenzglasklammer Kristallisierschale Bunsenbrenner Uhrglas Becherglas 500 ml zu 2/3 mit Wasser gefüllt 22 Versuchsaufbau: Abb. 28: Versuchsaufbau: Schmelzen von Schwefel Versuchsdurchführung und Beobachtungen: Das Reagenzglas wird mit obigen Mengen Schwefelblüte befüllt (etwa zu ¾). Das sieht aus, als wäre es zuviel, aber beim Schmelzen bleiben etwa nur 2/5 des Volumens übrig. Man lässt das Reagenzglas nur in der Nähe der Flamme kreisen, denn die Schmelze soll zunächst hellgelb und dünnflüssig bleiben. Erhitzt man etwas stärker beobachtet man eine zunehmende Rotfärbung, dabei ist die Schmelze nicht mehr ganz so dünnflüssig. Erhitzt man weiter wird die Schmelze braun bis schwarz, während die Viskosität sprunghaft zunimmt, sodass man das Reagenzglas umdrehen kann, ohne dass Schmelze herausläuft. Es wird kräftig weiter erhitzt. Am oberen Rand des Glases kondensiert gelbe Schwefelblüte aus der Gasphase. Die Schmelze wird wieder dünnflüssiger, während man sich dem Siedepunkt nähert. Achtung: Sollte der Schwefel Feuer fangen, einfach mit Uhrglas abdecken! Nachdem der Schwefel einige Sekunden siedet, wird die Flüssigkeit Langsam in das kalte Wasser geschüttet. Im Becherglas erstarrt eine hellbraune, plastisch verformbare Masse (plastischer Schwefel), der mit der Tiegelzange zur Demonstration auf die Kristallisierschale gegeben werden kann! Entsorgung: Der entstandene plastische Schwefel ist ungiftig und kann nach Abtropfen als mindergiftiger Feststoff entsorgt werden. 23 2.3 Demonstration 2: Schwefelhaltige Mineralien: Es wurden verschiedene schwefelhaltige Mineralien gezeigt: Elementar: Sulfide: Sulfate: Schwefel (gediegen) S8 Pyrit, Schwefelkies Selenit, Gips (Eisensulfid) FeS2 (Calciumsulfat) CaSO4. 2 H2O Galenit, Bleiglanz Cölestin (Bleisulfid) PbS (Strontiumsulfat) SrSO4 Chalkopyrit, Kupferkies Baryt, Schwerspat (Eisen-Kupfersulfid) CuFeS2 (Bariumsulfat) BaSO4 Sphalerit, Zinkblende (Zinksulfid) ZnS Chalkosin, Kupferglanz (Kupfersulfid) Cu2S Angesprochen wurde die Struktur des Pyrits und die Rolle der S2--Ionen im Gitter sowie die Zinkblende-Struktur. Des Weiteren wurde kurz die Elektronegativität der in den Mineralien vorhandenen Elemente eingegangen und auf das daraus folgende Resultat, ob es sich um Ionen- oder Molekülkristalle handelt. Bei den Sulfiden handelte es sich um Leihgaben des mineralogischen Museums der PhilippsUniversität Marburg (Museumsleitung: Prof. Dr. Peter Masberg). 2.4 Versuch 2: Darstellung von Schwefel: Chemikalien: H2S-Entwickler: FeS (s) R: - S: - Gefahrensymbol: - HCl (aq) (w = 0,35) R: 34-37 S: 26-45 Gefahrensymbol: C H2S (s) R: 12-26-50 S: 1/2-9-16-36-38-45- Gefahrensymbol: ( Zwischenprodukt) 61 T+, F+, N 24 SO2-Entwickler: NaHSO3 (s) 13,9 g R: 22-31 S: 25-46 Gefahrensymbol: Xn H2SO4 (w = 0,96) R: 35 S: 26-30-45 Gefahrensymbol: C SO2 R: 23-34 S: 1/2-9-26-36/37/39- Gefahrensymbol: T (für ca. 3L Gas) (Zwischenprodukt) KI-Lösung 45 R: - S: - Gefahrensymbol: - Geräte: Reaktionsapparatur: U-Rohr mit Schlauchstutzen, 125 mm 2 PVC Schlauchstücke (dünn) 20 cm 2 Kolbenprober 100 ml mit Dreiwegehahn PVC Schlauch 5 cm für H2S-Kolbenprober und Haltevorrichtung (siehe Aufbau) 2 Gummistopfen NS 19 Schwefelwasserstoff-Entwickler: Reagenzglas Tropfpipette Gummistopfen durchbohrt Bunsenbrenner Glasrohr (10 cm) gewinkelt Bleiacetatpapier PVC Schlauch 25 cm (evtl. dick und dünn) 2 Schlauchschellen mit Handrad Schwefeldioxid-Entwickler (kann aus SO2-Springbrunnen übernommen werden): Dreihalsrundkolben 1000 ml Stickstoffkolben 250 ml Glasschliffstopfen mit Schliff NS 29 PVC Schlauch 25 cm (evtl. dick und dünn) Hülse mit Schliff NS 29 auf NS 14 4 Schlauchschellen mit Handrad Tropftrichter 100 ml mit Druckausgleich und Messpipette 10 ml Schliff NS 14 2 Hahn mit Kern NS 29 Peleusball Glasschliffstopfen NS 14 Indikatorpapier Korkring für 1000 ml Kolben Spritzflasche Rührfisch 4 cm Becherglas 500 ml (Absorbtion)! 25 Stativmaterial Versuchsaufbau: Schwefeldioxid-Entwickler: Darauf achten, dass der Hahn des Tropftrichters zu Beginn geschlossen ist! Glasschliffstopfen NS 14 auf Tropftrichter aufsetzen, aber nicht mit Keckklemme befestigen. Zuvor im gut überlegen, wie man das Gas aus dem Vorlagekolben am einfachsten in den Kolbenprober zu befördert. Gleiches gilt auch für H2S-Vorlagekolben. Bei beiden Entwicklern hat sich gezeigt, dass es besser ist beide Vorgagekolben mit Stativklemmen zu befestigen. Reaktionsapparatur: Muss für Vortrag so aufgebaut werden, dass sie in den mobilen Abzug passt, was bedeutet, dass die Apparatur in der Breite höchstens 75 cm (mit befüllten Kolbenprobern) messen darf. Das U-Rohr muss unmittelbar vor Beginn mit Spüliwasser ausgewaschen worden sein, sonst funktioniert der Versuch nicht. Das Spüli sollte weiß sein und nicht gelb! 26 Abb. 29: Versuchsaufbau: Darstellung von Schwefel Versuchsdurchführung und Beobachtungen: Vorbereitungen: Die entwickelten Gase sollten jeweils am besten in 250 ml Stickstoffkolben geleitet werden. Das erlaubt diese eventuell schon vorher zu produzieren und aufzubewahren. Mit Hähnen versehen können die Gase sauber in die Kolbenprober überführt werden. Dabei beachte man, dass SO2 2,3 mal schwerer als Luft ist (also Hahn nach unten halten). H2S ist nur wenig schwerer als Luft! Schwefeldioxid-Entwicklung: Um gerade so viel SO2 zu entwickeln, dass die Apparatur etwa 2 mal gefüllt werden kann, reichen 13,9 g Natriumhydrogensulfit und etwa 15 ml Schwefelsäure. Dieser Ansatz 27 entwickelt ungefähr 3 Liter SO2. die Luftverdrängung in der Apparatur geht erfahrungsgemäß sehr schnell (wenige Sekunden) vonstatten. Ob die Vorlage gefüllt ist, prüft man mit feuchtem Indikatorpapier. Schwefelwasserstoff-Entwicklung: In das Reagenzglas gibt man einige kleine Stücke FeS. Darauf gibt man etwa eine Tropfpipette konzentrierte Salzsäure, so dass das Eisensulfid gerade bedeckt ist. Das Reagenzglas wird dann verschlossen mit dem durchbohrten Gummistopfen indem bereits das gebogene Glasrohr steckt. Modellversuch zum Claus-Prozess: Man füllt je einen trockenen Kolbenprober mit 60 ml SO2 und mit 100 ml H2S. Die Gase werden beginnend mit Schwefeldioxid langsam in das U-Rohr geschoben. Achtung: Die Verbindung zwischen U-Rohr und H2S-Kolbenprober wird geöffnet. Beim Einschieben von SO2 ins Rohr kann die Luft so nach draußen entweichen. Prüfung mit feuchtem Indikatorpapier. Kein Gas entwischen lassen. Dann Apparatur dort schließen! Die Kolbenprober bleiben offen, sodass man die Gase hin und her schieben kann. Man kann das solange machen bis ein Großteil des Gasvolumens wegreagiert ist (ca. die Hälfte). Das URohr enthält etwas Spüliwasser, welches als Katalysator wirkt. Das Spüli sorgt für eine größere benetzte Glasoberfläche. Es bilden sich bald weiße Nebel, an der Glaswand schlägt sich ein gelber Feststoff nieder. Entsorgung: Beide Entwickler möglichst abreagieren lassen. Gasreste, die in der Apparatur verblieben sind vertreiben (mit Kolbenprober)! Emulsion im SO2-Entwickler vorsichtig mit Wasser verdünnen, mittels Permanganat oxidieren und neutralisieren. 2 MnO4-(aq) + 5 SO2 (aq) + 2 H2O 2 Mn2+(aq) + 5 SO42-(aq) + 4 H+(aq) 28 Reste aus H2S-Entwickler vorsichtig mit Wasser verdünnen und mit neutralisieren. Neutrale Reste in flüssige anorganische Schwermetallabfälle geben! 2.5 Versuch 3: Darstellung von Schwefelwasserstoff: Chemikalien: Eisensulfid FeS (s) R: - S: - Gefahrensymbol: - Salzsäure HCl (aq) R: 34-37 S: 26-45 Gefahrensymbol: C R: 12-26-50 S: 1/2-9-16-36-38-45- Gefahrensymbol: (w = 0,35) Schwefelwasserstoff H2S (g) Bleiacetat Pb(ac)2 (S) R: 61-33-48/22- 61 T+, F+, N S: 53-45-60-61 Gefahrensymbol: 50/53-62 N, T Geräte: Stativmaterial Glasrohr (gebogen, einseitig ausgezogen) Reagenzglas Tropfpipette Gummistopfen (durchbohrt) Spatel Versuchsaufbau: Abb. 30: Versuchsaufbau: Darstellung von Schwefelwasserstoff 29 Versuchsdurchführung und Beobachtungen: Herstellen von Bleiacetat-Papier: Man schneidet Filterpapier in Streifen. Diese werden in eine zuvor angesetzte BleiacetatLösung getränkt und schließlich im Trockenschrank getrocknet. Darstellung von Schwefelwasserstoff: Man gibt einige kleine Stücke Eisensulfid in das Reagenzglas. Darauf gibt man etwa ein bis zwei Tropfpipetten voller konzentrierter Salzsäure, so dass das Eisensulfid gerade bedeckt ist. Sofort ist eine Reaktion durch Blasenbildung zu beobachten. Nun wird der Stopfen mit dem Glasrohr aufgesetzt. (Sollte in einem mobilen Abzug gearbeitet werden, muss die Austrittstelle dringend direkt über der Abzugsöffnung angebracht werden, da ansonsten durch schlechten Abzug Vergiftungsgefahr besteht! Außerdem muss ein Becherglas voller Absorbtionslösung bereitstehen!) Darauf wird mit dem Bunsenbrenner mäßig erhitzt. Die Gasentwicklung verstärkt sich. Das austretende Gas kann anschließend mit angefeuchtetem Bleiacetat-Papier identifiziert werden. Es färbt sich schwarz. Überschüssiges Gas wird in die Absorbtionslösung geleitet! Entsorgung: Reaktionsansatz möglichst abreagieren und abkühlen lassen. Vorsichtig mit Wasser verdünnen und neutralisieren. Reste des festen Eisensulfid abfiltrieren, trocknen und in den Abfall für mindergiftige Feststoffabfälle entsorgen. 30 2.6 Versuch 4: Reaktion mit Metallen: Chemikalien: Reaktion von Schwefel mit Kupfer: Schwefelblüte 5 g R: - S: - Gefahrensymbol: - Kupferblech (Streifen) R: - S: - Gefahrensymbol: - Reaktion von Schwefel mit Zink: Schwefelblüte 0,8 g R: - S: - Gefahrensymbol: - Zink (Pulver) 1,62 g R: 50/53 S: 60-61 Gefahrensymbol: N Geräte: Reaktion von Schwefel mit Kupfer: Reagenzglas Tiegelzange Pulvertrichter NS 14,5 Reagenzglasklammer Bunsenbrenner Reaktion von Schwefel mit Zink: Stativplatte (Unterlage) Spatel Lunte (Papierstreifen, verdrillt) (in gesättigter KNO3-Lösung getränkt und getrocknet) 31 Versuchsaufbau: Abb. 31: Versuchsaufbau: Reaktion mit Metallen Versuchsdurchführung und Beobachtungen: Reaktion von Schwefel mit Kupfer: Man gibt die angegebene Menge Schwefelblüte in das Reagenzglas, sodass es ca. zur Hälfte befüllt ist. Mittels Reagenzglasklammer erhitzt man das Reagenzglas über der rauschenden Bunsenbrennerflamme, bis sich die Schwefelschmelze dunkel verfärbt hat und sich kondensierter Schwefel am oberen, kalten Glasrand niederschlägt. Darauf gibt man mit der Tiegelzange einen schmalen Streifen gereinigtes Kupferblech in die Schmelze. Es kommt zu einer wenige Sekunden anhaltenden, lebhaften Reaktion unter roter Feuererscheinung. Das Reaktionsprodukt ist schwarz. Reaktion von Schwefel mit Zink: Man mischt 0,8 g Schwefelblüte und 1,62 g Zinkpulver vorsichtig mit dem Spatel auf einem Papier. Achtung: nicht verreiben, da es durch Einwirkung mechanischer Energie bereits zur Reaktion kommen kann. (Der Versuchsansatz ist zur Anwendung im mobilen Abzug gedacht). Die homogene Mischung positioniert man auf der feuerfesten Stativplatte. Das Gemisch darf nicht direkt entzündet werden, sondern mittels Zündschnur, die man sich aus einem Streifen verdrilltem Papier herstellt, welches zuvor in konzentrierter Kaliumnitrat-Lösung getränkt 32 und getrocknet wurde. Diese Lunte sollte ca. 6-8 cm lang sein. Die Zündung erfolgt unter explosionsartiger, grünlicher Feuererscheinung unter Rauchentwicklung. Entsorgung: Alle Rückstände in die mindergiftigen Feststoffabfälle entsorgen. 2.7 Versuch 5: Verbrennen von Schwefel: Chemikalien: Schwefelblüte R: - S: - Gefahrensymbol: - Methylrot-Lösung R: 40 S: 36/37 Gefahrensymbol: Xn Natronlauge R: - S: - Gefahrensymbol: - R: 8 S: 2-17 Gefahrensymbol: O (c = 1 Mol/L) Sauerstoff O2 (g) Wasser (entionisiert) Geräte: Weithalserlenmeyerkolben 1 L Tropfpipette Stopfen Heizplatte mit Magnetrührer Verbrennungslöffel Rührfisch Bunsenbrenner Druckgasflasche Sauerstoff Uhrglas 33 Versuchsaufbau: Abb. 32: Versuchsaufbau: Verbrennen von Schwefel Versuchsdurchführung und Beobachtungen: Vor Beginn des Versuchs wird der Raum verdunkelt! Man füllt zunächst soviel Indikatorlösung in den Erlenmeyerkolben, dass die Flüssigkeit etwa 3-4 cm hoch im Gefäß steht. Durch Zugabe weniger Tropfen 1 molarer Natronlauge wird die Lösung leicht basisch eingestellt. Mittels Schlauch wird der Kolben nun vollständig mit Sauerstoff aus der Gasdruckflasche befüllt und mit einem Uhrglas verschlossen. Der Magnetrührer wird angestellt, jedoch nicht so schnell, dass es spritzt. Der Verbrennungslöffel, der zuvor bereits durch den Stopfen gesteckt wurde wird mit etwas Schwefelblüte befüllt, welche an der rauschenden Bunsenbrennerflamme entzündet wird. Den Stopfen setzt man schließlich zügig aber möglichst ohne einen Luftzug zu erzeugen auf den Reaktionskolben. Der Schwefel brennt mit blauer, hell leuchtender Flammenerscheinung. Die Indikatorlösung hat sich rot gefärbt und zeigt somit saure Reaktion an. Entsorgung: Wasser im geschlossenen Kolben gut umschwenken, um entstandenes Schwefeldioxid restlos zu lösen. Saure Lösung mit Permanganat oxidieren und neutralisiert in Abfall für schwermetallhaltige Abfälle entsorgen. 2 MnO4-(aq) + 5 SO2 (aq) + 2 H2O 2 Mn2+(aq) + 5 SO42-(aq) + 4 H+(aq) 34 2.8 Versuch 6: Schwefeldioxid-Springbrunnen: Chemikalien: NaHSO3 (s) R: 22-31 S: 2-25-46 Gefahrensymbol: Xn H2SO4 (w = 0,96) R: 35 S: 26-30-45 Gefahrensymbol: C Methylrot-Lösung R: 40 S: 36/37 Gefahrensymbol: Xn S: - Gefahrensymbol: - (angefeuchtet) Natronlauge (c = 1 Mol/L) R: - Geräte: Dreihals-Rundkolben 1000 ml (3 . NS 29) Stickstoffkolben 500 ml 2 Glasschliffstopfen (NS 29) 2 durchbohrte Gummistopfen Tropftrichter mit Druckausgleich und Schliff Woulfsche Flasche (links verschlossen mit (NS29) NS 29, Hahn ohne Schliff NS 29) 2 Korkringe Peleusball Keckklemmen Glasrohr oben zu Spitze ausgezogen (ca. 50 cm) Schläuche Stativmaterial Versuchsaufbau: Wurde der Stickstoffkolben (statt Zweihalsrundkolben) mit SO2 befüllt, werden alle Hähne geschlossen. Der Schlauch zwischen Dreihalskolben und Stickstoffkolben wird in den Abzug gelegt, der andere wird entfernt. Der Stickstoffkolben wird so umgedreht, dass er zügig auf den Gummistopfen des Glasrohres gesteckt werden kann. 35 Abb. 33: Versuchsaufbau: Schwefeldioxid-Springbrunnen Versuchsdurchführung und Beobachtungen: Vorbereitungen: Die NaHSO3-Suspension (NaHSO3 mit wenigen mL Wasser) im Dreihals wird leicht geschwenkt und mit Rührfisch auch schon vor dem Versuch leicht gerührt. Das zu entwickelnde SO2 ist 2,3 mal schwerer als Luft, was beim Befüllen und beim Umbau der Apparatur bedacht werden muss. Achtung: Der hinten an den Stickstoffkolben (Vorlage) angelegte Schlauch führt direkt in die Absaugung. Die Woulffsche Flasche wird mit 800 ml Wasser und 15 Tropfen der Methylrot-Lösung befüllt. Man kann vorsichtig überprüfen, ob sich die Flüssigkeit mittels Peleusball gut hochpumpen lässt! Um unerwünschte, vorzeitige Umschläge des Indikators zu vermeiden, gibt man wenige Tropfen 1 molarer Natronlauge hinzu. Durchführung: Durch Zutropfen von H2SO4 in den Dreihalskolben wird SO2 entwickelt (alle Hähne müssen offen sein). Am Ende des Schlauches, der in den Abzug führt, kann mit feuchtem Indikatorpapier durch Rotfärbung ermittelt werden, wann der Zweihalskolben befüllt ist. 36 War die Probe auf SO2 erfolgreich, beendet man das Zutropfen von H2SO4, wartet aber noch einige Sekunden, bis man die Hähne am Stickstoffkolben schließt. Weiterhin entstehendes SO2 muss in eine Absorbtionslösung geleitet werden. Ist der Stickstoffkolben gut verschlossen, wird er mit der NS 29-Öffnung nach unten, vorsichtig über dem Glasrohr positioniert. Der am Glasrohr stechende Gummistopfen muss vorher auf Passform geprüft worden sein und bereits angebracht sein. An der Woulffschen Flasche ist bereits ein Gummigebläse angebracht. Das Glasrohr muss in der Flasche bis fast zum Boden reichen. Mit dem Gummigebläse wird nun Flüssigkeit nach oben gepumpt. Sobald SO2 Kontakt mit dem Wasser hat, sollte der Rest aus der Flasche nach oben gezogen werden. Das Gebläse wird schnell entfernt, damit Luft nachströmen kann. Der Indikator färbt sich im Zweihalskolben rot! Entsorgung: Wasser im geschlossenen Kolben gut umschwenken, um entstandenes Schwefeldioxid restlos zu lösen. Saure Lösung mit Permanganat oxidieren und neutralisiert in Abfall für schwermetallhaltige Abfälle entsorgen. 2 MnO4-(aq) + 5 SO2 (aq) + 2 H2O 2 Mn2+(aq) + 5 SO42-(aq) + 4 H+(aq) 2.9 Demonstration 3: Zuckerkohle: Chemikalien: Saccharose R: - S: - Gefahrensymbol: Schwefelsäure R: 35 S: 26-30-45 Gefahrensymbol: C (w = 0,96) Wasser 37 Geräte: Becherglas 50 ml (hohe Form) Peleusball Messpipette 25 ml Glasstab Messzylinder 25 ml Versuchsaufbau: Abb. 34: Versuchsaufbau: Zuckerkohle Versuchsdurchführung und Beobachtungen: Man füllt 30 g Saccharose in das schmale Becherglas. Zur Beschleunigung der Reaktion gibt man 4 ml Wasser auf die Saccharose. Mittels Messpipette werden 20 ml konzentrierter Schwefelsäure abgemessen, welche man zügig in einem Strahl in das Becherglas laufen lässt. Die Reaktion setzt nicht sofort sichtbar ein, sondern nimmt mehrere Sekunden in Anspruch. Der Inhalt des Gefäßes verfärbt sich langsam über Gelb hin zu Braun. Dabei dampft es aus dem Becherglas. Nach etwa 20 Sekunden hat sich die Farbe ins Schwarze vertieft, dabei erhebt sich eine Säule aus porösem Material aus dem Becherglas. Entsorgung: Das Reaktionsprodukt muss samt Becherglas in den Abfall für mindergiftige Feststoffabfälle entsorgt werden! 38 2.10 Zusatz: Rauchgasentschwefelung (Kalksteinverfahren): Chemikalien: Schwefeldioxidentwickler: NaHSO3 (s) R: 22-31 S: 2-25-46 Gefahrensymbol: Xn H2SO4 (w = 0,96) R: 35 S: 26-30-45 Gefahrensymbol: C CaCO3 (s) R: - S:- Gefahrensymbol: - O2 (g) R: 8 S: 2-17 Gefahrensymbol: O (angefeuchtet) Wasser Geräte: SO2-Entwickler: Magnetrührer mit Heizplatte Tropftrichter mit Druckausgleich und Schliff Rührfisch Stickstoffkolben 500 ml Dreihalsrundkolben 500 ml (3 . NS 29) Stativmaterial Hahn mit Schliff NS 29 Schlauch PVC Glasstopfen NS 29 4 Schlauchschellen mit Handrad Stattdessen wahlweise: SO2-Druckgasflasche O2-Druckgasflasche Glasrohr gebogen mit Gummistopfen 6mm-PVC-Schlauch für Sauerstoffflasche 4mm PVC-Schlauchmaterial 2 Gaswaschflaschen mit entfettetem Schliff, 6 Schlauchschellen mit Handrad der Sauerstoffflasche nachgeschaltet Stickstoffkolben 250 ml Korkring Magnetrührer Stativmaterial Rührfisch 39 Versuchsaufbau: Dreihalsrundkolben ist beschickt mit Natriumhydrogensulfit / Wasser-Suspension. Aus 13,9 g Natriumhydrogensulfit lassen sich theoretisch 3 Liter Schwefeldioxid erzeugen. Bei diesem Versuch wird man weit mehr benötigen. An die entsprechende Menge an Edukten muss man sich herantasten. Tipp: Vorher mit SO2-Druckgasflasche ausprobieren oder Entwickler komplett durch diese ersetzen. Abb. 35: Versuchsaufbau: Kalksteinvervahren Versuchsdurchführung und Beobachtungen: Vorbereitungen: Es empfiehlt sich, den Versuch zunächst probeweise mit SO2-Druckgasflasche als SO2-Quelle durchzuführen. Auf diesem Weg lässt sich besser abschätzen, wie viel Schwefeldioxid für die Reaktion benötigt wird benötigt wird. Zu beachten ist außerdem, dass der Versuch eigentlich zu lange dauert für einen 45-minütigen Vortrag. Jedoch lässt sich der bereits ausgefallene REA-Gips schön als Demonstration an beliebiger Stelle einbauen. Durchführung: Eine Suspension aus 150 ml Wasser und 1,5 g Calciumcarbonat wird in das Reaktionsgefäß, den Stickstoffkolben gegeben und wie im Versuchsaufbau zunächst mit der SO2-Quelle (Teil 40 1) verbunden. Unter ständigem Rühren wird nun solange SO2 über ein in die Suspension tauchendes Glasrohr eingeleitet, bis sich das Reaktionsgemisch klärt. Nun wird der Versuchsaufbau (Teil 2) so umgebaut, dass man mittels Druckgasflasche etwa 30 Minuten Sauerstoff durch die Lösung leiten kann. Danach lässt man die Lösung im Kolben 1-2 Tage stehen, bis sich nadelförmige bilden. Diese können zusätzlich abfiltriert und unter dem Mikroskop näher charakterisiert werden. Entsorgung: Gipskristalle abfiltrieren und getrocknet als mindergiftige Feststoffabfälle entsorgen. Übrige Lösung sofern neutral in Behälter für flüssige Schwermetallabfälle geben. Auswertung: (Da das Thema Rauchgasentschwefelung im theoretischen Teil nicht behandelt wird)! Leitet man Schwefeldioxid in Wasser reagiert die Lösung sauer. Aufgrund dessen löst sich der Kalk in der Suspension unter Bildung von Kohlendioxid auf. Durch Einleiten von Sauerstoff kann der Schwefel im Hydrogensulfit zum Hydrogensulfat oxidiert werden. SO2 (g) + H2O HSO3-(aq) + H+(aq) CaCO3 (s) + 2 H+(aq) Ca2+(aq) + H2O + CO2 (g)↑ 2 HSO3-(aq) + O2 (g) 2 HSO4-(aq) 2 HSO4-(aq) + Ca2+(aq) + CaCO3 (s) + 3 H2O 2 CaSO4 . 2 H2O (s)↓ + CO2 (g)↑ 41 3. Literaturverzeichnis Holleman-Wiberg: Lehrbuch der anorganischen Chemie; 101. Auflage, 1995 Walter Schumann: Mineralien, Gesteine; 12. durchgesehene Auflage, BLV 2005 Riedel-Janiak: Anorganische Chemie; 7. Auflage mit DVD, 2007 Kreysa-Küchler-Winnacker: Anorganische Grundstoffe, Zwischenprodukte; 5. Aufl. 2005; Wiley-VCH Jürgen Kühnle: Mineralienlexikon, 1999-2007, [Online] im WWW unter URL: http://www.wissen-im-netz.info, Aufruf 17.01.2008 BGIA-Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung: GESTIS-Stoffdatenbank, [Online] im WWW unter URL: http://www.dguv.de/bgia/de/gestis/stoffdb/index.jsp 42 4. Abbildungsverzeichnis 4.1 Schriftliche Ausarbeitung Abbildung: 1 (Seite 1) Stellung des Schwefels im Periodensystem, [Online] im WWW unter URL: http://www.matthey.ch/.../TableauP_riodique_2.jpg (letzter Zugriff: 02.02.08) Abbildung: 2 (Seite 2) Cyclooctaschwefel, [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 3 (Seite 2) Orthorhombischer Schwefel (Schema), [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 4 (Seite 2) Monokliner Schwefel (Schema), [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 5 (Seite 3) Nadelförmige Kristalle monoklinen Schwefels, [Online] im WWW unter URL: http://www.seilnacht.com/Lexikon/16Schwef.htm (letzter Zugriff: 02.02.08) Abbildung: 6 (Seite 4) Schwefel bei 20 °C / 119 °C / 159 °C / 444 °C, [Online] im WWW unter URL: http://www.schoolwork.de/fes/schwefelb.php (letzter Zugriff: 02.02.08) Abbildung: 7 (Seite 5) Mineral 1: Pyrit, [Online] im WWW unter URL: 43 http://www.icbm.de/~mbgc/bilder/Student_Exercises/Pyrite_peruOct.jpg (letzter Zugriff: 02.02.08) Abbildung: 8 (Seite 5) Mineral 2: Galenit, [Online] im WWW unter URL: http://www.niceus-mineralien.de/Mineralien/Galenit-Illinouis.jpg (letzter Zugriff: 02.02.08) Abbildung: 9 (Seite 5) Mineral 3: Sphalerit, [Online] im WWW unter URL: http://www.rolbox.it/astroweb/Planeten/mineralien/Zinkblende.jpg (letzter Zugriff: 02.02.08) Abbildung: 10 (Seite 6) Mineral 4: Realgar, [Online] im WWW unter URL: http://www.wrightsrockshop.com/gallery/realgar/realgarimages/5realgar21806.JPG (letzter Zugriff: 02.02.08) Abbildung: 11 (Seite 6) Mineral 5: Baryt, [Online] im WWW unter URL: http://www.pgi.gov.pl/muzeum/kolekcja/baryt/baryt-1.jpg (letzter Zugriff: 02.02.08) Abbildung: 12 (Seite 6) Mineral 6: Cölestin, [Online] im WWW unter URL: http://www.lessence.de/assets/images/coelestin.jpg (letzter Zugriff: 02.02.08) Abbildung: 13 (Seite 6) Cystein Quelle: Alexander Achenbach Abbildung: 14 (Seite 6) Methionin Quelle: Alexander Achenbach Abbildung: 15 (Seite 7) Hermann Frasch (Portrait), [Online] im WWW unter URL: 44 http://www.gaildorf.de/images/028.jpg (letzter Zugriff: 02.02.08) Abbildung: 16 (Seite 7) Frasch- Verfahren (Schema), [Online] im WWW unter URL: http://home.att.net/~cat6a/images/metals_nonmetals_108.jpg (letzter Zugriff: 02.02.08) Abbildung: 17 (Seite 8) Frasch-Verfahren (Foto), [Online] im WWW unter URL: http://www.science.uwaterloo.ca/~cchieh/cact/fig/sulfur.jpg (letzter Zugriff: 02.02.08) Abbildung: 18 (Seite 9) Vulkanische Gase, [Online] im WWW unter URL: http://www.schwarzaufweiss.de/island/myvatn.htm (letzter Zugriff: 02.02.08) Abbildung: 19 (Seite 9) Lewis-Formel von Monosulfan Quelle: Alexander Achenbach Abbildung: 20 (Seite 12) Ausgefällte Metallsulfide, [Online] im WWW unter URL: http://www.chemieunterricht.de/dc2/schwefel/s-v01.htm (letzter Zugriff: 02.02.08) Abbildung: 21 (Seite 12) Energiediagramm der Metallsulfidbildung Quelle: Alexander Achenbach Abbildung: 22 (Seite 14) Lewis-Formel Schwefeldioxid und Bindungen Quelle: Alexander Achenbach Abbildung: 23 (Seite 16) Lewis-Formel Schwefeltrioxid und Bindungen Quelle: Alexander Achenbach 45 Abbildung: 24 (Seite 18) Säurewirkung des Gashydrates von SO2 Quelle: Alexander Achenbach Abbildung: 25 (Seite 19) Das Sulfat-Ion Quelle: Alexander Achenbach Abbildung: 26 (Seite 20) Wasserentziehende Wirkung, [Online] im WWW unter URL: http://www2.uni-siegen.de/~pci/versuche/pics/h2so4ox.jpg (letzter Zugriff: 02.02.08) Abbildung: 27 (Seite 21) Versuchsaufbau: Monokline Schwefelkristalle Quelle: Alexander Achenbach Abbildung: 28 (Seite 23) Versuchsaufbau: Schmelzen von Schwefel Quelle: Alexander Achenbach Abbildung: 29 (Seite 27) Versuchsaufbau: Darstellung von Schwefel Quelle: Alexander Achenbach Abbildung: 30 (Seite 29) Versuchsaufbau: Darstellung von Schwefelwasserstoff Quelle: Alexander Achenbach Abbildung: 31 (Seite 32) Versuchsaufbau: Reaktion mit Metallen Quelle: Alexander Achenbach 46 Abbildung: 32 (Seite 34) Versuchsaufbau: Verbrennen von Schwefel Quelle: Alexander Achenbach Abbildung: 33 (Seite 36) Versuchsaufbau: Schwefeldioxid-Springbrunnen Quelle: Alexander Achenbach Abbildung: 34 (Seite 38) Versuchsaufbau: Zuckerkohle Quelle: Alexander Achenbach Abbildung: 35 (Seite 40) Versuchsaufbau: Kalksteinverfahren Quelle: Alexander Achenbach 4.2 Powerpoint-Präsentation: Abbildung: 1 (Seite 1) Schwefelstufe (roter Hintergrund), [Online] im WWW unter URL: http://geomuseum.tuclausthal.de/mineralogie/minerale/images/M450x300/schwefel_s037_m.jpg (letzter Zugriff: 02.02.08) Abbildung: 2 (Seite 1) Pyrit (schwarzer Hintergrund), [Online] im WWW unter URL: http://geo.web.ru/druza/M-pyrit-f.jpg (letzter Zugriff: 02.02.08) Abbildung: 3 (Seite 4) Schwefelkristall (orthorhombisch), [Online] im WWW unter URL: http://www.mineralienatlas.de/lexikon/index.php/Bildanzeige?pict=1111632808 (letzter Zugriff: 02.02.08) 47 Abbildung: 4 (Seite 1/6) Nadelförmige Kristalle monoklinen Schwefels, [Online] im WWW unter URL: http://www.seilnacht.com/Lexikon/16Schwef.htm (letzter Zugriff: 02.02.08) Abbildung: 5 (Seite 7) Schema Cyclooctaschwefel (Seitenansicht), [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 6 (Seite 7) Schema Cyclooctaschwefel (Aufsicht), [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 7 (Seite 8) Orthorhombisches Kristallsystem Abbildung: 8 (Seite 8) Monoklines Kristallsystem Abbildung: 9 (Seite 9) Orthorhombischer Schwefel (Schema), [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 10 (Seite 9) Monokliner Schwefel (Schema), [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 11 (Seite 10) Schwefelstufe (grüner Hintergrund), [Online] im WWW unter URL: http://upload.wikimedia.org/wikipedia/commons/2/2e/Sulfur.jpg (letzter Zugriff: 02.02.08) 48 Abbildung: 12 (Seite 10) Monokline Schwefelkristalle (Stufe), [Online] im WWW unter URL: http://upload.wikimedia.org/wikipedia/de/e/ef/Schwefel_monoklin.jpg (letzter Zugriff: 02.02.08) Abbildung: 13 (Seite 12) Schwefelschmelze (20°C – 119°C), [Online] im WWW unter URL: http://www.schoolwork.de/fes/schwefelb.php (letzter Zugriff: 02.02.08) Abbildung: 14 (Seite 1/13) Schwefelschmelze (119°C – 159°C), [Online] im WWW unter URL: http://www.schoolwork.de/fes/schwefelb.php (letzter Zugriff: 02.02.08) Abbildung: 15 (Seite 14) Schwefelschmelze (159°C – 444°C), [Online] im WWW unter URL: http://www.schoolwork.de/fes/schwefelb.php (letzter Zugriff: 02.02.08) Abbildung: 16 (Seite 15) Schema S20-Molekül, [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 17 (Seite 15) Schema Sx-Kettenausschnitt, [Online] im WWW unter URL: http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/ac1/s_rhombic.gif (letzter Zugriff: 02.02.08) Abbildung: 18 (Seite 16) Abbau von Schwefel auf Java, [Online] im WWW unter URL: http://oe1.orf.at/uimg/200511/1132661801376.jpg (letzter Zugriff: 02.02.08) 49 Abbildung: 19 (Seite 19) Frasch-Verfahren (Foto), [Online] im WWW unter URL: http://www.science.uwaterloo.ca/~cchieh/cact/fig/sulfur.jpg (letzter Zugriff: 02.02.08) Abbildung: 20 (Seite 20) Hermann Frasch (Portrait), [Online] im WWW unter URL: http://www.gaildorf.de/images/028.jpg (letzter Zugriff: 02.02.08) Abbildung: 21 (Seite 21) Frasch-Verfahren (Schema), [Online] im WWW unter URL: http://home.att.net/~cat6a/images/metals_nonmetals_108.jpg (letzter Zugriff: 02.02.08) Abbildung: 22 (Seite 23) Vulkanische Gase, [Online] im WWW unter URL: http://www.schwarzaufweiss.de/island/myvatn.htm (letzter Zugriff: 02.02.08) Abbildung: 23 (Seite 27) Ausgefällte Metallsulfide, [Online] im WWW unter URL: http://www.chemieunterricht.de/dc2/schwefel/s-v01.htm (letzter Zugriff: 02.02.08) Abbildung: 24 (Seite 1/31) Brennender Schwefel, [Online] im WWW unter URL: http://upload.wikimedia.org/wikipedia/commons/a/a0/Burning-sulfur.png (letzter Zugriff: 02.02.08) Abbildung: 25 (Seite 38) Schwefelsäure Kalottenmodell, [Online] im WWW unter URL: http://www.h-2-s.de/images/schwefelsaeure.gif (letzter Zugriff: 02.02.08) 50