6.2.2 Bestimmung pka werte glycin
Werbung
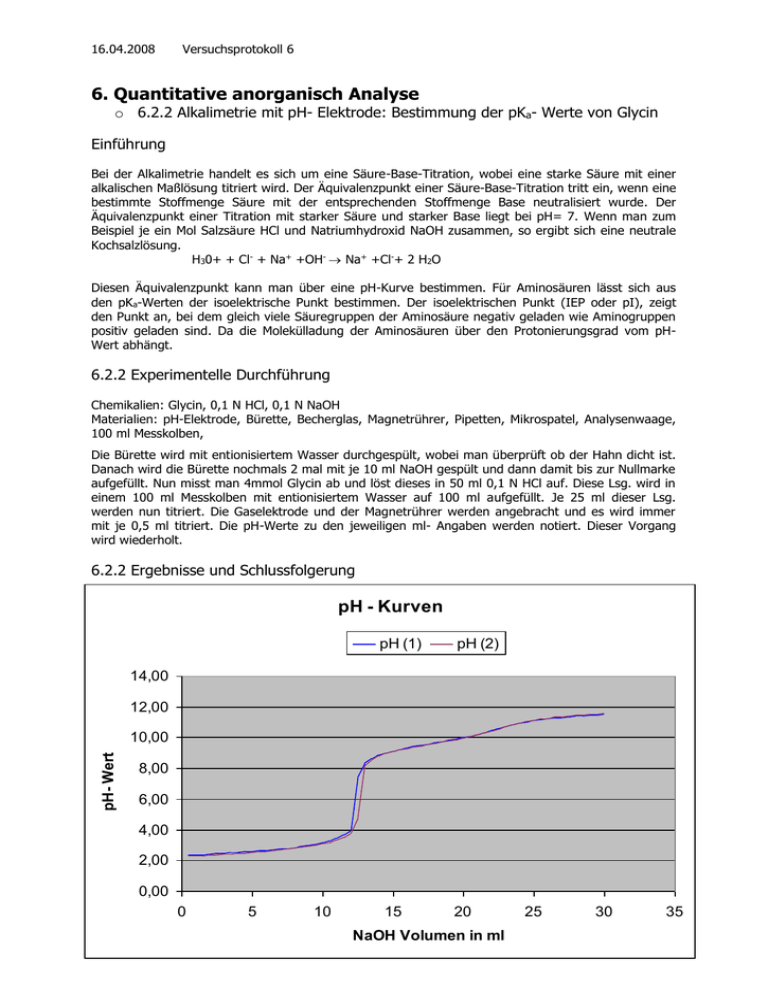
16.04.2008 Versuchsprotokoll 6 6. Quantitative anorganisch Analyse o 6.2.2 Alkalimetrie mit pH- Elektrode: Bestimmung der pKa- Werte von Glycin Einführung Bei der Alkalimetrie handelt es sich um eine Säure-Base-Titration, wobei eine starke Säure mit einer alkalischen Maßlösung titriert wird. Der Äquivalenzpunkt einer Säure-Base-Titration tritt ein, wenn eine bestimmte Stoffmenge Säure mit der entsprechenden Stoffmenge Base neutralisiert wurde. Der Äquivalenzpunkt einer Titration mit starker Säure und starker Base liegt bei pH= 7. Wenn man zum Beispiel je ein Mol Salzsäure HCl und Natriumhydroxid NaOH zusammen, so ergibt sich eine neutrale Kochsalzlösung. H30+ + Cl- + Na+ +OH- Na+ +Cl-+ 2 H2O Diesen Äquivalenzpunkt kann man über eine pH-Kurve bestimmen. Für Aminosäuren lässt sich aus den pKa-Werten der isoelektrische Punkt bestimmen. Der isoelektrischen Punkt (IEP oder pI), zeigt den Punkt an, bei dem gleich viele Säuregruppen der Aminosäure negativ geladen wie Aminogruppen positiv geladen sind. Da die Molekülladung der Aminosäuren über den Protonierungsgrad vom pHWert abhängt. 6.2.2 Experimentelle Durchführung Chemikalien: Glycin, 0,1 N HCl, 0,1 N NaOH Materialien: pH-Elektrode, Bürette, Becherglas, Magnetrührer, Pipetten, Mikrospatel, Analysenwaage, 100 ml Messkolben, Die Bürette wird mit entionisiertem Wasser durchgespült, wobei man überprüft ob der Hahn dicht ist. Danach wird die Bürette nochmals 2 mal mit je 10 ml NaOH gespült und dann damit bis zur Nullmarke aufgefüllt. Nun misst man 4mmol Glycin ab und löst dieses in 50 ml 0,1 N HCl auf. Diese Lsg. wird in einem 100 ml Messkolben mit entionisiertem Wasser auf 100 ml aufgefüllt. Je 25 ml dieser Lsg. werden nun titriert. Die Gaselektrode und der Magnetrührer werden angebracht und es wird immer mit je 0,5 ml titriert. Die pH-Werte zu den jeweiligen ml- Angaben werden notiert. Dieser Vorgang wird wiederholt. 6.2.2 Ergebnisse und Schlussfolgerung pH - Kurven pH (1) pH (2) 14,00 pH- Werte 12,00 10,00 8,00 6,00 4,00 2,00 0,00 0 5 10 15 20 NaOH Volumen in ml 20 25 30 35 16.04.2008 Versuchsprotokoll 6 pka – Werte (2) (4) pka1 = pH bei ca. 2,4 pka2 = pH bei ca. 9,6 Also stimmen die abgelesenen Werte mit denen aus dem Skript weitgehend überein. Isoelektrischer Punkt (3) - auch der erste Äquivalenzpunkt (3), 2ter Äquivalenzpunkt (5) Def.: Bsp.: pH = pka1 +pka2 2 Glycin pka1= 2,35 pH = 2,35 +9,78 = 6,065 pka2 = 9,78 2 Alle Werte oben in der Kurve gekennzeichnet Literatur: H.Fleischer Praktikum Chemie für Biologen: Anorganische, Organische und Physikalische Chemie, Mainz, 2004 21