Die Titration von Zitronensaft oder: Wieviel Zitronensäure ist im
Werbung

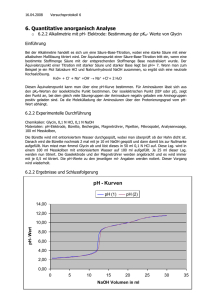
Anleitung Die Titration von Zitronensaft oder: Wieviel Zitronensäure ist im Zitronensaft? Ziele: - Das Prinzip der Titration verstehen und auf das Beispiel der Zitronensäure (Zitronensaft) anwenden können (inkl. Arbeitsblatt) Verstehen, was der Äquivalenzpunkt bei einer Titration aussagt Die Stoffmenge (und Masse) eines Stoffes in einer Lösung mittels einer Titration bestimmen können. Anhand der zusätzlichen Übung eine Titrationskurve interpretieren können. Voraussetzungen: Die Schülerinnen und Schüler kennen die Säure-Base-Theorie (starke Säure/schwache Säure) und wissen, was der pH Wert ist. Indikatoren sind bereits behandelt worden. Die Zusammenhänge Masse/Stoffmenge/Molekulargewicht sind bekannt. Zeitbedarf Versuch: ca. 10 min Skizze: Materialien: Chemikalien: Bürette 25 mL, 2 Magnetrührer, 2 Bechergläser 250 mL, pH-Meter 1 Zitrone, Phenolphthalein-Lösung, 0.1 M NaOH Lösung Durchführung: 1. Die beiden Bechergläser mit Magnetfisch werden mit 50 mL dest. Wasser gefüllt und mit je 2 Tropfen Phenolphthaleinlösung versetzt. 2. Das pH-Meter wird in Becherglas 1 getaucht (pH ca. 7.5) und zur Demonstration des Indikators unter Rühren mit ein paar Tropfen 0.1 M NaOH Lösung versetzt. Dabei wechselt der Indikator nach ein paar Tropfen NaOH-Lösung bereits die Farbe. 3. Ins Becherglas 2 werden nun zusätzlich 25 Tropfen Zitronensaft gegeben und der pH wird mittels pH-Meter gemessen (pH ca. 3.5) 4. Die Lösung wird nun tropfenweise mit 0.1 M NaOH-Lösung titriert. Dabei soll sowohl das pHMeter als auch die Titrierlösung beobachtet werden 5. Sobald der pH-Sprung oder die Veränderung des Indikators sichtbar wird, wird die Titration gestoppt. Der Äquivalenzpunkt ist erreicht. Reaktionsgleichungen: Zitronensäure: Auswertung: Am Äquivalenzpunkt ist die anfangs enthaltene Säure komplett durch die starke Base deprotoniert worden (n(Protonen der Säure) = n(NaOH)). Da der Hauptsäurebestandteil im Zitronensaft die Zitronensäure ist, kann diese als Vereinfachung für die Titration dienen. Über die Gleichung VNaOH·cNaOH = nNaOH = nHA, der am Äquivalenzpunkt ermittelten Basenmenge und bekannten Basenkonzentration folgt für das Beispiel der dreiprotonigen Zitronensäure: nZitronensäure = nNaOH/3 Entsorgung: Mit einer grösseren Menge Wasser verdünnt durch Abwassersystem. Bemerkungen: Die einzelnen Äquivalenzpunkte für die Protolysen der unterschiedlichen Carbonsäuregruppen sind nicht ersichtlich, da deren pK-Werte zu nahe beieinander liegen. Als Arbeitsauftrag kann zusätzlich die Titrationskurve von Zitronensäure aufgezeichnet werden. Wo liegt der Äquivalenzpunkt grafisch? Autor: Andri Schütz, [email protected]