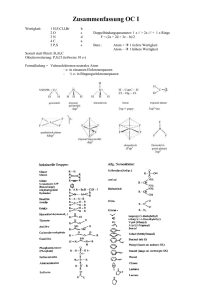
Gruppen der Organischen Säuren
Werbung

Wirtschaft Maschinenbau/Logistik Organische Säuren Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Inhalt Inhalt........................................................................................................................................................ 2 Geschichte ............................................................................................................................................... 3 Definition ................................................................................................................................................. 4 Eigenschaften der Säure:......................................................................................................................... 4 Wichtige Säuren: ..................................................................................................................................... 6 Definition ................................................................................................................................................. 8 Definition ............................................................................................................................................... 12 Eigenschaften der Säure ........................................................................................................................ 12 Carbonsäure: ......................................................................................................................................... 12 Gruppen der Organischen Säuren ......................................................................................................... 12 Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Geschichte Bei den Griechen und Römern war eine Säure ein Stoff, der essigähnliche Eigenschaften aufwies. Johann Rudolph Glauber (1604-1670) stellte eine ganze Reihe an neuen Säuren her, so gelang ihm erstmals die Herstellung von konzentrierter Salzsäure und deren Salze. Der französische Chemiker Antoine Lavoisier (1743-1794) glaubte noch im Jahre 1789, dass Sauerstoff in allen Säuren vorhanden war. Das Prinzip "oxygène" sah er als säureerzeugendes Prinzip im Sauerstoff vorliegen. Humphry Davy (1778-1829) widerlegte Lavoisiers Theorie und zeigte 1812, dass sich vom Chlor kein Sauerstoff abtrennen lassen konnte. Daraus folgerte er, dass auch die Salzsäure keine sauerstoffhaltige Verbindung sein kann, sondern dass Wasserstoff das kennzeichnende Element von Säuren sein muss. Den ionischen Charakter von Säuren (und von Salzlösungen) erkannte der schwedische Chemiker Svante Arrhenius (1859-1927). Nach ihm enthalten wässrige Säuren in ihrer Lösung positiv geladene Wasserstoff-Ionen und negativ geladene Säurerest-Ionen, Basen dagegen positiv geladene Baserest-Ionen und Hydroxid-Ionen. Der dänische Chemiker Johannes Nicolaus Brönstedt (1879-1947) erweiterte im Jahre 1923 den Säure-Basebegriff. Nach Broenstedt geben Säuren Protonen ab 1 1 http://www.seilnacht.com/Lexikon/Saeuren.htm Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Definition Säure: sind im engeren Sinne alle chemischen Verbindungen, die in der Lage sind, Protonen (H+) an einen Reaktionspartner zu übertragen – sie können als Protonendonator fungieren. In wässriger Lösung ist der Reaktionspartner im Wesentlichen Wasser. Es bilden sich Oxonium-Ionen (H3O+), der pH-Wert der Lösung wird damit gesenkt. Säuren reagieren mit sogenannten Basen unter Bildung von Wasser und Salzen. Eine Base ist somit das Gegenstück zu einer Säure und vermag diese zu neutralisieren. Im weiteren Sinn beschreiben verschiedene Säure-Base-Konzepte wesentlich breitere Paletten von chemischen Reaktionen, die weit über die oben erwähnten Reaktionen hinausreichen können. 2 Eigenschaften der Säure: Die Eigenschaften von Säuren, insbesondere die von ihnen ausgehenden Gefahren, sind sehr unterschiedlich. Als Beispiele seien hier Salpetersäure (Hauptgefahr: ätzend), Blausäure (Starkes Gift) und Pikrinsäure (ein Sprengstoff) genannt. Säuren greifen besonders unedle Metalle und Kalk an, aber auch Kleidung, Haut und Augen (allgemein alle organischen Materialien) laufen bei Kontakt Gefahr, von der Säure zerstört zu werden. Es gibt starke und schwache Säuren. Chlorwasserstoff ist eine starke Säure und dissoziiert in Wasser vollständig. Die wässrige Lösung nennt 2 http://de.wikipedia.org/wiki/S%C3%A4uren Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik man Salzsäure. Essigsäure ist eine schwächere Säure und dissoziiert in Wasser nur zum Teil. Säuren kann man mit Wasser verdünnen, dabei wird ihre Wirkung je nach Verdünnung deutlich schwächer. Das Verdünnen von konzentrierten Säuren ist eine exotherme Reaktion. Es entsteht also Wärme. Vor allem beim Verdünnen von konzentrierter Schwefelsäure kann die Säurelösung unkontrolliert wegspritzen. Daher gilt beim Verdünnen die Regel, die Säure in das Wasser zu geben, nicht umgekehrt: „Zuerst das Wasser, dann die Säure, sonst geschieht das Ungeheure.“ Es ist ein weit verbreiteter Irrtum, dass Säuren immer Flüssigkeiten sind. Bekannte Vertreter von Säuren, die rein als Feststoff vorliegen, sind Vitamin C und Zitronensauer, eine gasförmige Säure ist beispielsweise Chlorwasserstoff. Wässrige Lösungen von Säuren bewirken eine Farbveränderung von Indikatoren, zum Beispiel färben sie blaues Lackmuspapier rot. Die „Gegenspieler der Säuren“ sind die Basen (Basenlösung = Lauge). Sie können Säuren neutralisieren. Auch Basen sind ätzend und greifen viele andere Stoffe an, die mit Säuren nicht unbedingt reagieren. In Wasser gelöst leiten Säuren den elektrischen Strom. Hierbei erfolgt eine Elektrolyse, bei der sich an der Kathode (dem Minuspol) Wasserstoff und an der Anode (dem Pluspol) der neutralisierte Stoff des Säureanions bilden, bei der Salzsäure z. B. Chlor. An der Kathode erfolgt eine Reduktion (Elektronenaufnahme) und an der Anode erfolgt eine Oxidation (Elektronenabgabe). Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik 3 Wichtige Säuren: Schwefelsäure: ist eine chemische Verbindung des Schwefels mit der Summenformel H2SO4. Sie ist eine farblose, ölige, sehr viskose undhygroskopische Flüssigkeit. Schwefelsäure ist eine der stärksten Säuren und wirkt stark ätzend. Die Mineralsäure bildet zwei Reihen von Salzen, die Hydrogensulfate und die Sulfate, bei denen im Vergleich zur freien Säure ein beziehungsweise zwei Protonen durch Kationen ersetzt sind. Salzsäure: ist eine wässrige Lösung von gasförmigem Chlorwasserstoff, der in Oxoniumund Chloridionen dissoziiert ist. Sie ist eine starke, anorganische Säure und zählt zu den Mineralsäuren. Ihre Salze heißen Chloride, das bekannteste ist das Natriumchlorid (NaCl, Kochsalz). Phosphorsäure: 33 http://de.wikipedia.org/wiki/S%C3%A4uren#Eigenschaften_von_S.C3.A4uren Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik ist die wichtigste Sauerstoffsäure des Phosphors und eine der wichtigsten anorganischen Säuren. Sie ist eine dreiprotonige Säure und reagiert bezüglich der ersten Deprotonierung als mittelstarke Säure. Ihre Salze und Ester heißen Phosphate; auch die Bezeichnung Organophosphate ist für Ester der Phosphorsäure geläufig. Der Phosphor hat in diesen Verbindungen die Oxidationsstufe V. Wichtige Arbeiten zur Aufklärung der Struktur leistete Thomas Graham. Kohlensäure: (H2CO3) ist eine Säure und das Reaktionsprodukt ihres Säureanhydrids Kohlenstoffdioxid (CO2) mit Wasser. Die Salze der zweiprotonigen Säure heißen Carbonate bzw. Hydrogencarbonate. Ihre Ester werden ebenfalls Carbonate oder Kohlensäureester genannt. Technische Bedeutung haben die Polyester, die als Polycarbonatebezeichnet werden. Das Gas CO2 ist im Vergleich zu O2 und N2 relativ gut löslich in Wasser und reagiert zu einem geringen Anteil (etwa 0,2 %, je nach Temperatur) zu Kohlensäure: Essigsäure: ist eine farblose, flüssige, ätzende und typisch riechende Carbonsäure der Zusammensetzung C2H4O2 (Halbstrukturformel CH3COOH). Als Lebensmittelzusatzstoff hat sie die Bezeichnung E 260. Wässrige Lösungen der Essigsäure werden trivial nur Essig und reine EssigsäureEisessig genannt. Die Salze und Ester der Essigsäure heißen Acetateoder (systematisch) Ethanoate. Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Definition Organische Säuren: sind organische chemische Verbindungen, die über eine funktionelle Gruppe verfügen, die mit Wasser oder anderen protonierbaren Lösungsmitteln eine Gleichgewichtsreaktion eingeht. Dabei entsteht im Fall von Wasser das Oxoniumion H3O+, das die Lösung sauer werden lässt, während die Säure ein Proton an das Lösungsmittel Wasser abgibt: Meist wird der Begriff Organische Säure mit Carbonsäure gleichgesetzt, es gibt jedoch auch organische Säuren, die keine Carboxygruppe tragen. Als Maß für die Säurestärke gilt die Säurekonstante eines Stoffes. Diese Werte geben an, inwieweit eine Säure bei der Gleichgewichtsreaktion mit Wasser protolysiert, d. h. wie weit die Gleichung auf die rechte Seite verschoben ist. Dabei gilt: je kleiner der pKs-Wert ist, desto größer ist die Säurestärke des Stoffes. 4 Säurekonstante(Ks) : ist eine Stoffkonstante und gibt Aufschluss darüber, in welchem Maße ein Stoff in einerGleichgewichtsreaktion mit Wasser unter Protolyse reagiert. 4 http://de.wikipedia.org/wiki/Organische_S%C3%A4uren Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Carbonsäure: Carbonsäuren sind organische Verbindungen, die eine oder mehrere Carboxygruppen (–COOH) tragen. Die Carbonsäure salze werden Carboxylate und ihre Ester Carbonsäureester genannt. 5 Gruppen der Organischen Säuren Mitglieder der Gruppe der Carbonsäuren besitzen eine oder mehrere Carboxygruppen, die sauer reagieren. Es können aber auch andere Gruppen wie die Hydroxygruppe (– OH), Sulfanylgruppe(Thioale) –SH oder –SO3H (Sulfonsäuren) vorhanden sein, die Protonen abspalten können. Eine saure Reaktion einer Verbindung wird erleichtert, wenn das resultierende Anion durch Mesomeriestabilisiert wird. So hat Ascorbinsäure (Vitamin C) keine Carboxygruppe, wirkt aber durch seine Enolgruppen sauer. 5 http://de.wikipedia.org/wiki/Carbons%C3%A4uren Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Hydroxygruppe: −OH ist die funktionelle Gruppe der Alkohole und Phenole. Sie kommen auch bei Kohlenhydraten oder z. B. bei Hydroxycarbonsäuren als Strukturelemente vor. Die Hydroxygruppe ist ein Teilelement der Carboxygruppe der Carbonsäuren. 6 Thiolgruppe: sind organisch-chemische Verbindungen, die eine oder mehrere aliphatisch oderaromatisch gebundene Thiolgruppen (−SH) als funktionelle Gruppen tragen. Thioalkohole entsprechenAlkoholen, deren Sauerstoffatom durch ein Schwefelatom ersetzt ist. Wie sich Alkohole und Phenole formal vom Wasser (H2O) ableiten, sind die Thioalkohole und Thiophenole Abkömmlinge des Schwefelwasserstoffs (H2S) 7 6 7 http://de.wikipedia.org/wiki/Hydroxygruppe http://de.wikipedia.org/wiki/Alkanthiole Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Sulfonsäuren: sind organische Schwefelverbindungen mit der allgemeinen Struktur R–SO2– OH, wobei R ein organischer Rest ist. Ihre Salze und Ester mit der allgemeinen Struktur R–SO2–O–X heißen Sulfonate, dabei kann X ein organischer Rest oder ein Kation sein. 8 8 http://de.wikipedia.org/wiki/Alkanthiole Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Handout Definition Säure: sind im engeren Sinne alle chemischen Verbindungen, die in der Lage sind, Protonen (H+) an einen Reaktionspartner zu übertragen – sie können als Protonendonator fungieren. In wässriger Lösung ist der Reaktionspartner im Wesentlichen Wasser. Es bilden sich Oxonium-Ionen (H3O+), der pH-Wert der Lösung wird damit gesenkt. Eigenschaften der Säure Säuren greifen unedle Metalle und Kalk an Kleidung, Haut und Augen laufen Gefahr, von der Säure zerstört zu werden. Säuren kann Wasser verdünnen > Die Wirkung wird je nach Verdünnung schwächer. Carbonsäure: Carbonsäuren sind organische Verbindungen, die eine oder mehrere Carboxygruppen (–COOH) tragen. Die Carbonsäure salze werden Carboxylate und ihre Ester Carbonsäureester genannt. Gruppen der Organischen Säuren Mitglieder der Gruppe der Carbonsäuren besitzen eine oder mehrere Carboxygruppen, die sauer reagieren. Es können aber auch andere Gruppen wie die Hydroxygruppe (– OH), Sulfanylgruppe(Thioale) –SH oder –SO3H (Sulfonsäuren) vorhanden sein, die Protonen abspalten können. Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik English summary An organic acid is an organic compound with acidic properties. The most common organic acids are the carboxylic acids, whose acidity is associated with their carboxyl group –COOH. Sulfonic acids, containing the group –SO2OH, are relatively stronger acids. Alcohols, with –OH, can act as acids but they are usually very weak. The relative stability of the conjugate base of the acid determines its acidity. Other groups can also confer acidity, usually weakly: the thiol group –SH, the enol group, and the phenol group. In biological systems, organic compounds containing these groups are generally referred to as organic acids. Jeton Hasani Chemie Wirtschaft Maschinenbau/Logistik Jeton Hasani Chemie