PowerPoint-Präsentation
Werbung
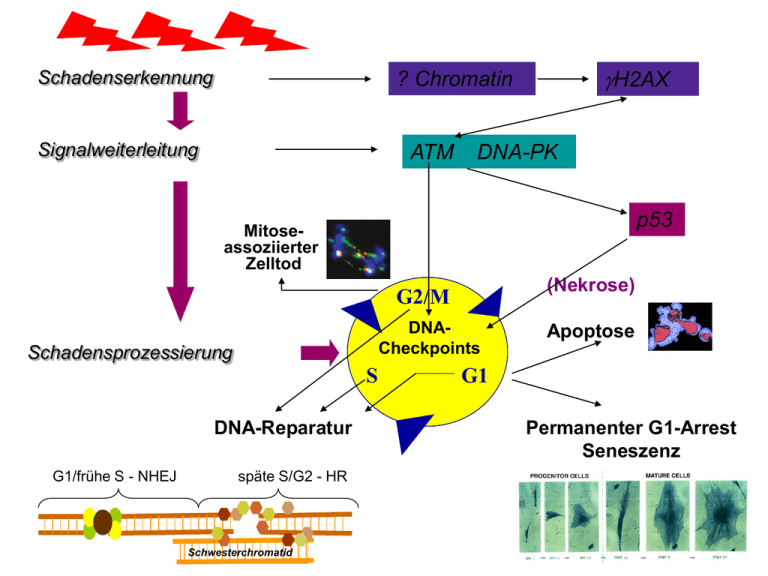
Schadenserkennung H2AX ? Chromatin Signalweiterleitung ATM DNA-PK p53 Mitoseassoziierter Zelltod (Nekrose) G2/M DNACheckpoints Schadensprozessierung S DNA-Reparatur G1/frühe S - NHEJ späte S/G2 - HR Schwesterchromatid Apoptose G1 Permanenter G1-Arrest Seneszenz Lernziele Biologische Grundlagen der Strahlentherapie Zum Nachlesen • • • • • Strahleninduzierter Zelltod Dosis-Effekt-Beziehungen Fraktionierung Einflussfaktoren (5 R) Radiochemotherapie Strahleninduzierter Zelltod • Apoptose Abbildung – (programmierter Zelltod) • Nekrose – (ATP-Mangel) Chromosomenaberrationen • Reproduktiver Zelltod Rez. Translokation – (dizentrische Chromosomen Anaphase-Brücken) • Seneszenz Abbildung – (permanenter Zellzyklusarrest) Dosis-Effekt-Beziehungen In vivo Erstellen von Strahlen-Dosis-Effekt-Kurven (Überlebenskurven) in vitro • Bestrahlen von Zellen mit unterschiedlichen Einzeldosen • Bebrüten bis zur Koloniebildung (ca. 6 Zellteilungen) • Auszählen der gebildeten Kolonien Dosisfraktionierung Prinzip Normal vs. Tumor • Aufteilung der Gesamtdosis in viele Einzeldosen – Bsp. 60 Gy werden in 30 Fraktionen à 2 Gy appliziert ! Grund: Toleranz des Normalgewebes Übersicht Faktoren die die Abtötung von Tumorzellen / den klinischen Verlauf beeinflussen O2-Diff. 1. Tumorgrö ße Kleine Tumoren - -große Tumoren wenig Tumorzellen viele Tumorzellen emp findli che Zellen resistente Zellen mangelnde Gefäßversorg ung, Hypoxie NHEJ HR 4. Hypoxische Fraktionen/ Reoxigenierung Die Strahlenreaktion jeder Zelle hängt wes entlich vom Sauerstoffgehalt ab Oxische Zellen sind empfindlicher als hypoxische Sauerstoff kann nur 200 m diffundieren, so daß in Tumoren hypoxische Bereiche/ Zellen ents tehen. Wird durch die Bestrahlung Tumormass e vernichtet, können die verbliebenen Zellen oxigeniert werden. Defizienz 5. Beschleunigte Repopulierung 2. Reparatur Zellen können Stra hlenschäden e ffizient reparieren, das Hauptziel des Überlebende Tumorzellen teilen sich unter und nach der Strahlentherapie weiter, die Teilungs raten können besonders zum Therapieende drastisch zunehmen Strahlenschadens ist die zelluläre DNS unabdin gbar für Normalgewebe trifft auch für Tumoren zu DNA-Schäden 6. Individuelle Strahlenempfindlichkeit 3. Redistribution im Ze llzyklus ZZ + ÜK Personen s ind unterschiedlich strahlenempfindlich Gewebe s ind unterschiedlich strahlenempfindlich Familiäre Syndrome die zelluläre Strahlensensitivität ist von der ze llzyklusphase abhängig: G1 und SPhase-Zellen sind relativ strahlenresistnt, G2- und M-Phase-Zellen sind strahlensensibel Toleranzdos en für Normalgewebe Übersicht -Tumordosen Tumor-ÜK Apoptose Aus: Eine Zelle begeht Selbstmord, Dr. Klaus Belka, DEGRO 2002 Bsp. für strahleninduzierte Chromosomenaberrationen Bestrahlte Chromosomen Mitose-assoziierter oder reproduktiver Zelltod Dizentrisches Chromosom + Bestrahltes Chromosom Terminale Deletion oder Interstitielle Deletion Bestrahlte Chromosomen Vollständige rez. Translokation Bestrahlte Chromosomen Insertion Unvollständige rez. Translokation Reziproke Translokation bei Chromosom #1 Zellalterung / Seneszenz Bei normalen Zellen durch Verkürzung der Telomere Bei Tumorzellen über den p53 / p21 / p16 pathway Von Prof. H.-P. Rodemann, Universität Tübingen Dosis-Effekt-Beziehung bei Tumorbestrahlung Tumorkontrolle [%] 100 80 60 40 20 0 0 20 40 Dosis [Gy] 60 80 100 Darstellung des Fraktionierungseffekts Erholung vom subletalen Strahlenschaden Vergleich des Fraktionierungseffekts bei unterschiedlichen Zelltypen Früh reagierende Gewebe (Mausergewebe) und viele Tumoren Aus: Klinische Strahlenbiologie, Fischer Verlag, Hrsg. Hermann, Baumann Spät reagierende Gewebe (Bindegewebe) Gewebetoleranz Sauerstoffdiffusion Zellzykluseffekte • Die zelluläre Strahlenempfindlichkeit ändert sich im Verlauf des Zellzyklus. • Die höchste Strahlenempfindlichkeit zeigen Zellen in der G2/M-Phase. • Weniger strahlenempfindlich sind Zellen in der G0/G1- und S-Phase Aus: Basic Clinical Biology, etd. By G.G. Steel Intrinsische Strahlensensitivität von Tumoren Überlebensfraktion 1 Glioblastom HNO-Tumor 0.1 Bronchial-Ca. Mamma-Ca. 0.01 Glioblastom mit Reparaturdefizienz 0.001 0 1 2 3 4 Dosis [Gy] 5 6 Familiäre Krebssyndrome mit Mutationen in DNA-Reparaturgenen (Beispiele) Erkrankung defiziente Reparatur Mutierte Gene (betroffeneDNA-Läsionen) Ataxia teleangiectasia DNA-Doppelstrangbrüche ATM Nijmegen Breakage Syndrom DNA-Doppelstrangbrüche NBS1 Fanconi Anämie DNA-Crosslinks u. DSB Hereditäres Mammakarzinom DNA-Doppelstrangbrüche Werner Syndrom DNA-Doppelstrangbrüche WRN Bloom Syndrom DNA-Doppelstrangbrüche BLM HNPCC DNA-Mismatches FANC - A, B, C, D1, D2, E, F, G BRCA1 , BRCA2 (= FANCB und D1) hMSH2, hMLH1, hPMS1, hPMS2 Nicht homologes Endjoining •Doppelstrangbruchreparatur WRN •Hauptsächlich in G1- und früher S-Phase • Reparatur meist fehlerhaft (Verlust von Basenpaaren durch zurechttrimmen der Bruchenden (Mikrodeletionen) Nach: Jackson SP, Carcinogenesis, 2002 Homologe Rekombinationsreparatur •Doppelstrangbruchreparatur BLM •Hauptsächlich in später Sund G2-Phase •Ermöglicht fehlerfreie Reparatur Nach: Jackson SP, Carcinogenesis, 2002 DNA-Schäden / Reparatur y az(ex) (DNA-PK -/-) y diz 1 2 y az(ex) (DNA-PK +/+) ydiz 3 4 5 Dosis [Gy] 1 M059K (DNA-PK +/+) 0.1 0.01 0.001 M059J (DNA-PK -/-) 0 1 2 3 4 Dosis [Gy] 5 6 DNA-PK-Mangel durch genetischen Defekt oder Hemmung führt zu •erhöhten Aberrationsausbeuten •reduziertem Überleben Überlebensfraktionon 3 2.5 2 1.5 1 0.5 00 Überlebensfraktion Aberrationsausbeute Erhöhte Strahlensensitivität bei Reparaturinsuffizienz 1 0,1 50 0,01 0 1 2 3 0 5 20 4 5 Dose [Gy] 6 7 8 Radiochemotherapie Spatiale Kooperation Chemotherapie, systemisch zur Therapie von Metastasen Radiotherapie, lokal zur Therapie des (Primär)tumors Radiosensibilisierung Radiotherapie und Chemotherapie sind unabhängig voneinander am Tumor wirksam (Additivität) Das Chemotherapeutikum vermindert die Strahlenwirkung am Tumor oder schützt das Normalgewebe (InfraÜK Additivität) Das Chemotherapeutikum verstärkt die Strahlenwirkung am Tumor, eine Radiosensibilisierung liegt dann vor, wenn das Chemotherapeutikum allein nicht wirksam ist. Übersicht RT CTX R T CTX Radiochemotherapie Voraussetzungen • Spatiale Kooperation: – Alleinige Wirksamkeit der Chemotherapie – Hohe Metastasierungstendenz des Tumors Indikationen • Spatiale Kooperation – Lymphome, Leukämien Multiples Myelom – Mammakarzinom – Kindliche Tumore – Vermeidung von Spätfolgen • Radiosensibilisierung – Additive oder synergistische Wirkung – Hohes Lokalrezidivrisiko – Schonung von Risikoorganen • Radiosensibilisierung – Zervixkarzinom – Bronchialkarzinom – Oesophaguskarzinom – Kopf-Hals-Tumore – Rektum- und Analkarzinom Radiochemotherapie - Therapeutische Breite Tumorkontrolle [%] 100 80 60 40 20 0 0 20 40 Dosis [Gy] 60 80 100 Beispiel für Infra-Additivität Tamoxifengabe (5 10 M) 72 h vor der Bestrahlung 0 Überlebende MCF-7-Zellen 10 -1 + Tamoxifen 10 -2 10 -3 10 -4 Kontrolle 10 -5 0 2 4 Dosis [Gy] 6 8 10 Radiosensibilisierung: Molekulare Interaktionsmechanismen Interaktionen auf zellulärer Ebene Verursachen zusätzlicher DNA-Schäden Platin Veränderung strahleninduzierter DNA-Schäden Veränderung der Schadensreparatur Inhibition der Schadensreparatur TPT Zytokinetische Kooperation Übersicht Synchronisation ÜK Taxol Übersicht Apoptosepromotion Übersicht Übersicht ÜK Übersicht NHEJ Tumorspezifische Reaktionen ÜK WMN Reoxigenierung und Tumorverkleinerung Übersicht Inhibierung der Tumorproliferation Modell ÜK Angiogenese-Inhibition Gewebespezifität Gentherapie Übersicht Übersicht Cetuximap Übersicht Verursachen zusätzlicher DNA-Schäden • Beispiel: Platinhaltige Zytostatika reparable Schäden: Excisionsreparatur, Mismatch Repair) irreparabler Schaden: zytostatikainduzierter-Schaden, (Platin-DNA-Addukt, Crosslink) strahleninduzierter Schaden, (Einzelstrangbruch (SSB), Basenschaden, alkali-labile Stelle) zwei unterschiediche Schäden in enger räumlicher Nähe Veränderung strahleninduzierter DNA-Schäden • Beispiel: Topoisomerasehemmer DNA-Schaden Topoisomerase Hemmer Topoisomerasen verändern durch Einschnitte in die DNA die Doppelhelix-Topologie und ermöglichen so die Replikation, Transskription und Reparatur. Veränderung der DNA-Schadensreparatur • DNA-Reparatur und -Synthese nutzen z. Teil gleiche Enzymkomplexe und Stoffwechselwege: Einsatz von DNA-Synthese-Inhibitoren in Kombination mit RT. Häufig benutzte Nukleosid-Analoga sind: 1. 5-FU inhibiert die Thymidylatsynthase, wird als Fluordesoxyuridin in die DNA und RNA eingebaut, beeinflußt den Zellzyklus Gemcitabin wird als Pyrimidin-Analog in die DNA und RNA eingebaut (!!! Klinisch hohe Toxizität) Fludarabin wir als Purin-Analog in die DNA und RNA eingebaut (wenig klinische Erfahrungen) BrdUrd und IDUrd, die an Stelle von Deoxythymidin in die DNA eingebaut werden, sind wegen ihrer allgemeinen Toxizität nicht für den klinischen Einsatz geeignet 2. 3. 4. Fludarabin + RT in-vitro Inhibition der Schadensreparatur • Viele DNA-Reparatur-Proteine sind identifiziert. • Der wahrscheinlich wichtigste Komplex, die DNA-PK, wird durch Wortmannin (PI3-Kinase-Inhibitor) gehemmt. Problem ist die in vivo Toxizität. Ionisierende Strahlung NHEJ wird in G1-Zellen bevorzugt DNA-DSB XRCC4 Reparatur Ku-Proteine Ku-Proteine DNA Ligase IV Wortmannin erhöht die Strahlenempfimdlichkeit von Glioblastom-Zellen M059K Überlebensfraktion 1 +5 M Wortmannin +20 M Wortmannin +50 M Wortmannin 0,1 0 50 20 5 0,01 0 1 2 3 4 Dose [Gy] 5 6 7 8 Zytokinetische Kooperation • Die zelluläre Strahlenempfindlichkeit ändert sich im Verlauf des Zellzyklus. • Werden Zytostatika mit hoher S-Phasen-Spezifität und RT zeitnah kombiniert, kommt es zu einer verstärkten (Strahlen)reaktion. • Beispiel sind Topoisomerase-I-Hemmer, aber wahrscheinlich auch die Nukleosid-Analoga. • Die Wirkungsverstärkung beruht in solchen Fällen auf der zytokinetischen Kooperation und ist keine Strahlensensibilisierung, da G1- oder G2-Zellen nicht betroffen sind, werden diese sensibilisiert ist eine Wechselwirkung mit Reparaturprozessen anzunehmen. Synchronisation • Die zelluläre Strahlenempfindlichkeit ändert sich im Verlauf des Zellzyklus. • Die höchste Strahlenempfindlichkeit zeigen Zellen in der G2/M-Phase. • Bestrahlung in G2/M nach erfolgreicher Synchronisation ließe eine maximale Strahlenreaktion erwarten. • Trotz vieler Ansätze gibt es keine klinische Evidenz für diese Theorie. • Aktuellstes Beispiel sind die Taxane, wo sich diese Theorie nicht bestätigen ließ. Beispiel für die Kombination von RT und Taxol ZMK-1 Taxol + XRT 1 Überlebensfraktion Taxol 3h a.RT, kein G2/M-Arrest 0,1 RT ohne Taxol Taxol 24h a.irr., 36% G2/M Taxol 9h a.irr., kein G2/M-Arrest 0,01 0 1 2 3 4 Dosis [Gy] 5 Aus: Pradier et al., J. Cancer Res. Clin Oncol, 1999 6 7 Apoptose-Promotion • Bestimmte Zelltypen oder Gewebe reagieren auf Noxen wie RT, oxidativen Stress, Hypoxie, Zytokinaddition oder-depletion und auf Kombinationen dieser Noxen mit vermehrter Apoptose. • Die wichtigsten sind: Lymphozyten, Thymozyten, Prostata, Speicheldrüsen, Endothelzellen oder Dünndarmkrypten. • Die weit überwiegende Mehrzahl der soliden Tumoren reagiert aber mit dem Mitose-assoziierten (reproduktiven) Zelltod. • Apoptose-Promotion als allgemeingültiger Mechanismus einer verstärkten Strahlenreaktion ist rein spekulativ. Reoxigenierung und Tumorverkleinerung z. Bsp. Taxane • Bestimmte Zytostatika (Mitomycin-C, Tirapazamin) eliminieren spezifisch hypoxische Zellen • Reduktion des Tumorvolumens durch eine Modalität verbessert den Oxigenierungsstatus und steigert de Strahlensensitivität bzw. die Chemosensitivität Sauerstoffgehalt der Tumoren permanente Hypoxie Reoxigenierung möglich Aus: Milas et al., Acta Oncol., 1995 Inhibierung der Tumorproliferation Tumorproliferation während RT (Repopulierung) kann Therapieversagen verursachen • Aktueller Ansatz: – Viele Karzinome (über)exprimieren Rezeptoren der EGF- (epidermal growth factor) Familie – Einsatz von AK gegen den Rezeptor (Cetuximap) oder Unterbrechung der Signaltransduktionskette (TyrosinKinase Hemung) – Präklinische Studien zeigten eine Verstärkung der Strahlenwirkung – erste Phase I/II Studien wurden erfolgreich durchgeführt Beispiel für die Kombination von RT und C225 (AK gegen den EGF-Rezeptor Cetuximap) HNSCC, Xenograft Aus: Harari et al. IJROBP, 2001 Angiogenesehemmung Angiogenese ist für das Tumorwachstum unerlässlich Modell für die tumorinduzierte Angiogenese (Aus:Folkman J., J Clin Oncol, 1994) Tumorzellen produzieren Wachstumsfaktoren (VEGF) Angiogenesehemmung • Hemmung kann zur Tumorreduktion führen • Präklinisch verursachten allein nicht wirksame Dosen eine Strahlensensibilisierung • Klinische Daten mit verschiedenen Angiogenesehemmern nicht eindeutig Tumorwachstumsinhibition Angiostatin+ RT RT allein Angiostatin allein keine Behandlung (Aus: Mauceri et al. 1998 Nature) Gewebespezifität • Manche Verbindungen sind nur in bestimmten Geweben wirksam • Bsp. Estramustin (ein Östradiolabkömmling) ist hochspezifisch für Prostatagewebe • Präklinisch wurde eine Verstärkung der Strahlenwirkung gezeigt • Phase II Studien waren erfolgreich Gentherapie Entwicklung von Ansätzen zur Kombination der Gentherapie mit ionisierender Strahlung. – Strahleninduzierbare Promotoren erlauben eine räumlich genau definierte Aktivierung der gewünschten Prozesse (Pro-Drug-Umbau, tumorspezifische Suizid-Gene) und damit eine höhere Spezifität/ Effektivität und geringere Nebenwirkungen. – experimentelle Daten sind erfolgversprechend, klinische Daten weniger ermutigend Zum Nachlesen











