PowerPoint-Präsentation
Werbung

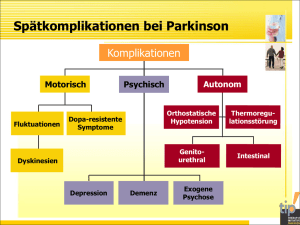
Die Rolle molekularer Targets für die Medikamentenentwicklung 10. GESENT Kongress, Bonn 05.12.2014 Prof. Dr. Peter Riederer University of Wuerzburg 200 Jahre PK Therapie Medik. Neuroprotektion ? Neurorestauration ? Impfung Transplantation Stammzellen? Tiefenhirnstimulation L-DOPA Anticholinergica 1817 James Parkinson 1800 Belladonna 1850 1900 1950 Amantadin Selegilin COMT-H. div.Agonisten 2000 ÄTIOLOGIE DER SPORADISCHEN PARKINSON KRANKHEIT • Unbekannt • Multiple Trigger: Virus, Chemikalien, CO, Schwermetalle • Multiple Gene: α-Syn, ... • Multiple Zelltodmechanismen: Ca++, GLU, APOPTOSE • Multiple Transmitter: DA, NA, 5-HT, GLU, ... • Multiple Phenotypen Die PK- Gen Datenbasis • Metaanalyse (Plasma) von 147 SNPs plus nicht-publizierte GWAS Daten • PK: 16.542 KO: 48.810 • Ergebnis: 11 Loci mit Signifikanz zeigen Bezug zu PK • BST1, CCDC62/HIP1R, DGKQ/GAK, GBA, LRRK2, MAPT, MCCC1/ LAMP3, PARK16, SNCA, STK39 and SYT11/RAB25, ITGA8. Klinische Faktoren beeinflussen die Genexpression • Pathologischer Stress • Agonalzustand /-phase • Chronische Medikation • Verlauf der Krankheit • Variationen des Genpolymorphismus • Ethnische Unterschiede Probleme mit GWAS - Studien • zu hohe Signifikanzbereiche Verlust an Information • man analysiert alle Subtypen der PK in einer Analyse (Notwendigkeit hoher Fallzahlen!) • Fehlen der Interaktion KlinikerGrundlagenwissenschaftler • regional unterschiedliche Genexpression • soziale Unterstützung • Lebenskrisen/-umstände de novo Mutationen • Geninteraktionen different • neue Einblicke / Verfahren der Genetik Epigenetik... Zusammenfassung „Genetik“ • Die Daten zur Genetik der PK sind schwer reproduzierbar und daher (noch) unzuverlässig • Sie stellen daher derzeit keine validierten Ziele für Medikamentenentwicklung dar Mechanismen des dopaminergen Zelltods Exzitotoxizität Mitochondriale Störung Zelltod Apoptose Freie Radikale Anstieg des zytosolischen Ca2+ Proteinaggregation Forschungspipeline – Morbus Parkinson NICE, 2006 Neue Wege, neue Substanzen in klinischen Prüfstudien CoQ10 electron acceptor, antioxidant, complex-I-activator Creatine phosphocreatine, ATP production; creatine kinase inhibits mitoch. transition pore: apoptosis inhibitor GPI-1485 (AMG-474) neuroimmunophillin regenerating properties TCH 346 (CGP 3466(B)) GAPDH-blocker without MAO inhibitory properties Aktuelle Medikamentenentwicklungen • CEP-1347 • IPX 066 Ph 3 Kinasehemmer, Apoptose I Ph 3 Carbidopa/Levodopa extended release Ph 2 Ca++- Kanalblocker Ph 2 GHRELIN-R-AGO • ISRADIPIN CR • RM-131 (Move-PD) • Nicotin Transdermal Ph 2 • Paroxetin/Venla Ph 3 Antidepressivum • GM1 Gangliosid Ph 2 • Ibuprofen Ph 3 Antientzündlich / Schmerz • XPro 1595 Antientzündlich • GDNF Wachstumsfaktor • Antiglutamatergika Clinical Trials GOV Basic Research Parkinson‘s Disease Glial aspects ● synthesis of glutathion / depletion (40%) of GSH ● inflammatory response to dying DA neurons → gliosis → activation of microglia → generation of ROS → release of iron from ferritin → extracellular NM activates microglia Reif and Simmons 1990 Mc Geer and MC Geer 1998 Schipper 2004, 2000 Hunot et al 1996 Zecca et al 2004 Block et al 2007 Wilms et al 2003 Entzündungshemmende Therapiestrategien (GLIA!) • COX-2-Hemmer • Thiadiazolidinon reduziert LPS-indizierte IL-6, TNF-α, iNOS, iCOX-2 Expression (Luna-Medina 2005) • Dextrometorphan hemmt Mikrogliaaktivierung; hemmt LPS induzierte Freisetzung von NO, TNF-α, PGE2, Superoxid (Li 2005) • Minocycline antibiotische Eigenschaften (Zenke 2004) • • • in klinischen Studien negativ Studien Entwicklung 1970 – 1980: Retrospektiv 1980 – 1995: Prospektiv + Behandlung als Endpunkt 1990 – 2002: Prospektiv + PET – Bildgebung 2005: „delayed onset design“ 2011: AMNOG PK-Modelle Nachteile: alle Modelle sind „AKUTMODELLE“ alle Modelle zeigen keine Lateralität alle Modelle sind Akinese / Rigor Modelle Langzeitmodelle sind kein Thema....!!!! Unklare Hierarchie von Zelltodmechanismen Versuchsmedikamente wirken auf vorgegebene Läsion eine Neubewertung der Modelle ist notwendig in Absprache mit Forschungsförderern Parkinson Subtypen • Tremordominanz • Akinetisch-rigider Typ • Äquivalenztyp • Lateralität / li-re-Betroffenheit • Verlaufsdynamik der Progression • Nicht-Motorsymptomausprägung • Differentialdiagnostik der Frühphase: PK-Symptomatik PK Parkinson Subtypen • Medikamentenentwicklung für PK-Subtypen wäre anzustreben, wird aber nicht gemacht Fallzahlen für Studien ev. zu nieder Markt zu klein Entwicklung zu teuer Ramanan and Saykin, 2013 Ramanan and Saykin, 2013 Hauptprobleme für die Entwicklung neuer Psychopharmaka • geänderte Rahmenbedingungen • Disconnect zwischen neurologischer Diagnose (auf Symptomebene) und Medikamentenwirkung (auf neurobiologischer Ebene) • • • Ungenügende Kenntnis der Neurobiologie neurologischer Störungen • • • Diagnosen sind neurobiologische mixed bags Grundlagenforschung ≠ klinische Anwendung Klinik ≠ Industrie es fehlen validierte Targets es fehlen validierte Biomarker Komplexität grosser multizentrischen Studien mit A. Szegedi, 2013 unberechenbaren Risiken R & D Investment nach Entwicklungsphase • • • • • • • Preclinical Phase I Phase II Phase III Approval Phase IV Unspecific 27,3 % 7,4 % 13,0 % 28,5 % 5,0 % 13,4 % 5,2 % Gesamtentwicklungskosten ≈ 1 Milliarde Euro Scheitern in Phase I > 90 % Scheitern in Phase II 300 – 500 Millionen Euro Scheitern in Phase III 50 – 60 % 600 – 800 Millionen Euro A. Szegedi, 2013 200 Jahre PK Therapie Medik. Neuroprotektion ? Neurorestauration ? Impfung Transplantation Stammzellen? Tiefenhirnstimulation L-DOPA Anticholinergica 1817 James Parkinson 1800 Belladonna 1850 1900 1950 Amantadin Selegilin COMT-H. div.Agonisten 2000 Neue Therapiestrategien • Individualisierte Therapie kontinuierliche DA-Versorgung DBS < 70 Jahre Physiotherapie Logopädie • Zellen-basierte Therapie Stimulation der Plastizität • Impfung: α-SYN als Target Erfolgreiche PH 1-Studie (AFF008) von PD01A Zusammenfassung Fehlen von Innovationen bedingt durch: • • • • • Fehlen validierter Targets Fehlen validierter Biomarker Multiple genetische und molekulare Zelltodmechanismen Heterogene statt homogene Patientengruppen Fehlen geeigneter experimenteller Modelle • Mehr bürokratische Hürden und Medikamenten Zulassungsvoraussetzungen Fehlende Akzeptanz für Psychopharmakotherapie in der Öffentlichkeit Kostenexplosion in der medizinischen Versorgung Fehlende Flexibilität der forschenden Arzneimittelunternehmen Strategien zur Medikamentenentwicklung zu hinterfragen (z.B. multifunktionale Medikamente vs. spezifische / selektive Medikamente) • • •