pKs – pH = log 1
Werbung

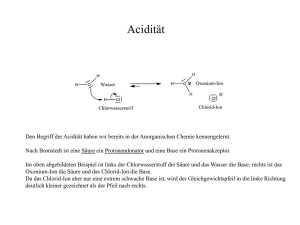
Puffer und schwache Elektrolyte Ein Elektrolyt ist ein Stoff, der in wässriger Lösung in Form von Ionen Die folgende Präsentation illustriert dievorkommt (deshalb leitet diese Lösung den elektrischen Strom). Häufig ist es eine Säure Kapitel VIII und 18 aus dem Buch nach der Gleichung: „Chemie berechnen“ HA D(Wawra/Dolznig/Müllner). H+ + AUnd ein schwacher Elektrolyt ist ein Stoff, bei dem dieses Gleichgewicht eher auf der linken Seite ist, bei dem also in Lösung der Anteil an HA (= der undissoziierte Elektrolyt) überwiegt. Da die Texte teilweise übereinander gelegt sind, man Power-Point auf beschrieben: So ein muss Gleichgewicht wirdim durch das Massenwirkungsgesetz Diese Massenwirkungskonstante deswegen schalten, umheißtalle Bildschirm-Präsentationen [H+] x [A-] Ks, weil die Gleichung ja die Reaktion einer K s = Texte und Animationen sehen können. [HA] Säure beschreibtzu (H dissoziiert ab). + In diesem Gleichgewicht kommen aber H+–Ionen vor. Und nach den Regeln des - / HA von der Massenwirkungsgesetzes ist damit das Verhältnis A Viel Vergnügen. Konzentration an H+ abhängig. Also viel H+ bedeutet viel HA und wenig A-, wenig H+ bewirkt das Gegenteil. Edgar Wawra Das ist übrigens der Grund, warum Chemiker solchen Wert auf die H+-Konzentration legen, sodass sie sogar extra dafür eine eigene Skala, den pH-Wert erfunden haben Also bestimmt der pH-Wert das Verhältnis HA / A(= Verhältnis undissoziierter/dissoziierter Elektrolyt, man könnte auch sagen, protonierte Form/deprotonierte Form). Um das entsprechend zu würdigen, kann man das Massenwirkungsgesetz entsprechend umformen und so die Abhängigkeit vom pHUnd glauben Sie und jetztlogarithmieren, ja nicht, dass schwache Elektrolyte Wert darstellen. Dann erhält man Formel: etwas Ausgefallenes sind.die (Der Eindruck entsteht leicht, weil Hier bedeuten: man in der Chemie zu Anfang alles mit starken Elektrolyten [HA] - erklärt.) Die biologisch bedeutenden pH der negative dekadische Logarith+ und pHwie = Na pKs –Cllog [A ] mus der Konzentration an H+ Verbindungen – also die Stoffe in unserem Körper – sind pKs der negative dekadische oder überwiegend noch allgemeiner: schwache Elektrolyte. Logarithmus von Ks [Protonendonator] HA die saure Form des Elektrolyten pH = pKs – log [Protonenakzeptor] A- dessen anionische Form Das ist die Henderson-Hasselbalch Gleichung, sie wird häufig auch Puffergleichung genannt, sie kann aber mehr als nur Puffer berechnen! Die Gleichung beschreibt die pH-Abhängigkeit der Dissoziation eines schwachen Elektrolyten, sagt uns also, bei welchem pH der Elektrolyt in welcher Form vorliegt. Da kommt aber eine ganz unsympathische, log 10006000 = 6 . mathematische Funktion vor, der Logarithmus. . Nun erinnern wir uns zwar noch, dass man, wenn man die Logarithmen zweier Zahlen addiert, den Logarithmus des Produktes dieser Zahlen erhält. log 1000 = 3 3 log 100 = 2 2 log 10 =1 1 logum 1= 0 dekadischen Es handelt Und das geht weiter, einen eigentlich log(10 xsich 10)sogibtnachist den ganz logarithmischen man Regeln braucht dasnur doppelte die der Logarithmus, d.h. ist 10, 0,1 =die -1Basis Jetzteinfach, dielog Gegenrichtung: -12. 10 ist daher 1. Nullen abzuzählen. Logarithmus von nämlich von Ganz1,wichtig, weil das ist der log 0,01 = -2 Also am Taschenrechner nicht log mit ln Mittelpunkt-2 der logarithmischen Skala. log 0,001 = -3 verwechseln. Der log -3von 1 ist Null ! ! ! ! ! ! ! (das wollen Leute glauben,geht: ist aber so.) Jetzt istviele klar, wienicht es weiter Und ganz wichtig: dereins Logarithmus bei Zahlen kleiner als wird der Logarithmus ist nur für dienegativ. Zahlen Und von unsere Null bisRegel mit dem Abzählen Nullenfür gilt noch unendlich definiert,der NICHT immer, nur bekommen die Zahlen ein negative Zahlen. minus als Vorzeichen. mehrEin Gefühl dafür entwickeln, negativer Logarithmus bedeutet Doch jetzt sollten wir alsoLogarithmen nicht den log einer negativen ja uns sogar ein paar einfache merken. Zahl, sondern es ist der log des Kehrwertes der Zahl. Brrrr !!!! Doch für uns sind jetzt hier eigentlich nur die Zahlen von 1 bis 10 relevant, denn sinnvolle Puffer mischt man nur im Verhältnis 1/10 bis 10/1 . Die Logarithmen von 1 und 10 kennen wir ja schon. Den Logarithmus von 2 sollte man sich unbedingt merken, er ist fast genau 0,3. (Genau ist es 0.30103, aber so genau will es eh niemand wissen.) Und dendass Logarithmus von 3 sollte man kennen, Wir auch merken, die Logarithmen bei höheren genau er 0.47, es genügt, wenn man sich merkt. Zahlenistimmer mehr zusammenrutschen. Im 0.5 vorigen Jahrtausend, man so noch Rechenschieber Und wenn manalsschon weit ist, kann man sich die verwendete,Werte war das geläufig. gerundeten für jedem 4,5,6 und 8 auch noch merken, einfach die nächsten Zahlen: 0.6, 0.7, 0.8 und 0.9 Was noch fehlt sind die Logarithmen für 7 und 9, die braucht man aber ganz selten, nehmen wir einfach die Zwischenwerte. Hier stehen Zahlen, doch die Abstände entsprechen dem Logarithmus. Zahl 1 2 3 4 5 6 7 8 9 10 log 0 0.3 0.5 0.6 0.7 0.8 0.85 0.9 0.95 1 Die Werte sind gerundet, aber genau genug für alle üblichen Rechnungen mit Puffern/Elektrolyten. Kehren wir zu unserer Gleichung zurück: [Protonendonator] pH = pKs – log [Protonenakzeptor] Das ist zwar die übliche Form, doch die ist unpraktisch. Viel vernünftiger wäre es, die Gleichung umzuformen: (den PKs auf die andere Seite, und alles mit minus eins multiplizieren) pKs – pH = log [Protonendonator] [Protonenakzeptor] Differenz Verhältnis ? Was ist der Vorteil davon Sie vergleichen jetzt zwei Dinge miteinander, die Differenz zweier logarithmischer Größen mit dem Logarithmus eines Verhältnisses. Und damit kann man alle Puffer im Kopf berechnen ! ! ! (vorausgesetzt man hat sich die paar notwendigen Logarithmen gemerkt) Im einfachsten Fall haben wir gleiche Konzentrationen von Donator und Akzeptor. Dann ist das Verhältnis eins, der Logarithmus von 1 (Sie erinnern sich) ist Null. Da die Differenz zwischen pKs und pH null ist, ist der pH gleich dem pKs. pKs – pH = log 1 _ pKs – pH = 0 pKs – pH = log _ pKs = pH [Protonendonator] [Protonenakzeptor] Und wenn 10 mal mehr Donator vorhanden ist, als Akzeptor: Das wichtig auch man muss es also sich10, merken: Dann ist haben wirwichtig: einund Verhältnis von 10/1, der log 10 ist 1, also ist der pH-Wert um eins kleiner als der pKs. Bei einem gleichen Verhältnis Konzentrationen der Konzentrationen von Donatorvon undDonator Akzeptorund ist der pKs – pH =10:1 log 10 _1:10 pKs pH pH-Wert = 1 _ umpKs - 1Einheit = pH pH-Wert Akzeptor gleich von dem bzw. pKs. ist–der eine kleiner wir bzw. als Akzeptor der oder pKs. (Verhältnis 1/10), wäre es genau Hätten 10größer mal mehr umgekehrt, dann derPuffer pH-Wert um eins alsnur derSinn, pKs. Bei einem Wenn manpH-Wert, damitwäre einen der dem pKs machen entspricht, will,größer hat haben das wir gleiche pKs – man pH =innerhalb log 0.1 _ pKsBereiches –und pH Akzeptor = -1 _ pKs = pH Konzentrationen vondieses Donator . also wenn bleibt, pH+=1pKs ± 1. Jetzt ein etwas realeres Beispiel: 15 ml Essigsäure (c=0.2mol/l) werden mit 30ml Acetatlösung (c= 0.2mol/l) gemischt. Welchen pH hat die Mischung? (pKs von Essigsäure = 4.7) Nachdem beide Lösungen die gleiche Konzentration haben, Durch diese Überlegung am Schluss, „ist es saurer kann man dieweniger Volumina sauer“, direkt inersparen das Verhältnis einsetzen. oder wir uns die (Natürlich ist die Säure der Protonendonator, das Anion der Akzeptor.) Beachtung aller Vorzeichen, und müssen uns auch von Zahlen pKsnicht – pHmit = Logarithmen log (15/30) = log (1/2)kleiner als eins plagen. Das ist nämlich der Hauptgrund für Fehler, weil man gerne irgendwo[Protonendonator] ein Minus übersieht. Mit pKs – pH = log diesem Trick sind Sie immer auf der sicheren Seite. [Protonenakzeptor] Und jetzt kommt der große Trick: Die andere Zahl muss aber eins sein, wenn also Scheren Sie sich zunächst nicht um Vorzeichen, z.B. 3/2 das Verhältnis wäre, muss man auf und was unter und ober dem Bruchstrich steht. 1.5/1 kürzen, und mit den 1.5 weiter arbeiten. Vergleichen Sie nur Zahlen ! ! ! Im Verhältnis ½ kommt die Zahl 2 vor. Der log2 ist 0.3 Folglich müssen sich pH und pKs um 0.3 unterscheiden. pKs ist 4.7, also ist das Ergebnis 4.7 ± 0.3, entweder 5.0 oder 4.4, da wir weniger Säure haben, wird es weniger sauer sein. Weniger sauer bedeutet höherer pH-Wert, also 5.0 Das Ganze jetzt umgekehrt: Sie wollen eine Mischung aus Essigsäure und Acetat herstellen, die einen pH-Wert von 4.2 hat. In welchem Verhältnis müssen Sie mischen? (pKs von Essigsäure = 4.7) Wir müssen nur die Differenz zwischen pKs und pH beachten. pKs – pH = 4.7 – 4.2 = 0.5 pKs – pH = log [Protonendonator] [Protonenakzeptor] Und jetzt wieder derselbe Trick: Beachten Sie nur den Zahlenwert der Differenz (Vorzeichen spielen keine Rolle) und vergleichen Sie den mit der Liste der Logarithmen ! ! ! Die Differenz ist 0.5, das ist der Logarithmus der Zahl 3. Folglich muss im Verhältnis der beiden Stoffe die Zahl 3 erscheinen, also 1/3 oder 3/1. pH von 4.2 ist saurer als 4.7(=pKs), daher benötigen wir mehr Säure. Also brauchen wir drei Teile Säure für einen Teil Acetat. So eine Mischung, die man sich bereitet, um einen bestimmten pH-Wert zu erhalten, nennt man Puffer. Üblicherweise mischt man einen Puffer aus einer schwachen Säure und ihrem ihrem Salz (die Anionen des Salzes sind der zweite Partner), seltener aus einer schwachen Base und ihrem Salz. ihrem Salz, mischen, nicht irgendeinem anderen Säure !!! Man kann einen Puffer auch anders und dannSalz wirdeiner es komplizierter. Man kann auch z.B.Essigsäure mit Natriumhydroxid mischen, nach der Gleichung: Aber CH3COOH + NaOH D H2O + Na+ + CH3COOEssigsäure Natriumhydroxid Wasser Acetat Ein Beispiel dazu: 15 ml Essigsäure (c=0.2mol/l) werden mit 10ml NaOH-Lösung (c= 0.2mol/l) gemischt. Welchen pH hat die Mischung? (pKs von Essigsäure = 4.7) Würde man jetzt blindlings in die Formel einsetzen: pKs – pH = log 15/10 = log 1.5 Dann käme pH=4.5 heraus, und das ist _ pKs – pH = 0.2 _ pH=4.5 falsch. NaOH ist ja nicht der Protonenakzeptor, sondern das aus gleichen Teilen Essigsäure und NaOH gebildete Acetat. So eine Mischung, die man sich bereitet, um einen bestimmten pH-Wert zu erhalten, nennt man Puffer. Üblicherweise mischt man einen Puffer aus einer schwachen Säure und ihrem Salz (die Anionen des Salzes sind der zweite Partner), seltener aus einer schwachen Base und ihrem Salz. Man kann einen Puffer auch anders mischen, und dann wird es komplizierter. Man kann auch z.B.Essigsäure mit Natriumhydroxid mischen, nach der Gleichung: Ende der Präsentation CH3COOH + NaOH D H2O + Na+ + CH3COOEssigsäure Natriumhydroxid Wasser Acetat Ein Beispiel dazu: 15 ml Essigsäure (c=0.2mol/l) werden mit 10ml NaOH-Lösung (c= 0.2mol/l) gemischt. Welchen pH hat die Mischung? (pKs von Essigsäure = 4.7) Wir haben 15 Teile Essigsäure und 10 Teile NaOH. Davon müssen wir 10 Teile Essig5 Teile 10 Teile 5 Teile Essigsäure 10 Teile 10 Teile Na-Acetat. säure mit 10 Teilen NaOH zu 10 Teilen Na-Acetat vereinigen. Es bleiben 5 Teile Essigsäure übrig. Der Rest ist Routine: pKs – pH = log 5/10 = log 1/2 _ log2 = 0.3 _ pH = pKs ± 0.3 Der pH ist 4.4 oder 5.0 , mit weniger Säure als Acetat ist es 5.0