Kein Folientitel
Werbung

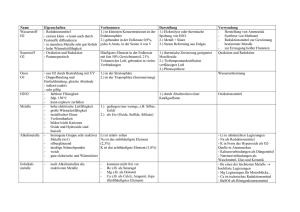
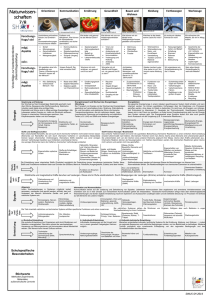
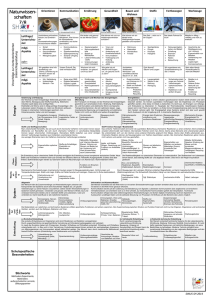
5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - Ionenverbindungen und kovalente Verbindungen sind meist stöchiometrisch zusammengesetzt - bei Verbindungen zwischen Metallen ist das Gesetz der konstanten Proportionen häufig nicht erfüllt, - die Zusammensetzung kann innerhalb weiter Grenzen schwanken: + Beispiel Messing, Schwankungsbreite von Cu0,34Zn0,66 - Cu0,42Zn0,58 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - zur Charakterisierung von Zwei(mehr)stoffsystemen werden Zustandsdiagramme bei konstantem Druck, sogenannte Schmelzdiagramme verwendet 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - Unbegrenzte Mischbarkeit im festen und flüssigen Zustand Silber und Gold sind beide kubisch flächenzentriert; das System Ag-Au bildet eine lückenlose Mischkristallreihe 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - zur Charakterisierung von Zwei(mehr)stoffsystemen werden Zustandsdiagramme bei konstantem Druck, sogenannte Schmelzdiagramme verwendet 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - im System Cu-Au ist ebenfalls unbegrenzte Mischkristallbildung möglich; jedoch tritt hier ein Schmelzpunktminimum auf: 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - im System Cu-Au existieren Überstrukturen, die sich durch relativ höhere elektrische Leitfähigkeit auszeichnen: 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - Mischbarkeit im flüssigen Zustand, Nichtmischbarkeit im festen Zust. Bismut- Cadmium 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - unbegrenzte Mischbarkeit im flüssigen Zustand, begrenzte Mischbarkeit im festen Zustand Kupfer- Silber 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - Mischbarkeit im flüssigen Zustand, keine Mischbarkeit im festen Zustand; Bildung einer neuen Phase Mg- Ge 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - Mischbarkeit im flüssigen Zustand, keine Mischbarkeit im festen Zustand; Bildung einer neuen inkongruent schmelzenden Phase Na-K 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme - Nichtmischbarkeit im festen und flüssigen Zustand Eisen-Blei 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme- häufige intermetallische Phasen - Metalle können ihrer Stellung im PSE nach in 3 Gruppen eingeteilt werden: T1, T2 und B 5 Metalle 5.2 der metallische Zustand Intermetallische Systeme- häufige intermetallische Phasen - Metalle können ihrer Stellung im PSE nach in 3 Gruppen eingeteilt werden: T1, T2 und B - hierdurch wird eine Klassifizierung der intermetallischen Systeme möglich: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Einleitung - alle Nebengruppenelemente sind Metalle - außer den s-Elektronen der äußersten Schale sind auch d-Elektronen der zweitäußersten Schale an chemischen Bindungen beteiligt - die meisten Ionen haben unvollständig besetzte d-Niveaus 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Einleitung - alle Nebengruppenelemente sind Metalle - außer den s-Elektronen der äußersten Schale sind auch d-Elektronen der zweitäußersten Schale an chemischen Bindungen beteiligt - die meisten Ionen haben unvollständig besetzte d-Niveaus - Die Ionen sind häufig gefärbt und neigen zur Komplexbildung 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Einleitung - alle Nebengruppenelemente sind Metalle - außer den s-Elektronen der äußersten Schale sind auch d-Elektronen der zweitäußersten Schale an chemischen Bindungen beteiligt - die meisten Ionen haben unvollständig besetzte d-Niveaus - Die Ionen sind häufig gefärbt und neigen zur Komplexbildung - durch WW paramagnetischer Momente der Ionen kann kollektiver Magnetismus entstehen - viele nichtstöchiometrische Verbindungen 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Komplexverbindungen werden auch als Koordinationsverbindungen bezeichnet - ein Komplex besteht aus dem Koordinationszentrum (Zentralatomoder Ion) und der Ligandenhülle - die Anzahl der vom Zentralteilchen chemisch gebundenen Liganden (Ionen oder Moleküle) wird Koordinationszahl (KZ) genannt 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Beispiele für Komplexverbindungen 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Komplexe sind an ihren typischen Eigenschaften und Reaktionen zu erkennen: + Farbe + elektrolytische Eigenschaften + Ionenreaktionen (z. B. „Maskierung“) 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Komplexe sind an ihren typischen Eigenschaften und Reaktionen zu erkennen: - Komplexe mit einem Koordinationszentrum sind einkernige Komplexe; mehrkernige Komplexe besitzen mehrere Koordinationszentren: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Komplexe sind an ihren typischen Eigenschaften und Reaktionen zu erkennen: - Komplexe mit einem Koordinationszentrum sind einkernige Komplexe; mehrkernige Komplexe besitzen mehrere Koordinationszentren - einzähnige Liganden besetzen im Komplex nur eine Koordinationsstelle, mehrzähnige dagegen mehrere: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - mehrzähnige Liganden, die mehrere Bindungen mit dem gleichen Zentralteilchen unter Ringschluß ausbilden , nennt man Chelatliganden (chelat, gr. Krebsschere) 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - mehrzähnige Liganden, die mehrere Bindungen mit dem gleichen Zentralteilchen unter Ringschluß ausbilden , nennt man Chelatliganden (chelat, gr. Krebsschere) EDTA räumlicher Bau des Chelatkomplexes [Me(EDTA)]2- 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Nomenklatur - zuerst wird der Name der Liganden, dann der des Zentralatoms angegeben - anionische Liganden werden durch ein angehängtes o gekennzeichnet 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Nomenklatur - zuerst wird der Name der Liganden, dann der des Zentralatoms angegeben - anionische Liganden werden durch ein angehängtes o gekennzeichnet - die Ligandenanzahl wird mit den griechischen Präfixen mono, di, tri, tetra, penta, hexa, hepta, octa bezeichnet: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Nomenklatur - zuerst wird der Name der Liganden, dann der des Zentralatoms angegeben - anionische Liganden werden durch ein angehängtes o gekennzeichnet - die Ligandenanzahl wird mit den griechischen Präfixen mono, di, tri, tetra, penta, hexa, hepta, octa bezeichnet - in negativ geladenen Komplexen endet der Name auf -at: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Nomenklatur - zuerst wird der Name der Liganden, dann der des Zentralatoms angegeben - anionische Liganden werden durch ein angehängtes o gekennzeichnet - die Ligandenanzahl wird mit den griechischen Präfixen mono, di, tri, tetra, penta, hexa, hepta, octa bezeichnet - in negativ geladenen Komplexen endet der Name auf -at: - bei verschiedenen Liganden ist die Reihenfolge alphabetisch: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - häufige Kordinationszahlen in Komplexen sind 2, 4 und 6 - die räumliche Anordnung ist dann linear (2), tetraedrisch oder quadratisch-planar (4) und oktaedrisch (6) - für die meisten Komplexe gibt es bei wechselnden Liganden Komplexe mit unterschiedlicher Koordination + z.B. kann Ni2+ oktaedrisch, tetraedrisch und quadratisch-planar koordiniert sein 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - für die meisten Komplexe gibt es bei wechselnden Liganden Komplexe mit unterschiedlicher Koordination + z.B. kann Ni2+ oktaedrisch, tetraedrisch und quadratisch-planar koordiniert sein - andere Ionen bevorzugen dagegen bestimmte Koordinationen: + Cr3+, Co3+ und Pt4+ die oktaedrische, + Pt2+ und Pd2+ die quadratisch-planare und + Ag+, Cu+ und Au+ die lineare Koordination 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen räumlicher Bau, Stereoisomerie 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen räumlicher Bau, Stereoisomerie 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen räumlicher Bau, Stereoisomerie 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen räumlicher Bau, Stereoisomerie 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - Komplexe, die dieselbe chemische Zusammensetzung und Ladung, aber einen verschiedenen räumlichen Aufbau haben, sind stereoisomer - man unterscheidet die folgenden Arten der Stereoisomerie: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 1: Cis/trans - Isomerie + zwei mögliche räumliche Anordnungen beim quadratisch- planaren Komplex Pt(NH3)2Cl2 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 1: Cis/trans - Isomerie + auch möglich bei oktaedrischen Komplexen; Beispiel [Cr(NH3)4Cl2]+ 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 1: Cis/trans - Isomerie + zwei mögliche räumliche Anordnungen beim quadratisch- planaren Komplex Pt(NH3)2Cl2 + auch möglich bei oktaedrischen Komplexen; Beispiel [Cr(NH3)4Cl2]+ + bei tetraedrischen Komplexen ist keine cis/trans-Isom. mögl. 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 2: Optische Isomerie (Spiegelbildisomerie) + bei tetraedrischer Koordination mit 4 verschiedenen Liganden treten zwei Formen auf, die sich nicht zur Deckung bringen lassen 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 2: Optische Isomerie (Spiegelbildisomerie) + bei tetraedrischer Koordination mit 4 verschiedenen Liganden treten zwei Formen auf, die sich nicht zur Deckung bringen lassen 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 2: Optische Isomerie (Spiegelbildisomerie) + bei tetraedrischer Koordination mit 4 verschiedenen Liganden treten zwei Formen auf, die sich nicht zur Deckung bringen lassen 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie en - 2: Optische Isomerie (Spiegelbildisomerie) + bei oktaedrischer Koordination tritt optische Isomerie häufig in Chelatkomplexen auf 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 2: Optische Isomerie (Spiegelbildisomerie) + bei tetraedrischer Koordination mit 4 versch. Liganden treten zwei Formen auf, die sich nicht zur Deckung bringen lassen + bei oktaedrischer Koordination tritt optische Isomerie häufig in Chelatkomplexen auf + optische Isomere bezeichnet man auch als enantiomorph oder enantiomer; sie besitzen bis auf eine Ausnahme gleiche phys. Eigenschaften: Polarisiertes Licht wird entgegenges. gedreht 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 3: Salzisomerie + tritt auf, wenn Liganden wie CN- oder NO2- durch verschiedene Atome an das Zentralteilchen gebunden sind Beispiel: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 4: Koordinationsisomerie + tritt auf bei Verbindungen, bei denen Anionen und Kationen Komplexe sind: Beispiel: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 5: Ionenisomerie + in einer Verbindung kann ein Ion als Ligand im Komplex oder außerhalb des Komplexes gebunden sein: Beispiel: + ein spezieller Fall der Ionenisomerie ist die Hydratisomerie: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Stabilität - für Komplexbildungsreaktionen gilt das MWG: - K wird Stabilitätskonstante des Komplexes genannt 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Stabilität - für Komplexbildungsreaktionen gilt das MWG - K wird Stabilitätskonstante des Komplexes genannt, Beispiele: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - Kohlenmonoxid bildet mit dem einsamen Elektronenpaar am Kohlenstoffatom eine dative s-Bindung Ligand Metall 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - die dadurch am Metallatom entstehende hohe Elektronendichte kann durch eine p-Rückbindung zum CO erniedrigt werden 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - Kohlenmonoxid bildet mit dem einsamen Elektronenpaar am Kohlenstoffatom eine dative s-Bindung Ligand Metall - die dadurch am Metallatom entstehende hohe Elektronendichte kann durch eine p-Rückbindung zum CO erniedrigt werden - die resultierende Bindung besitzt zwei mesomere Formeln 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - die Zusammensetzung der meisten Carbonyle kann mit der 18-Elektronenregel (Edelgasregel) vorhergesagt werden: + Anzahl der Valenzelektronen des Metallatoms + Anzahl der von den Liganden für s-Bindungen stammenden Elektronen = 18 + es wird die Valenzelektronenkonfiguration des nächsthöheren Edelgases erreicht 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - die Zusammensetzung der meisten Carbonyle kann mit der 18-Elektronenregel (Edelgasregel) vorhergesagt werden: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - die Zusammensetzung der meisten Carbonyle kann mit der 18-Elektronenregel (Edelgasregel) vorhergesagt werden - die kristallinen Carbonyle sublimieren im Vakuum - die bei RT flüssigen Carbonyle sind flüchtig, leicht entzündlich und sehr giftig! 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - zweikernige Carbonyle sind kristalline, meist farbige Substanzen mit niedrigen Schmelzpunkten - reaktionsfähiger als einkernige Carbonyle - Ru2(CO)9 und Os2(CO)9 zersetzen sich bei Raumtemperatur 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - zweikernige Carbonyle sind kristalline, meist farbige Substanzen mit niedrigen Schmelzpunkten 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - zweikernige Carbonyle sind kristalline, meist farbige Substanzen mit niedrigen Schmelzpunkten - reaktionsfähiger als einkernige Carbonyle - Ru2(CO)9 und Os2(CO)9 zersetzen sich bei Raumtemperatur - wenige mehrkernige Carbonyle sind existent: + Me3(CO)12 Me = Fe, Ru, Os + sie sind ebenfalls farbig, zersetzlich und sublimierbar 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - zweikernige Carbonyle sind kristalline, meist farbige Substanzen mit niedrigen Schmelzpunkten - reaktionsfähiger als einkernige Carbonyle - Ru2(CO)9 und Os2(CO)9 zersetzen sich bei Raumtemperatur 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - wenige mehrkernige Carbonyle sind existent: + Me3(CO)12 Me = Fe, Ru, Os + sie sind ebenfalls farbig, zersetzlich und sublimierbar 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - von Elementen der VIII. NG sind vierkernige Komplexe bekannt: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die Bindung Ligand Metall wird bei diesen Komplexen von den p-Elektronen organischer Verbindungen errichtet. - wie bei den Metallcarbonylen werden auch diese komplexe durch eine p-Rückbindung stabilisiert - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein - die resultierenden Komplexe haben ebene Ringsysteme, z.B.: + Dibenzolchrom (C6H6)2Cr 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein - die resultierenden Komplexe haben ebene Ringsysteme, z.B.: + Dibenzolchrom (C6H6)2Cr + Ferrocen, (C6H5)2Fe, der wichtigste Cyclopentadienyl (cp) komplex ist orange; Fe besitzt die Oxidationszahl +2; Ringe „auf Lücke“ 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein - die resultierenden Komplexe haben ebene Ringsysteme, z.B.: + Dibenzolchrom (C6H6)2Cr + Beim homologen Ruthenocen, (C6H5)2Ru liegen die cp-Ringe auf Deckung 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein - die katalytische Wirkung von Platinverbindungen bei der Oxidation von Alkenen beruht auf der intermediären Bildung von p-Komplexen - Alkene mit konjugierten Doppelbindungen können Chelate bilden: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - Alkene mit konjugierten Doppelbindungen können Chelate bilden: 5 Metalle 5.3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - Alkene mit konjugierten Doppelbindungen können Chelate bilden - Alkine können zwei p-Elektronenpaare für Bindungen zur Verfügung stellen und z.B. zwei CO-Moleküle ersetzen: 5 Metalle 5.4 die 1. Nebengruppe Gruppeneigenschaften Cu 5 Metalle 5.4 die 1. Nebengruppe Gruppeneigenschaften Ag Cu 5 Metalle 5.4 die 1. Nebengruppe Gruppeneigenschaften Ag Cu Au 5 Metalle 5.4 die 1. Nebengruppe Gruppeneigenschaften - 5 Metalle 5.4 die 1. Nebengruppe Gruppeneigenschaften - die Metalle der 1. NG werden auch als Münzmetalle bezeichnet - aufgrund der Elektronenkonfiguration Auftreten in der Ox-stufe +1, daneben auch +2 und +3 möglich, seltener +4, +5 - stabilste Ox-stufen für Cu +2, für Ag +1, für Au +3 - zu den Alkalimetallen besteht nur formale Ähnlichkeit : d10- Konfiguration schirmt Kernladung nicht so wirkungsvoll ab wie eine Edelgaskonfiguration, daher Ionisierungsenergien größer edlerer Charakter 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - alle Münzmetalle kristallisieren kubisch-flächenzentriert mit hohen Schmelzpunkten - Kupfer ist hellrot, zäh und dehnbar - Cu besitzt nach Ag die höchste elektrische Leitfähigkeit 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - alle Münzmetalle kristallisieren kubisch-flächenzentriert mit hohen Schmelzpunkten - Kupfer ist hellrot, zäh und dehnbar - Cu besitzt nach Ag die höchste elektrische Leitfähigkeit - mit Sauerstoff bildet sich an der Oberfläche eine fest haftende Schicht von Cu2O 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - mit Sauerstoff bildet sich an der Oberfläche eine fest haftende Schicht von Cu2O - an CO2- und SO3- haltiger Luft bilden sich fest haftende Deckschichten von basischem Carbonat Cu2CO3(OH)2 und Cu2SO4(OH)2 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - mit Sauerstoff bildet sich an der Oberfläche eine fest haftende Schicht von Cu2O - an CO2- und SO3- haltiger Luft bilden sich fest haftende Deckschichten von basischem Carbonat Cu2CO3(OH)2 und Cu2SO4(OH)2 - Cu ist toxisch für niedere Organismen (Bakterien, Algen, Pilze „Hausmittel“ Pfennig in Blumenvase, Kupfernagel in Nachbars Baum) 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - Cu wird von konz. Schwefelsäure und Salpetersäure, nicht aber von Salzsäure gelöst 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - Cu ist ein recht häufiges Metall, am häufigsten sind Sulfide - wichtige Kupfermineralien sind Kupferkies CuFeS2, Kupferglanz Cu2S, Bornit Cu5FeS4, Covellin CuS, Rotkupfererz Cu2O, Malachit Cu2(OH)2CO3, Azurit Cu3(OH)2(CO3)2 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - Ausgangspunkt der Kupferherstellung ist der Kupferkies CuFeS2 - zunächst wird der Eisenanteil in das Oxid überführt - danach erfolgt eine Röst-Reaktion 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - das so gewonnene Rohkupfer bedarf der elektrolytischen Raffination: 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - das so gewonnene Rohkupfer bedarf der elektrolytischen Raffination - nach Eisen und Aluminium ist Kupfer das wichtigste Gebrauchsmetall - breite Verwendung aufgrund hoher thermischer (Wärmetauscher) und elektrischer (Elektroindustrie) Leitfähigkeit sowie der guten Korrosionsbeständigkeit (Schiffbau, chemischer Apparatebau, Braukessel) 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - wichtige Kupferlegierungen sind Messing (Cu-Zn) 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - wichtige Kupferlegierungen sind Messing (Cu-Zn) , Bronze (Cu-Sn) 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Cu - wichtige Kupferlegierungen sind Messing (Cu-Zn) , Bronze (Cu-Sn) oder Neusilber (Alpaka, 60% Cu, 20% Ni, 20% Zn) 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Ag - Silber ist ein weißglänzendes, weiches, dehnbares Metall - es besitzt die höchste thermische und elektrische Leitfähigkeit aller Metalle 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Ag - Silber ist ein weißglänzendes, weiches, dehnbares Metall - es besitzt die höchste thermische und elektrische Leitfähigkeit aller Metalle - wird von O2 nicht angegriffen - mit H2S bildet sich in Gegenwart von Sauerstoff schwarzes Ag2S 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Ag - Ag wird nur von oxidierenden Säuren wie Salpetersäure und konz. Schwefelsäure gelöst - in Gegenwart von O2 löst es sich auch unter Komplexbildung in Cyanidlösungen - Silber ist wie Cu für Mikroorganismen toxisch; Silbersalze finden bei der Wassersterilisation Verwendung 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Ag - Ag (Silber) gehört wie Au (Gold) zu den seltenen Elementen, Lagerstätten mit gediegenem Silber sind weitgehend abgebaut 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Ag - Ag (Silber) gehört wie Au (Gold) zu den seltenen Elementen, Lagerstätten mit gediegenem Silber sind weitgehend abgebaut - in sulfidischen Erzen ist Ag - meist unter 0,1% - enthalten; daher wird Ag als Nebenprodukt bei der Pb- und Cu-Herstellung gewonnen - wichtige Silbermineralien sind Silberglanz (Argentit) Ag2S, Pyrar- gyrit Ag3SbS3 und Proustit Ag3AsS3 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Ag - Silber fällt als Nebenprodukt bei der Kupferraffination an - aus seinen Erzen wird Silber durch Cyanidlaugerei gewonnen: 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Ag - Silber ist für die meisten Verwendungen zu weich, daher wird es für den Gebrauch legiert (Ag-Gehalt wird auf 1000 Gewichtsteile bez.) - Verwendungen: + Münzen + Versilberungen + Elektronik 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Ag - Silber ist für die meisten Verwendungen zu weich, daher wird es für den Gebrauch legiert (Ag-Gehalt wird auf 1000 Gewichtsteile bez.) - Verwendungen: + Spiegel + Gebrauchs- gegenstände + Fotoindustrie 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Au - Gold ist „goldgelb“, das geschmeidigste und duktilste Metall + zu einer Dicke von 0,00001 mm auswalzbar! - 70% der Leitfähigkeit des Silbers - chemisch inert, wird nur von Königswasser und in GG von O2 von CN- angegriffen Gold + HCl Königswasser 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Au - Gold kommt hauptsächlich gediegen vor, aber meist mit Ag legiert - Gold in Primärlagerstätten heißt Berggold Goldnugget, AUS 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Au - Gold kommt hauptsächlich gediegen vor, aber meist mit Ag legiert - Gold in Primärlagerstätten heißt Berggold - Nach Gesteinsverwitterung weggeschmemmtes Gold lagert sich im Flußsand in Form von Goldstaub oder Goldkörnern als Seifen- oder Waschgold ab und kann dort durch „Waschen“ gewonnen werden 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Au - Nach Gesteinsverwitterung weggeschmemmtes Gold lagert sich im Flußsand in Form von Goldstaub oder Goldkörnern als Seifen- oder Waschgold ab und kann dort durch „Waschen“ gewonnen werden Altertum, l. Rheingoldwäscher, r. 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Au - Nach Gesteinsverwitterung weggeschmemmtes Gold lagert sich im Flußsand in Form von Goldstaub oder Goldkörnern als Seifen- oder Waschgold ab und kann dort durch „Waschen“ gewonnen werden Brasilien, l. Ekuador, r. 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Au - aus seinen Erzen wird Gold wie Silber durch Cyanidlaugerei gew. - beim Amalgamverfahren wird aus feingemahlenem Gestein Gold mit Quecksilber als Amalgam abgetrennt, das Hg wird danach destillativ abgetrennt - Effektivität bei der Cyanidlaugerei 95 %, beim Amalgamverfahren 65 % - Au entsteht als Nebenprodukt der Pb- oder Cu-Herstellung Umweltrisiken der Cyanidlaugerei hier die vergiftete Theis (H/ROM) 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Au - Gold findet Verwendung als Münz- (meist mit 10% Cu) oder als Schmuckmetall 5 Metalle 5.4 die 1. Nebengruppe die Elemente - Au - Gold findet Verwendung als Münz- (meist mit 10% Cu) oder als Schmuckmetall, der Au-Gehalt wird auf 1000 Gewichtsteile bezogen oder in „Karat“ ausgedrückt: 24 Karat 100 % Au 18 Karat 75 % Au, 750er Gold - Au wird ebenso wie Ag in der Elektronik verwendet - Weißgold ist ist eine Legierung mit Cu, Ni, Ag (1/4 bis 1/3 Au) 5 Metalle 5.5 die 2. Nebengruppe Gruppeneigenschaften 5 Metalle 5.5 die 2. Nebengruppe Gruppeneigenschaften Zn 5 Metalle 5.5 die 2. Nebengruppe Gruppeneigenschaften Cd Zn 5 Metalle 5.5 die 2. Nebengruppe Gruppeneigenschaften Cd Zn Hg 5 Metalle 5.5 die 2. Nebengruppe Gruppeneigenschaften 5 Metalle 5.5 die 2. Nebengruppe Gruppeneigenschaften - alle Elemente treten in der Oxadationsstufe +2 auf - Verbindungen höherer Oxidationsstufen sind bisher nicht isoliert worden - die Oxidationsstufe +1 ist nur für Hg von Bedeutung (als Hg22+) - die Elemente bilden nur Verbdg. mit voll besetzten Unterschalen keine Übergangselemente - die Ionen Me2+ und Hg22+ sind daher farblos - ähnlich den Übergangselemente gibt es jedoch mit Ausnahme von Carbonylen zahlreiche Komplexe 5 Metalle 5.5 die 2. Nebengruppe Gruppeneigenschaften - Zink und Cadmium sind sich chemisch recht ähnlich, Hg ist edler - Hg22+ ist stärker polarisierbar und bildet kovalente Verbindungen - analoge Zn- und Cd- Verbdg. sind besser löslich als die Hg-Verbdg. - Hg22+ - Komplexe sind stabiler als die von Zn2+ und Cd2+ - Zn2+ - Ionen sind tetraedrisch- Cd2+ - Ionen oktaedrisch koordiniert - für Hg(II) ist (ähnlich Cu(I), Ag(I) und Au(I)) die lineare Koordination typisch - geringe Ähnlichkeit zu Elementen der 2. HG (Ausn. Zn2+ Mg2+ ) 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn - Zink ist ein bläulich - weißes Metall; hochrein ist es duktil - oberhalb 200 °C und verunreinigt ist es spröde - der Dampf besteht aus Zn - Atomen - Zn ist ein unedles Metall alchemistisches Symbol 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn - Zink ist ein bläulich - weißes Metall; hochrein ist es duktil - oberhalb 200 °C und verunreinigt ist es spröde - der Dampf besteht aus Zn - Atomen - Zn ist ein unedles Metall, - jedoch wird es durch Schutzschichten aus Oxid, Carbonat bzw. Hydroxid passiviert - Zn löst sich auch in Laugen (amphoter) unter Wasserstoffentwicklung und Bildung von Hydroxokomplexen 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn - Zink kommt in der Natur nicht elementar vor - die wichtigsten Zinkerze sind Zinkblende ZnS und Zinkspat ZnCO3 Zinkblende Zinkspat 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn - Zink kommt in der Natur nicht elementar vor - die wichtigsten Zinkerze sind Zinkblende ZnS und Zinkspat ZnCO3 - Zink wird thermisch oder elektrolytisch dargestellt; zunächst erfolgt die Röstung von Zinkerz: 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn - Zink wird thermisch oder elektrolytisch dargestellt; zunächst erfolgt die Röstung von Zinkerz: - 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn - Zinkverwendungen : + Dächer, Dachrinnen + Trockenbatterien 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn - Zinkverwendungen: + Dächer, Dachrinnen + Trockenbatterien + Zn-Staub als Reduktionsmittel + Zinküberzüge (Feuerverzinken o. galvanisch) + Legierungen (Messing) 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn einige Reaktionen des Zinks: - alle wichtigen Zinkverbindungen enthalten Zink in der Oxidations- stufe +2 - Zinkoxid entsteht durch Entwässerung von Zn(OH)2, durch thermische Zersetzung von ZnCO3 oder durch Oxidation von Zinkdampf an der Luft dargestellt: 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn einige Reaktionen des Zinks: - die Darstellung von Zinkhalogeniden kann durch Auflösen von Zn in Halogenwasserstoffsäuren erfolgen: - das technisch wichtigste Zinksalz ZnSO4 wird technisch durch Auflösen von Zinkschrott in verdünnter Schwefelsäure hergestellt 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Zn einige Reaktionen des Zinks: - Zinksulfid ZnS kann aus den Elementen dargestellt werden Zn + S ZnS 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Cd - Cadmium ist ein silberweißes Metall, edler und duktiler als Zink - beständig an der Luft, schwerlöslich in nichtoxidierenden Säuren, leicht in verdünnter Salpetersäure - von Laugen wird Cd nicht gelöst - Cadmium ist stark toxisch; sowohl die Aufnahme löslicher Cadmiumsalze als auch die Inhalation von Cadmiumdämpfen ist gefährlich 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Cd - Cadmium kommt wie Zink nicht elementar vor - Cd ist in den meisten Zinkerzen mit 0,2 - 0,4% enthalten; daher wird es als Nebenprodukt bei der Zinkherstellung gewonnen - Cadmiumminerale spielen für die technische Erzeugung keine Rolle - Cd-Verwendungen: + in wiederaufladbaren Batterien 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Cd - Cd-Verwendungen: + Schutzüberzüge wie bei Zink + aufgrund des hohen Neutroneneinfangquerschnittes Einsatz als Material für Regelstäbe (3) in Kernreaktoren + Bestandteil niedrig schmelzender Legierungen (z.B. im Woodschen Metall) 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Cd einige Reaktionen des Cadmiums: - Cd(OH)2 löst sich in Säuren und in sehr starken Basen als [Cd(OH)4]2- - in NH3 löst sich Cd(OH)2 unter Bildung von [Cd(NH3)4]2+ - die Cd-Halogenide CdX2 bilden mit Halogenidionen die Komplexe CdX3- und CdX42- - CdS (Cadmiumgelb wird als gelbes Pigment verw., CdSe als rotes Pigment 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Cd einige Reaktionen des Cadmiums: - Cd(OH)2 löst sich in Säuren und in sehr starken Basen als [Cd(OH)4]2- - in NH3 löst sich Cd(OH)2 unter Bildung von [Cd(NH3)4]2+ - die Cd-Halogenide CdX2 bilden mit Halogenidionen die Komplexe CdX3- und CdX42- - CdS (Cadmiumgelb wird als gelbes Pigment verw., CdSe als rotes Pigment - CdS ist photoleitend Belichtungsmesser 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg - Quecksilber (engl. mercury) 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg - Quecksilber ist ein silberglänzendes Metall, das bei -39 °C erstarrt - hoher Dampfdruck; der Dampf besteht aus Hg-Atomen - Hg-Dämpfe sind sehr giftig und verursachen chronische Vergiftungen; verschüttetes Hg ist deshalb sofort mit Zinkstaub (Amalgambildung) oder Iodkohle (Reduktion zu HgI2) unschädlich zu machen 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg - Quecksilber ist ein edles Metall und unterscheidet sich in seinen Rkn von Zink und Cadmium - wird von Salpeter- nicht aber von Salz- oder Schwefelsäure gelöst - bei RT ist Hg beständig gegen O2, Wasser, CO2, SO2, HCl, H2S, NH3 - reagiert mit Halogenen und Schwefel, ab 300 °C mit O2 HgO HgO Hg + 0,5 O2 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg - das einzige für die Gewinnung von Quecksilber bedeutende Mineral ist der Zinnober HgS - Quecksilber erhält man hieraus durch Rösten: - Hg entweicht dampfförmig und wird kondensiert 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg - Quecksilber findet vielseitige Verwendung: + Füllung in wiss. Geräten (Thermometer, Barometer) + Hg-Dampflampen (hoher UV-Anteil) 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg - Quecksilber findet vielseitige Verwendung: + Füllung in wiss. Geräten (Thermometer, Barometer) + Hg-Dampflampen (hoher UV-Anteil) + Kathodenmaterial für die Chloralkalielekrolyse + Extraktionsmittel bei der Goldgewinnung + als Silberamalgam in der Zahnmedizin 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - wichtig ist das Disproportionierungsgleichgewicht - die dadurch eingeschränkte Stabilität von Hg(I)-Verbindungen zeigt sich exemplarisch in folgenden Rkn: 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - beim Erhitzen an der Luft auf 300 - 350 °C erhält man orthorhomb. rotes HgO, das oberhalb 400 °C wieder zerfällt - es ist polymer aus Zickzackketten aufgebaut: 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - beim Erhitzen an der 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - HgCl2 bildet mit gasförmigem Ammoniak das weiße, sogenannte „schmelzbare Präzipitat“: - das „unschmelzbare Präzipitat“ bildet sich aus Hg2Cl2 + NH3 und hat eine Zickzackkettenstruktur: 5 Metalle 5.5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - aus „Neßlers Reagenz“ K2[HgI4] entsteht mit Ammoniak ein orangefarbener Niederschlag von [Hg2N]I (Christobalitstruktur) 5 Metalle 5.6 die 3. Nebengruppe Gruppeneigenschaften 5 Metalle 5.6 die 3. Nebengruppe Gruppeneigenschaften Sc 5 Metalle 5.6 die 3. Nebengruppe Gruppeneigenschaften Y Sc 5 Metalle 5.6 die 3. Nebengruppe Gruppeneigenschaften Y Sc La 5 Metalle 5.6 die 3. Nebengruppe Gruppeneigenschaften 5 Metalle 5.6 die 3. Nebengruppe Gruppeneigenschaften - aufgrund ihrer Elektronenkonfiguration treten die Elemente der 3. NG ausschließlich in der Oxidationsstufe +3 auf - die Me3+ - Ionen besitzen Edelgaskonfiguration und sind farblos - Eigenschaften ähneln mehr denen der 2. HG denn denen der 2. NG - es bestehen Ähnlichkeiten zur Chemie des Aluminiums 5 Metalle 5.6 die 3. Nebengruppe Gruppeneigenschaften - aufgrund ihrer Elektronenkonfiguration treten die Elemente der 3. NG ausschließlich in der Oxidationsstufe +3 auf - die Me3+ - Ionen besitzen Edelgaskonfiguration und sind farblos - Eigenschaften ähneln mehr denen der 2. HG denn denen der 2. NG - es bestehen Ähnlichkeiten zur Chemie des Aluminiums - insbesondere Scandium ist wie Al amphoter - zusammen mit den Lanthanoiden werden Scandium, Yttrium und Lanthan als Seltenerdmetalle bezeichnet 5 Metalle 5.6 die 3. Nebengruppe Gruppeneigenschaften - die Metalle sind unedel und reaktionsfreudig - Zunahme der Ionenradien bewirkt Zunahme der Basizität der Hydroxide: + Sc(OH)3 ist amphoter + La(OH)3 eine ziemlich starke Base - Fluoride, Sulfate, Oxalate und Carbonate sind schwerlöslich - geringe Neigung zur Komplexbildung - Actinium Ac ist radioaktiv und kommt als radioaktives Zerfallsprodukt vor 5 Metalle 5.6 die 3. Nebengruppe die Elemente - in elementarem Zustand kristallisieren Sc, Y und La in typischen Metallstrukturen - es sind silberweiße, duktile Metalle - Sc und Y sind Leichtmetalle Lanthan 5 Metalle 5.6 die 3. Nebengruppe die Elemente - in elementarem Zustand kristallisieren Sc, Y und La in typischen Metallstrukturen - es sind silberweiße, duktile Metalle - Sc und Y sind Leichtmetalle - die Elemente der NG 3 sind unedler als Al und reagieren dementsprechend mit Säuren unter Wasserstoffentwicklung - in der Atmosphäre und in Wasser sind sie beständig, da sich passivierende Deckschichten bilden 5 Metalle 5.6 die 3. Nebengruppe die Elemente - entgegen ihrem Namen sind Sc, Y und La nicht selten, sondern ebenso häufig wie Blei und Zink - die Anreicherung in Lagerstätten ist allerdings gering - die wenigen wichtigen Mineralien sind: + Thortveitit (Y,Sc)2[Si2O7] 5 Metalle 5.6 die 3. Nebengruppe die Elemente - entgegen ihrem Namen sind Sc, Y und La nicht selten, sondern ebenso häufig wie Blei und Zink - die Anreicherung in Lagerstätten ist allerdings gering - die wenigen wichtigen Mineralien sind: + Thortveitit (Y,Sc)2[Si2O7] + Gadolinit Be2Y2Fe[Si2O8]O2 + Xenotim YPO4 - La kommt als Begleiter der Lanthanoiden, vor allem des Cers, vor 5 Metalle 5.6 die 3. Nebengruppe die Elemente - alle Metalle können durch Reduktion der Fluoride mit Ca oder Mg hergestellt werden: - Mg-Sc - Legierungen werden in der Kerntechnik als Neutronenfilter verwendet - in Magnetspeichern erhöht Dotierung mit Sc2O3 eine schnelle Ummagnetisierung - Rohre aus Yttrium dienen in der Kerntechnik als Brennstabummantel. 5 Metalle 5.6 die 3. Nebengruppe die Elemente - große Mengen Yttriumverbindungen werden in der Farbfernsehtecnik als Farbkörper (rote Fluoreszenz) verwendet - flüssiges Lanthan dient zur Plutoniumextraktion aus geschmolzenem Uran - eine Co.Y - Legierung dient als hervorragendes Material für Permanentmagnete 5 Metalle 5.6 die 3. Nebengruppe die Elemente einige Reaktionen von Sc, Y und La - Scandiumverbindungen ähneln den Aluminiumverbindungen - ScF3 ist schwerlöslich in Wasser, ScCl3 ScBr3 und ScI3 sind hygroskopisch und leichtlöslich - mit Halogeniden bilden sich die Halogenokomplexe [ScF6]3- (Kryolith-Analoga!) und [ScCl6]3- Sc(OH)3 ist eine schwache Base und weniger amphoter als Al(OH)3, in NaOH-Lösungen löst es sich unter Bildung von Na3[Sc(OH)6] 5 Metalle 5.6 die 3. Nebengruppe die Elemente einige Reaktionen von Sc, Y und La - Yttriumverbindungen ähneln den Scandiumverbindungen - Yttriumhydroxid ist stärker basisch und stärker löslich als Sc(OH)3 - LaF3 ist in Wasser schwerlöslich, es existieren die Fluorokomplexe [LaF4]- und [LaF6]3- - La2O3 wird durch Erhitzen von La(OH)3 oder durch Verbrennen von Lanthan erhalten