Vorlesung 00 Materie und Strahlung II
Werbung

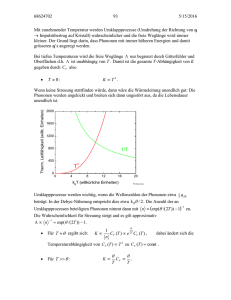
Strahlung und Materie: Teil II Zusammenfassung Teil I (Phänomenologie) • Strahlungsfeld • Intensität Iν, Energiefluss (Energie/Flächeneinheit), Leuchtkraft, Strahlungsstrom • thermodynamisches Gleichgewicht: Strahlung ist isotrop und Iν=Bν(T) (Planck-Funktion) • Hohlraumstrahlung (Strahlung eines schwarzen Körpers) 2h 3 1 I B (T ) 2 h /kT c e 1 • Wiensche’s Verschiebungsgesetz maxT 0.290 cm K 2h 3 h /kT 2h 2 • Grenzfälle: ν>>νmax : B (T ) 2 e , ν<<νmax : B (T ) 2 kT c c • Totale Flächenhelligkeit (Stefan-Bolzmann Gesetz): F 0 • Strahlungstransportgleichung I ( ) I e • im LTE: dI I B (T(s)) ds 2 • Dopplereffekt v 1 r c v 0 1 r c 1 ; /2 2 S e B (T )cos sin d d d BT 4 0 0 ( ' ) d ' mit dτν =κνds, Sν=εν/κν 0 Magnitudenskala S1 10 0.4(m1 m2 ) S2 • Der Energieaustausch zwischen dem elektromagnetischen Strahlungsfeld und stellarer Materie erfolgt durch Änderung der Energie freier und gebundener Elektronen, verbunden mit Absorption und Emission von Photonen • Fragen: welche Übergänge sind möglich? was ist das Verhältnis der Anzahl N der Atome (oder Ionen) in einem bestimmten Energiezustand? wie erklären wir die Spektrallinien? • Boltzmann-Gleichung • Saha-Gleichung • Atomare/molekulare Übergänge Boltzmann-Gleichung • Betrachte freie, nicht-entartete Atome mit einem angeregten Elektron. Die Energie des Atoms A ist die Summe aus kinetischer plus Anregungsenergie Ei: p A2 E Ei 2m A • Die Anzahl der Quantenzustände im Intervall (E, E+dE) ist (wobei gi=die Entartung des angeregten Zustandes, “statistisches Gewicht” oder Anzahl der Einzelzustände, die zur Energie Ei beitragen): d 3 xd 3 p A dg A gi 3 h • Integration über die Verteilungsfunktion liefert: 3/2 2 gi A Ei /kT (2 m kT ) p A /(2mA kT ) 3 3 A Ei /kT A Ni d Ni 3 e e e d xd p V e e A 3 h h • oder (wobei ni= Anzahldichte der Atome mit einem Elektron im Quantenzustand i): Ni (2 mAkT )3/2 A Ei /kT ni e e 3 V h Boltzmann-Gleichung • Daraus folgt das Verhältnis der Anzahldichten der Atome in zwei unterschiedlichen Energiezuständen Ei und Ej: E j Ei exp ni gi kT nj gj Boltzmann-Faktor Boltzmann-Gleichung für das Verhältnis der Besetzungszahlen • Beispiel: Wasserstoffatom -> Entartung der Energiezustände ist 2n2 (n=Hauptquantenzahl) Grundzustand: E = -13.6 eV, n=1, g1=2 1. Angeregter Zustand: E = -3.4 eV, n=2, g2 = 8 2. Angeregter Zustand: E = -1.5 eV, n=3, g3 = 18 • Sei Gas aus neutralem Wasserstoff; bei welcher T sind gleich viele Atome im Grundzustand und im ersten angeregten Zustand? Boltzmann-Gleichung • Wir setzen n1 = n2 in der Boltzmann-Gleichung und erhalten: Relative Besetzung des 1. angeregten 2(2)2 [(13.6eV /22 )(13.6eV /12 )]/kT Zustands von H als Fkt. der Temperatur 1 e 2 2(1) 8 10.2eV /kT 1 e 2 10.2eV ln(4) kT mit k=8.6174 10 -5 eV K -1 10.2eV 10.2eV 4 (Carroll&Ostlie) T 8.54 10 K -5 -1 k ln(4) 8.62 10 eV K ln(4) => es werden hohe Temperaturen benötigt, um viele H-Atome in den ersten angeregten Zustand zu bringen! => jedoch erreichen zB die Balmer-Linien (von n=2 nach n=3,4,...) ihr Maximum bei etwa 9520K und werden sogar schwächer in heisseren Sternen; warum? Boltzmann-Gleichung • Um die Anzahldichte nA,i eines Atoms (oder Ions) A im Quantenzustand i relativ zu der Anzahldichte aller Atome (oder Ionen) zu erhalten, müssen wir die Summe über alle Quantenzustände berechnen (= die Partitionsfunktion Z): EA,i ZA (T ) g A,i exp kT i0 • dann folgt: nA,i g A,i EA,i exp kT nA ZA (T ) Partitionsfunktion: die gewichtete Summe der Arten, in der ein Atom bei einer gegebenen Temperatur seine Elektronen arrangieren kann Die energiereicheren Konfigurationen werden dabei durch den Boltzmann-Faktor heruntergewichtet Die Saha-Gleichung • wir behandeln den einfachen Fall der Ionisation (gebunden-frei Übergang): Atom im Grundzustand + Photon => Ionisiertes Atom im Grundzustand + freies Elektron • Mit (mA≈mI): p A2 EA Energie des Atoms 2m A pI2 EI Eion kinetische Energie plus Ionisationsenergies des Ions 2m A pe2 Ee kinetische Energie des Elektrons 2me • ist die Anzahl der Zustände: d 3xd 3 p A dg A gA 3 h d 3xd 3 pI dgI gI 3 h d 3xd 3 pe dge ge 3 h • wir integrieren über die Verteilungsfunktionen um die Anzahldichten der Teilchen zu erhalten: Die Saha-Gleichung • mit ge = 2 (2 Spinzuständes des Elektrons): NA (2 m AkT )3/2 A nA gA e 3 V h NI (2 m AkT )3/2 I Eion /kT nI gI e e 3 V h Ne (2 me kT )3/2 e ne 2 e 3 V h • Da die Energie konserviert ist, müssen die chemischen Potentiale die Beziehung erfüllen: I e A 0 • Aus dem Produkt nIne/nA folgt die Saha-Gleichung: nI ne 2g I (2 me kT )3/2 Eion /kT e 3 nA gA h • geht zurück auf den indischen Astrophysiker Meghnad Saha, 1920 Die Saha-Gleichung nI 2g I (2 me kT ) 3 nA ne g A h 3/2 e Eion /kT • => das Verhältnis der Anzahl von ionisierten Atomen zu den Atomen im Grundzustand • abhängig von 1/ne: je mehr freie Elektronen da sind, umso leichter können Ionen wieder rekombinieren, umso weniger Atome sind im ionisierten Zustand • Beispiel: Sternatmosphäre aus Wasserstoff • => nI/nTot = nI/(nI+nA)=(nI/nA)/(1+nI/nA) • Bruchteil der ionisierten Atome zwischen • 5000 K und 25000 K • => Ionisation läuft in einem kleinen T-Bereich • von etwa 3000K um T~ 10000K herum ab • => Zone partieller Ionisation bei 9600 K sind 50% der H-Atome ionisiert bei 13000 K: ~ 100% (Carroll&Ostlie) Boltzmann + Saha-Gleichung • Die Stärke der Balmer-Linien hängt von dem Verhältnis n2/nTot ab = Anteil aller H-Atome, die im angeregten (n=2) Zustand sind. 1. • Aus der Kombination der Saha und Boltzmann-Gleichungen folgt das Verhältnis von Atomen im 1. angeregten Zustand zu allen Atomen Ergebnis: deutlicher Peak bei 9900 K, in guter Übereinstimmung mit Beobachtungen! Abnehmende Stärke der Balmer-Linien bei Teff>10000 K kommt durch schnelle Ionisation des Wasserstoffs bei hohen Temperaturen zustande (Carroll&Ostlie) e- im Grundzustand Max. der Balmer-Linie H ionisiert Atomare und molekulare Übergänge • Emission und Absorption von Photonen finden durch Prozesse in Atome/Moleküle. Diese Prozesse sind quantenmechanischer Natur. Wir erhalten ein: diskretes Spektrum von Energie-Eigenwerten für gebundene Elektronen (E<0) kontinuierliches Energiespektrum für freie Elektronen (E>0) • Folgende Wechselwirkungen zwischen Photonen und Elektronen sind möglich: Absorption Spontane Emission Stimulierte Emission • wobei Übergänge zwischen folgenden Energieniveaus stattfinden können: diskret-diskret (gebunden-gebunden) => Spektrallinien h Ei E j 2 m v e diskret-kontinuierlich (gebunden-frei) => Ionisation h Ei 2 me v2 => Rekombination h Ei 2 kontinuierlich-kontinuierlich (frei-frei) => Bremsstrahlung (im E-Feld eines Ions) h E' E'' Atomare und molekulare Übergänge Bender&Burkert http://www.mpe-garching.mpg.de/~bender Eigenwerte des Wasserstoffs • Der Zustand des Elektrons ist beschrieben durch die folgenden Quantenzahlen: n Hauptquantenzahl n=1, 2, 3, ... l Bahndrehimpuls l=0, 1, 2, .., n-1 ml z-Komponente des Bahndrehimpulses s Spin L l(l 1)h, Lz ml h ml=-l, -(l-1),...., l-1, l S ms=±1/2 3 h, 2 Sz ms h • Energieeigenwerte (a0=Bohr-Radius = 0.529 Å) e2 Z2 En 2a0 n 2 • Balmerlinien: n=2 -> n=3, 4, 5,... (Hα, Hβ, Hγ, ...) • Entartungsgrad pro Energieeigenwert: n1 gn 2 (2l 1) 2n2 l 0 Balmer-Linien des (Bohrschen) Wasserstoffatoms Emissionslinien Absorptionslinien (Carroll&Ostlie) Energienieveaus des (Bohrschen) Wasserstoffatoms E< 0: gebundene Zustände; E> 0: freie Zustände Ionisationslimit (n->∞) hat E=0 (Carroll&Ostlie) Eigenwerte von Atomen mit mehreren Elektronen • N (Elektronen) =1 Alkali-Metalle e2 Z2 En 2a0 n 2 Elektrostatische Abschirmung des Kernpotentials • N (Elektronen) >1: die Bahndrehimpulse und Spins der Elektronen koppeln LS-Kopplung (Spin-Bahn << Coulomb): r L li , r r S si , r r r J LS jj-Kopplung (Spin-Bahn >> Coulomb) r r ji li si , r r J ji • Moleküleigenwerte molekulare Übergänge wichtig im interstellaren Medium und kühle Sterne Übergänge durch Vibration ( nahes IR) und Rotation ( sub-mm, mm, radio) Eel>>Evib>>Erot LS J LS Auswahlregeln • die Übergangsmöglichkeiten bei Emission oder Absorption von elektrischer Dipolstrahlung sind beschränkt durch Auswahlregeln: Nur Übergänge zwischen geraden und ungeraden Niveaus J ändert sich nur um ΔJ=0 oder ΔJ =±1 (der Übergang J=0 →J=0 ist verboten) • Für LS-Kopplung gilt zusätzlich: ΔL=0,±1 ΔS=0 (keine Interkombinationen, zB von Singlett-Triplett) • Ein Übergang = erlaubt, falls keine Auswahlregel verlezt ist. Sind die ΔL und ΔS Auswahlregeln nicht erfüllt => verbotene Übergänge Diese finden durch elektrische Quadrupolstrahlung oder magnetische Dipolstrahlung mit sehr viel kleiner Wahrscheinlichkeit statt Streuprozesse • Rayleigh Streuung: WW von gebundenen Elektronen mit niederenergetischen Photonen 8 e 4 (1026 Å)4 3me2 4 Grund für den blauen Himmel! Der Wirkungsquerschnitt ist: • Thomson Streuung: WW von freien Elektronen mit niederenergetischen Photonen WQ: 8 e 4 25 2 6.665 10 cm 3me2 c 4 wichtig für IR, optische, UV-Strahlung in Sternatmospären, interstellarem + intergalaktischem Gas, Big Bang,... • Compton-Streuung: WW von freien Elektronen mit hochenergetischen Photonen WQ: 3 me c2 2h 1 T ln 2 8 h me c 2 wichtig für sehr heisse Gase, Röntgen-und Gammastrahlung (bei Egamma> 2mec2 (=1.02 MeV) => Paarerzeugung im Coulombfeld einer Ladung) 1 ; Z T , 137 2