Werbung

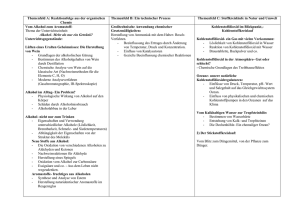
"Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 1 Grafiken wurden aufgrund ihrer Größe entfernt 1. Nomenklatur: Alkohole werden durch Voranstellen der Wendung Hydroxi- oder durch Anhängen der Endung -ol an den Namen des entsprechenden Kohlenwasserstoffs benannt. Die Position der OH-Gruppe(n) wird durch vorgestellte Ziffern bestimmt. Bei Verbindungen mit mehreren OH-Gruppen stellt man griech. Zahlwörter vor die Endung -ol (-diol,-triol usw.). 2.Einteilung: Man unterscheidet je nach Stellung der OH-Gruppe zwischen primären, se kundären und tertiären Alkoholen: Primäre Alkohole: An dem C-Atom, das die OH-Gruppe trägt, hängt maximal noch ein direktes C-Atom.→ Die OH-Gruppe befindet sich am Ende der Kette. Sekundäre Alkohole: An dem C-Atom, das die OH-Gruppe trägt, hängen noch zwei direkte C-Atome.→ Die OH-Gruppe befindet sich innerhalb der Kette). Tertiäre Alkohole: An dem C-Atom, das die OH-Gruppe trägt, hängen drei direkte C-Atome.→ Die OH-Gruppe befindet sich an einer Verzweigung der Kette. Man bezeichnet die Alkohole auch nach der Anzahl der OH-Gruppen als einwertige, zwei-wertige bzw. mehrwertige Alkole. Letztere haben den Fachausdruck Polyole und sind eine wichtige Grundsubstanz von Zucker. 3. Physikalische Eigenschaften: Die physikalischen Eigenschaften eines Alkohols werden von den beiden Strukturelementen bestimmt, aus denen sich das Molekül zusammensetzt, nämlich der Kohlenstoffkette und der OH-Gruppe: C-Kette: kohlenwasserstofähnlich, unpolar, hydrophob OH-Gruppe: wasserähnlich, polar, hydrophil Bei zunehmender Länge der C-Kette läßt die Wirkung der OH-Gruppe immer mehr nach. Die OH-Gruppe ist befähigt zur Wasserstoffbrückenbindung. Daraus ergibt sich bei Alkoholen deutlich höhere Schmelz und Siedepunkte im Vergleich zu "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 2 Kohlenwasserstoffen mit gleicher Molekülmasse. Wird die C-Kette länger, so werden die Unterschiede geringer. Molekülmasse SchmelzSiedetemperatur tempertatur in °C in °C Methanol CH3OH 32 -98 65 Ethan CH3CH3 30 -172 -89 Bei Alkoholen mit mehreren OH-Gruppen sind die Kräfte zwischen den Molekülen besonders stark: z.B. Siedetemperaturen von: Ethanol 78°C Ethandiol (Glykol) 197°C Propantriol (Glycerin) 290°C Die OH-Gruppe bildet auch zu H2O-Molekülen Wasserstoffbrückenbindungen aus und bewirkt dadurch die Wasserlöslichkeit der Alkohole. Bei längeren Ketten nimmt die Wasserlöslichkeit ab, dagegen steigt die Löslichkeit in unpolaren Lösungsmitteln. Kurzkettige Alkohole sind wichtige Lösungsmittel. z.B. Verwendung von Ethanol in der Pharmazie und Lebensmitteltechnik zur Herstellung von Pflanzenextrakten. 4. Chemische Eigenschaften: Im Gegensatz zu NaOH oder KOH liegen bei Alkoholen keine OH- -Ionen vor. Bei chemischen Reaktionen kann entweder die O-H -Bindung oder die C-O Bindung getrennt werden. Alkohole sind schwache Säuren und geben H+ ab. 4.1. Reaktionen an der O-H -Bindung a) Säure-Base Reaktionen: Wie Wasser können auch Alkoholmoleküle als Säuren oder Basen reagieren. Säure- und Basenstärke sind geringer als die von Wasser. Mit sehr starken Basen reagiert ein Alkohol als Säure. Es bildet sich ein negativ geladenes Ion - ein sogenanntes Alkoholation. Mit sehr starken Säuren wirkt er als Base, es entsteht ein positiv geladenes Ion (Oxonium-Ion). Diese Ionen spielen als Zwischenprodukte bei vielen säurekatalysierten Reaktionen eine wichtige Rolle und sie erleichtern die Abspaltung von Wasser. "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 b) Etherbildung: Mit Halogenkohlenwasserstoffen reagieren Alkohole bzw. Alkoholate unter Bildung von Ethern. Auch durch das Erhitzen von Alkoholen mit konzentrierter Schwefelsäure bilden sich Ether; z.B. aus Ethanol bei 140°C wird Diethylether. (INTRAKONDENSATION) 4.2. Reaktionen an der C-O -Bindung a) Bildung von Halogenalkanen: Reagieren Alkohole mit Halogenwasserstoffen, findet eine nucleophile Substitution der OH-Gruppe statt. b) Bildung von Estern: Reagieren Alkohole bei niedrigen Temperaturen mit Säuren, so wird die OH-Gruppe durch den Säurerest ersetzt. wichtig: Ester der Schwefel-, Salpeter- u. Phosphorsäure, sowie Essigsäureester (Klebstoff) Veresterung - Verseifung: Bei der Reaktion von Carbonsäuren mit Alkoholen entstehen Ester. Bei der Veresterung werden unter Abspaltung eines Wassermoleküls Alkohol und Carbonsäure verknüpft - Esterkondensation. Die Umkehrung , die Spaltung eines Estermoleküls in einen Alkohol und eine Carbonsäure, nennt man Hydrolyse oder Verseifung. H3─C─CH2─O─NO2 + H2O Salpetersäure- ethylester → H3C─CH2─OH + H─O─NO2 Ethanol Salpetersäure Veresterungen verlaufen sehr langsam und sind typische Gleichgewichtsreaktionen. Bei Reaktion von kurzkettigen Alkoholen mit kurzkettigen Carbonsäuren entstehen sogenannte Fruchtester (kommen in Früchten vor; werden als Duftstoffe verwendet). Bei Reaktion von langkettigen Carbonsäuren mit langkettigen Alkoholen entstehen Wachse. 4.3. Oxidation von Alkoholen Primäre Alkohole können mit Luft oder Sauerstoff bei hoher Temperatur zu CO2 oder H2O oxidiert werden. Auch starke Oxidationsmittel wie Kaliumdichromat (K2Cr2O7) und Kaliumpermanganat (KMnO4) in Lösung oxidieren Alkohole zu Aldehyden und Säuren. Sekundäre Alkohole reagieren weniger stark (zu Ketonen → Fragmentierung), tertiäre überhaupt nicht, bzw. kommt es zu einer Fragmentierung. Die unterschiedliche Reaktionsweise der 3 "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 4 primären, sekundären und tertiären Alkohole bei Oxidation kann zu ihrer analytischen Unterscheidung eingesetzt werden. (Lukas Test !) Durch Oxidation von primären einwertigen Alkoholen gewinnt man Aldehyde. 5. Wichtige Alkohole: a) Methanol CH3OH einfachster Alkohol ♦ Eigenschaften: farblose Flüssigkeit, Siedepunkt 65°C, sehr giftig (letale Dosis: 8 - 10g), Genuß von kleineren Mengen führt zu Erblindung (Sehnerv wird angegriffen). ♦ Herstellung: durch Oxidation von Methan oder aus Kohlenmomoxid und Wasserstoff. ♦ Verwendung: • Ausgangsstoff für viele großtechnische Herstellung von Kunststoffen • billiges Lösungsmittel • Treibstoffzusatz Synthesen → b) Ethanol C2H5OH („Alkohol“, Weingeist) ♦ Eigenschaften: wasserklare, brennend schmeckende Flüssigkeit, Siedetemp. 78°C ♦ Herstellung: erfolgt hauptsächlich durch Gärung. Hefezellen, die in der Natur fast überall vorkommen, beziehen ihre Energie aus dem Abbau von Zuckern. Unter anaeroben Bedingungen entsteht mit Hilfe des Enzymkomplexes Zymase Ethanol und Kohlendioxid. Aus Stärke (Getreide, Kartoffeln) kann Hefe erst dann Ethanol erzeugen, wenn durch stärkespaltende Enzyme der Abbau zu Zucker erfolgt ist. Die Gärung kommt (falls überhaupt soviel Zucker vorhanden ist) zum Stillstand, wenn der Ethanolgehalt ca. 18% beträgt. Ein zu hoher Alkoholgehalt sowie ein zu hoher Zuckergehalt kann die Gärung verhindern (konservierende Wirkung von Alkohol und Zucker). Daher läßt sich durch Gärung allein kein konzentrierter Alkohol gewinnen. Durch wiederholtes "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 Destillieren kann die Hauptmenge des Wassers , restliche flüchtige Pflanzeninhaltsstoffe sowie höhere Alkohole (Fuselöle), die ebenfalls bei der Gärung entstehen, abgetrennt werden. So kann Alkohol bis max. 96 % Vol. gewonnen werden. Dieser ist ein Aceotrop, d.h. er kann durch Destillation nicht weiter getrennt werden. Um einen absoluten Alkohol (100 % Vol.) zu bekommen, muß man chemische Trennverfahren anwenden. ♦ Verwendung Ethanol ist ein wichtiges Lösungsmittel: Viele pharmazeutische Wirkstoffe werden in Ethanol gelöst. Ethanol ist ein Genußmittel, das bei ständigem Konsum zu seelischer und körperlicher Abhängigkeit führt. Wegen ihrer Wirkung als Genußmittel und ihrer einfachen Herstellung durch Gärung findet man alkoholische Getränke bei allen Völkern, die Ackerbau betreiben. Die Erhöhung des Alkoholgehalts durch Destillation (bis 96 Vol.-%) (Schnapsbrennen) kam in Europa erst um 1000 n.Chr. auf. Beim Brauen von Bier wird die Stärke der Gerste zunächst durch Enzyme zu Malzzucker abgebaut. Traubenzucker wird schließlich durch weitere Enzyme der Hefe vergoren. Der Zusatz von Hopfenextrakt bewirkt die Haltbarkeit und den Geschmack von Bier. Bei der Herstellung von Wein werden reife Weintrauben ausgepreßt und der erhaltene Traubensaft wird vergoren. Auch bei diesem Vorgang bewirken Enzyme, die aus den Hefepilzen auf den Trauben stammen, den Gärungsprozeß. Bei Likören wird ein alkoholisches Destillat mit Zucker und Geschmacksstoffen versetzt. Der Alkoholgehalt von Bier liegt zwischen 3,5 und 6 Vol.-%, jener von Wein zwischen 7 und 16 Vol.-%. Die physiologische Wirkung des Ethanols hängt von der Menge ab, die frei im Blut zirkuliert. Ethanol beeinflußt die Kontrollfunktion des Gehirns. Der Gleichgewichtssinn wird beeinträchtigt und die Reaktionszeit verlängert. Die Durchblutung der Haut wird angeregt, was ein erhöhtes Wärmegefühl zur Folge hat, obwohl dabei vermehrt Wärme an die Umgebung abgegeben wird. Der Wasserhaushalt und die Nierenfunktion werden verändert. Bei 0,3 Promille beginnt man im Durchschnitt die Wirkung des Alkohols zu merken. Bei 0,8 Promille ist die Reaktionsfähigkeit bereits deutlich eingeschränkt. Bei ca. 1 Promille wird der Verlust der Muskelkontrolle merkbar, das Gleichgewichtsgefühl wird unsicher, das Sprechen verlangsamt sich. Bei 2 Promille tritt Torkeln auf, bei 3 Promille kann man sich nicht 5 "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 6 mehr aufrecht halten und verliert meist das Bewußtsein. Die tödliche Dosis ist bei ca. 4 Promille erreicht. Durch den Abbau des Ethanols in der Leber verringert sich der Blutalkoholgehalt um ca. 0,1 Promille pro Stunde. Chronischer Alkoholmißbrauch führt zu einem Absterben von Gehirnzellen und zur Schädigung der Leber. Der Alko-Test zum Nachweis von Alkohol in der Atemluft beruht auf der leichten Oxidierbarkeit des Ethanols. Eine bestimmte Menge Atemluft wird in einen Ballon gepreßt. Die Füllung des Alko-Test-Röhrchens enthält Kaliumdichromat. Bei positivem Test wird diese gelb gefärbte Chromverbindung zu grünem Chromsalz reduziert. Formel v. Widmark zur Bestimmung des Blutalkoholgehalts: gEt .− OH = ‰ kgKörperg.*0,6 Verunreinigtes ( durch Benzin od. Methanol), d.h. zum Genuß nicht mehr geeignetes (=vergälltes) Ethanol heißt (Brenn-)Spiritus. c) Propanol & Butanol: im Volksmund auch Fusl genannt, entstehen z.B. am Ende des Schnapsbrennens schlechter Geschmack 2-Propanol (i-Propanol) wird als Frostschutzmittel für Autoscheiben verwendet. d) 1.2-Ethandiol (Glykol) einfachster zweiwertiger Alkohol ♦ Eigenschaften: farblos, dickflüssig, von leicht süßlichem Geschmack, schwach giftig ♦ Verwendung: • Rohstoff zur Kunststoffproduktion • Frostschutzmittel • Feuchthaltemittel (Pfeifentabak, Süßspeisen, Zucker) Eine dem 1.2-Ethandiol ähnliche Substanz, das Diethylenglykol, wurde bekannt, weil sie in einer Reihe von Fällen illegal dem Wein zugemischt worden war, um eine bessere Qualität vorzutäuschen. Eigentliche Verwendung: Weichmacher für Kunststoffe e) 1.2.3- Propantriol (Glycerin) "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 ♦ Eigenschaften: farblose, ölige Flüssigkeit, schwach giftig, süßlicher Geschmack, schwach desinfizierend ♦ Verwendung: Wegen seiner wasseranziehenden Wirkung wird es für Farbbänder, Druckfarben, Salben und Hautcremes, sowie zur Herstellung von Nitroglycerin (Brisanzspregstoff) verwendet. 6. Weitere Folgeprodukte: • Schwefelsäureester höherer Alkohole haben große wirtschaftliche Bedeutung; ihre Natriumsalze werden als Waschmittel verwendet. Außerdem sind sie für die Entgiftung des menschlichen Körpers wichtig. • • Ester der Salpetersäure haben als Sprengstoffe Bedeutung. Salpetersäure- ester entstehen, wenn man Schwefelsäure mit Salpetersäure mischt (Nitriesgemisch) und die dabei entstehende Nitriersäure mit Alkohol versetzt.. Bekanntester Vertreter dieser Gruppe ist der Trisalpetersäureglycerinester, besser bekannt unter dem Namen Nitroglycerin. Nitroglycerin ist eine ölige Flüssigkeit, die bei geringen Erschütterungen oder geringfügiger Erwärmung explosionsartig zerfällt. Es wurde erstmals 1847 vom Italiener Sobrero hergestellt. 1866 entdeckte der Schwede Alfred Nobel, daß Nitroglycerin sicher zu handhaben ist, wenn es von Kieselgur aufgesaugt wurde und erfand so den ersten brauchbaren hochbrisanten Sicherheitssprengstoff ⇒ Dynamit • Einige kompliziert gebaute Ester der Phosphorsäure haben als Schädlings- bekämpfungsmittel Bedeutung (z.B. das Parathion). Sie sind auch sehr wichtig im Stoffwechsel der Zellen. 7. Alkohol, eine zentralnervös dämpfende Substanz: Der Begriff Alkohol steht in der Umgangssprache für Ethanol oder Ethylalkohol, also jene Substanz, die in Spirituosen enthalten ist. Alkohol (Ethanol) unterscheidet sich daher von anderen zentral dämpfenden Substanzen darin, dass er vorwiegend als Genussmittel (wie z.B. auch Coffein) verwendet wird, was die Häufigkeit seines Gebrauchs natürlich drastisch ansteigen lässt. 7.1. Pharmakologie des Alkohols 7 "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 a) Resorption: Als wasser- und fettlösliche Substanz diffundiert Alkohol leicht durch biologische Membranen, daher wird er schnell und vollständig vom gesamten Magendarmtrakt resorbiert. Die Resorptionsgeschwindigkeit hängt von versch. Faktoren ab. Ein leerer Magen zum Beispiel resorbiert bereits etwa 20% einer eingenommen Alkoholdosis. Der Rest wird erst im Dünndarm abgebaut. Da ein voller Magen sich gegenüber eines leeren erst wesentlich später entleert, setzt die Resorption im Dünndarm später ein. Folglich steigt der Blutalkoholgehalt deutlich langsamer, wenn gerade ein große Mahlzeit verdaut wird. b) Verteilung: Nach der Resorption verteilt sich Alkohol gleichmäßig in allen Geweben und Körperflüssigkeiten, was eine große Gefahr darstellen kann. Nicht einmal die Blut-Hirn-Schranke vermag es ihn aufzuhalten. Ebenso ungehindert gelangt Alkohol vom Blut einer schwangeren Frau in das Blut des Foetus. Der fetale Blutalkoholgehalt erreicht dasselbe Niveau wie der der Mutter. So kann Alkoholkonsum während der Schwangerschaft zu schweren angeborenen Defekten beim Kind führen, da das Gehirn in seiner Entwicklung geschädigt wird (=fetales Alkoholsyndrom). c) Ausscheidung: Nur etwa 5% einer Konsumierten Alkoholmenge gelangen unverändert wieder aus dem Körper (hauptsächlich über die Lunge →“Fahne“). Der größte Teil wird von Enzymen Alkoholdehydrogenase und Aldehyddehydrogenase, die vor allem in der Leber aktiv sind, abgebaut. Diese wandeln Alkohol unter Freisetzung von Energie in CO2 und H2O um. Schritte des Abbaus: Ethanol→ Acetaldehyd→ Essigsäure→ CO2 + H2O Der Abbau in der Leber ist nicht konzentrationsabhängig, sondern verläuft zeitlich Linear. Der Stoffwechsel eines Erwachsener baut pro Stunde ungefähr 10ml reinen Ethanol ab. Das ist etwa die Ethanolmenge die in 0.2l Bier enthalten ist. Trinkt man also nicht mehr als einen Pfiff pro Stunde, bleibt der Alkoholspiegel im Blut relativ konstant. Natürlich wird die Metabolisierungsgeschwindigkeit von versch. Faktoren beeinflusst, die klinisch nicht signifikant sind. 7.2. Pharmakologische Wirkung Die wichtigste pharmakologische Wirkung des Alkohols ist eine zunehmende und reversible Dämpfung zentralnervöser Funktionen: a) Atmung: 8 "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 Die Atmung wird bei geringer Dosis stimuliert, bei weiterer Dosissteigerung jedoch immer stärker gehemmt. Bei hohem Blutalkoholspiegel tritt Atemlähmung und der Tod. b) antiepileptische Wirkung: Alkohol wirkt zwar antiepileptisch, wird zu diesem Zweck in der Medizin jedoch nicht verwendet. Umgekehrt können aber bei Entzug nach chronischem Alkoholkonsum Übererregbarkeit und sogar epilepsieartige Anfälle auftreten. c) Herz & Kreislauf: Unter der Wirkung auf Herz und Kreislauf ist zunächst die Erweiterung der Hautblutgefäße zu nennen, welche zu einem subjektiven Wärmegefühl führt. Jedoch wird mehr Wärme abgegeben, was eine Senkung der Körpertemperatur zur Folge hat. Es ist also sinnlos, wenn nicht sogar gefährlich, bei kaltem Wetter Alkohol zu trinken um sich warm zu halten. Langzeitiger Alkoholkonsum steht in Verbindung mit Herzmuskelerkrankungen, die schließlich zu Herzversagen führen können. Andererseits wurde in Studien festgestellt, dass tägliche Einnahme geringer Mengen (z.B. ¼l Rotwein) das Risiko von Herzkrankheiten senken kann. d) kein Aphrodisiakum: Wie alle dämpfenden Substanzen ist auch Alkohol kein Aphrodisiakum. Er führt zwar zunächst zu psychischer Enthemmung, doch wird die sexuelle Leistungsfähigkeit durch die dämpfende Wirkung des Alkohols beeinträchtigt. e) Beeinträchtigung motorischer & intellektueller Fähigkeiten: Die wohl auffallendste zentralnervös dämpfende Wirkung des Alkohols ist eine je nach Dosis höhere oder niedriger Beeinträchtigung der motorischen und intellektuellen Fähigkeiten des Menschen. Weiters schwinden Aufmerksamkeit und Konzentrationsfähigkeit. Diese Wirkung wird bei Kombination von Alkohol mit Sedativa noch um ein Vielfaches angehoben. 7.3. Psychische Wirkung 9 "Dr. Volkmar Lorenz" [email protected] Spezialgebiet Chemie Harald Lorenz 8b 1998 / 99 10 Die kurzzeitigen psychischen und verhaltensbeeinflussenden Wirkungen des Alkohols beschränken sich hauptsächlich auf das Zentralnervensystem. Wirkung des Alkohols in Beziehung mit der Blutalkoholkonzentration: 7.4. Nebenwirkungen & Toxität Bei akutem Alkoholmißbrauch entsteht ein reversibles substanzbedingtes Psychosyndrom, welches sich in Form von Bewußtseinstrübung, Desorientiertheit, fehlender Urteilsfähigkeit, Amnesie und eingeschränkten intellektuellen Fähigkeiten zeigt. Bei starkem Trinken kann es zu Wahnvorstellungen und Halluzinationen kommen. Die schwerwiegendste physiologische Langzeitfolge ist ein Leberschaden. Die Leberzirrhose ist offenbar auf eine alkoholbedingte Störung der körperlichen Immunfunktionen zurückzuführen, was den immunsuppressiven Effekt von Ethanol bestätigt. Überdies kann Alkohol bei Langzeittrinkern Nervenzellen irreversibel zerstören, wodurch bleibende psychische Schäden entstehen. Zudem kann auch noch der Verdauungstrakt von der schädlichen Wirkung des Alkohols betroffen sein, was sich meist in Pankreatitis (Entzündung der Bauchspeicheldrüse), chronischer Gastritis (Entzündung der Magenschleimhaut) und Magengeschwüren äußert. Weiters ist nachgewiesen worden, dass Alkohol die Wirkung kerbsbegünstigender Substanzen stark erhöht. Er erhöht das Krebsrisiko vor allem im Mund- und Rachenbereich (in Verbindung mit Tabak kommt es nicht selten zur Ausbildung eines Mundboden-Karzinoms).