Neuroendokrine Tumore - Behandlung von Lebermetastasen
Werbung
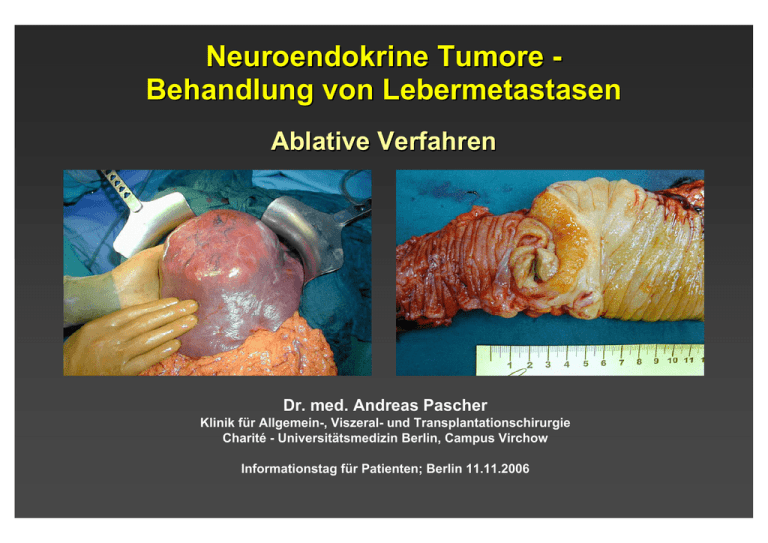
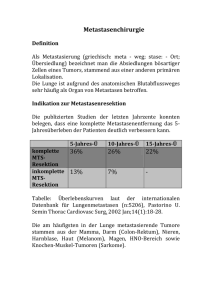
Neuroendokrine Tumore Behandlung von Lebermetastasen Ablative Verfahren Dr. med. Andreas Pascher Klinik für Allgemein-, Viszeral- und Transplantationschirurgie Charité - Universitätsmedizin Berlin, Campus Virchow Informationstag für Patienten; Berlin 11.11.2006 Aktuelle klinische Standards Leitlinienkonferenz “Kolorektales Karzinom” 2004 30.06.2004 Patienten mit auf die Leber oder Lunge beschränkten resektablen Metastasen sollten primär reseziert werden (Evidenzstärke 4). Eine Indikation für eine adjuvante Theapie nach R0-Resektion (Evidenzstärke 2-a) oder neoadjuvante Therapie (Evidenzstärke 3-b) außerhalb von Studien besteht nicht. Empfehlungsgrad: A, starker Konsens Anmerkungen: Die Indikation zur primären Resektion von Lebermetastasen hängt ab von Lokalisation der Lebermetastasen in Bezug zu großen Gefäßen, etwaiger vorhandener Vorschädigungen der Leber (z.B. Steatosis) sowie erwartetem Residualvolumen nach Resektion und Erfahrung des Operateurs. Voraussetzung ist, dass eine RO-Resektion grundsätzlich möglich erscheint. Die Patienten sollten ausgewiesenen Zentren vorgestellt werden. Resektion kolorektaler Lebermetastasen Überlebenswahrscheinlichkeit 1.0 Resektion in kurativer Absicht (n = 226) (n = 62) resektabel, unbehandelt (n = 921) nicht resektabel 0.8 0.6 0.4 7 0.2 0.0 0 1 2 3 4 5 6 7 Jahre nach Laparotomie Scheele et al., al Br J Surg 1989 8 9 10 Resektion von neurendokrinen Lebermetastasen Überlebenswahrscheinlichkeit (170 Patienten) 1 0,8 0,6 Überleben Erneute Symptome 0,4 0,2 0 0 6 12 18 24 30 36 42 Monate nach Leberresektion Samiento et al., J Am Coll Surg 2003 48 54 60 Chirurgische Therapie hepatisch metastasierter NET • Primärtumorentfernung • Aussicht auf R0 - Resektion (kurative Therapie) • Bilobäre u./o. multilokuläre Lebermetastasen bei – Aussicht auf R0 - Resektion – Unzureichender medikamentöser Palliation durch große Tumormassen (Debulking - 90% Resektion) – Nichtansprechen auf Therapie „Nonresponder“ – Stable disease / metachronen Lebermetastasen – Vertretbares Operationsrisiko Resektion von neurendokrinen Lebermetastasen Berliner Erfahrung OP vs. konservativ metachron vs. synchron 100 100 P=0.010 60 40 20 0 nicht operiert 1 2 3 60 40 20 operiert R0,R2 (n=47) (n=27) 4 5 P=0.020 80 Überleben [%] Überleben [%] 80 metachron (n=19) synchron 6 7 Jahre 8 9 10 11 12 13 14 (n=55) 0 1 2 3 4 5 6 7 Jahre 8 9 10 11 12 13 14 Unabhängige positive prognostische Faktoren (Multivariate Analyse) Variable p-Wert Exp B 95% Konfidenzintervall des Exp B metachron vs. synchron 0.020 3.029 1.179 - 7.782 Operative Therapie vs. konservativer Therapie 0.010 3.651 1.699 - 7.848 Wachstumsfraktion ≤/> 10% <0.001 5.265 2.390 - 11.595 Wie erreicht man R0 Resektionen? Limitierend • • • • Ausmaß der Leberresektion Leberfunktion Lokalisation des Tumors Allgemeinzustand des Patienten Wie wird der Befund operationsfähig? CT-gesteuerte Embolisation der rechten Pfortader • Embolisation der Gefäßversorgung tumortragenden Seite • Alternativ: V. porta oder A.hepatica Wie wird der Befund operationsfähig? vor Embolisation 6 Wochen nach Embolisation Behandlung nicht operabler Lebermetastasen Lebermetastasen Möglichkeiten bei nicht resektablen Lebermetastasen • kombinierte Verfahren: Resektion + art. Chemotherapie Resektion + ablatives Verfahren portal-venöse Embo. + Resektion • intraarterielle Chemotherapie • Transarterielle Chemoembolisierung (TACE) • Laser induzierte Thermotherapie (LITT) • Radiofrequenzablation (RFA; RITA) • Kryotherapie • (Ethanolinjektion) Alternative - Lokale Tumordestruktion PEI Laser Radiofrequenzablation (RFA/RITA) • Erzeugen von Hitze durch Friktion auf molekularem Level durch hochfrequenten Wechselstrom • Erhitzen Gewebes auf 90-95°C und 100105°C Cryotherapie RFA-Erfahrung in Deutschland Birth M. Chirurg 2004 RFA - Durchführung Birth M. Chirurg 2004 RFA - Durchführung Unterschiedliche RFA - Systeme Unterschiedliche Therapiealgorithmen Berber E. Surg Endosc 2004 Lokale Tumordestruktion Zwerchfell RITA-Sonde Vor Beginn Ultraschallkopf Leber Nach 15 Minuten RFA-Erfahrung in Deutschland 25% der behandelten Patienten hatten resektable Tumormanifestationen ! Birth M. Chirurg 2004 418 Patienten: Kolorektale Lebermetastasen (nachgew. durch Operation) 348 Patienten: potentiell kurative Behandlung 190 Resektion 158 Komplette Resektion Nicht möglich 101 Resektion + RFA Heilungsansatz 57 Nur RFA 70 Weder Resektion noch RFA Nicht komplett resektabel Abdalla Ann Surg 2004 Rezidive jeglicher Art % of patients operated *P < 0.001 compared to Resection 90 80 70 60 50 40 30 20 10 0 * 84% 63% 52% Resection Rsxn + RFA Abdalla Ann Surg 2004 RFA Rezidive - Leber *P < 0.001 compared to Resection % of patients operated 50 40 * 27% 30 20 * 44% 11% 10 0 Resection Rsxn + RFA Abdalla Ann Surg 2004 RFA Lokalrezidiv an der Resektionsgrenze oder am RFA -Ort % of patients operated *P < 0.02 compared to Resection 10 9 8 7 6 5 4 3 2 1 0 * 9% 5% 2% Resection Rsxn + RFA Abdalla Ann Surg 2004 RFA Resektion vs. RFA bei solitären Metastasen Überleben (%) 1.0 p < 0.0001 0.8 Resektion 0.6 0.4 Resektion + RFA 0.2 RFA Nur Chemo 0.0 0 12 24 36 48 60 Monate Abdalla et al., Ann Surg 2004 72 Resektion vs. RFA Solitäre Lebermetastasen Resektion solitärer Tumore: 5-Jahres Überleben > 60% Solitary Lesions Resektion erzielt mutmasslich bessere Ergebnisse als RFA Abdalla Ann Surg 2004 Lokale Tumordestruktion bei kolorektalen Lebermetastasen Nicht-resezierbare Erkrankung: RFA hat nur geringen Überlebensvorteil gegenüber Chemotherapie RFA oder RFA + Resektion sind mit höherer Rezidivrate und niedrigerem rezidivfreien Überleben und niedrigerem Gesamtüberleben als die chir. Resektion verbunden Komplette Resektion bleibt der Goldstandard und das Ziel der Behandlung Abdalla Ann Surg 2004 Tumor Radiofrequency Ablation Italian Network (TRAIN) – multicenter Studie - 423 Patienten (19 Monate mediane Nachsorge) • • • • • ≤ 4 Tumore, ≤ 5 cm, keine extrahepatische Manifestation Keine chir. Therapieoption oder OP abgelehnt Persistierende RF bei Follow-up 15% Progrediente RF bei Follow-up 25% 5-Jahres PÜ gesamte Gruppe 24% multiple Läsionen 11% solitär > 2.5 cm 13% solitär ≤ 2.5 cm 56% Potentieller Nutzen NUR für sehr kleine solitäre Läsionen ? Lencioni Radiology, in press; prelim Lencioni Inv Rad 2004 Multivariate Metaanalyse Lokalrezidiv nach RFA bei Lebermetastasen (95 Studien; 5224 Patienten) • • • RFA - Perkutan RFA - Laparoskopie RFA - Laparotomie 68% 12% 20% Rezidivrate • nach 1 Jahr • Perkutan • Laparoskopie • Laparotomie 12,4% 16,4% 5,8% 4,4% (p<0,001) • • • 58,1% 24,5% 14,1% (p<0,001) Tumor > 5cm Tumor 3-5cm Tumor < 3cm Mulier S. Ann Surg 2005 Multivariate Metaanalyse Lokalrezidiv nach RFA bei Lebermetastasen (95 Studien; 5224 Patienten) Tumor-abhängige Faktoren, die Rezidivrate positiv beeinflussen (univariat) • Tumorgröße • Neuroendokrine Metastasen • Oberflächenferne Lokalisation • Gefäßferne Lokalisation Behandlungs-abhängige Faktoren, die Rezidivrate positiv beeinflussen (univariat) • Offene Anwendung • Durchblutungsunterbrechung • Intubationsnarkose • 1cm Koagulationsabstand • Erfahrung des Operateurs Mulier S. Ann Surg 2005 Multivariate Metaanalyse Lokalrezidiv nach RFA bei Lebermetastasen (95 Studien; 5224 Patienten) Multivariate Analyse Signifikante Einflußfaktoren für eine niedrige Rezidivrate: • Tumorgröße (p<0.001) • Chirurgisches vs. Perkutanes Vorgehen (p<0.001) Einfluß der Tumorart auf Rezidivrate (p<0.001) Tumorart Anzahl Leberzell - Carcinom 2369 Dickdarm - Carcinom 763 Nicht näher spezifiziert 1046 Brustkrebs 97 Neuroendokriner Tumor 330 Mulier S. Ann Surg 2005 Rezidivrate 14,9 14,7 9,8 8,2 3,3 Stellenwert der RFA bei Lebermetastasen 1. Nicht-resektable Lebermetastase(n) (nach zeitgemäßen Kriterien) 2. Komorbidität oder zugrunde liegende Erkrankung schließen Leberresektion aus 3. Ungünstig (zentral) lokalisiertes Rezidiv nach Resektion 4. Restbefund nach ausgedehnter Leberresektion Stellenwert der RFA / LITT bei Lebermetastasen 1. Bestandteil von interdisziplinären Behandlungskonzepten nach kompetenter Abschätzung der Resektabilität (durch erfahrenen Leberchirurgen) 2. Kein Ersatz für chirurgische Resektion bei resezierbaren Tumoren 3. Unklare Rolle als Kombinationstherapie mit chirurgischer Resektion 4. Unklare Rolle in der Tumormassenverringerung Therapiealgorithmus für NET - Lebermetastasen Chirurgische Therapie von Lebermetastasen neuroendokriner Tumore Metachron (oder hepatisches Rezidiv) Synchron Einseitig Beidseitig Nicht resektabel * Resektabel Resektion Resektion - Einstufig - Zweistufig - Erweitert - Ggf. mit ablativer Therapie Systemische Therapie Resektion Ablative Therapie (RFA,LITT) -Ggf. mit ablativer Therapie (RFA,LITT) TACE Debulking * Lebertransplantation in Selektierten Fällen Consensus Conference on the ENETS Guidelines for the Diagnosis and Treatment of Neuroendocrine Gastrointestinal Tumors; Frascati, Italy 11/2006