Thieme: Orbita – Interdisziplinäres Management der
Werbung

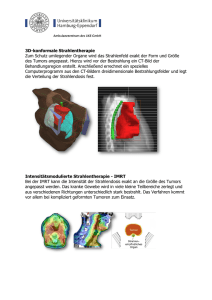
Kapitel 14 Strahlentherapie orbitaler Erkrankungen 14.1 Einführung 262 14.2 Technik 262 14.3 Strahlentherapie maligner Neoplasien der Orbita 266 Strahlentherapie benigner Erkrankungen der Orbita 276 4 14.4 14.5 Radiogene Nebenwirkungen und Toxizitäten im Orbitabereich 281 14.6 Literatur 284 Strahlentherapie Merke H ● Hochmaligne okulozerebrale Lymphome werden wie ZNS-Lymphome behandelt. Hier steht die Polychemotherapie im Vordergrund. Eine konsolidierende Bestrahlung des ZNS spielt in den aktuellen Therapiestudien nur noch bei nicht vollständiger Remission der Lymphome nach Chemotherapie eine Rolle. Hierbei muss das Strahlendosiskonzept unbedingt das Auftreten einer radiogenen Leukenzephalopathie vermeiden, die bei 30 % der Betroffenen einen letalen Verlauf nimmt. Bei Patienten, die aus internistischen Gründen keine Chemotherapie erhalten können, oder bei Rezidiven nach Polychemotherapie ist der Stellenwert der Ganzhirnbestrahlung unbestritten. Therapie der niedrig malignen Lymphome Die Rolle der Strahlentherapie bei diesen Entitäten ist deutlich besser definiert. Traditionell wurden indolente Lymphome aller Lokalisationen mit Strahlendosen zwischen 24 Gy und mehr als 40 Gy lokal behandelt. Dadurch wird bei MALT-Lymphomen der Orbita verlässlich eine lokale Kontrolle mit sehr hohen Kurationsraten induziert [33]. Eine SEER-Analyse (Surveillance, Epidemiology and End Results) über 1111 Patienten mit niedrig malignen Orbitalymphomen, die von 1998–2010 behandelt wurden, zeigte, dass von den bestrahlten Patienten im weiteren Verlauf keiner lymphombedingt verstarb, von den nicht bestrahlten Patienten hingegen 11,5 % [72]. In einer randomisierten Studie wurde prospektiv die Gleichwertigkeit von 24 Gy im Vergleich zu 36 Gy in diversen Lymphomlokalisationen nachgewiesen [58]. Verschiedene Serien berichteten über gute und lang anhaltende Remissionsraten nach einer Dosisdeeskalation auf 2 × 2 Gy. Auch dieses Konzept wurde prospektiv randomisiert in diversen Lokalisationen mit 12 × 2 Gy verglichen [37]. Dabei wurden allerdings signifikant niedrigere Raten an kompletten Remission (44 % bei 2 × 2 Gy im Vergleich zu 60 % bei 12 × 2 Gy) und ein geringeres lokales progressionsfreies Überleben beschrieben. Im Unterschied zu den Erfahrungen mit den indolenten Lymphomen anderer Körperlokalisationen wurde aktuell eine retrospektive Serie mit hervorragenden Ergebnissen nach Niedrigdosisbestrahlung im Bereich der Orbita publiziert. Dies kann auf die meist geringere Tumorlast im Orbitabereich und die frühere Diagnosestellung bei sichtbarer bzw. frühzeitig klinisch symptomatischer Erkrankung im Vergleich zur Lymphomentstehung in anderen Lokalisationen zurückgeführt werden. Fasola et al. berichten über 20 Patienten mit 27 Lymphommanifestationen im Bereich der Orbita-Adnexe, die mit 2 × 2 Gy bestrahlt wurden [26]. Nach einer medianen Nachbeobachtung von über 2 Jahren zeigte sich bei 85 % der behandelten Lymphome eine komplette Remission, bei 11 % eine partielle Remission. Nur bei einem Patienten kam es zu einem intraorbitalen Rezidiv außerhalb der Bestrahlungsfelder. 80 % der Patienten berichteten keine akuten Nebenwirkungen, bei 20 % kam es zu milden, selbst limitierenden Toxizitäten wie periorbitalem Ödem, Augentrockenheit oder Konjunktivitis. Chronische Toxizitäten traten nicht auf. Obwohl es sich hierbei um retrospektive Daten bei einem überschaubaren Patientenkollektiv mit nur 2 Jahren Nachbeobachtung handelt, sind diese Ergebnisse in mehrfacher Hinsicht normativ für die Strahlentherapie der indolenten Lymphome der Orbita, da so eine sehr schonende Behandlung ermöglicht wird: 14 270 1. Höhere Strahlendosen sind mit höheren Risiken für akute und chronische Toxizitäten assoziiert, so wurden über 50 % akute Komplikationen bei Dosen zwischen 19–48 Gy berichtet [94] (Details s. Kap. 14.5.4). Selbst bei einem lokalen Progress nach 2 × 2 Gy Vorbelastung ist eine Rebestrahlung in dieser Größenordnung komplikationsarm möglich. 2. Weiterhin ist die Zielvolumendefinition bislang strittig: Nach selektiver Bestrahlung der befallenen Region der Orbita ist in bis zu 30 % der Patienten ein Rezidiv außerhalb des Bestrahlungsvolumens berichtet worden, sodass eine initiale Bestrahlung der gesamten Orbita diskutiert wurde [75]. Eine Fraktionierung von 2 × 2 Gy ermöglicht die partielle Orbitabestrahlung, da im Falle eines Rezidivs eine Rebestrahlung selbst bei Feldüberschneidung mit der radiogenen Vorbelastung problemlos durchführbar ist. Andererseits kann eine vollständige Orbitabestrahlung mit 2 × 2 Gy mit minimaler Toxizität auch primär durchgeführt werden. 3. Die partielle Orbitabestrahlung mit niedriger Strahlendosis setzt aber eine engmaschige Nachsorge voraus. Dabei ist auch die kontralaterale Orbita zu kontrollieren, da auch in diesem Bereich gelegentlich Rezidive beschrieben wurden [26]. Merke H ● Niedrig maligne MALT-Lymphomen der Orbita sind durch eine EBRT mit niedrigen Strahlendosen (2 × 2 Gy oder 12 × 2 Gy) heilbar. Ob dabei die gesamte betroffene Orbita behandelt werden muss ist nicht gesichert. Bei den extrem niedrigen Strahlendosen ist auch eine alleinige Behandlung der befallenen Struktur gut zu rechtfertigen. Der Patient wird in einer individuell gefertigten thermoplastischen Maske gelagert. Das GTV (gross tumor volume, bildgebend abgrenzbarer Tumor) wird durch die Klinik und die Bildgebung bestimmt. Das CTV umfasst entweder das GTV einschließlich der befallenen okulären Struktur (Glandula lacrimalis oder Konjunktiva), oder aber die gesamte Orbita (Diskussion s. o.). Prinzipiell sollten oberflächlich liegende Tumoren mit Elektronen unter Verwendung von Bolusmaterial behandelt werden, um einen optimalen Dosisaufbaueffekt zu gewährleisten. Tiefer liegende Volumina (z. B. Glandula lacrimalis) werden mit Photonen nach 3D-Planung behandelt (▶ Abb. 14.9). Abb. 14.9 Dosisverteilung einer Bestrahlung bei niedrig malignem Orbitalymphom links. Durch den Einsatz von 3 verschiedenen Strahlrichtungen, bei denen eine von kranial über die Schädelkalotte eintritt, gelingt eine sehr gute Erfassung des Zielvolumens mit einem scharfen Dosisabfall in die umliegenden, nicht beteiligten Strukturen. Die angestrebte Dosis ist als rötlich-bräunliche Einfärbung im Transversalschnitt (rechte Bildhälfte) zu erkennen, niedrige Strahlendosen als grüne/blaue Einfärbung. 14.3 Maligne Neoplasien Wann immer sinnvoll möglich, sollte die Linse mit einer Kalotte abgeschirmt werden (Kap. 14.3.1, Abschnitt „Metastasen und Tumoren des Augenlids“). 14.3.3 Aderhautmelanome Seit den 1980er Jahren hat sich die Therapie der Aderhautmelanome grundlegend gewandelt. Während vorher die Enukleation den Hauptpfeiler der Behandlung darstellte, wird seitdem – wann immer technisch möglich und vom Patienten gewünscht – der Schwerpunkt auf augenerhaltende Verfahren gelegt. Bestrahlung kann Aderhautmelanome onkologisch kontrollieren und zugleich den Visus als auch den Bulbus erhalten [69]. Allerdings sind die erforderlichen Strahlendosen oberhalb der Toleranzdosen von Retina, N. opticus, Linsen, Augenlidern und Glandula lacrimalis. Deshalb sind entsprechend angepasste Techniken resp. Bestrahlungsplanungen notwendig. Erzielt werden können die notwendigen Dosisverteilungen durch episklerale Brachytherapie, Bestrahlung mit Protonen/schweren Ionen oder durch radiochirurgische Techniken. Die Brachytherapie wird international am häufigsten angewendet. Stellenwert der Strahlentherapie Der Stellenwert der Strahlentherapie wurde wegweisend durch die langfristig angelegten, prospektiv randomisierten Studien der COMS-Gruppe geprüft [34]. Diese Daten sind sehr wichtig, weil das Aderhautmelanom mit in den USA geschätzten 1400 Neuerkrankungen pro Jahr zu den seltenen Erkrankungen zählt [23]. Durch die Initiative des National Eye Institute wurden 1986 3 multizentrische, prospektive Studien geöffnet, in denen ca. 2500 Patienten mit unilateralen choroidalen Melanomen rekrutiert wurden. Dabei wurden die Melanome in 3 Kategorien unterteilt [59]: ● kleine Melanome: 1,5–2,4 mm Tumorhöhe, Durchmesser 5– 16 mm ● mittlere Melanome: 2,5–10 mm Tumorhöhe, Durchmesser ≤ 16 mm (seit 11/1990) ● große Melanome: > 10 mm Tumorhöhe, Durchmesser > 16 mm Kleine Melanome Patienten mit kleinen Tumoren wurde die Aufnahme in eine prospektive Beobachtungsstudie angeboten. Bei diesen Patienten besteht die Gefahr einer Fehldiagnose bei Verwechselung mit einem gutartigen Nävus, sodass das engmaschig überwachte Wachstumsverhalten letztlich Aufschluss über die Dignität geben sollte. 188 Tumoren wurden initial beobachtet, von denen ca. 10 %, 20 % bzw. 30 % nach 1, 2 bzw. 5 Jahren progredient waren [99]. Obwohl die meisten Patienten nicht behandelt wurden, war innerhalb von 5 Jahren nur 1 % der Patienten am Melanom verstorben. Merke H ● Kleine Aderhautmelanome mit Tumorhöhen unter 2,4 mm und Durchmessern unter 16 mm lassen sich oft nur durch das langfristige Wachstumsverhalten von gutartigen Naevi abgrenzen. Innerhalb von 5 Jahren zeigen nur 30 % eine Progredienz. Mittlere Melanome Patienten mit mittleren Melanomen (keine Lokalisation peripapillär oder im Ziliarkörper, cM0) wurden zwischen einer episkleralen Brachytherapie mit einem 125Jod-Applikator oder einer primären Enukleation randomisiert. Insgesamt wurden in einem Zeitraum von 12 Jahren 1317 Patienten behandelt [18]. Die 5Jahres-Überlebens-Rate unterschieden sich nicht signifikant mit 81 % nach Enukleation und 82 % nach Brachytherapie, ebenfalls nicht die tumorspezifischen Überlebensraten. Auch Langzeitdaten mit 10- und 12- Jahres-Überlebens-Raten zeigten keine signifikanten Unterschiede [103]. Fast die Hälfte der Patienten in der Studie lebte noch nach 12 Jahren krankheitsfrei. Negative prognostische Faktoren waren ein Tumordurchmesser > 11 mm und Alter > 60. Dabei zeigte das organerhaltende Vorgehen eine gute onkologische Effektivität: In den ersten 5 Jahren nach Brachytherapie wurden nur ca. 12,5 % der Patienten enukleiert, 10 % bei Tumorprogress (v. a. in den ersten 3 Jahren nach Primärbehandlung), 2,5 % aufgrund anderer Ursachen (Schmerzen, Visusverlust) [44]. Bei 2 % der Patienten wurde zwar ein Rezidiv dokumentiert, es erfolgte aber keine Enukleation. Als Rezidiv wurde dabei eine Tumorhöhenzunahme um 15 % im Ultraschall oder Wachstum um 250 μm in Fotografien in jeweils 2 aufeinander folgenden Untersuchungen definiert. Mit der Rezidivhäufigkeit assoziiert waren: ● Lebensalter > 50 Jahre ● Tumorhöhe > 5 mm ● Tumorwachstum bis an die Fovea Die Mortalität von Patienten nach einer sekundären Enukleation könnte erhöht sein (Risk Ratio 1,5). Dieser Befund verfehlte jedoch nach Adjustierung für andere Risikofaktoren das statistische Signifikanzniveau knapp (p = 0,08) und wirkte sich nicht auf die Überlebensraten der gesamten Gruppen aus. Deshalb kann die Brachytherapie als sichere Therapiealternative in dieser Patientengruppe angesehen werden. Hinsichtlich radiogener Nebenwirkungen wurden 532 Patienten ohne Katarakt vor Brachytherapie weiter untersucht [102]. Die erste Katarakt entwickelte sich im Median 2,5 Jahre nach Primärtherapie, die ersten Operation war im Median nach 3,5 Jahren notwendig (wobei keine definierten Kriterien für die Operationsindikation vorgegeben waren). Nach 5 Jahren hatten sich in 83 % der betroffenen Augen Katarakte entwickelt, allerdings mussten nur 12 % deswegen operiert werden. Nach einer Linsendosis von ≥ 24 Gy wurden 18 % der Patienten operiert, bei < 12 Gy nur 4 %. Der Visus nahm bei den meisten Patienten nach Kataraktoperation zu oder stabilisierte sich. Die Kataraktchirurgie war trotz der Tumorbehandlung effektiv. Funktionelle Einschränkung im Sinne eines substanziellen Visusverlusts nach Brachytherapie erfuhren nach 1 Jahr 17 % der Patienten, nach 2 Jahren 33 % und nach 3 Jahren > 40 %. Dabei war das Risiko assoziiert mit: ● Diabetes mellitus ● Tumorhöhe ≤ 5 mm vs. > 5–7,5 vs. > 7,6 ● Abstand zwischen Tumor und Makula ● tumorassoziierter Netzhautablösung (insbesondere bei Involvierung der Makula) 14 271