Laminierung [Bearbeiten]
Werbung
![Laminierung [Bearbeiten]](http://s1.studylibde.com/store/data/002675562_1-75537cc091b485163ea524f6877d4c25-768x994.png)
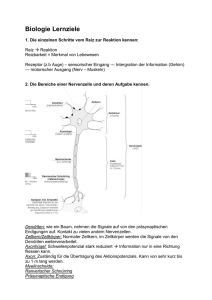
Sinnesphysiologie [Notizen hauptsächlich nach Klinke/Pape/Kurtz/Silbernagl, Physiologie, Thieme, 2009 und Schmidt/Lang/Heckmann, Physiologie des Menschen, Springer, 2010] 1. Stunde: Das zentrale Nervensystem – Grundlage bewussten Menschseins: Neurone, Synapsen, Rezeptoren Zur Erinnerung: • Zentrales Nervensystem (Gehirn, Rückenmark) • Peripheres Nervensystem (Nerven: Afferente, efferente Systeme) • Gehirn besteht aus Nervenzellen (Neuronen) und Gliazellen • Nervenzellen: Morphologie: Zellkörper, initiales Segment, Axon, Axonterminale, Dendriten: Funktionen? • Gliazellen: Myelin: Funktionen? • Synaptische Transmission: Präsynapse, Postsynapse, Botenstoffe Fünf klassische Sinne: Riechen, Fühlen, Hören, Sehen, Schmecken. Plus: Gleichgewichtssinn, Schmerzsinn, andere Systeme, die den Zustand des Körpers an ZNS melden (Gelenkstellungen, Muskelkraft, Muskellänge, Blutdruck, CO2-Gehalt des Blutes, etc). Alle brauchen spezialisierte Sinnesrezeptoren. Sinnesrezeptoren: Adäquater Reiz: Erregung von Sinneszellen: Umsetzung in eine „Sprache“, die das ZNS versteht: Aktionspotenziale Adäquater Reiz: Im Allgemeinen der Reiz, der die minimale Energie benötigt, um das betreffende Organ zu erregen. Inadäquater Reiz: z.B. Stäbchen und Zapfen der Retina lassen sich auch erregen, wenn man den Bulbus kräftig massiert; Kaltsensoren in der Schleimhaut von Mund und Nase reagieren auf Kälte, aber auch Menthol. Reiztransduktion: • der Reiz wird durch einen reizleitenden Apparat an die Rezeptoren herangebracht • ein Transduktionsvorgang am Rezeptor: z.B. Mechanorezeptor: dehnungsaktivierte Ionenkanäle: bei Dehnung wird der Durchmesser dieser Kanäle vergrößert: elektrische Leitfähigkeit steigt: Transduktionsstrom: Veränderung des Membranpotenzials: im Allgemeinen eine Depolarisation (nicht an Photorezeptoren). So entsteht ein Rezeptorpotenzial, dessen Größe die Särke des Reizes widerspiegelt. Wichtig: Die Rezeptorpotenziale bilden den Reiz in analoger Form ab, obwohl nicht in der physikalischen Dimension des Reizes. • Rezeptormodulation: Rezeptorzellen werden über efferente Nervenbahnen innerviert und moduliert. Die Empfindlichkeit wird modifiziert, um sie an die vorhandene Reizstärke anzupassen (Adaptation). Beispiel für Adaptation => die Erhöhung der Reizschwelle bei kontinuierlicher Reizung in Sinnesorganen. Reiztransformation: • Signale können nicht auf analoge Weise ans ZNS weitergegeben werden: Kodierung in Aktionspotenzialen: Digitale Form • Sinneszellen, die in der Lage sind, auf die reizabhängige Depolarisation hin Aktionspotenziale zu generieren und weiterzuleiten sind primäre Sinneszellen (z.B. Mechanosensorik) • Sinneszellen, die reizabhängig Botenstoffe freisetzen, aber keine Aktionspotenziale generieren, sind sekundäre Sinneszellen. Aktionspotenziale werden über synaptische Verschaltung in den nachgeschalteten Neuronen ausgelöst (z.B. Hören) • Über afferente Nervenbahnen gelangt die informationstragende Folge von Aktionspotenzialen ans ZNS Reizkodierung: Primäre Sinneszellen • Das Rezeptorpotenzial breitet sich elektrotonisch bis zum ersten Ranvier-Schnürring aus • Hier kann ein Aktionspotenzial entstehen – aber das ist nicht genug für eine korrekte Kodierung! 1 • Je stärker der Reiz, desto stärker der Generatorstrom (bzw. das Rezeptorpotenzial): Umso mehr Aktionspotenziale pro Zeiteinheit werden ausgelöst (höherer Reiz => höhere AP Frequenz) Sekundäre Sinneszellen • Rezeptorpotenzial breitet sich elektrotonisch bis zur Botenstoff-freisetzenden Maschinerie aus (Präsynapse) • Transmitterausschüttung, abhängig von Reizstärke/Rezeptorpotenzialstärke • Aktionspotenziale in die afferenten Nerven, wie oben Antwortverhalten: • Einige Rezeptoren reagieren stark, wenn der Reiz rasch zunimmt. Sie signalisieren die Geschwindigkeit der Reizänderung. Dieser Antworttyp => dynamische = phasische = differenziale Antwort. • Rezeptoren, die unabhängig von der Geschwindigkeit reagieren, signalisieren nur die Reizgröße. Diese Antworttyp => statische = tonische = proportionale Antwort. • Die meisten Rezeptoren übermitteln Informationen über die Reizgröße, aber auch über die Geschwindigkeit => Proportional-differenziales Antwortverhalten (PD). Informationsleitung/Übertragung: Nervenfasern, Myelin, Synaptische Übertragung. Reizverarbeitung: • Primäre rezeptive Felder: afferente Nervenfasern verzweigen sich in ihrem Innervationsgebiet in mehrere Kollaterale, die jeweils in Sensoren enden: alle Sensoren einer Nervenfaser bilden ihr primäres rezeptives Feld. Größe: Funktionsangepasst (z.B. für Mechanoafferenzen in der Haut: kleiner in der Fingerspitze als im Unterarm). • Sekundäre rezeptive Felder: unterschiedlich viele primär afferente Nervenfasern konvergieren und haben synaptische Kontakte mit einzelnen zentralen sensorischen Neuronen. Die rezeptiven Felder dieser zentralen Neurone = Sekundäre Felder. • Neuronale Netzwerke: Information wird von einem Neuron auf viele andere verteilt (Divergenz) • Umgekehrt erhält ein Neuron Informationen von vielen anderen Neuronen (Konvergenz) • Räumliche oder zeitliche Bahnung: Entstehung von Aktionspotenzialen nach einem an sich unterschwelligen Reiz, wenn an diesem Neuron noch weitere exzitatorische Synapsen anderen Ursprungs aktiviert werden => Summation • Hemmungen: wichtig um repetitive Entladungen zu verhindern: Vorwärts- (Neuron A hemmt Neuron B) und Rückwärtshemmung (Neuron A hemmt durch ein hemmendes Interneuron sich selbst) • Laterale Inhibition (Laterale Hemmung): Viele Neurone im visuellen und somatosensorischen System werden z.B. von Zentrum ihres rezeptiven Feldes her erregt, von einem mehr oder minder großen und mehr oder minder regelmäßig geformten Umfeld hingegen gehemmt. Hemmung: Die primären Afferenzen sind mit Interneuronen verbunden, die an den betreffenden zentralen Neuronen hemmende Synapsen bilden. Generiert Kontrastverschärfung. Wichtig z.B für die Augen: Information über die Helligkeitsunterschiede im Bild wird geliefert => also über die Begrenzungen einzelner Bildelemente (viel wichtiger als Information über die absoluten Helligkeiten). • Reizmodulation: Disinhibition (der inhibitorische Einfluss auf ein Neuron von Seiten hemmender Synapsen fällt weg); Disfazilitation (Unterdrückung einer tonischen Exzitation führt zu eine relativen Hyperpolarisation); Habituation (Anpassung an einen wiederholten, für den Organismus als unwichtig erkannten Reiz). • Plastizität: Das Gehirn verändert sich, Synapsen werden ständig abgeändert – kann die Wahrnehmung/Empfindung ändern. 2 2. Stunde: Subjektive Sinnesphysiologie: Weber – Fechner – Stevens Empfindungen = Konstrukte des Gehirns. Die Empfindungs- und Wahrnehmungsprozesse sind einer direkten naturwissenschaftlichen Analyse nicht zugänglich. Sie werden mithilfe von Angaben von Versuchspersonen studiert, weswegen dieser Bereich als Subjektive Sinnesphysiologie bezeichnet wird. Methoden: Psychophysik => studiert die Beziehungen zwischen Reiz und Empfindung Psychophysiologie => studiert die Korrelation zwischen Empfindungsgröße und Aktivitätszuständen der Rezeptoren und/oder afferenten Nervenbahnen Um die Empfindungsintensität (Empfindungsstärke) zu quantifizieren, studieren wir die Aussage des Wahrnehmenden. Psychophysik: Johannes Müller (1837) => „Gesetz der spezifischen Sinnesenergien“ = die Empfindung einer bestimmten Sinnesmodalität hängt nur vom gereizten Sinneskanal und nicht von der Art des Reizes ab (z.B. Augen; siehe oben). Empfindungen haben immer eine bestimmte Intensität (obwohl Empfindungen auch verschiedene andere „Qualitäten“ haben können: z.B. Farbe von Licht, nicht nur Intensität). Die Intensität ist nicht unbedingt leicht zu messen. Ein Beispiel = die Hörschwellenkurve des Ohres, welche den Mindestschalldruck zur Hörempfindung ( = die Absolutschwelle) über die verschiedenen Frequenzen des Hörbereichs darstellt. Methoden für die Schwellenmessung: die Grenzmethode: man beginnt mit einem intensiven Reiz, dann wird die Intensität verringert bis der Reiz unterschwellig ist; dann beginnt man mit einem sehr schwachen Reiz, der gesteigert wird, bis die Schwelle erreicht ist. Die Konstantreizmethode: Die Schwelle = die Reizintensität die in der Hälfte der Fälle wahrgenommen wird. Messung: Probanten bekommen Reize mit verschiedene Intensitäten in randomisierter Reihenfolge. Für jede Reizintensität wird gemessen, wie oft sie wahrgenommen wird. Eine Kurve wird gezeichnet, mit % erkannte Reize vs. Reizintensität – generell s-förmig = psychometrische Funktion. Die psychometrische Funktion errinnert an die kumulierte Form der Normalverteilung (das Integral der Gauss-Verteilung). Diese Art von Funktion ist als Ogive bekannt. Weber. Es ist wichtig zu wissen, wie groß der Unterschied zwischen zwei Reizstärken sein muss, um Unterschiede zwischen den Reizen zu empfinden = Unterschiedsschwelle. Versuch von Weber (1834): Um wie viel sich zwei Gewichte voneinander unterschieden müssen: • Zwei Gewichte von 1 und 2 kg – leicht zu unterscheiden • Zwei Gewichte von 50 und 51 kg – sehr schwer zu unterscheiden, obwohl der Unterschied immer 1 kg ist. • => große Gewichte müssen sich um einen größeren absoluten Betrag voneinander unterscheiden als kleine, damit sie unterschieden werden können • Das Weber-Gesetz: Die Änderung der Reizintensität, die gerade eben noch wahrgenommen werden kann (ΔΦ) ist ein konstanter Bruchteil (c) der Ausgangsintensität (Φ). ΔΦ ist auch als „just noticeable difference“ oder „difference limen“ (Differenzlimen) bekannt. Formel: ΔΦ/ Φ = c was auch als ΔΦ= c x Φ geschrieben wird. • • • c ist als Weber-Quotient bekannt. c wird benutzt, um die relative Empfindlichkeit von Sinnessystemen zu untersuchen. Das Weber Gesetz beschreibt die experimentellen Daten nur im mittleren Bereich befriedigend. In der Nähe der Reizschwelle nehmen z. B. die Weber-Quotienten zu => es ist schwer, schwache Reize (Signale) von stochastischen Prozessen in den Sensoren (spontane Aktivität, auch als Rauschen bezeichnet) zu unterscheiden. In anderen Bereichen muss eine Korrektur eingefügt werden: Formel: ΔΦ/ (Φ+a) = c was auch als ΔΦ= c x (Φ+a) geschrieben wird 3 • • Der Korrekturfaktor a (wie c eine Konstante) beschreibt die Größe des Rauschens im Sinneskanal Weber => Formel sagt nichts über die Wahrnehmungsintensität. Fechner. Fechner, Begründer der Psychophysik, sagt, dass die Wahrnehmungsintensität von der Stärke der Erregung im Hirn abhängt (1860). • Idee: Eine logarithmische Zunahme der Reizstärke (Φ) führt zu einer linearen Zunahme der Empfindungsstärke (ψ). • Fechner nutzt Webers Gesetz zur Definition einer Skala der Empfindungsstärke. Nullpunkt ist die Absolutschwelle, die nächst-stärkere Empfindung ist um eine „Unterschiedschwelle“ (Differenzlimen, DL) größer, etc => DL ist die Grundeinheit der Empfindungsstärke (für Fechner). Formel: ψ = k x log (Φ/ Φ0) (k ist eine Konstante, und Φ0 ist die Absolutschwelle) • Die Gültigkeit von Fechners Formel ist sehr begrenzt, wie Webers Gesetz. Stevens. Stevens (1953) führt eine Methode der quantitativen Abschätzung der Empfindungsstärke ein. Probanten sollen angeben, wann ein Reiz doppelt so groß, dreimal so groß, etc ist wie ein Vergleichsreiz => die Probanten machen direkte Angaben über die Stärke ihrer Empfindungen. Eine zweite Methode = Intermodaler Intensitätsvergleich = Probanten versuchen, die Empfindungsstärke in einer Sinnesmodalität durch Angaben in einer anderen Sinnesmodalität auszudrücken. Formel = Potenzfunktion: abhängt. ψ = k x (Φ - Φ0) a wobei a ein Exponent ist, der von der Sinnesmodalität Was ist die Bedeutung des Exponenten? Warum ist er viel größer bei Schmerz? Log (Formel) => log (ψ)= log(k) + a x log (Φ - Φ0), was relativ einfach dargestellt ist (Potenzfunktionen werden zu linearen Beziehungen unter logarithmischen Koordinaten). Psychophysiologie => Messung von Rezeptorantworten zeigt, dass die Empfindungsschwelle nicht nur von der Rezeptorempfindlichkeit, sondern auch von der Übertragung, abhängt (zum Beispiel Mechanosensoren der Haut in Fingerspitze und Handfläche). 4 3. Stunde: Das Somatosensorische System: Bahnsysteme, somatosensorische Neurone Somatoviszerale Sensibilität (Somatosensorik) = Sinnesleistungen, deren Sinnesorgane über den gesamten Körper verteilt sind (inklusive der inneren Organe). Verschiedene Submodalitäten: • Mechanorezeption: Vermittelt die Qualitäten Druck, Berührung, Vibration • Propriozeption: Lage, Bewegung und Kraft • Thermorezeption: Wärme und Kälte (Veränderungen der Hauttemperatur) • Nozizeption: Schmerz • Viszerozeption: Verschiedene Qualitäten von viszeralem Schmerz zu Hunger, Durst oder Atemnot Diese Modalitäten nutzen verschiedene afferente Nervenfasern – schnellste bei Propriozeption und Mechanorezeption (30-80 m/s) und langsamste bei den anderen Modalitäten (~1-2 m/s). Das somatosensorische System nutzt zwei Bahnsysteme, um diese Submodalitäten zu leiten: • Das Lemniskale System für Mechanorezeption und Propriozeption. Erste synaptische Verschaltung in Medulla oblongata; die Axone kreuzen dann auf die Gegenseite und ziehen auf die Gegenseite als „Lemniscus medialis“ zum somatosensorischen Thalamus • Das spinotalamisches System (= extralemniskales System) für Thermorezeption, Nozizeption, Viszerozeption. Erste synaptische Verschaltung in Hinterhorn des Rückenmarks, ziehen dann direkt zum somatosensorischen Thalamus • Was passiert bei halbseitiger Durchtrennung des Rückenmarks? Brown-Séquard Syndrom. • Vom Thalamus => zu somatosensorischen Arealen in der Großhirnrinde Beide Bahnen (Lemniskales System, LS, und spinotalamisches System, STT) nutzen vier Neuronenpopulationen: • 1. Neuron, im ipsilateralen Spinalganglion bzw. Ganglion Gasseri des V. Hirnnerven [im Bereich des Kopfes] • 2. Neuron, ipsilateral in den Hinterstragkernen (LS), im Rückenmark (STT) • 3. Neuron, kontralateral im somatosensorischen Thalamus • 4. Neuron, kontralateral in somatosensorischen Arealen in der Großhirnrinde Das 1. Neuron: • Primäre Sinneszellen • Zellkörper im Spinalganglion, zusammen mit Gliazellen (Satellitenzellen) • Axone teilen sich in zwei Äste: Peripheren Ast, der das Organ innerviert (und afferente Nervenfasern ausbildet), und zentralen Ast, der Synapsen mit 2. Neuron macht • Periphere Äste enden in korpuskulären Endigungen (Propriozeption und Mechanorezeption) oder frei (andere Modalitäten) • Die afferenten Nervenfasern: Myelinisiert (drucksensitiv) und unmyelinisiert (empfindlich gegen Lokalanästhetika) • Generatorpotenziale finden in den Endingungen statt • Transduktion: mechanische Reize: Ionenkanäle, die auf Zugspannungen in der Membran reagieren • Transduktion: thermische Reize: temperaturgesteuerte Ionenkanäle (TRPV1) • Transduktion: chemische Reize: ligand-gesteuerte Ionenkanäle oder G-Protein-gekoppelte Rezeptoren • Transformation: Aktionspotenziale finden im Bereich der Schnürringe statt (myelinisierte Axone) oder in der Axonmembran (unmyelinisierte Axone) • Die Axone im zentralen Ast machen erregende Synapsen (Glutamat + Neuropeptide) Das 2. Neuron: Lemniskales System: • Zellkörper in der Medulla oblongata in Hinterstrangkernen (Nucleus cuneatus, Nucleus gracilis). Die Neurone sind somatotopisch angeordnet (Fuß medial, Hand lateral, etc) • Axone kreuzen die Mittelebene als Lemniscus medialis und ziehen zum kontralateralen somatosensorischen Thalamus. Spinotalamisches System: 5 • • • • • Zellkörper im Hinterhorn des Rückenmarks (in den oberflächlichen und tiefen Schichten des Hinterhorns) Axone kreuzen die Mittelebene ventral des Zentralkanals und ziehen zum kontralateralen somatosensorischen Thalamus. Afferenzen der Propriozeption ziehen auch ins Vorderhorn => erregende Synapsen mit Interneuronen oder mit Motoneuronen => Reflexwege im Rückenmark. Die 2. Neuronen sind auch Bestandteile von motorischen und vegetativen Reflexen im Hirnstamm Afferente Innervation zeigt eine räumliche Ordnung entsprechend der segmentalen Gliederung der Spinalnerven: Die Afferenzen jedes Spinalnerven innervieren ein klares Hautgebiet, das Dermatom. Analog: Myotome, Viszerotome Das 3. Neuron: • Zellkörper in spezifischen Thalamuskernen (ventrobasaler Anteil des Thalamus) • Reziproke exzitatorische Verbindungen mit Teilen der Großhirnrinde • Es gibt generell eine somatotope Anordnung • Die Axone erregen auch inhibitorische Neurone des retikulären Thalamuskerns => diese projezieren zu dem spezifischen Thalamuskern, führen zu lateraler Hemmung • Diese Neurone funktionieren auch im Schlaf-Wach-Rhythmus: Regulation von Wachheit und Schlaf (non-REM) durch das System Hirnstamm-Thalamus-Kortex: - Wachheit: Hirnstammneurone aktiv => aktivieren Thalamusneurone => APs in Thalamus generiert => Aktivität im Thalamus = getreue Übertragung afferenter Sinnessignale von Peripherie zum zerebralen Kortex => Aktivität im Kortex - Schlaf: Aktivität in Hirnstammneuronen nimmt ab => Hyperpolarisation der Thalamusneurone. Diese beginnen langsam-rhythmische Salven von Aktionspotenzialen zu generieren (Oszillationen). Getreue Übertragung afferenter Sinnessignale von Peripherie zum zerebralen Kortex verhindert! Das 4. Neuron: im Kortex Primärer somatosensorischer Kortex (Gyrus postcentralis) • Aktivität in diesen Arealen => dann werden Reize bewusst wahrgenommen • Somatotop angeordnet (Homunkulus) • Überrepräsentation von Mund, Finger, Zehen => proportional zur räumlichen Auflösung des Tastsinns in den verschiedenen Arealen • Neurone in vertikal zur Hirnoberfläche liegenden Säulen angeordnet • Hier erfolgen Schritte wie Mustererkennung (z.B. Orientierung von Objektkanten) Sekundärer somatosensorischer Kortex (parietales Operculum) • Somatotop angeordnet • Schritte wie Kodierung von Form (bei Tastobjekten) • Weniger bekannt Posteriorer Parietaler Kortex • Assoziationsareale • Reagieren auf Hautreize + visuelle Reize • Steuerung der Motorik • Kortikale Repräsentation des Körperschemas Inselrinde • Thermorezeption, Nozizeption, Viszerozeption • Kortikale Repräsentation des inneren Zustandes des Körpers Plastizität im System: Wenn z.B. Finger denerviert/amputiert wird, gibt es eine Lücke in der kortikalen Repräsentation. Nach einiger Zeit erhalten diese Gebiete andere funktionelle Anschlüsse => neue Synapsen. Auch in anderen Fällen, z.B. bei Training. 6 4. Stunde: Mechanorezeption und Propriozeption Mechanorezeption: Vermittelt die Qualitäten Druck, Berührung, Vibration Was können wir fühlen? • Druck: Statischen Druck, natürlich nur über einer bestimmten Intensitätsschwelle (besonders niedrig im Gesicht). Die räumliche Unterschiedsschwelle (wie wird die gemessen?) ist besonders niedrig an Zunge, Lippen, Fingerspitzen. • Bewegte Reize => wir können dann die Bewegungsrichtung erkennen • Vibrationen – auch für Schwingungen von nur ein paar µm. Klassifizierung von Rezeptoren: Diese sind mechanorezeptive Aβ-Fasern mit korpuskulären Endigungen. Klassifizierung nach adäquatem Reiz, Geschwindigkeit und dem Ausmaß der Adaptation (= wie schnell/stark wird die Antwort bei anhaltendem Reiz abnehmen): Langsam adaptierende (slowly adapting), SA; kodieren die Reizstärke. Sie zeigen nach der Adaptation noch eine statische Antwort, die nur bei Beendigung des Reizes endet. Funktionieren als Proportional-Differenzial Sensoren (übermitteln Information über die Reizgröße – Proportionalantwort – aber reagieren auch auf rasche Reizänderungen – Differenzialantwort). SA1 Rezeptoren = Merkel-Endigungen. In Basalschicht der Epidermis in der unbehaarten + behaarten Haut. Umgewandelte Epithelzellen (Merkel-Zellen), die rezeptive Endigungen umgeben. Kleine rezeptive Felder (~3 mm). Kodieren die Stärke von länger andauerndem Druck. Sie reagieren stärker auf Kanten als auf ebene Flächen => sie sind besonders nützlich für Objekterkennung. SA2 Rezeptoren = Ruffini Körperchen. In Dermis in der unbehaarten + behaarten Haut. Sensorische Endigungen sind umschlungen von einem kolbenförmigen Gebilde, in das kollagene Fasern einstrahlen (meist von einer Kapsel aus Perineuralzellen umgeben). Weniger empfindlich, langsamer adaptierend als SA1. Große rezeptive Felder (~3 cm). Kodieren tangentiale Dehnung der Haut => lang andauernden Druck und Spannung. Schnell adaptierende (rapidly adapting), RA; kodieren die Veränderung der Reizstärke => sie sind Geschwindigkeitssensoren RA = Meißner Körperchen. In der unbehaarten Haut. Lamellen-artig angeordnete Schwannzellen mit einer perineuralen Kapsel. Von mehreren sensorischen Endigungen innerviert (schraubenförmig zwischen die Schwanzellen eingelagert). Durch Kollagenfibrillen an Epithelzellen gebunden (was die mechanische Übertragung ermöglicht). Kodieren die Geschwindigkeit eines Druckreizes und langsame Vibrationen. Sehr schnell adaptierende (Pacini), PC; funktionieren als Beschleunigungssensoren. PC = Pacini Körperchen. Im subkutanen Gewebe, auch im Mesenterium. Ovale Korpuskeln; das Ende einer sensorischen Nervenfaser wird von vielen Schichten umgewandelter Schwannzellen und Perineuralzellen eingehüllt. Kodieren die Geschwindigkeitswechsel von Reizen (Beschleunigung), Vibrationen. Extrem empfindlich, sehr große rezeptive Felder. Räumliche Diskrimination: Am besten durch SA1 Rezeptoren (warum?), deren Innervationsdichte besonders hoch an den Fingerspitzen ist. Räumliche Diskrimination => Relation zu Hemmung (siehe oben). Formkodierung: Von SA1 Rezeptoren bis zu kortikalen Neuronen im primären somatosensorischen Kortex (Brodmann Area 3b) gibt es eine Punkt-zu-Punkt Repräsentation der Hautoberfläche. Innerhalb von Subregionen des primären somatosensorischen Kortex => Neurone, die auf Kanten, Orientierungen, etc. reagieren => Mustererkennung. Weitere Schritte im sekundären somatosensorischen Kortex. 7 Bewegungskodierung: RA-Rezeptoren => zu bewegungssensitiven Neuronen in Area 1 (primärer somatosensorischer Kortex). Antworten bevorzugt auf eine bestimmte Bewegungsrichtung. Weitere Schritte im posterioren parietalen Kortex. Vibrationskodierung: Meissner (<40 Hz) und PC-Rezeptoren (100-200 Hz). Schwelle = Die Schwingungsamplitude, bei der die afferenten Nervenfasern ein AP pro Schwingungsperiode generieren; niedrigere Amplitude => einige APs fehlen; höhere Amplitude => mehr als 1 AP pro Periode. Propriozeption: Vermittelt die Qualitäten Lage, Bewegung, Kraft. • • • • Lagesinn: Information über die Stellung der Gelenke. Bewegungssinn: Vermittelt die Geschwindigkeit der Bewegung (egal ob aktive oder passive Bewegungen) Kraftsinn: Vermittelt das Ausmaß der Muskelkraft, die für die Aufrechterhaltung einer Gelenkstellung oder für die Durchführung einer Bewegung erförderlich ist. Untersucht von…? Ergorezeption: Ein grober Kraftsinn, vermittelt durch freie Nervendigungen im Muskel (Temperatur- oder Metabolit-sensitiv). Propriozeptoren: • Korpuskuläre Endigungen (Ruffini-ähnlich) in Gelenkkapseln => Dehnungsrezeptoren. • Muskelspindeln, die Endigungen von Gruppe Ia- und Gruppe IIa-Afferenzen enthalten (dynamische vs. statische Reizantworten). Parallel zu den Muskelfasern angeordnet. Signalisieren die Muskellänge (Reiz = Längezunahme des Muskels) • Golgi-Sehnenorgane, die Endigungen von Gruppe Ib-Afferenzen enthalten und sich am Übergang vom Muskel in die Sehne befinden. In Serie zu den Muskelfasern angeordnet. Signalisieren die Muskelkraft (Reiz = aktiv erzeugte Muskelkraft, nicht passive Dehnung). 8 5. Stunde: Thermorezeption, Viszerozeption Thermorezeption: Vermittelt die Qualitäten Wärme und Kälte (Veränderungen der Hauttemperatur). Es gibt nicht eine „Temperaturempfindung“, sondern zwei Arten: Wärme- und Kälteempfindung. Die Rezeptoren sind freie Nervendigungen in der Haut (Epidermis oder Dermis, noch nicht klar). • Kaltrezeptoren werden von Aδ-Fasern gebildet (nach Erlanger und Gasser; = III nach Lloyd und Hunt) • Warmrezeptoren werden von ummyelinisierte C-Fasern ( = IV) gebildet. • Beide Rezeptortypen funktionieren als Proportional-Differential Sensoren: Sie reagieren stark (durch eine starke Änderung ihrer Aktionspotenzialfrequenz) auf stufenförmige Temperaturänderungen (dynamische Antwort), aber kodieren auch die statische Temperatur mit tonischen Antworten. • Dynamische Temperaturempfindungen: Detektionsschwellen hängen von der Geschwindigkeit der Temperaturänderung, der Größe der gereizten Hautfläche und der Ausgangstemperatur ab; kann so niedrig sein wie 0.2°C. Abhängigkeit von Ausgangstemperatur: Im Kaltbereich wird eine Abkühlung leichter erkannt als eine Erwärmung; im Wärmebereich wird eine Erwärmung leichter erkannt. • Ausgeprägte Adaptation (was ist Adaptation?). Beispiel für Adaptation: Webers „ZweiSchalen-Versuch“. • Jeder Kalt- und Warmrezeptor besitzt eine individuelle Antwortkurve mit einer optimalen Temperatur, bei der die tonische Aktivität am höchsten ist. Die Temperaturempfindung entsteht im ZNS aus der Differenz der Aktivitäten von Kalt- und Warmrezeptoren. • Kaltrezeptoren: Aktiv von ~10°C bis ~38°C; Maximum bei ~25°C. Unterhalb wird die Kälteempfindung durch Kälteschmerz ersetzt (Nozizeptoren werden aktiviert). • Warmrezeptoren: Aktiv von ~30°C bis ~45°C; Maximum bei ~43°C. Oberhalb wird die Wärmeempfindung durch Hitzeschmerz ersetzt (Nozizeptoren). • Thermische Indifferenzzone (oder Indifferenztemperatur): ~30-35°C: beide Rezeptortypen aktiv, aber nach Adaptation verschwindet die Wärme- oder Kälteempfindung völlig • Einige Kaltrezeptoren werden über 45°C aktiv (inadäquat gereizt) => paradoxe Kälteempfindung. Zentrale Neurone der Thermorezeption: Kalt-Neurone: lokalisiert im Hinterhorn des Rückenmarks. Werden von Kaltrezeptorafferenzen erregt, von Warmrezeptorafferenzen gehemmt => Axon zum somatosensorischen Thalamus. Andere Neurone im Hinterhorn werden durch Abkühlung und Erwärmung aktiviert => HPC Neurone, aktiviert von „heat“, „pinch“, „cold“. Die Kalt-Neurone hemmen die thalamokortikale Verarbeitung der Ausgangssignale dieser Neurone. Paradoxe Hitzeempfindungen: Diese Hemmung entfällt z.B. bei Blockade der myelinisierten Afferenzen durch Nervkompression. Viszerozeption: verschiedene Qualitäten von viszeralem Schmerz zu Hunger, Durst oder Atemnot. • Generell nicht bewusst wahrgenommen: Empfindungen entstehen bei Abweichungen von der normalen physiologischen Funktion => unangenehm/schmerzhaft. • Viszeraler Schmerz wird in die Haut fehllokalisiert • Viszeraler Schmerz wird durch spinale Afferenzen vermittelt; kortikale Repräsentation in der Inselrinde. Verschiedene Beispiele: Mechanorezeptoren: • Mechanorezeptoren in der Bauchwand; Dehnungrezeptoren im Gastrointestinaltrakt vom Ösophagus bis zum Rektum (für die Kontrolle der Peristaltik). Leichte Dehnung => phasische Antwort; starke Dehnung => tonische Antwort => Schmerz. Struktur: Unmyelinisierte Endigungen, die von myelinisierten afferenten Nervenfasern gebildet werden. • Herz-Kreislauf System: Mechanorezeptoren, die Blutdruck oder intravasale Volumina messen. Mechanorezeptoren auch in Thoraxwand (um Herzaktivität zu detektieren). • Dehnungrezeptoren in der Harnblase (=>Harndrang), Lungendehnungsrezeptoren, Mechanorezeptoren in den Mammillen der stillenden Mutter (für den Milchejektionsreflex). 9 Chemorezeptoren: • Chemorezeptoren der Glomera carotica und aortica. Registrieren die Veränderungen des O2und CO2-Partialdrucks. Für CO2 auch Rezeptoren in der Medulla oblongata und Area postrema. • Glucose-Rezeptoren im Duodenum/Dünndarm. • Chemorezeptoren in der Schleimhaut von Bronchien, Pharynx, Nase => zur Steuerung des Hustenreflexes, Würgereflexes und Niesreflexes. • Nozizeptive Afferenzen aus dem Herzen oder den Blutgefäßen, die chemisch gereizt werden können => Schmerz. 10 6. Stunde: Schmerz Schmerz = „ein unangenehmes Sinnes- und Gefühlserlebnis, das mit aktueller oder potenzieller Gewebsschädigung verknüpft ist oder mit Begriffen einer solchen Schädigung beschrieben wird“. (International Association for the Study of Pain, IASP). Der Schmerz hat verschiedene Komponenten: Sensorische, affektive (Emotionen), vegetative (Reaktionen des vegetativen Nervensystems, z.B. Blutdruckabfall, Übelkeit), motorische (Schutzreflexe) und kognitive (z.B. Schmerzäußerungen). Nozizeption: vermittelt Schmerz = objektive Vorgänge, mit denen das Nervensystem noxische Reize aufnimmt und verarbeitet. Schmerzklassifikationen: Nach Art der Schmerzentstehung: • Physiologischer Nozizeptorschmerz (bei Gewebeschädigungen). Dies sind „normale“ Schmerzen: Zeigen Krankheiten an; erzwingen ein nützliches Verhalten (z.B. Schonung) • Pathophysiologischer Nozizeptorschmerz (bei Gewebeveränderungen, z.B. Entzündung). Die Schmerzschwelle sinkt, so dass niedrige Reizintensitäten als schmerzhaft empfunden werden (Hyperalgesie). Die Hyperalgesie ist nicht nur auf den Ort der Schädigung begrenzt (z.B. Sonnenbrand, Gelenkentzündung) • Neuropatischer Schmerz (Schädigung von Nervenfasern). Bei Schädigung im Zentralnervensystem=> zentrale Schmerzen • In manchen Fällen (oft bei chronischen Rückenschmerzen) gibt es keine pathologische Schädigung, sondern ein psychisches Phänomen (sensorische, psychologische und soziale Faktoren) Nach Entstehungsort: • Somatischer Oberflächenschmerz (Haut) • Somatischer Tiefenschmerz (Muskulatur, Knochen, Gelenke, Bindegewebe) • Viszeraler Tiefenschmerz (Eingeweide) Nozizeptoren: • Rezeptoren sind freie Nervenendigungen in der Epidermis/Dermis/Eingeweideorganen/Teilen des Bewegungsapparats; z.B. wird stechender Schmerz dünnen myelinisierten Aδ (III; Leitungsgeschwindigkeit 2,5-30 m/s) Afferenzen zugeschrieben, brennender Schmerz => C (IV; 1-2,5 m/s) unmyelinisierten Afferenzen. • Die Schwelle => hoch – nur durch intensive Reize erregt. • Die räumliche Auflösung in der Haut ist ~1 cm; viel schlechter in Eingeweiden. • Die meisten Nozizeptoren sind polymodal => reagieren auf mechanische, thermische und chemische Reize. Es gibt z. B. auch Mechanonozizeptoren. • Die Rezeptoren adaptieren langsam. • Einige Empfindungen, die durch Nozizeptoren vermittelt werden werden nicht als Schmerz erkannt: Nozizeptoren in der Schleimhaut vermitteln z.B. scharfen Geschmack. • Gereizte Nozizeptoren können verschiedene Substanzen (z.B. Substanz P, Neurokinin A, Somatostatin oder Calcitonin-gene related peptide, CGRP) lokal freisetzen => lokale Änderungen der Durchblutung und Gefäßpermeabilität = neurogene Entzündung. Immunzellen können auch lokal aktiviert werden. • Das zentralnervöse nozizeptive System: nozizeptive Neurone des Rückenmarks und des Trigeminuskerns (für den Kopfbereich) und des nozizeptiven thalamokortikalen Systems (für die Entstehung bewusster Schmerzempfindungen verantwortlich). Transduktionsmechanismen: • Mechanische Reize: Durch Kationenkanäle, die mechanisch geöffnet werden • Hitzereize: Der Vanilloidrezeptor 1 aus der „transient receptor potential“ (TRP) Familie, TRPV1 genannt. Kationenkanal, der durch Hitze aktiviert wird. Auch durch Capsaicin aktiviert. • Chemische Reize: Viele verschiedene Rezeptoren, die durch Moleküle (Mediatoren) aktiviert und/oder sensibilisiert werden; z.B. Entzündungsmediatoren wie Bradykinin, Prostaglandine. Metabotrope Rezeptoren (G-Protein-gekoppelt; z.B. Prostaglandinrezeptoren) und auch ionotrope Rezeptoren (z.B. Serotoninrezeptoren). + • Säure-sensitive Kanäle: Na -permeable Kanäle, die bei niedrigen pH-Werten geöffnet werden (ASIC = acid sensing ion channel) 11 Spinales nozizeptives System: Nozizeptive Rückenmarkneurone • Aufsteigende Bahnen, die das thalamokortikale System aktivieren (=> bewusste Schmerzempfindung). • Über nozizeptive Interneurone werden motorische Reflexe ausgelöst; z.B. der Wegziehreflex, der gekreuzte Streckreflex (Zurückziehen + Aktivierung der kontralateralen Seite => Körperstabilisierung). Auch komplexe motorische Reaktionen; z.B. Schonhaltungen verletzeter Gliedmaßen. • Auch vegetative Reflexe (vegetative und neuroendokrine Reaktionen) • Viele Nozizeptoren konvergieren auf eine nozizeptive Zelle => das rezeptive Feld eines Rückenmarkneurons ist größer als das eines Nozizeptors. Einige Rückenmarkneurone werden von A) Primärafferenzen, und B) Nozizeptoren aktiviert. A) – die Neurone reagieren mit APs mit niedriger Frequenz. B) – hohe Frequenz. Konvergenz: ¾ Nur von der Haut, reagieren auf Oberflächenschmerz ¾ Haut + Tiefengewebe (Gelenke, Muskulatur) ¾ Nur Tiefengewebe, reagieren auf somatischen Tiefenschmerz ¾ Viszera, Haut und/oder Tiefengewebe ¾ Das resultiert im „übertragenen Schmerz“ (z.B. bei Ischämie des Herzens wird der Schmerz im linken Arm empfunden). Die verschiedenen Fälle wurden von Head beschrieben; bekannt als „Head-Zonen“. • Nozizeptive Neurone haben Post-Synapsen für u.a. Mechanosensoren, Nozizeptoren (erregend) und Interneurone (inhibitorisch). ¾ Erregung: Durch Glutamat, Neuropeptide (Substanz P, CGRP). Glutamat = Haupttransmitter. Substanz P, CGRP => stärken die Glutamatwirkung über GS-Proteine. ¾ Hemmung: Durch GABA und/oder Glycin, hemmende Neuropeptide wie Opioidpeptide (z.B. Enkephalin) ¾ Glutamat: Aktiviert AMPA/Kainat-Rezeptoren, NMDA Rezeptoren, mGluR Rezeptoren. Niedrige Depolarisation (z.B. durch Mechanosensoren) aktiviert hauptsächlich AMPA-Rezeptoren. Höhere Depolarisation: NMDA Rezeptoren auch aktiviert (Magnesiumblock der NMDA Rezeptoren wird aufgehoben – wie?). ¾ NMDA Rezeptor Aktivierung kann plastische Konsequenzen haben (Sensibilisierung) ¾ Deszendierende Bahnen können den Schmerz kontrollieren; z.B. durch Opioide wie Endorphine und Endomorphine (wirken an µ-Rezeptoren), Enkephaline (δ-Rezeptoren) oder Dynorphin (κ-Rezeptoren) => Neurone werden hyperpolarisiert. Diese Neurone ermöglichen vielleicht Plazeboeffekte => durch die Erwartung werden anti-nozizeptive Neurone aktiviert, die Opioide freisetzen. Thalamokortikales nozizeptives System: • Bewusste Schmerzempfindung. • Thalamokortikales System im Wachzustand => Schmerz wird empfunden. Starke Schmerzreize aktivieren Wachmechanismen. • Mehrere Areale im Kortex beteiligt (S1 im Gyrus postcentralis, mit sensorisch-diskriminativen Aufgaben; S2 im Parietalkortex, sensorisch-integrativ; Insula, sensorisch-limbische Interaktionen; Gyrus cinguli, Aufmerksamkeit; präfrontaler Kortex, Kontrolle über Affekt, Emotion, Gedächtnis). Klinisch-relevante Schmerzen: • Entzündungsschmerzen. Polymodale Nozizeptoren werden sensibilisiert durch Mediatoren von Entzündungszellen, Plasma, Thrombozyten => Schwelle sinkt => primäre Hyperalgesie. Sensibilisierung erfolgt durch Second-Messenger-Systeme; z.B. ProstaglandinAdenylatzyklase-cAMP-Protein Kinase A-Phosphorylierung von Ionenkanälen oder Bradykinin-Phospholipase C-Diacylglycerin-Protein Kinase C-Phosphorylierung von Ionenkanälen. Auch spontane Nozizeptoraktivität in entzündetem Gebiet => Ruheschmerzen. „Stumme“ Nozizeptoren (die eine extrem hohe Erregungsschwelle besitzen) werden auch sensibilisiert und werden durch mechanische/thermische Reize erregbar. • Neuropatische Schmerzen. Durch Entstehung ektoper Aktionpotenziale (verletzte, erkrankte Nervenfasern). 12 • • • Zentrale Sensibilisierung; z.B. bei Rückenmarksneuronen: Entzündung aktiviert Rückenmarksneurone, die durch die wiederholte Stimulation sensibilisiert werden (z.B. durch die oben erwähnten plastischen Effekte der NMDA-Aktivierung) und nun ähnlich auf schwächere Inputs aus anderen Regionen reagieren (sekundäre Hyperalgesie). Schmerz duch kortikale Reorganisation – Areale, die keinen sensorischen Eingang besitzen, werden von anderem Eingang „mitbenutzt“ (z.B. Phantomschmerz nach Amputation). Schmerz als Lernprozess => klassische oder operante Konditionierung. Schmerztherapie: Kausale Schmerztherapie = Beseitigung des schmerzauslösenden Krankheitsprozesses. Auch symptomatische Schmerztherapie; besonders bei chronischen Schmerzen => z.B. medikamentös; auch physikalische Methoden wie Akupunktur; oder neurochirurgische Maßnahmen. Analgetika: • Non-steroidal anti-inflammatory drugs (NSAID) wie Azetylsalizylsäure. Hemmen die Bildung von Prostaglandinen. • Opiate; wie Morphin. Siehe oben. • Lokalanästhetika => Alle Nervenfasern werden lokal inaktiviert; z.B. Procain: Blockierung von + Na -Kanälen. Wofür? • Antikonvulsiva, die generell die Erregbarkeit von Nervenzellen hemmen, oder Antidepressiva, die die endogene Schmerzhemmung stärken. Physikalische Methoden: • Massage, Krankengymnastik, Bewegungstherapie => wahrscheinlich indirekte Mechanismen (fördern Heilung, lockern Muskelspannung, etc). • Kälte- und Wärmebehandlung. Durch verschiedene Mechanismen; z.B. Bekämpfung der Entzündung durch Absenkung metabolischer Vorgänge (Kälte) oder Förderung von Heilungsprozessen (Wärme). Kälte kann auch die Temperatur bis unterhalb der Temperatur, die die (sensibilisierten) Nozizeptoren erregt, senken. • Akupunktur => Plazeboeffekte? (siehe oben). Afferente Hemmung? (via Prinzip der Gegenirritation: Schmerzhafte Empfindungen werden durch andere gleichzeitig wirkende Sinnesreize unterdrückt). 13 7. Geschmackssinn Chemosensibilität: Wichtig für die Steuerung des Ess- und Trinkverhaltens (unterstützt z.B. die Aufnahme von Aminosäuren, Salzen, Kohlenhydraten); soziale Funktionen (Mutter-Kind-Bindung, Partnerwahl); Abwehr gegen verdorbene Lebensmittel, Gifte (wie bittere Alkaloide), etc. • Spezifische Chemosensibilität: Geschmackssinn + Geruchssinn. Chemische Substanzen interagieren mit Membranmolekülen => Rezeptorpotenziale in Sinneszellen (Geschmackspapillen, Riechepithelium). • Unspezifische Chemosensibilität: Afferenzen der Nervus trigeminus, Nervus vagus und Nervus glossopharyngeus (in hinterer Zungenregion, Epiglottis, Ösophagus); reagieren auf Reizstoffe (z.B. Capsaicine, Meerrettich). Ermöglichen Reflexe wie Niesen, Husten, Wügen, Erbrechen, vermehrte Speichel- und Tränensekretion. Geschmacksrezeptoren: • Auf der Zunge (~2/3), Gaumen, Epiglottis, Pharynx. Bei Säugling/Kleinkind auch auf den Schleimhäuten der Wangen (warum?) • Vermitteln 5 Qualitäten: süß, sauer, salzig, bitter, Umami (durch Glutamat auslösbarer Geschmack) • Geschmackspapillen: 3 Typen: ¾ Pilzpapillen (Papillae fungiformes); über die Zungenoberfläche verstreut; es gibt 200400 Pilzpapillen. Enthalten ~3-4 Geschmacksknospen (pro Pappilla), die in den Wänden und Gräben der Papillen liegen. ¾ Blätterpapillen (Papillae foliatae); als dicht hintereinander liegende Falten am hinteren Seitenrand der Zunge; 15-20 Blätterpapillen. Enthalten ~ 50 Geschmacksknospen. ¾ Wallpapillen (Papillae vallatae), an der Grenze zum Zungengrund; 7-12. Enthalten ~100 Geschmacksknospen. ¾ [Fadenpapillen, Papillae filiformes, haben keine Geschmacksfunktion! Nur taktile Funktion] ¾ Erwachsene haben 2000-4000 Geschmacksknospen (weniger mit zunehmendem Alter). • Geschmackssinneszellen = spezialisierte Epithelzellen = sekundäre Sinneszellen, ohne Nervenfortsatz. ¾ Jede Geschmacksknospe enthält 10-50 Sinneszellen, die wie in einer Citrusfrucht angeordnet sind. Apikal ein Porus. ¾ Basalzellen am Fuß der Geschmacksknospen generieren ständig Sinneszellen, die nur 10-15 Tage überleben. ¾ Andere Zellen in den Geschmacksknospen: Stützzellen, die vielleicht zur Sensitivität gegenüber Anionen beitragen; sie entfernen ATP (siehe unten) mithilfe von Ectonucleotidasen (Enzymen). Nachbarzellen, die Serotonin freisetzen (siehe unten). + + ¾ Die Sinneszellen können spannungsgesteuerte Na - und K -Kanäle enthalten, um APs zu generieren (aber nicht immer!) ¾ Die Sinneszellen sind polare Zellen: Mikrovilli (apikal), die die Oberfläche vergrößern. Basolateraler Teil durch gap junctions mit den Nachbarzellen verbunden. ¾ Geschmacksrezeptoren in Mikrovilli => Rezeptorpotenzial entsteht apikal. Transformation (in AP) => an der basolateralen Membran und den nachgeschalteten afferenten Fasern. ¾ Basal finden sich Endigungen afferenter Fasern der Geschmacksnerven (VII, IX, X). ATP depolarisiert die Endigungen => APs. ¾ Geschmackssinneszellen wirken auf mehrere Axone und Nachbarzellen. Auch die afferenten Fasern kontaktieren mehrere Sinneszellen (oft aus verschiedenen Geschmacksknospen), aber typischerweise nur Sinneszellen, die auf eine bestimmte Geschmacksqualität reagieren. => Große rezeptive Felder. ¾ Aus der Aktivität einzelner Fasern => keine eindeutige Information. Ein Vergleich der Erregungsmuster mehrerer Fasern = Information. ¾ Generelle Transduktionsmechanismen: Depolarisation in Sinneszellen => Erhöhung des intrazellulären Calciumspiegels => ATP wird von Sinneszellen durch nichtsynaptische Mechanismen (z.B. durch porenbildende Proteine (Pannexine)) freigesetzt. ATP aktiviert ATP-gesteuerte Ionenkanäle der afferenten Nervenfasern (P2X Rezeptoren = Purinozeptoren); auch auf den Nachbarzellen, die Serotonin freisetzen (synaptisch!). Die afferenten Fasern generieren APs. 14 ¾ Einzelne Sinneszellen reagieren auf Vertreter einer oder mehrerer Geschmacksqualitäten! Aber eine Zelle ist für eine Modalität am empfindlichsten (z.B. süß). Transduktion und Transformation von Geschmacksreizen: • Sauer. Kationenkanäle der TRP-Familie (transient-receptor-potential) werden durch eine Erhöhung der H+-Konzentration (=verminderter pH-Wert) geöffnet. Sie leiten überwiegend Na+ und Ca2+. Andere Kanäle spielen hier auch eine Rolle; wie z.B. Kaliumkanäle, die zum Ruhemembranpotenzial beitragen und duch H+ blockiert werden => Depolarisation. • Salzig. Natriumkanäle der EnaC-Familie (epitheliale Natriumkanäle) in der Membran => bei Aufnahme salziger Speisen wird der Einström von Na+ erhöht => Depolarisation. Amilorid blockiert diese Kanäle. Sowohl Kationen als auch Anionen tragen zur Geschmacksintensität bei; einige Salze mehr als andere: NH4+ >K+>Ca2+>Na+>Li+>Mg2+. Für Anionen: SO42- >Cl->Br>I->HCO3->NO3-. • Süß. Zuckermoleküle und D-Aminosäuren binden an T1-Rezeptoren (metabotrope, G-Proteingekoppelte Rezeptoren). Verschiedene Isoformen: T1R1, T1R2, T1R3. Die Rezeptoren funktionieren als Dimere: Süß-Rezeptoren sind T1R2-T1R3 Dimere. G-Protein (Gustducin?) Aktivierung => Phospoholipase C Aktivierung => Diacylglycerol + IP3 => Ca2+ Einstrom (z.B. aus endoplasmatischem Retikulum) => Transmitterfreisetzung. • Umami. Wie für „süß“, aber Nutzung von T1R1 + T1R3. T1R1 Rezeptoren haben eine niedrige Affinität => Zucker und Aminosäure werden nur in hohen Konzentrationen wahrgenommen (10-100 mM). Warum? • Bitter. Wie für „süß“ oder „Umami“ => Dimere von T2 Rezeptoren. Gustducin-aktiviert, wie oben. Bittersubstanzen haben im Gegensatz zu Zuckern oder Aminosäuren eine sehr niedrige Schwelle – warum? Die Geschmacksempfindung wird durch die Schwellenkonzentration von Substanzen bestimmt. Wahrnehmungsschwelle = Geschmack wird wahrgenommen, aber nicht erkannt; liegt unter der Erkennungsschwelle. Zusätzlich kann die Konzentration die Geschmacksqualität beeinflussen: Einige Salze können bei niedrigen Konzentrationen als süß empfunden werden. Wie andere Rezeptoren können auch die Geschmackssensoren adaptieren. Adaptation – schneller bei z.B. salzig-schmeckenden Stoffen als bei Bitterstoffen – warum? Negative Nachbilder = Rezeptoren z.B. auf süß adaptiert => destilliertes Wasser wird danach sauer schmecken. Zentrale Verarbeitung: • Afferente Fasern der Geschmacksnerven (Hirnnerven VII, IX, X). • Vordere 2/3 der Zunge => über die Chorda timpani in Nervus facialis (VII); Papillen am Gaumen => über Nervus petrosus major auch in Nervus facialis. • Papillen im hinteren Zungengrund => Nervus glossopharyngeus (IX) • Papillen tief im Gaumen und Pharynx => Nervus vagus (X) • Efferenzen zum Nucleus tractus solitarii (im Hirnstamm). Axone vom Nucleus tractus solitarii zum Thalamus (Nucleus ventralis posterior) und auch zum limbischen System. • Kortex: Primäres Projektionsfeld = am Fuß des Gyrus postcentralis. Sekundäre Areale = orbitofrontaler Kortex. 15 8. Geruchssinn Geruch wird mithilfe von Riechsinneszellen in der Nase empfunden; diese sind primäre Sinneszellen (Neurone). Düfte werden subjektiv bewertet (Hedonik => Düfte werden als angenehm oder unangenehm bewertet). Für manche Düfte genetisch determiniert (faules Fleisch = unangenehm), für die meisten => gelernt. [Wichtig: Freie Nervenendigungen des N. trigeminus in der Nasenschleimhaut haben neben der nozizeptiven auch olfaktorische Funktionen; reagieren auf stechende Gerüche wie Salzsäure, Ammoniak, Chlor. Nervendigungen im Mund reagieren auf brennende Scharfstoffe - Capsaicin]. Organisation: 2 • In der Nasenhöhle => Riechepithel, ca. 2x5 cm groß. Besteht aus Riechsinneszellen, Stützzellen und Basalzellen (= Stammzellen). • Ca. 30 Millionen Riechsinneszellen. Diese überleben ~1 Monat. Basalzellen differenzieren sich in Riechzellen (ungewönlicher Mechanismus!). • Riechsinneszellen = bipolare Zellen; die apikalen Enden formen feine Sinneshaare (Zilien). Die basalen Enden formen Axone, die direkt zum Gehirn projizieren. Die Axone laufen durch die Siebbeinplatte und ziehen zusammen (als Nervus olfactorius) zum Bulbus olfactorius. • Die Axone enden in den Glomeruli (100 – 200 µm groß), die von Riechsinneszellaxonen und Dendriten von Mitralzellen (=> viele Synapsen) gebildet werden. Konvergenz => mehr als 1000 Axone projizieren auf die Dendriten einer Mitralzelle. Zahl von Glomeruli korreliert mit der Zahl der funktionalen Riechrezeptoren. • Interneurone (periglomeruläre Zellen) schicken auch Dendriten in die Glomeruli => Synapsen mit Axonen von Riechsinneszellen. Auch andere Interneurone beteiligt (Körnerzellen). • Horizontal werden die Glomeruli durch ein Netz von GABAergen, hemmenden Interneuronen verbunden (periglomeruläre Neurone). Aktivierung von Interneuronen führt zur lateralen Hemmung => wofür? • Zwischen periglomerulären Zellen, Mitralzellen und Körnerzellen (weniger) bilden sich dendrodendritische Synapsen => ermöglichen rekurrente Hemmung => Kontrastverschärfung. • Die Mitralzellenaxone formen den Tractus olfactorius. Ein Hauptast kreuzt in der vorderen Komissur zum Bulbus der anderen Hirnseite; andere Fasern zu Projektionsfeldern im Paleokortex. Signale werden weitergeleitet zum Neokortex (Cortex praepiriformis), limbischen System (Mandelkern, Hippokampus), Hipothalamus, Formatio reticularis. • Adaptation: Auf Rezeptorebene; aber auch durch zentrale Mechanismen. Geruchsdiskriminierung: • ~10.000 Düfte konnen diskriminiert werden • Jeder Duftstoff aktiviert eine besondere Auswahl von Riechrezeptoren • 7 typische Geruchsklassen: blumig, ätherisch, moschusartig, kampherartig, faulig, schweißig, stechend • Anosmie = kompletter Verlust des Geruchssinnes. Partielle Anosmien => z.B. fehlen Rezeptormoleküle für bestimmte Düfte Signaltransduktion: • Rezeptormoleküle: Eine Genfamilie G-Protein-gekoppelter Rezeptoren mit ~350 Proteinen, die in Clustern über alle Chromosomen verteilt ist (nicht Y und #20). Jede Riechzelle stellt nur einen oder wenige Typen von Rezeptorproteinen her. • Transduktion: G-Protein-vermittelte Aktivierung der Adenylatzyklase => cAMP steigt => + Kationenkanäle öffnen sich (cAMP/cGMP-aktivierte Ionenkanäle = CNG-Kanäle) => Na - und 2+ 2+ 2+ Ca -Einstrom => Depolarisation. Durch Ca -Einstrom können auch Ca -aktivierte Chloridkanäle geöffnet werden => Chloridausstrom => Verstärkung der Zellerregung. • Adaptation => z.B. durch Ca2+/Calmodulin, das die CNG-Kanäle blockiert. • Am Übergang zum Nervenfortsatz => APs. • AP Frequenz hängt vom Duftstoff ab; bestimmte Duftstoffe können auch eine Hemmung der Spontanrate triggern. • Summenableitungen der Erregung von größeren Arealen der Riechsschleimhaut => Elektroolfaktogramm (EOLG; ähnlich am EEG). 16 Wie beim Geschmackssinn gibt es eine Wahrnehmungsschwelle und eine Erkennungsschwelle für jeden Geruch. Diese Schwellen sind generell sehr niedrig. Die Unterschiedsschwelle (was ist das?) ist relativ groß (~25%). Jeder Mensch ist durch einen individuellen Körpergeruch identifizierbar, der wahrscheinlich durch Zerfallsprodukte von Haupthistokompatibilitätskomplex (MHC) Molekülen entsteht => wichtig für Partnerwahl. Viele Säugetiere haben ein weiteres Organ, das Vomerosanalorgan, das der Wahrnehmung von Pheromonen dient. Es ist beim Menschen unterentwickelt und hat wahrscheinlich keine Funktion. Spermien besitzen auch alle molekularen Komponenten der Duftsignalkaskade => um die Eizelle via Chemotaxis zu finden. 17