Aufbau der Elemente in Stichworten (Merksätzen)
Werbung
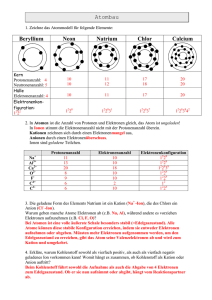
Aufbau der Elemente in Stichworten (Merksätzen) Atom Das Atom besteht aus einem Atomkern und einer Atomhülle Atomkern Der Atomkern besteht aus Protonen und Neutronen Atomhülle Die Atomhülle besteht aus Elektronen Elektronenzahl Die Elektronenzahl in einem Atom ist gleich der Protonenzahl Protonen Protonen sind einfach positiv geladene Teichen mit einer Masse der −27 kg Größenordnung 10 Neutronen Neutronen sind ungeladene Teilchen und sind leicht schwerer als Protonen Elektronen Elektronen sind negativ geladene Teilchen und etwa 2000 mal leichter als Protonen Kennzeichnung von Atomen Der Name eines Atoms wird durch einen Großbuchstaben und einem oder keinem Kleinbuchstaben abgekürzt. Die Protonenzahl wird links oben neben die Abkürzung geschrieben, Die Summe aus Protonen und Neutronen links unten. (siehe Beispiel): Schalenmodell K-Schale Das Schalenmodell beschreibt die Anordnung der Elektronen in der Atomhülle. Die Atomhülle besteht aus einzelnen Schalen, die von innen nach außen alphabetisch durchgezählt werden, beginnend bei K Die K-Schale ist die 1. (innerste) Schale eines Atoms und kann 2 Elektronen aufnehmen Beispiel 1: Natrium 11 23 Na enthält 11 Protonen und 12 Neutronen = 23 Nukleonen, sowie 11 Elektronen. Die 11 Elektronen sind auf 3 Elektronenschalen aufgeteilt K-Schale : L-Schale : M-Schale : 2 Elektronen 8 Elektronen 1 Elektron 2 2 6 1 Elektronenkonfiguration : 1s 2s 2 p 3s Beispiel 2: Silizium 14 14 14 14 Si hat drei Isotope , 28 Si , 29 Si und 30 Si .Es enthält 14 Protonen und eine unterschiedliche Neutronenzahl (14, 15 und 16), sowie 14 Elektronen. Die 14 Elektronen sind auf 3 Elektronenschalen aufgeteilt K-Schale : L-Schale : M-Schale : 2 Elektronen 8 Elektronen 4 Elektronen 2 2 6 2 2 Elektronenkonfiguration : 1s 2 s 2 p 3s 3 p Beispiel 3: Chlor 17 Die L-Schale ist die 2. Schale eines Atoms und kann 8 Elektronen aufnehmen 17 17 Cl hat zwei Isotope 31 Cl und 33 Cl . Es enthält 17 Protonen und eine unterschiedliche Neutronenzahl (14 und 16), sowie 17 Elektronen. M-Schale Die M-Schale ist die 3. Schale eines Atoms und kann 18 Elektronen aufnehmen Die 17 Elektronen sind auf 3 Elektronenschalen aufgeteilt Unterschalen Ab der L-Schale existieren Unterschalen, die mit s,p,d,f bezeichnet werden K-Schale : L-Schale : M-Schale : L-Schale 2 Elektronen 8 Elektronen 7 Elektronen s-Unterschale Enthält maximal 2 Elektronen p-Unterschale Enthält maximal 6 Elektronen d-Unterschale Enthält maximal 10 Elektronen f-Unterschale Enthält maximal 14 Elektronen Kennzeichnung der Elektronenkonfiguration Die Elektronenkonfiguration wird angegeben durch das Hintereinanderschreiben der Schalennummer, des Unterschalenbuchstabens und der „hochgestellten Elektronenanzahl in der Unterschale (siehe Beispiel) Isotope Isotope sind Atome/Elemente gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl. Sie verhalten sich chemisch gleich Die 6 Elektronen sind auf 3 Elektronenschalen aufgeteilt Isobare Isobare sind Atome/Elemente gleicher Neutronenzahl, aber unterschiedlicher Protonenzahl K-Schale : L-Schale : M-Schale : Edelgase/Edelgas- Edelgase sind Atome/Elemente deren Schalen mit der Maximalzahl möglicher konfiguration Elektronen gefüllt sind. In Verbindungen können Atome eine edelgasähnliche Hülle bekommen, indem sie Elektronen an einen Bindungspartner abgeben oder von diesem Elektronen aufnehmen Ionen Ionen sind Atome, denen mindestens ein Elektron fehlt 2 2 6 2 5 Elektronenkonfiguration : 1s 2 s 2 p 3s 3 p Beispiel 4: Kohlenstoff 6 C hat zwei Isotope 126 C und 136 C . Es enthält 6 Protonen und eine unterschiedliche Neutronenzahl (6 und 7), sowie 6 Elektronen. 2 Elektronen 4 Elektronen - 2 2 2 Elektronenkonfiguration : 1s 2s 2 p Ein weiteres bekanntes Isotop ist 146 C . Dieses Isotop ist radioaktiv und zerfällt mit einer Halbwertszeit von 5730 Jahren. Es wird zur Altersbestimmung benutzt (Radiokarbonmethode). Aufgabe: Beispiel einer chemischen (Ionen-) Bindung Sauerstoff Natrium hat ein einzelnes Elektron in der äußersten Schale. Ohne dieses Elektron wären alle anderen Schalen komplett besetzt (Edelgaskonfiguration). Chlor hat die aüßerste Schale bis auf ein fehlendes Elektron besetzt. Mit einem zusätzlichen Elektron wäre die Schale komplett besetzt (auch eine Edelgaskonfiguration) Na 8 O hat 3 Isotope mit jeweils unterschiedlicher Neutronenzahl (8, 9 und 10). 1. Wie lautet die korrekte Kennzeichnung der 3 Isotope ? 2. Wie viele Elektronen sitzen in der jeweiligen Schale ? 3. Wie lautet die Elektronenkonfiguration? Cl 4. Zeichne das zugehörige Schalenmodell. 5. 2 Natriumatome und 1 Sauerstoffatom verbinden sich zu einem Molekül analog zur Darstellung des NaCl. Versuche den Prozess anhand des Schalenmodells und der von den Atomen angestrebten Edelgaskkonfiguaration zu erläutern. Radioaktivität (Zerfallsmechanismen) in Stichworten (Merksätze): β − − Zerfall Atomkerne zu viele Neutronen besitzen sind instabil. Durch die Umwandlung eines Neutrons (oder mehrerer in Folge) in jeweils 1 Proton und ein Elektron sowie ein weiteres neutrales Elementarteilchen kann wieder ein stabiles Gleichgewicht hergestellt werden. Das Proton verbleibt durch die anziehenden − Kernkräfte im Atomkern, während das Elektron als radioaktive β -Strahlung und das weitere Elementarteilchen (Neutrino) den Kern und das Atom verlassen. Bei einer Verbindung zwischen den beiden Elementen findet folgender Prozess statt: β + − Zerfall Das Natrium-Atom gibt sein äußerstes Elektron an das Chloratom ab und ist daher insgesamt positiv geladen (11 Protonen, 10 Elektronen) hat aber eine Edelgaskonfiguration.(volle L-Schale, M-Schale leer) Das Chlor hat ein zusätzliches Elektron bekommen und hat dadurch ebenfalls eine volle (Unter-) Schale ist durch das zusätzliche Elektron aber negativ geladen. Diese Konstellation aus einem positiven und einem negativen Ion ist verantwortlich für die stabile Verbindung der beiden Elemente Na und Cl zu Natriumchlorid (Kochsalz). Diesen Bindungstyp nennt man daher auch Ionenbindung. (+) Kochsalz (NaCl) (-) Atomkerne zu viele Protonen besitzen sind instabil. Durch die Umwandlung eines Protons (oder mehrerer in Folge) in jeweils 1 Neutron und ein Positron (positiv geladenes Elektron) sowie ein weiteres neutrales Elementarteilchen kann wieder ein stabiles Gleichgewicht hergestellt werden. Das Neutron verbleibt durch die + anziehenden Kernkräfte im Atomkern, während das Positron als radioaktive β Strahlung und das weitere Elementarteilchen (Neutrino) den Kern und das Atom verlassen. α-Zerfall Sehr schwere Atomkerne, die instabil sind kommen durch Aussendung eines αTeilchens (Ein Helium-Kern, 2Protonen und 2 Neutronen) in einen stabileren Zustand. Spontanspaltung Einige sehr schwere - natürlich vorkommende - Atomkerne neigen dazu spontan in 2 (selten auch mehr) Bruchstücke zu zerfallen. Da schwere Atomkerne neutronenreicher als leichte Atomkerne sind, haben die Spaltprodukte einen Neutronenüberschuss und zerfallen danach in mehreren Schritten über den β − − Zerfall wieder in stabile Kerne/Atome Kernspaltung Künstlich (in der Regel durch Neutronenbeschuss) hervorgerufene Kernspaltung. Die Folgeprozesse entsprechen denen der Spontanspaltung