Atmungskette ( Endoxidation)
Werbung

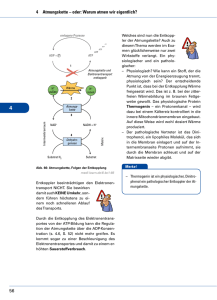
Atmungskette ( Endoxidation) Reaktionen und ATP-Synthase Einleitung Aufrechterhaltung von Struktur und Funktion aller Lebensformen hängt von einer ständigen Energiezufuhr ab Höchste Energieausbeute liefert die Verwendung von Sauerstoff als Oxidationsmittel Ort der sauerstoffabhängigen Energiekonservierung ist bei Eukaryonten die innere Mitochondrienmembran Mitochondrien besitzen 2 Membransysteme Äußere Membran ist durchlässig für kleine Moleküle und Ionen, sie enthält das porenbildende Protein Porin Innere Membran besitzt eine Anzahl von Einstülpungen ( Cristae) und ist für die meisten Moleküle undurchlässig Abb. 1 Mitochondrium schematisch ( aus Stryer Biochemie) Oxidative Phosphorylierung findet in der inneren Mitochondrien membran statt Reaktionen des Citratzyklus und der Fettsäureoxidation laufen in der Matrix ab Redoxpotenziale NADH+ H+ und FADH2 sind starke Reduktionsmittel und geben daher ihre Elektronen leicht ab Sauerstoff ist ein starkes Oxidationsmittel und nimmt Elektronen leicht auf Innerhalb der Atmungskette nimmt das Redoxpotential der einzelnen Komponenten zum Ende hin, immer positivere Werte an Übersicht 1. 2. 3. 4. 1. 2. Die Atmungskette besteht aus 4 Proteinkomplexen: NADH-Q-Oxidoreduktase ( Komplex 1) Succinat-Q- Reduktase (Komplex 2) Q- Cytochrom-c- Oxidoreduktase (Komplex3) Cytochrom-c-Oxidase ( Komplex 4 ) Sie sind verbunden durch 2 mobile Elektronen- Carrier : Coenzym Q ( Ubichinon) Cytochrom c Abb.2 Übersicht Atmungskette 1. SCHRITT Elektronen des NADH+H+ treten über die NADH- Q- Oxidoreduktase in die Atmungskette ein 1. 2. 3. Übertragung zweier Elektronen auf die prosthetische Gruppe Flavinmononucleotid (FMN)Æ FMNH2 ( reduzierte Form) Flavine und Chinone binden bei Reduktion Protonen Elektronen werden vom FMNH2 auf eine Reihe von Eisen- Schwefel- Clustern transferiert, welche die zweite prosthetische Gruppe des Komplexes bilden 2. SCHRITT Elektronen in den Eisen- Schwefel- Clustern werden auf das Coenzym Q übertragen 2. Die Reduktion von Q zu QH2 führt zur Aufnahme zweier Protonen aus der Matrix 3. Elektronen wandern zurück zum Fe-SCluster und reduzieren ein weiteres Coenzym Q ( Aufnahme von 2 zusätzlichen Protonen aus der Matrix) Æ Durch den Fluss von 2 Elektronen zum Ubichinol werden 4 Protonen aus der Matrix in das Cytosol des Mitochondriums gepumpt 1. 3. SCHRITT Elektronen vom FADH2 treten über das Coenzym Q ( Ubichinol) in die Atmungskette ein 1. 2. 3. Das Enzym Succinat- Dehydrogenase bildet im Citratcyklus FADH2 und ist gleichzeitig auch Komponente des Komplex 2 der Atmungskette Gebildetes FADH2 verlässt Komplex nicht, Elektronen wandern über Fe-S- Zentren zum Ubichinol Komplex 2 ist keine Protonenpumpe Æ bei der Oxidation von FADH2 wird weniger ATP gebildet 4. SCHRITT Elektronen fließen vom Ubichinol über die Q-Cytochrom-c- Oxidoreduktase zum Cytochrom c Q- Cytochrom-c-Oxidase ( CytochromReduktase) ist die zweite Protonenpumpe in der Kette 2. Cytochrom ist ein elektronenübertragendes Protein, enthält ein Häm als prosthetische Gruppe Æ Reduktase katalysiert Elektronenübertragung von QH2 auf das oxidierte Cytochrom c und pumpt gleichzeitig Protonen aus der Matrix 1. Struktur des Komplex 3 Enthält insgesamt 3 Hämgruppen (bl, bh,c1) Prosthetische Gruppe der Häme ist das Eisenprotoporphyrin IX ( Æ Myoglobin, Hämoglobin) Fe-S-Protein mit einem 2 Fe-2S-Zentrum Æ Rieske Zentrum 1. Eines der beiden Eisenionen ist mit 2 Histidinresten koordiniert Æ Stabilisierung des Zentrums in seiner reduzierten Form Zwei getrennte Bindungsstellen für Ubichinone Q0 und Qi Q- Zyklus Verknüpfung des Q- Elektronentransfers zu Cytochrom c mit dem Protonentransmembrantransport Erleichtert Übergang vom 2 Elektronentransporter Q zum 1 Elektronentransporter Cytochrom c Ergebnis: 2 Moleküle QH2 werden zu 2 Molekülen Q oxidiert, wobei ein Molekül Q zu QH2 reduziert wird, 2 Moleküle Cytochrom c werden reduziert, 4 Protonen gelangen ins Cytosol und 2 werden aus der Matrix entfernt Abb.3 Q – Zyklus (aus Stryer Biochemie) 5.SCHRITT Cytochrom-c-Oxidase katalysiert die Reduktion von O2 zu H2O 1. Cytochrom-c-Oxidase enthält 2 Häm-A-Gruppen(a,a3) und 3 Kupferionen in 2 Kupferzentren A u. B( CuA/CuA, CuB) Reduziertes Cytochrom c überträgt ein Elektron auf CuA/CuA=> Elektron wandert über Hämgruppen und reduziert zum Schluss CuB Zweites übertragene Elektron reduziert Häm a3 zu seiner Fe2+ Form In diesem Zustand bindet Häm a3 Sauerstoff Æ CuB reduziert O2 zu O22Aufnahme eines dritten Elektrons und eines Protons führt zur Spaltung der O-O Bindung Aufnahme eines weiteren Elektrons und Protons Durch Reaktion mit 2 weiteren Protonen werden 2 Wassermoleküle abgespalten und das Enzym liegt wieder in seiner oxidierten Form vor 4 aufgenommene Protonen stammen aus der Matrix ->Protonengradienten Cytochrom-c-Oxidase pumpt 4 weitere Protonen aus der Matrix in das Cytosol Insgesamt werden also 8 Protonen aus der Matrix entfernt Das Superoxidradikal Unvollständige Reduktion des O2 führt zu gefährlichen Verbindungen z.B. . Superoxidanion (O 2 ),Peroxid (O22-) Geringe Erzeugung dieser toxischen Derivate sind unvermeidbarÆ Zelle verwendet Schutzenzyme ( Superoxid- Dismutase und Katalase) ATP- Synthese Elektronentransport und ATP- Synthese sind durch einen Protonengradienten an der inneren Mitochondrienmembran gekoppelt ATP- Synthese erfolgt durch die ATPSynthase ( Komplex V, mitochondriale ATPase) 2 e- -> Gradient -> 1 Molekül ATP Struktur der ATP- Synthase Abb. 4 Struktur der ATP – Synthase (aus Stryer Biochemie) Synthesemechanismus Wechselwirkungen der γ- Untereinheit mit den 3 β – Untereinheiten -> ADP+P Bindung, ATP- Synthese und ATP- Freisetzung Protonenbewegung durch die Membran treibt Rotation an Abb. 5 Mechanismus des Bindungswechsels der ATP – Synthase (aus Stryer Biochemie) Regulation der oxidativen Phosphorylierung/ Atmungskontrolle Aerob:1 Molekül Glucose zu CO2-> 30 Moleküle ATP ( 26 alleine durch die Atmungskette) Anaerob:1 Glucose ->2 Moleküle ATP ADP-Spiegel->geschwindigkeitsbestimmend O2-Verbrauch der Mitochondrien erhöht bei ADP Zugabe Kein ATP-Bedarf:e- fließen nicht durch Atmungskette Hemmung und Entkopplung Hemmung der Elektronentransportkette-> keine ATP – Synthese Hemmung der ATP – Synthase Æ Inhibition der Elektronentransportkette (Kopplung der beiden Mechanismen) Entkopplung:Atmungskette läuft weiter,jedoch keine ATP-Synthese, da keine protonenmotorische Kraft mehr vorhanden istÆ Energie wird als Wärme freigesetzt BEISPIELE Oligomycin und Dicyclohexylcarbodiimid hemmen den Elektronenfluss durch die ATP – Synthase Rotenon und Amytal blockieren die Elektronenübertragung innerhalb der NADH-QOxidoreduktase ( Keine Verwendung von NADH als Substrat) Cyanid, Azid und Kohlenmonoxid blockieren den Elektronentransfer in der Cytochrom-c- Oxidase 2,4 Dinitrophenol wirkt als Entkoppler, weil es in der Lage ist, Protonen durch die innere Mitochondrienmembran zu befördern Æ Zerstörung des Protontengradienten Entkopplung als Mittel zur Wärmeerzeugung Winterschlaf haltende Tiere einige neugeborene Tiere(auch menschliche Babys) Kälteangepasste Säuger =>zur Aufrechterhaltung der Körpertemperatur Zusammenfassung Die bei der Glykolyse, der Fettsäureoxidation und im Citratzyklus entstehenden energiereichen Moleküle NADH+H+ und FADH2 besitzen ein Elektronenpaar mit hohem Übertragungspotential Die Reduktion von molekularem Sauerstoff zu Wasser durch diese Elektronen setzt viel Energie frei => stark exergone Knallgasreaktion Zusammenfassung „Zähmung der Knallgasreaktion“ durch Reduktionsäquivalente Reaktion verläuft in einer Reihe von Elektronentransferreaktionen ( Elektronentransportkette) in einer Anordnung von Membranproteinen Zusammenfassung Während der Übertragung der Elektronen auf den Sauerstoff werden Protonen aus der mitochondrialen Matrix herausgepumpt Æ pH – Gradient (Protonengradient) Positive Ladung der ProtonenÆ PotenzialdifferenzÆ Intermembranraum (+) gegenüber MatrixÆ chemi- osmotisches Potenzial Zusammenfassung Protonenmotorische Kraft wird zur ATPErzeugung genutzt. NADH+H+ liefert 3 ATP und FADH2 ergibt 2 ATP Moleküle Durch Kanäle in komplexen Proteinen, die ATPSynthasen, fließen die Protonen, entsprechend dem Konzentrations- und Ladungsgradienten, wieder in den Mitochondrieninnenraum zurück Oxidation und Phosphorylierung sind gekoppelt Gesamtübersicht Abb. 6 Übersicht Atmungskette ( aus Schroedel Stoffwechselphysiologie)