Aufgabenblatt 10 – Übungsblatt Stöchiometrie
Werbung
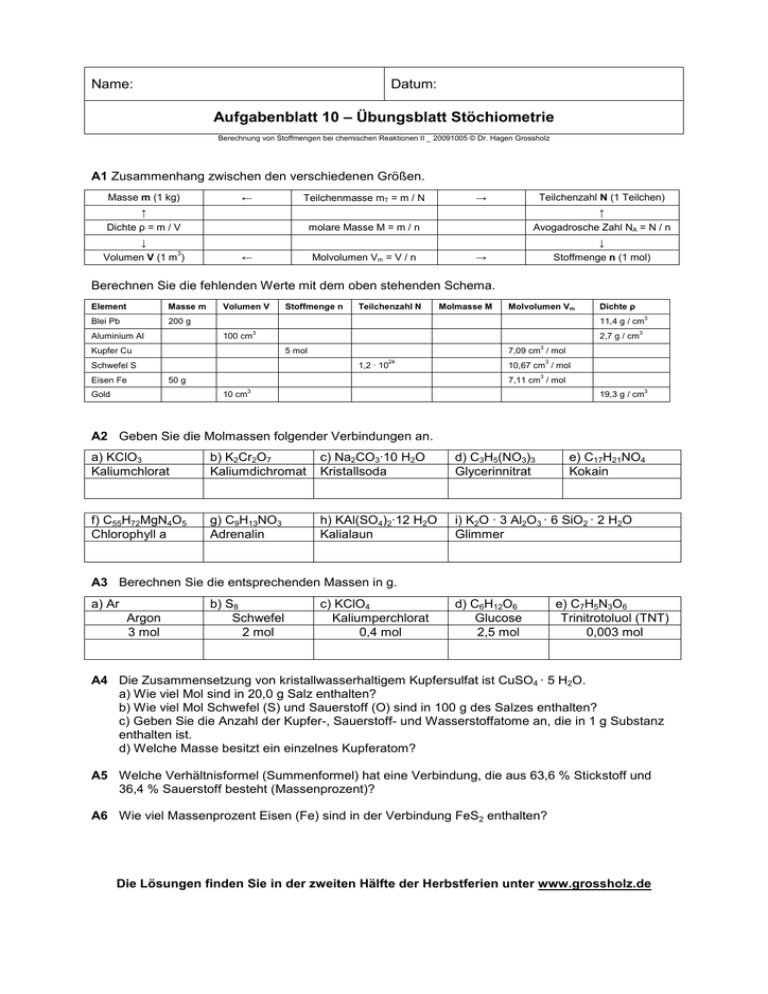
Name: Datum: Aufgabenblatt 10 – Übungsblatt Stöchiometrie Berechnung von Stoffmengen bei chemischen Reaktionen II _ 20091005 © Dr. Hagen Grossholz A1 Zusammenhang zwischen den verschiedenen Größen. Masse m (1 kg) Teilchenmasse mT = m / N ← Teilchenzahl N (1 Teilchen) → ↑ ↑ Dichte ρ = m / V molare Masse M = m / n Avogadrosche Zahl NA = N / n ↓ ↓ Volumen V (1 m3) Molvolumen Vm = V / n ← Stoffmenge n (1 mol) → Berechnen Sie die fehlenden Werte mit dem oben stehenden Schema. Element Masse m Blei Pb 200 g Aluminium Al Volumen V Stoffmenge n Molvolumen Vm Dichte ρ 11,4 g / cm3 100 cm 2,7 g / cm3 7,09 cm3 / mol 5 mol 24 Schwefel S 1,2 · 10 10,67 cm3 / mol 3 50 g Gold Molmasse M 3 Kupfer Cu Eisen Fe Teilchenzahl N 7,11 cm / mol 10 cm 3 19,3 g / cm3 A2 Geben Sie die Molmassen folgender Verbindungen an. a) KClO3 Kaliumchlorat b) K2Cr2O7 Kaliumdichromat c) Na2CO3·10 H2O Kristallsoda d) C3H5(NO3)3 Glycerinnitrat e) C17H21NO4 Kokain f) C55H72MgN4O5 Chlorophyll a g) C9H13NO3 Adrenalin h) KAl(SO4)2·12 H2O Kalialaun i) K2O · 3 Al2O3 · 6 SiO2 · 2 H2O Glimmer A3 Berechnen Sie die entsprechenden Massen in g. a) Ar Argon 3 mol b) S8 Schwefel 2 mol c) KClO4 Kaliumperchlorat 0,4 mol d) C6H12O6 Glucose 2,5 mol e) C7H5N3O6 Trinitrotoluol (TNT) 0,003 mol A4 Die Zusammensetzung von kristallwasserhaltigem Kupfersulfat ist CuSO4 · 5 H2O. a) Wie viel Mol sind in 20,0 g Salz enthalten? b) Wie viel Mol Schwefel (S) und Sauerstoff (O) sind in 100 g des Salzes enthalten? c) Geben Sie die Anzahl der Kupfer-, Sauerstoff- und Wasserstoffatome an, die in 1 g Substanz enthalten ist. d) Welche Masse besitzt ein einzelnes Kupferatom? A5 Welche Verhältnisformel (Summenformel) hat eine Verbindung, die aus 63,6 % Stickstoff und 36,4 % Sauerstoff besteht (Massenprozent)? A6 Wie viel Massenprozent Eisen (Fe) sind in der Verbindung FeS2 enthalten? Die Lösungen finden Sie in der zweiten Hälfte der Herbstferien unter www.grossholz.de -23 A7 Ein Atom hat die Masse m = 4,6662 · 10 Atomsorte handelt es sich? g. Berechnen Sie die Masse in u. Um welche A8 Ermitteln Sie die Atommassen von Wasserstoff, Argon, Kupfer und Zink in atomaren Masseneinheiten und in Gramm. A9 Wie viel Gramm wiegt ein Chloratom? A10 Wie viele Atome befinden sich in folgenden Stoffmengen: n(Kohelenstoff) = n(C) = 2,5 mol n(Silizium) = n(Si) = 0,38 mol n(Natrium) = n(Na) = 3,12 mol A11 Welche Stoffmenge besitzen 4 a) 1,68616 · 10 Quecksilberatome? 23 b) 2,7099 · 10 Calciumatome? c) Welche Massen m besitzen diese Stoffmengen? A12 Für eine chemische Reaktion braucht man 4 mol Ethanol (C2H6O). a) Geben Sie die Masse eines Methanmoleküls in atomaren Masseneinheiten (u) an. b) Wie viel Gramm Ethanol werden für die Reaktion benötigt? A13 Ein Gefäß enthält 1 L Liter Wasser. Wie viel mol Wasser befinden sich in ihm? A14 Was versteht man unter der Molmasse (molaren Masse). Erläutern Sie den Begriff anband eines von Ihnen selbst gewählten Elements und einer Verbindung. A15 Milchzucker (Lactose) hat die Summenformel C12H22O11. a) Welche Masse hat ein Milchzuckermolekül? Geben Sie diese in den Einheiten u und Gramm an. b) Geben Sie die molare Masse von Milchzucker an. c) Von der Verbindung sind 5483,82 g gegeben. Welche Stoffmenge ist das? d) Wie viele C12H22O11-Moleküle befinden sich in 5483,82 g? e) Wie viele Moleküle sind in 1 kg enthalten? A16 Wie viel Gramm Schwefel enthalten die gleiche Zahl von Atomen wie 58,74 g Kalium? Wie viele Atome sind es? A17 0,125 mol Ethanol hat die Masse von 5,769 g. Berechnen Sie aus diesen Angaben die molare Masse von Ethanol. Stoffumsatz bei chemischen Reaktionen A18 Wie viel Gramm Eisen (Fe) entstehen, wenn 60 g Eisenoxid (Fe2O3) mit Aluminium (Al) zu Eisen (Fe) und Aluminiumoxid (Al2O3) reagieren? A19 Wenn man ein Gemenge aus Eisen (Fe) - und Schwefelpulver (S) erhitzt, entsteht Eisensulfid (FeS). Wie viel Gramm muss man von den Ausgangsstoffen einsetzen, um 50 g Eisensulfid zu erhalten? A20 Brom (Br2) reagiert mit Aluminium (Al) zu Aluminiumchlorid (AlBr3) a) Wie viel Kilogramm Brom (Br) müssen zur Herstellung von 1 kg Aluminiumbromid (AlBr3) umgesetzt werden? b) Wie viel Gramm Aluminium (Al) sind dazu notwendig? A21 Wie viel Gramm Magnesiumchlorid (MgCl2) werden bei der Reaktion von 100 g Magnesium (Mg) mit Chlor (Cl2) erhalten? Die Lösungen finden Sie in der zweiten Hälfte der Herbstferien unter www.grossholz.de Name: Datum: Aufgabenblatt 10 – Übungsblatt Stöchiometrie - Lösungen Berechnung von Stoffmengen bei chemischen Reaktionen II _ 20091005 © Dr. Hagen Grossholz A1 Zusammenhang zwischen den verschiedenen Größen. Masse m (1 kg) Teilchenmasse mT = m / N ← Teilchenzahl N (1 Teilchen) → ↑ ↑ Dichte ρ = m / V molare Masse M = m / n Avogadrosche Zahl NA = N / n ↓ ↓ 3 Volumen V (1 m ) Molvolumen Vm = V / n ← Stoffmenge n (1 mol) → Berechnen Sie die fehlenden Werte mit dem oben stehenden Schema. Element Masse m Volumen V Stoffmenge n Teilchenzahl N Blei Pb 200 g 17,5 cm3 0,965 mol 5,81·10 3 23 24 Molmasse M Molvolumen Vm 207,2 g/mol 18,18 cm / mol 3 3 Dichte ρ 11,4 g / cm 3 3 Aluminium Al 270 g 100 cm 10,0 mol 6,022·10 26,98 g/mol 10,0 cm / mol 2,7 g / cm Kupfer Cu 317,75 g 35,5 cm 3 5 mol 3,0·10 63,55 g/mol 7,09 cm3 / mol 8,96 g / cm 3 2,0 mol 1,2 · 1024 32,06 g/mol 10,67 cm3 / mol 3,00 g / cm3 0,896 mol 5,4·1023 55,8 g/mol 7,11 cm3 / mol 7,85 g / cm3 Schwefel S 64,12 g 21,3 cm Eisen Fe 50 g 6,37 cm3 193 g Gold 10 cm 3 24 0,979 mol 23 6,00·10 197 g/mol 3 10,21 cm / mol 3 19,3 g / cm3 A2 Geben Sie die Molmassen folgender Verbindungen an. a) KClO3 Kaliumchlorat 122,6 g/mol b) K2Cr2O7 Kaliumdichromat 294,2 g/mol c) Na2CO3·10 H2O Kristallsoda 286 g/mol d) C3H5(NO3)3 Glycerinnitrat 165 g/mol e) C17H21NO4 Kokain 303 g/mol f) C55H72MgN4O5 Chlorophyll a 892,3 g/mol g) C9H13NO3 Adrenalin 183 g/mol h) KAl(SO4)2·12 H2O Kalialaun 474 g/mol i) K2O · 3 Al2O3 · 6 SiO2 · 2 H2O Glimmer 797 g/mol A3 Berechnen Sie die entsprechenden Massen in g. a) Ar Argon 3 mol 120 g b) S8 Schwefel 2 mol 64,1 g c) KClO4 Kaliumperchlorat 0,4 mol 55,44 g d) C6H12O6 Glucose 2,5 mol 450 g e) C7H5N3O6 Trinitrotoluol (TNT) 0,003 mol 0,681 g A4 Die Zusammensetzung von kristallwasserhaltigem Kupfersulfat ist CuSO4 · 5 H2O. a) Wie viel Mol sind in 20,0 g Salz enthalten? n(CuSO4 · 5 H2O) = m(CuSO4 · 5 H2O) / M(CuSO4 · 5 H2O) = 20 g / (249 g/mol) = 0,080 mol b) Wie viel Mol Schwefel (S) und Sauerstoff (O) sind in 100 g des Salzes enthalten? 100 g sind n(CuSO4 · 5 H2O) = 100 g / (249 g/mol) = 0,402 mol => n(S) = n(CuSO4 · 5 H2O) · 1 = 0,402 mol => n(O) = n(CuSO4 · 5 H2O) · 9 = 3,6 mol c) Geben Sie die Anzahl der Kupfer-, Sauerstoff- und Wasserstoffatome an, die in 1 g Substanz enthalten ist. CuSO4 · 5 H2O 1· Cu 9·O 10 · H m 1g M 249 g/mol n=m/M -3 4,316·10 mol -3 4,316·10 mol 0,036 mol 0,040 mol N = n · NA 21 2,418·10 Atome 21 2,418·10 Atome 22 2,177·10 Atome 22 2,418·10 Atome d) Welche Masse besitzt ein einzelnes Kupferatom? 23 -22 m(Kupferatom) = M(Cu) / NA = 63,546 g/mol / (6,022·10 Teilchen/mol) = 1,055·10 g. A5 Welche Verhältnisformel (Summenformel) hat eine Verbindung, die aus 63,6 % Stickstoff und 36,4 % Sauerstoff besteht (Massenprozent)? m(NxOy) = 100 g m(N) = 63,6 g und m(O) = 36,4 g n(N) = m(N) / M(N) = 63,6 g / 14,00 g/mol = 4,5 mol n(O) = m(O) / M(O) = 36,4 g / 16,00 g/mol = 2,3 mol Atomzahlverhältnis n(N) : n(O) = 4,5 mol : 2,3 mol = 2 : 1 = X : Y Die Verhältnisformel ist N2O. A6 Wie viel Massenprozent Eisen (Fe) sind in der Verbindung FeS2 enthalten? m(Gesamtmasse FeS2) = 119,9 g m(Teilmasse Fe) = 55,8 g 119,9 g sind 100 % => 55,8 g sind 46,5 % -23 A7 Ein Atom hat die Masse m = 4,6662 · 10 Atomsorte handelt es sich? -23 M(?) = m(?) · NA = 4,6662 · 10 23 g · 6,022·10 g. Berechnen Sie die Masse in u. Um welche = 28,1 g/mol Es ist ein Siliziumatom. A8 Ermitteln Sie die Atommassen von Wasserstoff, Argon, Kupfer und Zink in atomaren Masseneinheiten und in Gramm. 23 -24 m(H) = 1 u = M(H) / NA = 1,008 g/mol / 6,022·10 = 1,67·10 g 23 -23 m(Ar) = 39,95 u = M(Ar) / NA = 39,95 g/mol / 6,022·10 = 6,63·10 g 23 -22 m(Cu) = 1 u = M(Cu) / NA = 63,55 g/mol / 6,022·10 = 1,06·10 g 23 -22 m(Zn) = 1 u = M(Zn) / NA = 65,37 g/mol / 6,022·10 = 1,09·10 g A9 Wie viel Gramm wiegt ein Chloratom? 23 -23 m(Cl-Atom) = M(Cl) / NA = 35,45 g/mol / 6,022·10 = 5,89·10 g A10 Wie viele Atome befinden sich in folgenden Stoffmengen: n(Kohlenstoff) = n(C) = 2,5 mol n(Silizium) = n(Si) = 0,38 mol n(Natrium) = n(Na) = 3,12 mol C Si Na n 2,5 mol 0,38 mol 3,12 mol N = n · NA 24 1,51·10 C- Atome 23 2,29·10 Si-Atome 24 1,88·10 Na-Atome A11 Welche Stoffmenge besitzen 4 a) 1,68616 · 10 Quecksilberatome? 4 23 -20 n(Hg) = N(Quecksilberatome) / NA = 1,68616 · 10 Quecksilberatome / 6,022·10 = 2,8·10 mol 23 b) 2,7099 · 10 Calciumatome? 23 23 n(Ca) = N(Calciumatome) / NA = 2,7099 · 10 Calciumatome / 6,022·10 = 4,5 mol c) Welche Massen m besitzen diese Stoffmengen? -18 m(Ha) = n(Hg) · M(Hg) = 5,62·10 g m(Ca) = n(Ca) · M(Ca) = 18,04 g A12 Für eine chemische Reaktion braucht man 4 mol Ethanol (C2H6O). a) Geben Sie die Masse eines Methanmoleküls in atomaren Masseneinheiten (u) an. m(C2H6O-Molekül) = 2·12,01 u + 6 · 1,008 u + 1 · 16,00 u = 166,17 u b) Wie viel Gramm Ethanol werden für die Reaktion benötigt? m(C2H6O) = n(C2H6O) · M(C2H6O) = 4 mol · 166,17 g/mol = 664,7 g A13 Ein Gefäß enthält 1 L Liter Wasser. Wie viel mol Wasser befinden sich in ihm? 3 ρ(Wasser) = 1 g/cm 3 3 n(H2O) = V(Wasser) · ρ(H2O) / M(H2O) = 1000 cm · 1 g/cm / 18,00 g/mol = 55,56 mol Ein Liter Wasser entspricht einer Stoffmenge von 55,56 mol. A14 Was versteht man unter der Molmasse (molaren Masse). Erläutern Sie den Begriff anband eines von Ihnen selbst gewählten Elements und einer Verbindung. 23 Molmasse: Die Masse von 6,022·10 Teilchen. 23 z.B. 6,022·10 Aluminiumatome besitzen eine Molmasse von 26,98 g/mol. 23 z.B. 6,022·10 Wassermoleküle (H2O) besitzen eine Molmasse von 18,00 g/mol. A15 Milchzucker (Lactose) hat die Summenformel C12H22O11. a) Welche Masse hat ein Milchzuckermolekül? Geben Sie diese in den Einheiten u und Gramm an. m(C12H22O11-Molekül) = 342 u 22 m(C12H22O11-Molekül) = M(C12H22O11) / NA = 5,679·10 g b) Geben Sie die molare Masse von Milchzucker an. M(C12H22O11) = 342 g/mol c) Von der Verbindung sind 5483,82 g gegeben. Welche Stoffmenge ist das? n(C12H22O11) = m(C12H22O11) / M (C12H22O11) = 16,03 mol d) Wie viele C12H22O11-Moleküle befinden sich in 5483,82 g? 24 N(C12H22O11) = n(C12H22O11) · NA = 9,66 · 10 Moleküle e) Wie viele Moleküle sind in 1 kg enthalten? 24 N(C12H22O11) = m(C12H22O11) / M(C12H22O11) · NA = 1,76·10 Moleküle A16 Wie viel Gramm Schwefel enthalten die gleiche Zahl von Atomen wie 58,74 g Kalium? Wie viele Atome sind es? K S m 58,74 g 48,09 g M 39,10 g/mol 32,06 g/mol n = m/M 1,50 mol 1,50 mol N 23 9,05·10 Kaliumatome 23 9,05·10 Schwefelatome A17 0,125 mol Ethanol hat die Masse von 5,769 g. Berechnen Sie aus diesen Angaben die molare Masse von Ethanol. M(Ethanol) = m(Ethanol) / n(Ethanol) = 5,769 g / 0,125 mol = 46,15 g/mol Stoffumsatz bei chemischen Reaktionen A18 Wie viel Gramm Eisen (Fe) entstehen, wenn 60 g Eisenoxid (Fe2O3) mit Aluminium (Al) zu Eisen (Fe) und Aluminiumoxid (Al2O3) reagieren? Produkte Edukte Fe2O3 Masse m = n · M Molare Masse M = m / n Verhältnis Stoffmenge n = m / M Al 60 g Al2O3 21 g 159,7 g/mol 1 Fe 55,85 g/mol 1 0,376 mol Bei der Reaktion werden 21 g Eisen (Fe) erhalten. 1 0,376 mol 1 A19 Wenn man ein Gemenge aus Eisen (Fe) - und Schwefelpulver (S) erhitzt, entsteht Eisensulfid (FeS). Wie viel Gramm muss man von den Ausgangsstoffen einsetzen, um 50 g Eisensulfid zu erhalten? Edukte Masse m = n · M Molare Masse M = m / n Verhältnis Stoffmenge n = m / M Produkte Fe S FeS 31,8 g 18,3 g 50 g 55,85 g/mol 32,06 g/mol 87,91 g/mol 1 1 1 0,57 mol 0,57 mol 0,57 mol An Ausgangsstoffen müssen 31,8 g Eisen (Fe) und 18,3 g Schwefel (S) eingesetzt werden. A20 Brom (Br2) reagiert mit Aluminium (Al) zu Aluminiumchlorid (AlBr3) a) Wie viel Kilogramm Brom (Br) müssen zur Herstellung von 1 kg Aluminiumbromid (AlBr3) umgesetzt werden? Edukte Masse m = n · M Molare Masse M = m / n Verhältnis Stoffmenge n = m / M Produkte 3 Br2 2 Al 898,1 101,2 g 2 AlBr3 1000 g 159,8 g/mol 26,98 g/mol 266,68 g/mol 3 2 2 (/2·3) 5,62 mol 3,75 mol 3,75 mol Es müssen 0,898 kg Brom (Br2) umgesetzt werden. b) Wie viel Gramm Aluminium (Al) sind dazu notwendig? Dazu sind 101,2 g Aluminium notwendig. A21 Wie viel Gramm Magnesiumiodid (MgI2) werden bei der Reaktion von 100 g Magnesium (Mg) mit Iod (I2) erhalten? Edukte Mg Masse m = n · M Molare Masse M = m / n Verhältnis Stoffmenge n = m / M Produkte I2 MgI2 1143,0 g 100 g 24,31 g/mol 253,8 278,1 g/mol 1 1 1 4,11 mol 4,11 mol 4,11 mol
