Exkurs: Nomenklatur Anorganischer Verbindungen<<<
Werbung

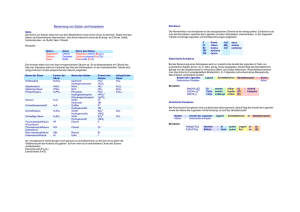
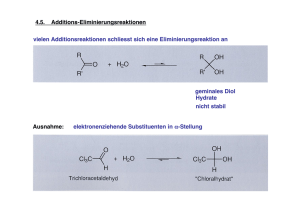
E. Freisinger – CHE 175 Seite 1/4 >>> Exkurs: Nomenklatur Anorganischer Verbindungen<<< 1) Nomenklatur allgemeiner binärer Verbindungen AmBn ein Atom ist immer elektropositiver und das andere elektronegativer elektropositive(s) Atom(e): Name unverändert elektronegative(s) Atom(e): Name + "-id" (Name event. abgekürzt bzw. Verwendung des lateinischen (griechischen etc.) Namens) H¯ Hydrid F¯ Fluorid S2¯ Sulfid N3¯ P3¯ C22¯ Nitrid Phosphid Carbid Beispiele: H2O Dihydrogenoxid ("Wasser") Sauerstoffdifluorid OF2 Al2O3 Dialuminiumtrioxid ("Aluminiumoxid") KMgF3 => (KMg)F3 Kaliummagnesiumtrifluorid PBrClF => P(BrClF) Phosphorbromidchloridfluorid im Falle "mehrerer elektropositiver oder –negativer Atome" werden diese alphabetisch geordnet. PbCl2 Blei(II)-chlorid ("Bleidichlorid") PbCl4 Blei(IV)-chlorid ("Bleitetrachlorid") im Falle von Metallen wird bevorzugt die Oxidationsstufe desselben angegeben statt den elektronegativeren Atomen eine Zahl voranzustellen veraltete Bezeichnungen: FeII "Ferro-" III Fe "Ferri-" I Hg "Mercuro-" II "Mercuri-" Hg 2) Nomenklatur der Anionen der Elementsauerstoffsäuren EOnm¯ Spezialfall: Bezeichnung der Oxidationsstufen durch Endungen, bzw. Vorsilbe: "hypo-" um 2 Einheiten tiefere Oxidationsstufe "-it" um 2 Einheiten tiefere Oxidationsstufe "-at" entspricht im allgemeinen der gebräuchlichsten Oxidationsstufe "per-" um 2 Einheiten höhere Oxidationsstufe Beispiele: SO32– SO42– SeO32– SeO42– ClO– ClO2– ClO3– ClO4– Sulfit Sulfat Selenit Selenat Hypochlorit Chlorit Chlorat Perchlorat NO2– NO3– Nitrit Nitrat H2PO2– HPO32– PO43– (Hyper/Unterchlorige Säure) (Chlorige Säure) (Chlorsäure) (Perchlorsäure) Hypophosphit Phosphit Phosphat E. Freisinger – CHE 175 Seite 2/4 Elementsauerstoffsäuren: HmEOn "hypo-" "hypo-, bzw, unter- ...ige Säure" "-it" "-ige Säure "-at" "...säure" "per-" "Per...säure" "–O–O–" "Peroxo...säure" z.B.: H2SO5 "O" "S" "Thio...säure" z.B.: H2S2O3 H3PO3S Peroxoschwefelsäure Thioschwefelsäure Thiophosphorsäure 3) Nomenklatur der Komplexsalze Komplex negativ geladen, benötigt Kation zum Ladungsausgleich: Komplex positiv geladen, benötigt Anion zum Ladungsausgleich: Reihenfolge der Benennung: Kation – Komplex – Anion Xn[Komplex]m [Komplex]mYn a) Benennung des Kations: Name unverändert b) Benennung des Anions: Name + "-id" (Einatomige Anionen) siehe Vorlesung 25. Juni 2004 für Beispiele mehr-atomiger Anionen (Sulfat, Nitrit, Perchlorat usw.) c) Benennung der Komplexe Komplexe bestehen aus einem Zentralatom (in der Regel ein Metall, welches meist, jedoch nicht immer, in einer positiven Oxidationsstufe vorliegt) und einer Anzahl Liganden (neutral oder geladen (in der Regel negativ)) Reihenfolge der Benennung: Ligand – Zentralatom (mehrere Liganden in alphabetischer Reihenfolge) – negativ geladene Liganden: Endung "-o" F¯ FluoroO2¯ OxoH¯ HydridoCN¯ Cyano– neutrale Liganden: H2O Aqua (veraltet "Aquo") NH3 Ammin CO Carbonyl NO Nitrosyl – Zentralatom Name unverändert – Zentralatom (negativ geladener Komplex) Name + "-at" (Name event. abgekürzt bzw. Verwendung des lateinischen (griechischen etc.) Namens) -aluminat (Al) -ferrat (Fe) -palladat (Pd) Beispiele: Na3[AlF6] -platinat (Pt) -cuprat (Cu) usw... -manganat (Mn) -aurat (Au) => Kation – Komplex (negative Gesamtladung, negativ geladene Liganden) Trinatrium-hexafluoroaluminat [Mg(H2O)6]SO4 · H2O => Komplex (positive Gesamtladung, neutrale Liganden) – Anion – Kristallwasser Hexaquamagnesium-sulfat-monohydrat [Fe(H2O)5OH][Cr(H2O)2(ox)2] => Komplex (pos. Ladung) – Komplex (neg. Ladung) Pentaquahydroxoeisen(III)-diaquadioxalatochromat(II) oder: Pentaquahydroxoeisen(II)-diaquadioxalatochromat(III) E. Freisinger – CHE 175 Seite 3/4 4) Nomenklatur anorganischer Anionen a) Elementanionen besitzen die Endung id. Häufig liegen die Atome (bzw. im Falle von binären Anionen und Anionen noch höherer Ordnung das Nichtmetall mit der höchsten EN) auch noch in ihrer kleinsten Oxidationsstufe vor (=am stärksten negativ, z.B. Nitrid NIII 3). z.B. Carbid (C22, auch C4) ausserdem: Nitrid (N3) Oxid (O2) Fluorid (F) Phosphid (P3) Sulfid (S2) Chlorid (Cl) Arsenid (As3) Selenid (Se2) Bromid (Br), etc. Hydroxid (OH), Peroxid (O22), Cyanid (CN), Azid (N3), Amid (NH2), etc. b) Binäre oder Anionen noch höherer Ordnung (meist kovalente Verbindungen eines Nichtmetalls mit Sauerstoff) enden auf at oder it at: Das Nichtmetall liegt in seiner höchsten Oxidationsstufe vor (Ausnahme: 7. Hauptgruppe!!!). Man sagt auch, das Nichtmetall liegt in seiner „gebräuchlichsten“ Oxidationsstufe vor bzw. die zugehörige Säure ist die „wichtigste“ Säure des Elements (gilt so für alle Hauptgruppen). it: Das Nichtmetall besitzt eine Oxidationsstufe, die um 2 geringer ist als im entsprechenden Anion mit der Endung at. Praktisch bedeutet dies, dass formal ein Sauerstoffatom aus dem Anion entfernt wurde. Die Ladung des Anions auf at und die des Anions auf it bleibt gleich (z.B. Sulfat SVIO42 und Sulfit SIVO32). Die Vorsilbe Hypo bedeutet, dass das Nichtmetall in einer Oxidationsstufe vorliegt, die um 2 geringer ist als die im entsprechenden Anion mit der Endung it. Auch hier wurde wieder formal ein Sauerstoffatom aus dem Anion entfernt. Die Ladung des Anions verändert sich nicht. Die Vorsilbe Per bedeutet, dass das Nichtmetall in einer Oxidationsstufe vorliegt, die um 2 höher ist als die im entsprechenden Anion mit der Endung at. Praktisch bedeutet dies, dass formal ein Sauerstoffatom zum Anion hinzugefügt wurde. Die Ladung des Anions verändert sich nicht. (Die Vorsilbe Peroxo bedeutet hingegen, dass formal ein Sauerstoffatom im entsprechenden Anion mit der Endung at durch eine Peroxogruppe (OO) ersetzt wurde. Die Oxidationszahl des Nichtmetalls ändert sich nicht, ebensowenig wie die Ladung des Anions. E. Freisinger – CHE 175 Seite 4/4 at Perat it Bemerkungen Hypoit Perchlorat ClVIIO4 Chlorat ClVO3 Chlorit ClIIIO2 Hypochlorit ClIO (Perchlorsäure HClO4) (Chlorsäure HClO3) (Chlorige Säure HClO2) (Hypochlorige Säure HClO) Sulfat SVIO42 Sulfit SIVO32 Sulfoxylat SIIO22 Peroxosulfat (Schwefelsäure H2SO4) (Schweflige Säure H2SO3) (Sulfoxylsäure H2SO2) (Peroxoschwefelsäure H2S(O2)O3) gilt analog für Br und I Sauerstoffsäuren von F bzw. deren Salze unbekannt. SVI(O2)O32 H2SeO2 und H2TeO2 bzw. SeO22 und TeO22 unbekannt Nitrat NVO3 Nitrit NIIIO2 Nitroxyl-Anion NIO (Salpetersäure HNO3) (Salpetrige Säure HNO2) (Nitrosowasserstoff HNO) Peroxosalpetersäure HNV(O2)O2 ist instabil Phosphat PVO43 Phosphonat PIIIO33 Phosphinat PIO23 Peroxophosphat (Phosphorsäure H3PO4) Carbonat CIVO32 (Kohlensäure “H2CO3”) Silikat SiIVO44 (Orthokieselsäure H4SiO4) (früher: Phosphit) (früher: Hypophosphit) (Phosphonsäure H3PO3) (früher: Phosphorige Säure) (Phosphinsäure H3PO2) (früher: Hypophosphorige Säure) PV(O2)O33 (Peroxophosphorsäure H3P(O2)O3)