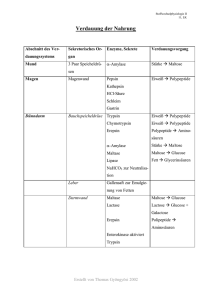
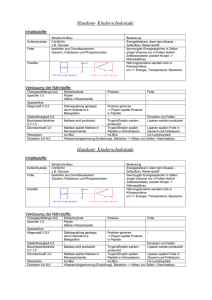
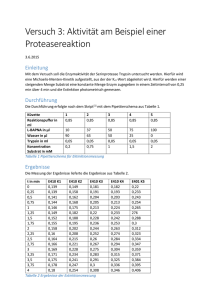
Trypsin - Inhibitor aus Sojabohnen
Werbung

Trypsin - Inhibitor aus Sojabohnen Artikel-Nr. A1441 Beschreibung Molekulargewicht: CAS-Nr.: HS-Nr.: Form: Gehalt (enzym.): Isoelektrischer Punkt: pH-Optimum: Lösungsmittel: Stammlösung: Arbeitskonzentration: Haltbarkeit: Lagerung: ca. 21500 [9035-81-8] 35040000 lyophilisiert, salzfrei min. 10.000 U/mg 4,5 7,0 Wasser 1 mg/ml 2 - 200 µg/ml bzw. äquimolar mit Trypsin min. 2 Jahre -20°C Lagerung der Lösung bei -20°C Wiederholtes Einfrieren/Auftauen vermeiden! Hinweis Der Trypsin-Inhibitor aus Sojabohnen hemmt Trypsin in einem molaren Verhältnis 1 : 1. Chymotrypsin wird weniger gut gehemmt. Das pH-Optimum für seine Aktivität ist 7,0. Da der Trypsin-Inhibitor ein Protein ist, kann er nicht in organischen Lösungsmittel gelöst werden und ist hitzesensitiv! Er ist wasserlöslich (Wasser oder verdünnte Puffer). Eine Einheit Inhibitor hemmt eine Einheit Trypsinaktivität (BAEE; Einheiten-Definition Trypsin nach NF/USP: Die Enzymmenge, die einen Anstieg der Absorption bei 253 nm von 0,003 pro Minute bei 25°C durch die Hydrolyse von BAEE bewirkt). Anwendung und Literatur (1)Die reaktive Gruppe des Trypsininhibitors. (Ozawa, K. & Laskowski, M. (1966) J. Biol. Chem. 241, 39553961). (2)Die reaktive Gruppe des Sojabohne-Trypsininhibitors (Kunitz). (De Vonis Bidlingmeyer, U. et al. (1972) Biochemistry 11, 3303-3310). (3)Übersichtsartikel: Trypsin- und Chymotrypsininhibitoren aus der Sojabohne. (Birk, Y (1976) Methods Enzymol. 45, 700-707). (4)Bestimmung der Orientierung von Proteinen in Membranen. Inkubation von Proteoliposomen (100 µg Protein) mit 10 µg Trypsin. Abstoppen der Reaktion nach 5 Min. mit 2fachem Gewichtsüberschuß (200 µg) Sojabohne Trypsininhibitor und 0,1 mM PMSF. (Lévy, D. et al. (1992) Biochim. Biophys. Acta 1107, 283298) (5)Untersuchung der Bindung von 125I-Tyr11-Somatostatin an Pankreas-Acinarmembranen der Ratte in Bindungspuffer [50 mM Tris-HCl (pH 7,4), 0,5 mM MgCl2, 3 mM NaCl, 0,2 mM CaCl2, 0,2% (w/v) BSA, 0,5 mg/ml Bacitracin, 0,3 mg/ml Sojabohne-Trypsininhibitor] und 125I-Secretin an Pankreas-Acinarmembranen der Ratte in Bindungspuffer [20 mM Tris-HCl/1% Albumin-Puffer (pH 7,4), 0,05 mg/ml Bacitracin, 0,1 mg/ml Sojabohne-Trypsininhibitor]. (Alvaro-Alonso, I. et al. (1995) Biochim. Biophys. Acta 1268, 115121) 1 (6)Isolierung von Mikrosomen aus Skelettmuskel durch differentielle Zentrifugation. Resuspendieren der Mikrosomen in PI-Puffer [300 mM Saccharose, 150 mM Kaliumgluconat, 0,1 mM PMSF, 10 µg/ml Aprotinin, 0,8 µg/ml Antipain, 2 µg/ml Sojabohne-Trypsininhibitor, 20 mM MES (pH 6,8)] (El-Hayek, R. et al. (1995) J. Biol. Chem. 270, 15634-15638) (7)Immunpräzipitation von Myosin II aus menschlichen Venen-Endothelzellen. Aufnahme der Zellen bei +4°C in Extraktionspuffer [25 mM Tris-HCl (pH 7,9), 250 mM NaCl, 100 mM Na4P2O7, 75 mM NaF, 5 mM EGTA, 5 mM EDTA, 1% NP-40, 0,5% DOC, 0,2 mM PMSF, 0,5 mM DTT, 100 µg/ml Benzamidin, 100 µg/ml Sojabohne Trypsininhibitor, je 10 µg/ml TLCK, TPCK, Aprotinin, Leupeptin, Pepstatin, 15 mM Mercaptoethanol]. (Goeckeler, Z.M. & Wysolmerski, R.B. (1995) J. Cell Biol. 130, 613-627) JB120327 2