Ligandenfeld
Werbung

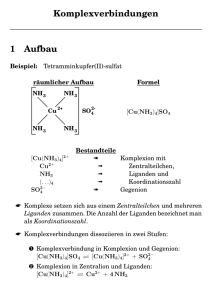
Anorganische Chemie I • Inhalte: Grundlagen der Koordinationschemie (Komplexe = Koordinationsverbindungen), sowie der Bioanorganischen Chemie, Umwelt- und Radiochemie • Literatur: • J. Huheey, E. Keiter, R. Keiter, "Anorganische Chemie (Prinzipien von Struktur und Reaktivität)", 2. Auflage, Walter de Gruyter Verlag; • St. Lippard, J. Berg, "Bioanorganische Chemie", Spektrum Verlag; • E. Riedel Hrsg. „Moderne Anorganische Chemie“, 3. Auflage, Walter de Gruyter Verlag; • Holleman/Wiberg, Lehrbuch der Anorganischen Chemie, 102. Auflage, Walter de Gruyter Verlag Komplexchemie • Lehre von Synthese, Struktur, Eigenschaften (Farbe, magnetische Eigenschaften etc.) und Reaktivität der Koordinationsverbindungen • Bioanorganische Chemie = Komplexchemie der belebten Natur, befasst sich mit den natürlichen biologischen Funktionen anorganischer Elemente, vor allem von Metall-Ionen in Metalloproteinen, und auch mit Metallen für medizinische Anwendung. Koordinationschemie = Chemie der Übergangsmetalle • Pionier Alfred Werner, Nobelpreis 1913 • Valenzbindungstheorie (VB Theorie, Linus Pauling, Nobelpreis 1954) • Ligandenfeld-Theorie • Molekülorbital-Theorie (MO Theorie) Komplexe = Koordinationsverbindungen • • • • • • • • • Moleküle oder Ionen ZLn, in denen an ein geladenes (oder ungeladenes) Zentralion (oder Zentralatom) Z (=Koordinationszentrum) entsprechend seiner Koordinationszahl n mehrere ungeladene oder geladene, ein- oder mehratomige Gruppen L (Liganden) angelagert sind Diese bilden die Ligandenhülle (innere Koordinationssphäre) Die Liganden sind meistens auch als solche (also nicht koordiniert) existenzfähig Die Liganden in der Koordinationssphäre können alle gleich oder auch verschiedenartig sein Komplexbildung als Lewis-Säure-Base Reaktion. Es entsteht dabei zwischen Metall und Ligand eine kovalente Bindung mit polaren Anteilen Ein Metallkomplex ist eine neue Verbindung, mit anderen Eigenschaften als die Bindungspartner Metallorganische Verbindung: Wenn eine C-Metall-Bindung vorhanden ist. Zählt auch zu den Komplexverbindungen Wenn Heteroatome eines organischen Liganden an das Metallatom gebunden sind, spricht man nicht von metallorganischen Verbindungen, sondern von Komplexverbindungen Alfred Werner (1866-1919): Erste Arbeiten auf dem Gebiet der Koordinationschemie Strukturen mit Fällungsreaktionen und Leitfähigkeitsmessungen in wässr. Lsg aufgeklärt (heute: spektroskopisch) (eine Leitfähigkeitsmesszelle besteht aus 4 Elektroden, es wird mit Wechselspannung gemessen) Komplex Farbe Reaktion mit Überschuss an Silbernitrat CoCl3∙6 NH3 gelb CoCl3∙6 NH3+ Ag+ 3 AgCl CoCl3∙5 NH3 purpur CoCl3∙5 NH3+ Ag+ 2 AgCl CoCl3∙4 NH3 grün CoCl3∙4 NH3+ Ag+ 1 AgCl CoCl3∙4 NH3 violett CoCl3∙4 NH3+ Ag+ 1 AgCl Deutung der Ergebnisse: • [Co(NH3)6]Cl3 gelb • [CoCl(NH3)5]Cl2 purpur • [CoCl2(NH3)4]Cl grün bzw. violett, es gibt also 2 Isomere • Postulate von Alfred Werner: Co3+ besitzt in diesen Verbindungen die gleichbleibende Koordinationszahl = 6 • Die Bindungen zu den Liganden sind räumlich gerichtet Räumliche Struktur: aus der Zahl der Isomeren ableitbar • Werner nahm an, dass sich die 6 Liganden symmetrisch anordnen, sodass alle den gleichen Abstand vom Zentralatom haben • Für die Koordinationszahl 6 wären dann 3 räumliche Anordnungen möglich: hexagonal planar trigonal prismatisch oktaedrisch Oktaeder = trigonales Antiprisma • [CoCl2(NH3)4]Cl grün bzw. violett • a) ebenes Sechseck: 3 Isomere (ortho, meta, para) • b) trigonales Prisma: 3 Isomere • c) Oktaeder: 2 Isomere (cis, trans): experimentell gefunden • • Praseo-Salz, grün, trans Violeo-Salz, violett, cis • Komplexen von Pt2+ mit der Koordinationszahl 4 wie [PtCl2(NH3)2] ordnete Werner eine planar quadratische Struktur zu, weil 2 Isomere (cis, trans) existieren. • Für eine tetraedrische Struktur wäre nur 1 Isomer möglich. • Die von Alfred Werner entwickelten Vorstellungen fanden ab 1921 durch Röntgenstrukturanalyse vieler kristalliner Komplexe ihre endgültige Bestätigung. Bindungsmodelle der Übergangsmetallkomplexe • Valenzbindungstheorie = VB Theorie (entwickelt von W. Heitler und F. London 1927, ausgebaut durch J.C. Slater und L. Pauling) • Die Komplexe werden danach durch Anlagerung einer Lewis-Base (= Donoratom des Liganden) an eine Lewis-Säure (Metallatom) gebildet, wobei sich lokalisierte Metall-Ligand Bindungen bilden. • Durch Hybridisierung von d- s- und p- Orbitalen lassen sich in vielen Fällen Zusammensetzung, Struktur, Stabilität und magnetische Eigenschaften des Komplexes erklären. • Die VB Theorie steht am Anfang und besitzt als „Pionier-Modell“ noch mehr qualitativen Charakter. Sie genügt nicht, um den elektronischen Zustand richtig zu beschreiben. Elektronisch angeregte Zustände können nicht berücksichtigt werden. Daher ist keine Interpretation von Farbspektren der Komplexe möglich. VB Theorie • Wie bei einer Nichtmetallverbindung teilen sich die Bindungspartner ein Elektronenpaar (kovalente Bindung). • Das Elektronenpaar stammt jedoch nicht je zur Hälfte von beiden Partnern, sondern vollständig vom Liganden. • Es müssen zwei Arten von d-Elektronenkonfigurationen des Zentralmetalls in Übergangsmetallkomplexen berücksichtigt werden: • Die Einzelelektronen in den d-Orbitalen des Zentralmetalls rücken paarweise zusammen. Dadurch werden innere d-Orbitale frei, die, nach Hybridisierung mit unbesetzten s-Obitalen der nächsthöheren Schale, die Liganden-Elektronen aufnehmen (low-spin-Komplexe) • Kein Zusammenrücken von Elektronen in den d-Orbitalen des Zentralmetalls. Der normale Paramagnetismus des Metallzentrums bleibt erhalten. Für die Hybridisierung und Aufnahme von LigandenElektronen werden äußere d-Orbitale genutzt (high-spin-Komplexe) Wird ein Stoff in ein Magnetfeld gebracht, so verändert sich die Kraftflussdichte B des Magnetfeldes (Diamagnetismus ist auf Änderung des Bahndrehimpulses von Elektronen im Magnetfeld zurückzuführen und tritt in jedem Stoff auf!) Verhalten im Magnetfeld • Paramagnetische Stoffe: Die Kraftflussdichte B nimmt im inneren der Probe zu. Es tritt eine Kraft F in Richtung höherer Feldstärke auf. • Diamagnetische Stoffe: Die Kraftflussdichte B nimmt im Inneren der Probe ab. Es tritt eine Kraft F in Richtung niedrigerer Feldstärke auf. • Die Änderung der Kraftflussdichte ΔB im Inneren der Probe ist zur Kraftflussdichte B des ungestörten Magnetfeldes proportional ΔB= χ ∙B • χ (chi) ist die magnetische Suszeptibilität • Die Kraft F kann man ausnutzen, um die magnetische Suszeptibilität mit einer empfindlichen Waage zu messen. • Die Probe wird in ein Probenröhrchen gefüllt und so in ein inhomogenes Magnetfeld gebracht, dass der untere Rand in einem Bereich größerer Feldstärke und der obere Rand in einem Bereich kleiner Feldstärken ist. • Paramagnetische Stoffe: Probe wird ins Magnetfeld „hineingezogen“, sie wird „schwerer“. • Diamagnetische Stoffe: Probe wird aus dem Magnetfeld „herausgedrängt“, sie wird „leichter“. Magnetische Suszeptibilität: verursacht durch Bahn- und Spindrehimpulse der Elektronen • Das zum Kernspin gehörende magnetische Moment ist – wegen der bedeutend größeren Masse der Nukleonen – zu schwach, um einen nennenswerten Beitrag liefern zu können. Es ist aber messbar und wird für NMR und Magnetresonanztomographie verwendet!! • In Atomen, Ionen und Molekülen mit mehreren Elektronen koppeln die Bahn- und Spindrehimpuse der einzelnen Elektronen miteinander zu einem Gesamtdrehimpuls, welcher ein magnetisches Gesamt-Moment bewirkt. • Bei komplex gebundenen Metall-Ionen der ersten Übergangsmetall-Reihe kann das Gesamtbahnmoment in erster Näherung vernachlässigt werden, sodass das magnetische Moment dem Gesamt-Spinmoment entspricht („spin-only-Werte“). Durch magnetische Messungen kann die Anzahl an ungepaarten Elektronen bestimmt werden • • • • • Liegen zwei Elektronen gepaart vor (antiparallel), so heben sich ihre magnetischen Momente gegenseitig auf. Liegen Elektronen ungepaart vor (parallel), so entsteht ein magnetisches Moment. Dieses magnetische Moment wird mit zunehmender Anzahl an ungepaarten Elektronen größer. Bei paramagnetischen Teilchen gilt für das gesamte magnetische Spinmoment : μ = μB ∙2 ∙(S ∙(S+1)) ½ • S: Summe aller Elektronenspins (ein ungepaartes Elektron S = ½, zwei ungepaarte Elektronen S = ½ + ½ = 1) • 1 μB = 9,27 · 10 –24 A · m2 ( SI - Einheit des „Bohr‘schen Magnetons“) • Durch die Messung der magnetischen Suszeptibilität werden die magnetischen Momente ermittelt. Diese können nun mit den rechnerisch ermittelten Werte verglichen werden. So erhält man die Anzahl an ungepaarten Elektronen in einem Komplex. Quelle: Holleman-Wiberg, 102. Auflage Kristallfeld-Theorie • 1929 von Hans Bethe entwickelt • Hans Bethe (1906-2005), Nobelpreis für Physik 1967 (für seine Arbeiten über die Energieumwandlung in Sternen) • Die Kristallfeld-Theorie blieb zunächst auf die Festkörperphysik beschränkt und wurde erst ab 1951 auf Übergangsmetall-Komplexe angewendet • Die reine Kristallfeld-Theorie geht dabei von einer ausschließlich elektrostatischen Wechselwirkung zwischen dem Liganden und dem Zentralatom aus. Es werden keine kovalenten Überlappungen zwischen Metall- und Ligandenorbitalen berücksichtigt Die Kristallfeldtheorie ist eine quantenmechanische Theorie zur Erklärung der magnetischen Eigenschaften und Farben von Übergangsmetall-Komplexen. Hier wurde erstmals ein quantenmechanisches Problem mit Hilfe von Argumenten der Punktgruppen - Symmetrie gelöst. Das Übergangsmetall-Ion befindet sich zentral in einem elektrostatischen Feld, das durch die umgebenden Liganden (Ionen oder polare Moleküle) hervorgebracht wird. Dieses Feld hat eine geringere Symmetrie als die volle Rotationssymmetrie des freien Zentralions . Durch diese Verringerung der Symmetrie spalten die 5 entarteten d-Orbitale in zwei Energieniveaus auf. Das ursprüngliche Kristallfeldmodell versucht nicht zu erklären, warum die Konfiguration des Ions mit den umgebenden Liganden stabil ist. John van Vleck hat daher später die Ligandenorbitale mit berücksichtigt , und durch diese Erweiterung der Kristallfeld-Theorie die Ligandenfeld-Theorie geschaffen. • Nach der Kristallfeldtheorie beruht der chemische Zusammenhalt zwischen dem positiv geladenen Metallzentrum und den negativ geladenen oder polarisierten Liganden auf elektrostatischen Ionen/Ionen oder Ionen/Dipol Wechselwirkungen. • Im Zuge der Komplexbildung Mm+ + n L → MLnm+ ist die insgesamt nach außen abgeführte potentielle Energie Ep als Summe zweier Energieanteile zu sehen: 1.) gewinnbarer Energieanteil Ep‘, beruht auf der elektrostatischen Anziehung zwischen Zentralmetall und Liganden 2.) aufzuwendender Energieanteil Ep‘‘, beruht auf der elektrostatischen Abstoßung zwischen der Elektronenhülle von Mm+ und den n Liganden, sowie zwischen den Liganden untereinander Ligandenfeld-Theorie • Untersucht die Wirkung der Liganden (= punktförmige Ladungen) auf die äußeren d-Elektronen des Zentralmetalls d.h. die (aus der Kristallfeldtheorie entwickelte) Ligandenfeldtheorie befasst sich mit der elektrostatischen Abstoßung zwischen der Elektronenhülle von Mm+ und den n Liganden, und berücksichtigt darüber hinaus durch kovalente MLBeziehungen erhältliche Energieanteile Ligandenfeld-Theorie • Übergangsmetallatome haben in ihren Verbindungen eine teilweise besetzte d-Schale. Diese bestimmt hauptsächlich die physikalischen und chemischen Eigenschaften des Übergangsmetalls • Die Liganden werden als negative Punktladungen behandelt • Am Metall werden nur die d- (bzw. f-)Orbitale betrachtet • I) Einelektronenäherung: keine Kopplung der Elektronen untereinander, d-Orbitale voneinander unabhängig • II) Mehrelektronenäherung mit gekoppelten Elektronen, Russell-Saunders Kopplungsschema • Die fünf d-Orbitale (dx2-y2, dz2, dxy, dxz, dyz) eines ligandenfreien Zentralatoms sind energiegleich („entartet“) • sie werden nach der Hund‘schen Regel zunächst einzeln mit Elektronen gleichen Spins besetzt, • dann, unter Aufwendung der Spinpaarungsenergie, doppelt mit Elektronen entgegengesetzten Spins: • Das Einbringen des Zentralmetalls in ein (hypothetisches) sphärisches (=kugelsymmetrisches) Ligandenfeld würde zu einer gleich großen Erhöhung der Energie jedes der fünf d-Orbitale führen. Damit würden die d-Zustände nach wie vor entartet bleiben. • Reale Ligandenfelder sind aber nicht-kugelsymmetrisch (z.B. oktaedrisch, tetreadrisch, quadratisch) • Die unterschiedlich große abstoßende Wirkung des Ligandenfeldes auf Elektronen in unterschiedlichen d-Orbitalen führt dazu, dass entsprechend der vorgegebenen Ligandenfeld-Symmetrie, einige der fünf d-Orbitale des Metalls stärker, andere weniger stark energetisch angehoben werden. • Für die Energieaufspaltung der d-Orbitale gilt dabei der EnergieSchwerpunkt-Satz: die mittlere Energie der fünf d-Orbitale im nichtsphärischen Ligandenfeld ist gleich der (entarteten) Energie dieser Orbitale in einem sphärischen Ligandenfeld der gleichen Stärke. [Ti(H2O)6]3+ Das Elektron (roter Pfeil) ist in einem Orbital eingezeichnet, aber in Wirklichkeit befindet es sich in allen Orbitalen der gleichen Energie mit der gleichen Wahrscheinlichkeit Quelle: Holleman-Wiberg, 102. Auflage 490 nm Quelle: Wikipedia Quelle: Holleman-Wiberg. 102. Auflage Quelle: Holleman-Wiberg, 102. Auflage Ligandenfeldstabilisierungsenergie Im sphärischen Ligandenfeld ist der Energieinhalt jedes äußeren d-Elektrons eines Metallzentrums um den Wert ε gegenüber der d-Elektronenenergie des ligandenfreien Metallatoms bzw. –Ions erhöht. Beim Übergang zu einem nicht-sphärischen Ligandenfeld ist dieser Betrag wegen der dOrbitalenergieaufspaltung für einzelne Elektronen größer, für andere kleiner als ε. Nach Addition der Energiebeträge für die einzelnen dElektronen kann das insgesamt zu einem Energiegewinn gegenüber dem kugelsymmetrischen Feld führen. Dieser Energiegewinn beim Übergang vom sphärischen zum realen Ligandenfeld heißt LFSE. Quelle: Holleman-Wiberg, 102. Auflage Biologische Funktionen von Metall-Ionen Ionenpumpen=TransmembranTransportproteine. Die LipidDoppelschicht biologischer Membranen ist für Ionen undurchlässig. Der steile Kurvenabschnitt entspricht gerade dem im Körpergewebe vorherrschen O2 Partialdruckbereich. Arbeitet der Muskel, so fällt der pO2 in der Umgebung, und das Hämoglobin gibt viel Sauerstoff ab. ---------------------------------Im stoffwechselaktiven Gewebe entsteht AtmungsCO2 Durch Bildung von Kohlensäure sinkt der pH Wert in der Umgebung von pH=7,4 auf pH=7,2 Das erhöht stark die O2 Abgabe. Quelle: Eberhard Hofmann, Funktionelle Biochemie des Menschen, Akademie-Verlag Berlin Vitamin B12 wird von den Darmbakterien des Dickdarms in großen Mengen gebildet. Kann dort aber nicht resorbiert werden! Wird daher aus der Nahrung mit Hilfe des IF resorbiert (im Dünndarm) . Ein Katalysator stabilisiert den Übergangszustand einer Reaktion, indem er dessen Energie herabsetzt. Z.B. Plastocyanin (Plastocyanin gehört zu den blauen Kupferproteinen, die in Pflanzen, Archaeen und Bakterien vorkommen ): ein Elektronentransferzentrum innerhalb der Photosynthese, dessen Kupfer im aktiven Zentrum zwischen den Oxidationsstufen I und II pendelt. Die typische Koordinationsumgebung für Cu(I) ist tetraedrisch, für Cu(II) quadratisch-planar. Analyse der Strukturen verschiedener Plastocyanine: die Koordinationsgeometrie des Kupferzentrums im Protein liegt näherungsweise zwischen tetraedrisch und quadratischplanar. Das heisst, dass das Protein dem Metallzentrum eine Koordinationsgeometrie aufzwingt, die der des Übergangszustands ähnelt! Dadurch ist der Energieaufwand bei der Bildung des Übergangszustandes besonders gering.