pch_ausarbeitung
Werbung
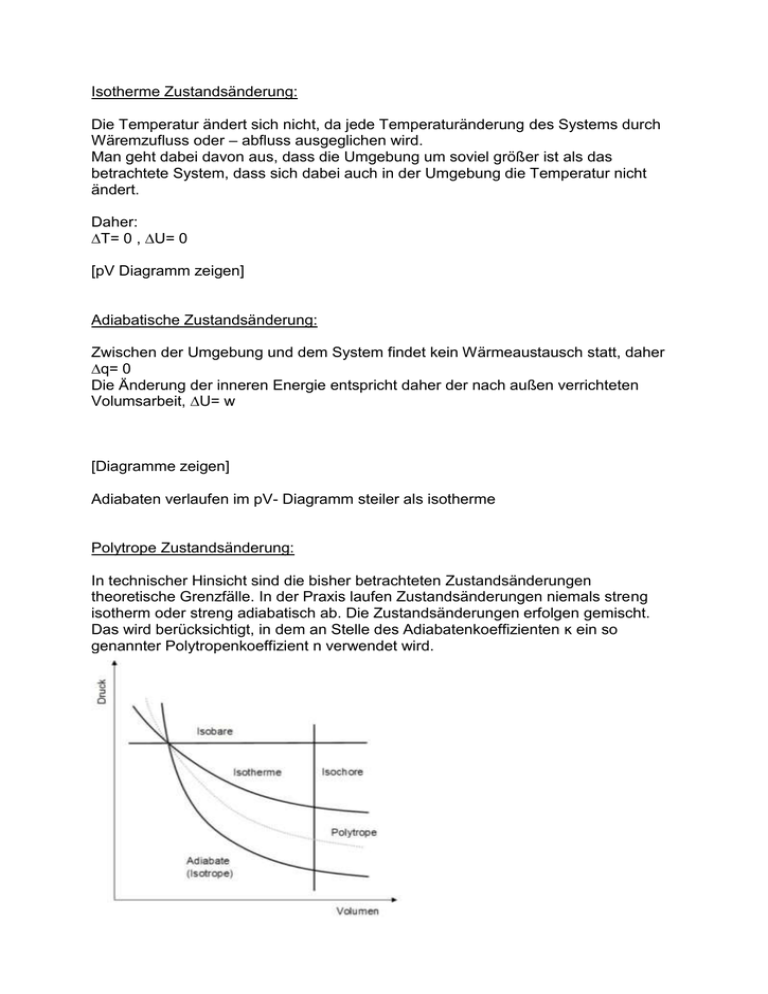
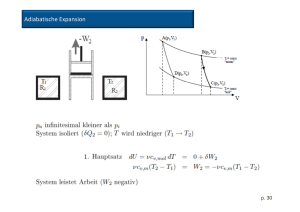
Isotherme Zustandsänderung: Die Temperatur ändert sich nicht, da jede Temperaturänderung des Systems durch Wäremzufluss oder – abfluss ausgeglichen wird. Man geht dabei davon aus, dass die Umgebung um soviel größer ist als das betrachtete System, dass sich dabei auch in der Umgebung die Temperatur nicht ändert. Daher: ∆T= 0 , ∆U= 0 [pV Diagramm zeigen] Adiabatische Zustandsänderung: Zwischen der Umgebung und dem System findet kein Wärmeaustausch statt, daher ∆q= 0 Die Änderung der inneren Energie entspricht daher der nach außen verrichteten Volumsarbeit, ∆U= w [Diagramme zeigen] Adiabaten verlaufen im pV- Diagramm steiler als isotherme Polytrope Zustandsänderung: In technischer Hinsicht sind die bisher betrachteten Zustandsänderungen theoretische Grenzfälle. In der Praxis laufen Zustandsänderungen niemals streng isotherm oder streng adiabatisch ab. Die Zustandsänderungen erfolgen gemischt. Das wird berücksichtigt, in dem an Stelle des Adiabatenkoeffizienten ĸ ein so genannter Polytropenkoeffizient n verwendet wird. Cannonischer Kreisprozess: In einem thermodynamischen Kreisprozess ist die Gesamtänderung einer Zustandsfunktion gleich Null. Der ideale Fall, ein Kreisprozess ausschließlich aus Isothermen und Adiabaten ist der so genannte Carnot- Prozess. Er besteht aus vier reversiblen Teilschritten: 1. Schritt: Reversible isotherme Expansion Durch die Expansion wird Arbeit an der Umgebung verrrichtet Die Innere Engergie ändert sich nicht, da Wärme von außen zugeführt wird. ∆U= 0 2. Schritt: Reversible adiabatische Expansion Das System gibt keine Wärme an die Umgebung ab: q= 0 Die Entropieänderung ist Null: ∆S= 0 Die Temperatur fällt von ab 3. Schritt: Reversible isotherme Kompression Durch die Kompression wird Arbeit am System verrichtet Die Innere Energie ändert sich nicht, da Wärme nach außen an die kalte Umgebung abgeführt wird. ∆U= 0 4. Schritt: Reversible adiabatische Kompression Das System nimmt keine Wärme von der Umgebung auf: q= 0 Die Entropieänderung ist Null: ∆S= 0 Die Temperatur steigt an Da q= 0 ist entspricht w= ∆U Die Gesamänderung der Entropie ist gleich Null, da die Entropie eine Zustandsfunktion ist. Wirkungsgrad: Die dem warmen Reservoir entnommene Wärmemenge entspricht der Arbeit bei der isothermen Expansion(q= -w), Für den Wirkungsgrad eingesetzt ergibt das: η= ∆T/TW Wärmekraftmaschine: Aus Wärme kann nur dann mechanische Arbeit gewonnen werden wenn ein freiwilliger Vorgang abläuft bei dem die Gesamtenthropie zunimmt. Ein solcher Vorgang kann nur der Transport von Wärme von einem warmen zu einem kalten Reservoir sein. Die dem warmen Reservoir entnommenen Wärme bewirkt eine geringere Entropieabnahme als dieselbe Wärme die dem kalten Reservoir zugeführt wird an Entropiezunahme bewirkt q/T Wirkungsgrad von Wärmekraftmaschinen: ist das Verhältnis von Ertrag zu Aufwand η= geleistete Arbeit/aufgenommene Wärme Die aufgenommene Wärme ist die Wärme die der Maschine durch den Brennstoff zugeführt werden muss. Durch die Verbrennung und die Bewegung der Maschine kommt es jedoch zu zahlreichen Energieverlusten, der Wirkungsgrad ist daher in der Praxis nicht erreichbar, er ist die obere theoretische Grenze des Wirkungsgrades für jede mögliche Wärmekraftmaschine. Da der Wirkungsgrad gegen 1 strebt wenn die Temperatur des klaten Reservoirs gegen Null geht oder die Temperatur des warmen Reservoirs unendlich groß wird, sind folgende Verhältnisse anzustreben: Eine möglichst große Temperaturdifferenz zwischen dem warmen und kaklten Reservoir Eine möglichst niedrige Temperatur des kalten Reservoirs