3.3.2 Energiebilanz und 1. Hauptsatz der Thermodynamik
Werbung
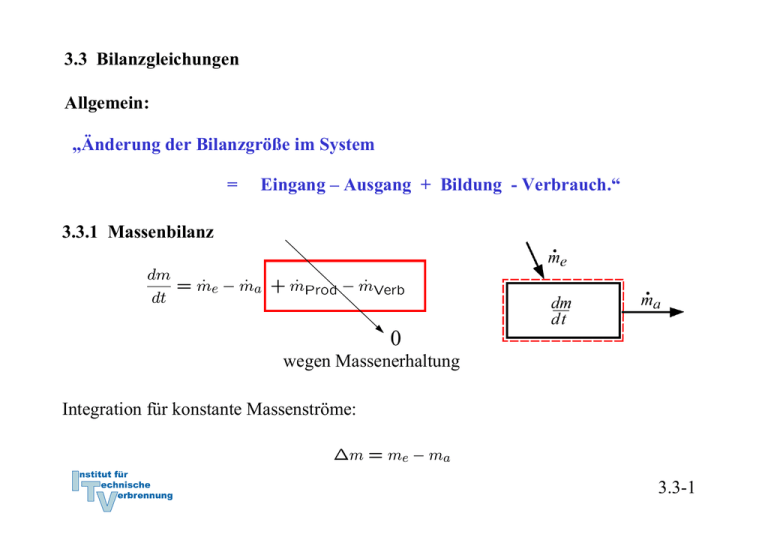
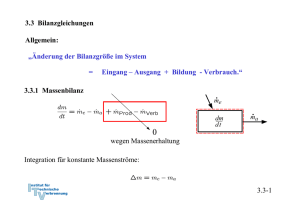
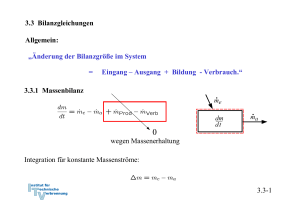
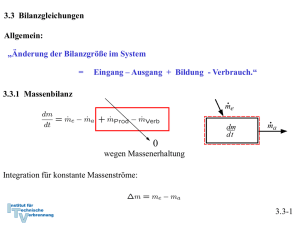
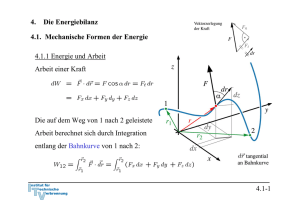
3.3 Bilanzgleichungen Allgemein: „Änderung der Bilanzgröße im System = Eingang – Ausgang + Bildung - Verbrauch.“ 3.3.1 Massenbilanz 0 wegen Massenerhaltung Integration für konstante Massenströme: 3.3-1 3.3.2 Energiebilanz und 1. Hauptsatz der Thermodynamik 0 wegen Energieerhaltung oder 1. Hauptsatz der Thermodynamik Integration: Zustandsänderung Flüsse: Arbeit, Wärme, mit Massenstrom mitgeführte Energie 3.3-2 Verschiedene Schreibweisen Integrale Form: Ratenform: Massenbezogene integrale Form: Massenbezogene differentielle Form: Formulierung der Energiebilanz: 1. Geschlossenes oder offenes System 2. Absolut- oder Ratenform 3. Spezifisch oder Massenform 3.3-3 Energiebilanz in geschlossenen Systemen Zustandsänderung Zustandsänderung 1 → 2 oder bzw. 3.3-4 Beispiel 1: Wasserdampf in Zylinder m = 5 kg p1 = 500 kPa, ϑ1 = 200 oC p2 = p1 = 500 kPa, ϑ2 = 120 oC Wie groß ist die ausgetauschte Wärmemenge Q12? Skizze im T,v – Diagramm! Lösung: 1. Hauptsatz: da 3.3-5 Zustand 1 überhitzt Zustand 2 unterkühlt Tabelle Überhitzter Dampf Inkompressible Flüssigkeit, Sättigungstabelle 3.3-6 Skizze im T,v - Diagramm 3.3-7 Näherung: u’ (ϑ2) = 503,5 kJ/kg, v’ (ϑ2) = 0,00106 m3/kg Sättigungsenthalpie gute Näherung, aber ( h’(ϑ2) = 503,71 kJ/kg ) oft nicht genau genug. h2 (ϑ2) = 504,03 kJ/kg 3.3-8 h1 = 2855,4 kJ/kg Q12 = m (h2-h1) = 5 kg ( 2855,4 kJ/kg - 504,03 kJ/kg ) ≅ - 11757 kJ 3.3-9 Beispiel 2: Kolben-Zylindersystem im Schwerefeld der Erde Ein Kolben mit Masse mK schließt einen mit Gas, Masse mG, gefüllten Zylinder nach oben ab. Der Kolben werde ein kleines Stück dz langsam nach oben bewegt, so dass das Gas im Inneren stets im Gleichgewicht sei. Der Kolben gleite ferner reibungsfrei. Formulieren Sie die differenzielle Energiebilanz für diesen Prozess! Lösung: Der 1. Hauptsatz für ein geschlossenes System mit Änderung äußerer Energien lautet allgemein: 3.3-10 Nebenstehend sind zwei mögliche Systemabgrenzungen skizziert. Für beide Systeme sollen die Bilanzen formuliert werden. Für beide Systeme wird der Vorgang als langsam angenommen, so dass diese stets im Gleichgewicht stehen (quasistatische Zustandsänderung). Die Systeme besitzen dann keine kinetische Energie. Die Trägheit von Massen kann vernachlässigt werden ( → Kräftegleichgewicht an allen Systemen). Weiterhin wird angenommen, dass der Kolben reibungslos gleite. 3.3-11 Die Bilanz lautet unter diesen Voraussetzungen für beide Systeme: System 1: Bei Verschiebung der oberen Grenze gewinnt das Gas potentielle Energie. Damit ist die Arbeit der Gewichtskraft bei der Verschiebung des Schwerpunkts erfasst. Durch den Druck vom Kolben auf das Gas wird die Volumenänderungsarbeit geleistet: Andere äußere Kräfte treten nicht auf: Die Bilanz für System 1 lautet also: 3.3-12 System 2: Bei Verschiebung der oberen Grenze gewinnen das Gas und der Kolben die potentielle Energie: Die Volumenänderungsarbeit ist Verschiebearbeit gegen die Umgebung: Die resultierende äußere Kraft leistet die Arbeit: Die Bilanz für System 2 lautet also: Wegen der hydrostatischen Aussage folgt wieder wie für System 1: 3.3-13 3.3.3 Spezifische Wärmekapazitäten Spezifische Wärmekapazitäten bei konstantem Volumen: cv Änderung der Inneren Energie: Definition der spezifischen Wärmekapazität bei konstantem Volumen: Zur Bestimmung der Änderung der Inneren Energie auf Grund einer Temperaturänderung ist es zweckmäßig isochore Prozesse zu betrachten. Dann gilt: Mit dem 1. Hauptsatz du = δq folgt cv ist die spezifische Wärme, die zugeführt werden muss, um die Temperatur im System bei konstantem Volumen um 1 K zu erhöhen. 3.3-14 Bei konstantem Volumen gilt: Bemerkung: Wir haben die Änderung der inneren Energie mit der zugeführten Wärme gekoppelt, indem wir einen isochoren Prozess betrachtet haben: Für ideale Gase ist die Einschränkung auf einen isochoren Prozess aber nicht notwendig, da hier wegen gilt und damit immer: Der 1. Hauptsatz für reversible Prozesse idealer Gase lautet: 3.3-15 Spezifische Wärmekapazität bei konstantem Druck: cp Änderung der Enthalpie: Definition der spezifischen Wärmekapazität bei konstantem Volumen: Zur Bestimmung der Änderung der Enthalpie auf Grund einer Temperaturänderung ist es zweckmäßig isobare Prozesse zu betrachten. Dann gilt: 3.3-16 Isobarer Prozess: 1. Hauptsatz isobar Mit folgt und cp ist die spezifische Wärme, die zugeführt werden muss, um die Temperatur im System bei konstantem Druck um 1 K zu erhöhen. 3.3-17 Bei konstantem Druck gilt: Bemerkung: Wir haben die Änderung der Enthalpie mit der zugeführten Wärme gekoppelt, indem wir einen isobaren Prozess betrachtet haben: Für ideale Gase ist die Einschränkung auf einen isobaren Prozess aber nicht notwendig, da hier wegen immer gilt: Der 1. Hauptsatz für reversible Prozesse idealer Gase lautet: 3.3-18 Spezifische Wärmekapazitäten idealer Gase Bei idealen Gasen sind die innere Energie und die Enthalpie ausschließlich Funktionen der Temperatur. Daher müssen auch die molaren und spezifischen Wärmekapazitäten reine Temperaturfunktionen sein: Es gilt ferner: 3.3-19 Ableitung Ebenso Verhältnis der spezifischen Wärmen: κ ∗) Es ergibt sich: Das Billardkugelmodell des idealen Gases beschreibt im angegebenen Temperaturbereich den Wert für einatomige Gase richtig (vergl. 3.2-26): Verhältnis der spezifischen Wärmen κ spielt eine besondere Rolle. Wir werden sehen, dass für die idealen Gase κ gleich dem Isentropenxponenten k ist. *) Das 3.3-20 Das Verhältnis der spezifischen oder der molaren Wärmen nimmt bei Umgebungstemperatur näherungsweise folgende Zahlenwerte an: Einatomige Gase: κ = 5/3 = 1,66 Zweiatomige Gase: κ = 7/5 = 1,4 3.3-21 Für mehratomige Gase zeigen Messungen, dass die spezifischen Wärmekapazitäten deutlich größer und deutlich temperaturabhängig sind: Für zweiatomige Gase bei Raumtemperatur liest man im vorstehenden Diagramm folgenden Wert ab: Zweiatomige Gase können bei diesen Temperaturen noch als starres Hantelmodell dargestellt werden. Da die innere Energie als die Summe der Energien der frei betrachteten Moleküle dargestellt werden kann, kommt bei zweiatomigen Gasen zu den drei Energieanteilen der Translation des Billardkugelmodell noch die Rotationsenergie um zwei Achsen hinzu. Nach dem Gleichverteilungssatz erhält im statistischen Mittel jeder Freiheitsgrad die gleiche innere Energie. Daher ist: Noch höhere Temperaturen regen Molekülschwingungen und bisher eingefrorene Freiheitsgrade an, so dass die Wärmekapazitäten mit der Temperatur weiter ansteigen. 3.3-22 Translatorische und rotatorische Freiheitsgrade Einatomige Gase (Beispiel Edelgase wie He, Ar etc) Freiheitsgrade der Translation: 3 Freiheitsgrade der Rotation: alle eingefroren*) Zweiatomige Gase (Beispiel Gase wie N2, O2 etc) Freiheitsgrade der Translation: 3 Freiheitsgrade der Rotation: 2 (einer eingefroren*)) Dreiatomige Gase mit gewinkelter Struktur (Beispiel Gase wie H2O, SO2 etc) Freiheitsgrade der Translation: 3 Freiheitsgrade der Rotation: 3 Aus den Messwerten lässt sich deshalb folgern, dass CO2 keine gewinkelte Struktur wie H2O oder SO2 hat! *) Die Tatsache, dass einige rotatorische Freiheitsgrade eingefroren sind, ist ein quantenmechanischer Effekt und lässt sich mit der klassischen Physik nicht erklären. Die Quantisierung des Drehimpulses erfordert bei kleinem Trägheitsmoment eine ausreichend hohe Temperatur, um die Rotation um die entsprechende Achse anzuregen. Alle klassischen Erklärungen widersprechen dem Gleichverteilungssatz, nachdem jeder Freiheitsgrad die gleiche Energie aufnimmt. 3.3-23 Spezifische Wärmekapazitäten idealer Flüssigkeiten Annahme: inkompressibel, d. h. konstantes Volumen: dv = 0 1. Hauptsatz liefert mit pdv = 0: Die innere Energie für ideale Flüssigkeiten ist also nur von der Temperatur abhängig. 3.3-24 Folgerung für die Enthalpie idealer Flüssigkeiten und cp Definition der Enthalpie: Vollständiges Differential: Vergleich: ⇒ Wärmekapazitäten cp und cv sind gleich für ideale Flüssigkeiten. Die Enthalpie für ideale Flüssigkeiten ist also von der Temperatur und vom Druck abhängig. Die kalorische Zustandsgleichung lautet: 3.3-25 3.3.4 Bewertung von thermodynamischen Prozessen Generell: Vergleich von Nutzen zu Aufwand • bei Arbeitsmaschinen → thermischer Wirkungsgrad ηth • bei Kühlprozessen und Wärmepumpen: → Leistungszahl ε 3.3-26 Beispiel: Otto-Motor Viertaktmotoren (schematisch) 3.3-27 Der idealisierte Otto-Prozess (Gleichraumprozess) • Ideales Gas mit konstanten Wärmekapazitäten • Vernachlässigung von Verlusten ↔ Annahme eines reversiblen Prozesse • Massenaustausch mit der Umgebung (Ein- und Ausschieben) bleibt unberücksichtigt • die mit der Materie transportierte Energie wird durch Wärmeabfuhr ersetzt • Kompression und Expansion werden als reversibel-adiabate Prozesse aufgefasst. • Wärmezufuhr und Wärmeabfuhr erfolgen bei konstantem Volumen. 3.3-28 Darstellung im p,V-Diagramm Wirkungsgrad: 3.3-29 Darstellung im T,pvk-Diagramm Wirkungsgrad: 3.3-30 Bilanz des Kreisprozesses Volumenänderungsarbeiten 1. HS 1→ 2 : 1. HS 3→ 4 : Wärmezufuhr und –abfuhr 1. HS 2→ 3 : 1. HS 4→ 1 : 3.3-31 Thermischer Wirkungsgrad Bestimmung der Temperaturverhältnisse: analog . . . 3.3-32 Thermischer Wirkungsgrad des idealisierten Otto-Prozesses mit Der Wirkungsgrad steigt mit dem Verdichtungsverhältnis ε an. *) Werden Wärmeverluste bei Kompression und Expansion und andere Verluste berücksichtigt, so kann statt des Isentropenexponenten k auch ein adäquater Polytropenexponent n verwendet werden. 3.3-33 3.3.4 Stationärer Fließprozess in offenen Systemen Annahmen: Stationär → Masse und Gesamtenergie im System konstant: 3.3-34 Bilanz am stationären offenen System: 3.3-35 Beispiel: Kühlschrank 1. Hauptsatz geschlossenes System, stationär: Gesamtsystem Prozessbewertung durch Leistungszahl: 3.3-36 Bilanz am Kompressor: System Kompressor 1. Hauptsatz offenes System, stationär und adiabat: Annahme Δekin = Δepot ≅ 0 : 3.3-37 Bilanz am Verdampfer: System Verdampfer 1. Hauptsatz offenes System, stationär: Annahme Δekin = Δepot ≅ 0 : ⇒ Leistungszahl: 3.3-38 Bilanz am Kondensator: Gesamtsystem System Kondensator Aus Bilanz am Gesamtsystem, stationär oder 1. Hauptsatz offenes System, stationär, Δekin = Δepot ≅ 0 : ( Es folgt: ) 3.3-39 Bilanz an der Drossel: System Drossel 1. Hauptsatz offenes System, stationär, adiabat, Δekin = Δepot ≅ 0 : Eine adiabate Drossel ist isenthalp! 3.3-40 T,v - Diagramm: • In der Drossel soll mit dem Druck auch die Temperatur absinken → Kühlmittel μ > 0 (siehe Joule-Thomson-Koeffizient (Thermodynamik II): • Die Drücke p1 und p2 werden so gewählt, dass T3 > TRaum T4 < TKühlschrank 3.3-41 Kühlmittel R – 134a Aus Tabellen: h1 = 231,4 kJ/kg h2 = 280,2 kJ/kg h3 = h4 = 105,3 kJ/kg ⇒ ε = 2,58 • Die Kühlleistung ist damit um einen Faktor 2,58 höher als die eingesetzte Leistung ! • Energie wird zur Verschiebung der thermischen Energie eingesetzt. 3.3-42 Beispiel: Elektrische Heizung 1. Hauptsatz geschlossenes System Leistungszahl: Heizung mit Strom ineffizient, da Wirkungsgrad der Stromerzeugung im Kraftwerk ηKW ≅ 40 %, so dass Gesamtleistungszahl 3.3-43 Beispiel: Konventionelle Heizung Wärmeleistung aus chemischer Energie 1. Hauptsatz geschlossenes System für stationäre Verhältnisse im Haus (In der Heizung wird gespeicherte chemische Energie in Wärme überführt ⇒ dEH/dt ≠ 0.) Leistungszahl: 3.3-44 Beispiel: Heizung mit elektrischer Wärmepumpe Wärmeleistung aus chemischer Energie 1. Hauptsatz geschlossenes System für stationäre Verhältnisse im Haus Leistungszahl: Mit Zahlenwert für Kühlschrank: Berücksichtigung der Stromerzeugung: 3.3-45