Struktur und Wirkungsweise - BIO
Werbung

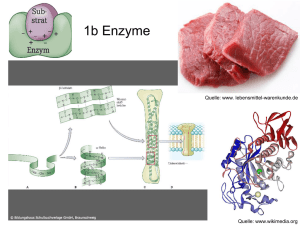
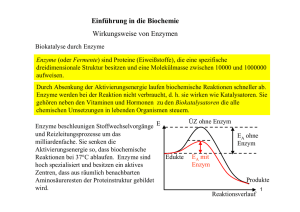
Struktur und Wirkungsweise Fast alle der mehreren Tausend Enzyme sind Proteine, also Eiweiße. Allerdings gibt es auch einige RNA-Moleküle, die ebenfalls kat alytische Funktionen haben (Ribozyme). Die chemischen Eigenschaften von Proteinen sind allerdings ideal, um sie als Biokatalysator einzusetzen. Vor allem ihre mögliche Strukturvielfalt ist für den Organismus von großer Bedeutung. Proteine bestehen fast immer aus mehr als 100 Aminosäuren. Die Sequenz an Aminosäuren bezeichnet man als Primärstru ktur , sie bildet die Basis für weitere Strukturebenen, wobei bei Enzymen gerade die Tertiär- und Quartärstruktur , also die räumliche Struktur, wichtig ist. Sie ist bei allen Enzymen ähnlich. Folgenden Aufbau weisen Enzyme auf: - meistens globuläre (kugelförmig) Proteine - bestehen fast immer aus min. 100 Aminosäuren - besitzen eine Einbuchtung, die man aktives Zentrum nennt Das aktive Zentrum bindet Substrate. Entweder durch den sogenannte Schlüssel-Schloss-M echanismus oder durch den Induced-fit-Mechanismus , wobei bei zweiterem nach bzw. während der Einlagerung eine Konformationsänderung stattfindet, damit das Substrat noch noch fester vom aktiven Zentrum umschlossen wird. In beiden Fällen wird jedenfalls ein Enzym-Substrat-Komplex (ES-Komplex) gebildet. Dieser Komplex bestätigt auch die Beobachtungen, dass es einen Schwellenwert bei der Substratkonzentration gibt, nach welchem durch weitere Erhöhungen der Substrate keine schnellere Reaktionsgeschwindigkeit bewirkt. Da die Substrate sich kurzzeitig mit den Enzymen verbinden müssen, sind irgendwann alle aktiven Zentren besetzt und schneller kann die Reaktionsgeschwindigkeit dann nur noch noch mit mehr Enzymen (mehr aktive Zentren) vonstatten gehen. Damit eine chemische Reaktion stattfinden kann, müssen chemische Bindungen bei den Aus gangsstoffen (Edukten) gelöst werden. Dafür wird Energie benötigt. Dabei gibt es natürlich einen Übergangszustand, bei dem alte Bindungen noch nicht völlig gelöst, neue sich aber auch erst 1/2 Struktur und Wirkungsweise zu bilden beginnen. Diesen energetisch ungünstigen Übergangszustand zu überwinden benötigt eine Menge Aktivierungsenergie, die aus der Wärmeenergie beteiligter Moleküle genommen wird. Nicht enzymatisch katalysierte Reaktionen laufen aus diesem Grund nur bei hohen Temperaturen mit einer angemessenen Geschwindigkeit ab. Bei niedrigen Temperaturen können Enzyme helfen, die Reaktionsgeschwindigkeit auf ein leb ensnotwendig hohes Niveau zu bringen. In die aktiven Zentren ragen Aminosäurereste hinein, welche durch ihre Orientierung (Lage) und La dung (+/-) den Übergangszustand stabilisieren können. Er ist damit energetisch weniger ungünstig. Damit ist auch die benötigte Aktivierungsenergie herabgesetzt . Enzyme und ihre Substrate finden übrigens nicht gezielt, sondern durch ungerichtete Bewegungen (Diffusion) zueinander. Da viele Stoffwechselwege aus mehreren aufeinander folgenden Reaktionen b estehen, also z.B. der Citratzyklus , gibt es die sogenannten Multienzymkomplexe. Bei einem Multienzymkomplex liegen mehrere Enzyme eng nebeneinander, beispielsweise in die Zellmembran eingebettet. Dadurch, dass das Produkt des einen Enzyms gleich das Substrat für das direkt daneben liegende Enzym ist, kann viel Zeit gespart werden. Die Diffusionswege sind kurz . 2/2