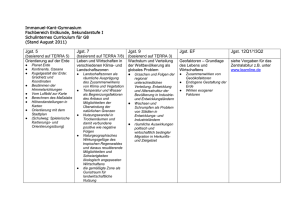
Grundwissen Chemie 9. Jgst
Werbung
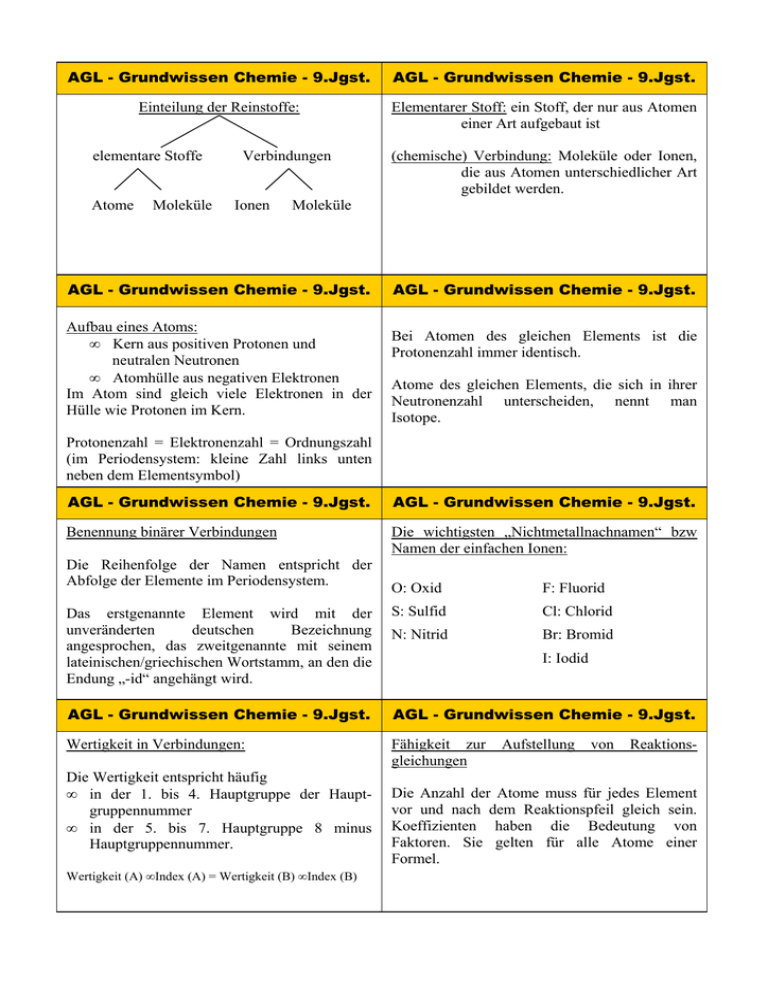
AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Einteilung der Reinstoffe: Elementarer Stoff: ein Stoff, der nur aus Atomen einer Art aufgebaut ist elementare Stoffe Atome Moleküle Verbindungen Ionen (chemische) Verbindung: Moleküle oder Ionen, die aus Atomen unterschiedlicher Art gebildet werden. Moleküle AGL - Grundwissen Chemie - 9.Jgst. Aufbau eines Atoms: • Kern aus positiven Protonen und neutralen Neutronen • Atomhülle aus negativen Elektronen Im Atom sind gleich viele Elektronen in der Hülle wie Protonen im Kern. AGL - Grundwissen Chemie - 9.Jgst. Bei Atomen des gleichen Elements ist die Protonenzahl immer identisch. Atome des gleichen Elements, die sich in ihrer Neutronenzahl unterscheiden, nennt man Isotope. Protonenzahl = Elektronenzahl = Ordnungszahl (im Periodensystem: kleine Zahl links unten neben dem Elementsymbol) AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Benennung binärer Verbindungen Die wichtigsten „Nichtmetallnachnamen“ bzw Namen der einfachen Ionen: Die Reihenfolge der Namen entspricht der Abfolge der Elemente im Periodensystem. O: Oxid F: Fluorid Das erstgenannte Element wird mit der unveränderten deutschen Bezeichnung angesprochen, das zweitgenannte mit seinem lateinischen/griechischen Wortstamm, an den die Endung „-id“ angehängt wird. S: Sulfid Cl: Chlorid N: Nitrid Br: Bromid AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Wertigkeit in Verbindungen: Fähigkeit zur gleichungen Die Wertigkeit entspricht häufig • in der 1. bis 4. Hauptgruppe der Hauptgruppennummer • in der 5. bis 7. Hauptgruppe 8 minus Hauptgruppennummer. Wertigkeit (A) • Index (A) = Wertigkeit (B) • Index (B) I: Iodid Aufstellung von Reaktions- Die Anzahl der Atome muss für jedes Element vor und nach dem Reaktionspfeil gleich sein. Koeffizienten haben die Bedeutung von Faktoren. Sie gelten für alle Atome einer Formel. AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Folgende elementaren Stoffe sind zweiatomigen Molekülen aufgebaut: Reaktionsenergie: Der Energieumsatz einer chemischen Reaktion ergibt sich aus der Differenz der inneren Energie zwischen Produkten und Edukten. Sauerstoff O2 Fluor F2 Wasserstoff H2 Chlor Cl2 Stickstoff N2 Brom Br2 aus Iod I2 Aktivierungsenergie: Die zum Auslösen einer chemischen Reaktion notwendige Energie AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. exotherme Reaktion: Chemische Reaktion, bei der Energie frei wird. endotherme Reaktion: Chemische Reaktion, bei der Energiezugeführt werden muss. Aktivierungsenergie E Aktivierungsenergie E Produkte Edukte Reaktionsenergie Reaktionsenergie Produkte Edukte Reaktionsverlauf Reaktionsverlauf AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Katalysator: Sortierung der Elemente im PSE: • Periode: waagrechte Zeilen, gibt die Anzahl der Elektronenschalen der Atome / der Elemente an • Gruppe: senkrechte Spalte, bei den acht Hauptgruppen gibt sie die Anzahl der Valenzelektronen an. • Metalle: links / unten und Nebengruppen; Nichtmetalle: rechts / oben • beschleunigt Reaktionen • senkt die Aktivierungsenergie • wird selbst nicht verbraucht AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Edelgaskonfiguration: Die Atome der Edelgase (8. Hauptgruppe, außer Helium) haben 8 Elektronen in der Valenzschale (äußerste besetzte Elektronenschale). Elektronendonatoren: Oktettregel: In den meisten Verbindungen nehmen die Atome die energetisch besonders günstige Elektronenkonfiguration von Edelgasatomen an, also (außer Helium: 2 e-) acht Valenzelektronen. Metallatome sind Elektronendonatoren. Sie geben bei Reaktionen mit Nichtmetallatomen Elektronen ab und werden so zu Kationen (positiv geladenen Ionen) AGL - Grundwissen Chemie - 9.Jgst. Elektronenakzeptoren: AGL - Grundwissen Chemie - 9.Jgst. Bau der Salze • bestehen aus Kationen und Anionen • regelmäßige Anordnung im Ionengitter • Zusammenhalten durch starke elektrostatische Anziehungskräfte (Ionenbindung) Nichtmetallatome sind Elektronenakzeptoren. Sie nehmen bei Reaktionen mit Metallatomen Elektronen auf und werden so zu Anionen (negativ geladenen Ionen) AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Wichtige komplexe Ionen: Verhältnis-Formeln Sulfat SO42− Sulfit, SO32− Nitrat NO3− Nitrit NO2− Phosphat PO43− Carbonat CO32− Die Formeln von Salzen sind VerhältnisFormeln. Diese drücken aus, in welchem Zahlenverhältnis die Ionen in den Stoffen vorhanden sind. Dabei müssen sich die Ladungen der Kationen und der Anionen ausgleichen. Ammonium NH 4+ AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Metallbindung Atombindung Die Atome der Metalle geben ihre Valenzelektronen ab. Die dadurch entstendenen, positiv geladenen Atomrümpfe werden durch delokalisierte Elektronen (Elektronengas), die sich zwischen den Atomrümpfen frei bewegen, zusammen gehalten. Atome gleicher oder verschiedener Elemente können Moleküle bilden. Dazu überlappen die Atomhüllen der einzelnen Atome. Die Elektronen gelangen dadurch in den Anziehungsbereich beider Kerne. Es kommt zur Bindung (bindendes Elektronenpaar). Neben Einfachbindungen gibt es auch Doppel- und Dreifachbindungen. AGL - Grundwissen Chemie - 9.Jgst. AGL - Grundwissen Chemie - 9.Jgst. Valenzstrichformel: Atome und ihre Bindungen in Molekülen werden durch Valenzstrichformeln dargestellt. 1. 2. 3. Für jedes Atom gilt: die Anzahl der Valenzelektronen ist gleich der Hauptgruppennummer. Durch die Ausbildung von Atombindungen erreichen die Bindungspartner meist eine Edelgaskonfiguration. Daher gilt: Die Anzehl der für die Edelgaskonfiguration noch benötigten Elektronen ist gleich der Anzahl der bindenden Elektronen. Zieht man von der Anzahl der Valenzelektronen die Anzahl der bindenden Elektronen ab, so bleibt die Anzahl der nichtbindenen Elektronen übrig.