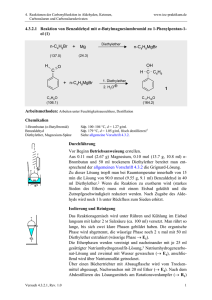
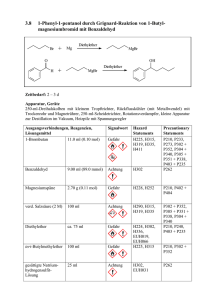
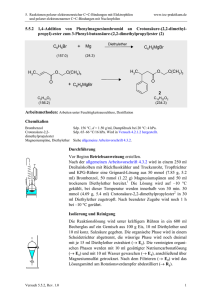
Musterlösung zur 6. Übung
Werbung
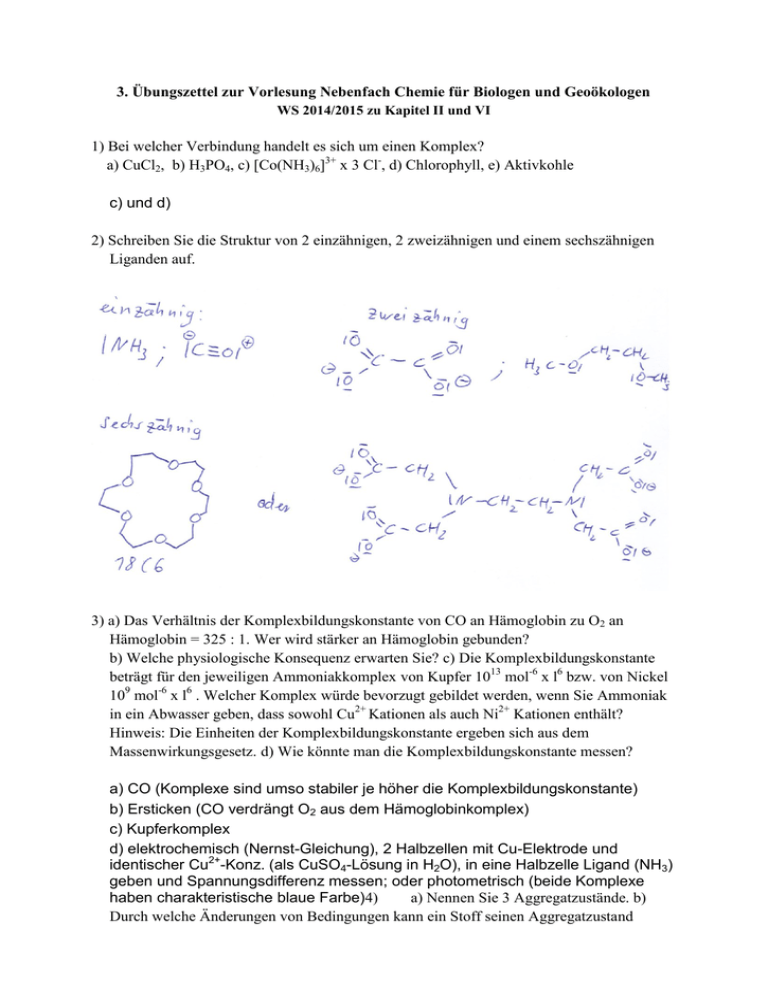
3. Übungszettel zur Vorlesung Nebenfach Chemie für Biologen und Geoökologen WS 2014/2015 zu Kapitel II und VI 1) Bei welcher Verbindung handelt es sich um einen Komplex? a) CuCl2, b) H3PO4, c) [Co(NH3)6]3+ x 3 Cl-, d) Chlorophyll, e) Aktivkohle c) und d) 2) Schreiben Sie die Struktur von 2 einzähnigen, 2 zweizähnigen und einem sechszähnigen Liganden auf. 3) a) Das Verhältnis der Komplexbildungskonstante von CO an Hämoglobin zu O2 an Hämoglobin = 325 : 1. Wer wird stärker an Hämoglobin gebunden? b) Welche physiologische Konsequenz erwarten Sie? c) Die Komplexbildungskonstante beträgt für den jeweiligen Ammoniakkomplex von Kupfer 1013 mol-6 x l6 bzw. von Nickel 109 mol-6 x l6 . Welcher Komplex würde bevorzugt gebildet werden, wenn Sie Ammoniak in ein Abwasser geben, dass sowohl Cu2+ Kationen als auch Ni2+ Kationen enthält? Hinweis: Die Einheiten der Komplexbildungskonstante ergeben sich aus dem Massenwirkungsgesetz. d) Wie könnte man die Komplexbildungskonstante messen? a) CO (Komplexe sind umso stabiler je höher die Komplexbildungskonstante) b) Ersticken (CO verdrängt O2 aus dem Hämoglobinkomplex) c) Kupferkomplex d) elektrochemisch (Nernst-Gleichung), 2 Halbzellen mit Cu-Elektrode und identischer Cu2+-Konz. (als CuSO4-Lösung in H2O), in eine Halbzelle Ligand (NH3) geben und Spannungsdifferenz messen; oder photometrisch (beide Komplexe haben charakteristische blaue Farbe)4) a) Nennen Sie 3 Aggregatzustände. b) Durch welche Änderungen von Bedingungen kann ein Stoff seinen Aggregatzustand ändern? c) Sind die Änderungen der Aggregatzustände reversibel? d) Wozu kann man die Änderung von Aggregatzuständen im Labor einsetzen – nennen Sie mindestens 2 Möglichkeiten. a) fest, flüssig, gasförmig b) Druck, Temperatur c) ja d) Abtrennung von Lösungsmittel durch Destillation, Auftrennung von Lösungsmittelgemischen durch Destillation, Reinigung von Feststoffen durch Kristallisation oder Sublimation 5) a) Beschreiben Sie das Benetzungsverhalten von Wasser bei 20 °C und Normaldruck auf Metall-, Glas- und Wachsoberflächen. b) Wie verändert sich das Benetzungsverhalten von Wasser unter den genannten Bedingungen auf Glas bei der Zugabe von Tensiden. c) Beschrieben Sie kurz was ein Tensid ist und nennen Sie ein Beispiel. a) je unpolarer das Substrat (weniger Wechselwirkung mit Wassermolekülen) desto schlechter ist die Benetzung (höher der Kontaktwinkel), bessere Benetzung in Reihenfolge Wachs, Metall, Glas b) Wassertropfen spreitet (verläuft) auf Glas aufgrund Herabsetzung der Oberflächen-/Grenzflächenspannung c) Tenside bestehen aus einem langen unpolaren Kohlenwasserstoffrest und einer polaren Kopfgruppe (Carbonsäure, Sulfat, quartäre Aminogruppe, ...), z.B. Natriumdodecylsulfat (SDS) 6) a) Was unterscheidet polare Lösungsmittel von unpolaren Lösungsmitteln? b) Nennen Sie 3 Beispiele. c) Wie kann man Lösungsmittelgemische im Labor auftrennen? c) Wie kann man ungelöste Salzkristalle von einer gesättigten Lösung desselben Salzes abtrennen? d) Wie könnte man die Salzkristalle zum Auskristallisieren bekommen? a) Dipolmoment b) polar: Wasser, Ethanol, Essigsäure; unpolar: Hexan, Tetrachlorkohlenstoff, Benzol c) Destillation d) dekantieren, filtrieren e) abkühlen (Herabsetzen des Löslichkeitsproduktes) 7) a) Was geschieht wenn man flüssiges Wasser mit flüssigem Ethanol mischt? b) Was geschieht wenn man flüssiges Wasser mit Diethylether mischt? c) Welches Gleichgewicht stellt sich dabei ein? d) Welches Gleichgewicht in der Chemie kennen Sie noch? e) Wird sich ein Stoff ohne Energiezufuhr in einem Lösungsmittel lösen, wenn die Lösungsenthalpie +100 kJ und die Entropie +35 kJ bei 295 K beträgt? a) es entsteht eine homogene Mischung (Ethanol löst sich molekular in Wasser) b) Wasser und Diethylether mischen sich nicht, es entsteht eine Phasengrenze (Wasser unten, Diethylether oben (kleinere Dichte)) c) Verteilungsgleichgewicht (Löslichkeit Diethylether in Wasser ca. 6%; Diethylether kann bis zu 1.5% Wasser aufnehmen) d) Säure/Base Gleichgewicht e) G = H –TS = 100 kJ – 295 K * 35 kJ/molK = - 10225 kJ/mol, d.h. löst sich (G < 0)