BSE – Diagnostik - Schulen
Werbung
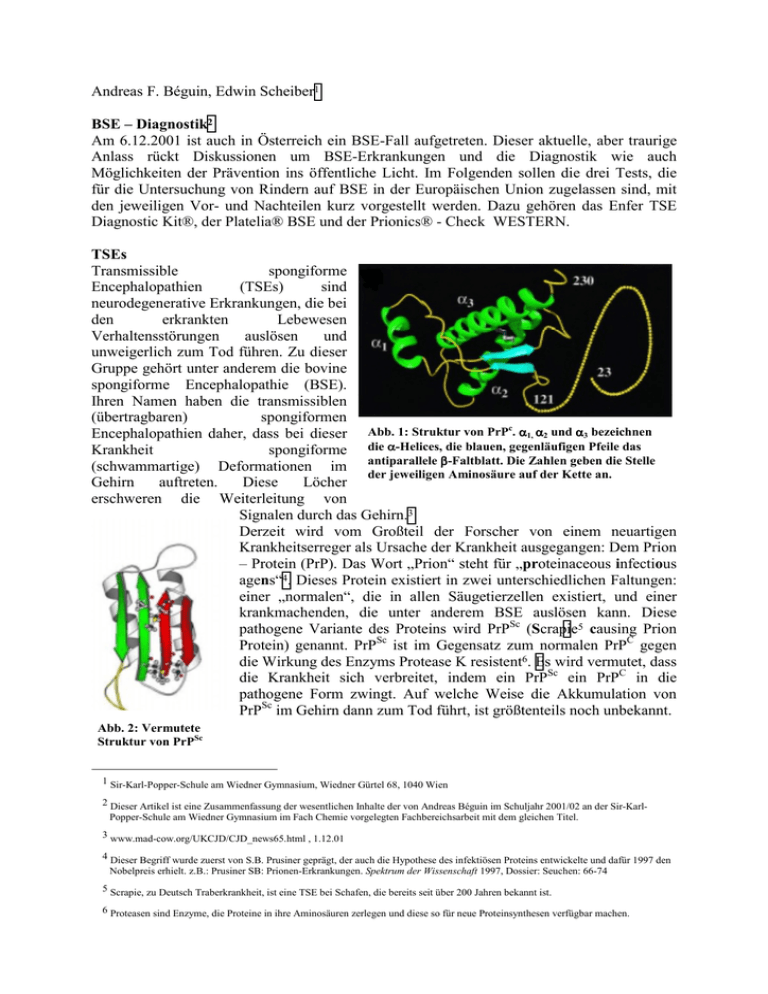
Andreas F. Béguin, Edwin Scheiber1 BSE – Diagnostik2 Am 6.12.2001 ist auch in Österreich ein BSE-Fall aufgetreten. Dieser aktuelle, aber traurige Anlass rückt Diskussionen um BSE-Erkrankungen und die Diagnostik wie auch Möglichkeiten der Prävention ins öffentliche Licht. Im Folgenden sollen die drei Tests, die für die Untersuchung von Rindern auf BSE in der Europäischen Union zugelassen sind, mit den jeweiligen Vor- und Nachteilen kurz vorgestellt werden. Dazu gehören das Enfer TSE Diagnostic Kit®, der Platelia® BSE und der Prionics® - Check WESTERN. TSEs Transmissible spongiforme Encephalopathien (TSEs) sind neurodegenerative Erkrankungen, die bei den erkrankten Lebewesen Verhaltensstörungen auslösen und unweigerlich zum Tod führen. Zu dieser Gruppe gehört unter anderem die bovine spongiforme Encephalopathie (BSE). Ihren Namen haben die transmissiblen (übertragbaren) spongiformen c Encephalopathien daher, dass bei dieser Abb. 1: Struktur von PrP . α1, α2 und α3 bezeichnen Krankheit spongiforme die α-Helices, die blauen, gegenläufigen Pfeile das (schwammartige) Deformationen im antiparallele β-Faltblatt. Die Zahlen geben die Stelle der jeweiligen Aminosäure auf der Kette an. Gehirn auftreten. Diese Löcher erschweren die Weiterleitung von Signalen durch das Gehirn.3 Derzeit wird vom Großteil der Forscher von einem neuartigen Krankheitserreger als Ursache der Krankheit ausgegangen: Dem Prion – Protein (PrP). Das Wort „Prion“ steht für „proteinaceous infectious agens“4. Dieses Protein existiert in zwei unterschiedlichen Faltungen: einer „normalen“, die in allen Säugetierzellen existiert, und einer krankmachenden, die unter anderem BSE auslösen kann. Diese pathogene Variante des Proteins wird PrPSc (Scrapie5 causing Prion Protein) genannt. PrPSc ist im Gegensatz zum normalen PrPC gegen die Wirkung des Enzyms Protease K resistent6. Es wird vermutet, dass die Krankheit sich verbreitet, indem ein PrPSc ein PrPC in die pathogene Form zwingt. Auf welche Weise die Akkumulation von PrPSc im Gehirn dann zum Tod führt, ist größtenteils noch unbekannt. Abb. 2: Vermutete Struktur von PrPSc 1 Sir-Karl-Popper-Schule am Wiedner Gymnasium, Wiedner Gürtel 68, 1040 Wien 2 Dieser Artikel ist eine Zusammenfassung der wesentlichen Inhalte der von Andreas Béguin im Schuljahr 2001/02 an der Sir-KarlPopper-Schule am Wiedner Gymnasium im Fach Chemie vorgelegten Fachbereichsarbeit mit dem gleichen Titel. 3 www.mad-cow.org/UKCJD/CJD_news65.html , 1.12.01 4 Dieser Begriff wurde zuerst von S.B. Prusiner geprägt, der auch die Hypothese des infektiösen Proteins entwickelte und dafür 1997 den Nobelpreis erhielt. z.B.: Prusiner SB: Prionen-Erkrankungen. Spektrum der Wissenschaft 1997, Dossier: Seuchen: 66-74 5 Scrapie, zu Deutsch Traberkrankheit, ist eine TSE bei Schafen, die bereits seit über 200 Jahren bekannt ist. 6 Proteasen sind Enzyme, die Proteine in ihre Aminosäuren zerlegen und diese so für neue Proteinsynthesen verfügbar machen. Prionics® - Check WESTERN Um das pathogene Prion PrPSc (Scrapie causing prion protein) im Hirnstamm eines Rindes nachzuweisen, verwendet der Prionics® - Check zwei Kriterien: Die teilweise Resistenz des Proteins gegen Protease K die relative Molekülmasse und des Reststücks nach dem ProteaseVerdau von 27 – 30. Dazu wird der homogenisierten Probe zunächst die Protease hinzugesetzt und danach eine Gelelektrophorese durchgeführt. Die Proteinbruchstücke werden auf eine PVDF-Membran7 übertragen. Anschließend wird der nach dem Molekulargewicht aufgetrennten Proteinmischung der monoklonale Antikörper 6H4 zugesetzt, um das Prion Protein nachzuweisen. Die Vorbehandlung mit Protease K ist notwendig, da der Antikörper8 nicht zwischen PrPC („cellular prion protein“) und PrPSc unterscheiden kann. Erst furch die Auftrennung der Proteinbruchstüche ist eine eindeutige Identifizierung möglich. An den monoklonalen Antikörper ist ein Enzym gebunden, das bei Zugabe eines bestimmten Substrats eine Chemolumineszenz zeigt. Dies ermöglicht die Sichtbarmachung des Testergebnisses durch eine konventionelle Photoentwicklung. Ist im Bereich zwischen den relativen Molekülmassen von 27 und 30 ein schwarzer Fleck zu sehen, war das Tier Abb. 3: Ein typisches Prionics®-Check Testergebnis. Die nicht von Protease verdaute BSE – positiv. Der Prionics® - Check WESTERN zeichnet Probe ganz links dient zur Kontrolle der korrekten Durchführung. Bei den negativen Proben ist ein sich durch seine einfache Handhabung im dünner Strich zu erkennen: Das ist die Protease K. Routinelabor aus. Die für den Laborbetrieb geeignete Anfertigung der benötigten Geräte ermöglicht einen reibungslosen Ablauf der Tests. Inzwischen haben die anderen Tests auf diesem Gebiet gleichgezogen, aber zu Beginn der Massentestung war die einfache Handhabung ein entscheidender Wettbewerbsvorteil für den Test. Der Prionics® - Check WESTERN war bereits im Jahr 1997, 4 Jahre vor Beginn der serienmäßigen BSE – Tests, erhältlich. Aus diesen Gründen ist der Prionics® - Check heute einer der meistverwendeten Tests. Der wesentliche Unterschied des Prionics® - Check WESTERN zu den beiden anderen zugelassenen Methoden besteht darin, dass dieser Test alle mit Sicherheit bekannten Eigenschaften des PrPSc - Moleküls als Nachweiskriterien für die Krankheit heranzieht: Die anderen Tests stützen sich nur auf die Proteaseresistenz, um PrPC von PrPSc zu unterscheiden. Allerdings gibt es auch Einwände gegen die Verwendung des Prionics® - Check, so die geringe Sensitivität des Tests. Für diese Schwachstelle gibt es zwei Gründe. Eine liegt am verwendeten monoklonalen Antikörper. Gelegentlich treten unspezifische Bindungen zwischen Proteinbruchstücken und dem Antikörper auf. Diese erschweren die Diagnose, da sie den Ergebnisfilm „verrauschen“. Ein zweites Problem stellt die Art des Testergebnisses dar. Der Nachweis geschieht visuell: Wurde nicht sauber genug gearbeitet, so ist das Ergebnis nicht genau erkennbar. Eine quantitative Bestimmung von PrPSc in der Probe ist prinzipiell unmöglich. 7 Polyvinylidendifluorid-Membran 8 Monoklonale Antikörper binden an ihr Ziel nur an einer Stelle. Sie können gentechnisch in Bakterien kostengünstig hergestellt werden, binden allerdings unter Umständen auch andere Proteine als das Gesuchte. Platelia® BSE Der von Bio-Rad® vermarktete BSE-Test Platelia® BSE basiert auf einem Sandwich Immunoassay. Bei dieser Testmethode wird das Prion mit Hilfe zweier monoklonaler Antikörper nachgewiesen. Der „Fangantikörper“ ist an einer Membran befestigt. Nach der Inkubation dieser Membran mit der bereits mit Protease K behandelten Probe werden die ungebundenen Fragmente abgewaschen. Danach dockt ein Nachweisantikörper an das Protein. An den Nachweisantikörper ist kovalent ein Enzym gebunden, welches eine Farbreaktion auslösen kann. War in der ursprünglichen Probe PrPSc enthalten, wird die Probenlösung am Ende des Tests gelb. Die Intensität der Farbe ist direkt proportional zur Menge PrPSc in der Probe. Dadurch wird eine Quantifizierung des PrPSc – Gehalts möglich. Dies erleichtert den Vergleich mit anderen Testergebnissen bzw. Testmethoden. Bei einer Studie im November 2001 konnte gezeigt werden, dass die Sensitivität des Platelia® BSE vergleichbar mit der eines Tierversuchs ist.9 Dieser Tierversuch, der bis heute als goldener Standard für BSE – Tests gilt, besteht darin, dass Hirnmaterial des zu testenden Tieres in das Gehirn einer Maus injiziert wird. Nach ca. 230 Tagen entwickelt die Maus eine BSE – ähnliche Erkrankung. Allerdings hat es einen bedenklichen Zwischenfall bei der Anwendung des Platelia® BSE gegeben: Im Dezember 2000 wurde bei einem definitiv BSE – positives Tier die Krankheit nicht entdeckt.10 Enfer TSE Diagnostic Kit® Das Testsystem des Enfer TSE Diagnostic Kit® ist ein klassischer ELISA11. Dabei wird ein polyklonaler Antikörper zum Nachweis des Prions verwendet. Ein solcher Antikörper wird hergestellt, indem man pathogene Prionen des Rinds in Kaninchen injiziert. Das Immunsystem der Kaninchen bildet daraufhin polyklonale Antikörper gegen den körperfremden Stoff. Polyklonale Antikörper gegen PrPSc können nur durch Injektion des Reinstoffes in eine andere Säugerart hergestellt werden, da das Immunsystem des Rinds das Rind-PrPSc – Molekül nicht als körperfremd erkennt. Abb. 4: Schema des ELISA - Nachweises von PrPSc mit dem Testsystem von Enfer 9 Grassi J, Comoy E, Simon S, Créminion C, Frobert Y, Trapmann S, Schimmel H, Hawkins SAC, Moynagh J, Deslys JP, Wells GAH: Rapid test for the preclinical postmortem diagnosis of BSE in central nervous tissue. Veterinary Record 2001; 149; 577-582 10 www.spiegel.de/spiegel/0,1518,113335,00.html “BSE: Blindflug ins Hirn, 18.11.01, [email protected] 11 Enzyme Linked Immunosorbent Assay Die so hergestellten polyklonalen Antikörper binden an mehrere Stellen das Protein und können deshalb schon geringe Mengen des Proteins nachweisen. Die gebundenen Kaninchenantikörper werden mit Hilfe eines monoklonalen Antikörpers, der an alle Kaninchenantikörper bindet, nachgewiesen. Zu diesem Zweck ist an diesen monoklonalen Sekundärantikörper ein Enzym gebunden, das bei der Zugabe eines bestimmten Substrats eine Chemolumineszenz ergibt. Aus der Intensität dieses Leuchtens wird der PrPSc – Gehalt der Probe berechnet. BSE-Tests am lebenden Tier Testmethoden, die den Nachweis einer BSE-Erkrankung mit Hilfe leicht zugänglicher Gewebe oder Körperflüssigkeiten lebender Tiere ermöglichen sind momentan sehr gefragt. Solche Tests würden eine Feststellung des status quo der BSE-Epidemie in Europa erlauben. Viele Firmen investieren in dieses Gebiet viel Geld. Derzeit scheint der Ansatz von Böhringer Ingelheim Vetmedica der vielversprechendste zu sein. Derzeit arbeitet die Firma an der Entwicklung eines BSE-Bluttests. Das Testprinzip besteht darin, im Blut erkrankter Tiere Expressionsunterschiede verschiedener Markerproteine nachzuweisen. Diese Proteine (Interferon γ, Lamininrezeptor, Lamininrezeptor – Precursor, gesundes PrPC) werden von Blutzellen erkrankter Tiere in größerer Menge produziert als von gesunden Tieren. Als Nachweismethoden für die entsprechenden Markerproteine sind der ELISA und die RT – PCR im Gespräch. Bei der RT – PCR (reverse transcriptase polymerase chain reaction) macht man sich den Umstand zu Nutze, dass die Häufigkeit einer bestimmten RNA – Sequenz in einer Zelle dem Expressionsgrad direkt proportional ist. Bei der Testung wird zunächst mit Hilfe des Enzyms Reverse Transkriptase die gesamte RNA in cDNA (copy DNA) übersetzt. Daraufhin wird mit Hilfe der PCR die cDNA-Sequenz des gesuchten Markers vermehrt. Die vermehrte DNA wird untersucht. Dabei wird die Länge des Produkts gemessen und mit der Länge des Markergens verglichen. Ein entscheidender Vorteil dieser Testmethode steht bereits fest: Es wird bei der Analysemethode keine Protease K benötigt. Diese ist der größte Kritikpunkt an den momentanen Testmethoden. Wird nämlich zu wenig Protease beigegeben, werden nicht alle PrPC – Moleküle zerstört. Im Falle einer zu großen Menge Protease K wird jedoch möglicherweise auch ein Teil der PrPSc – Moleküle zerstört. Die Proteasenmenge bleibt so bei jedem BSE – Test ein Unsicherheitsfaktor. Ausblick Derzeit wird die Evaluierung von fünf neuen post-mortem BSE – Tests abgeschlossen. Unter diesen hat der Prionics® - Check LIA (Luminiscence Immuno Assay) sehr hohe Erfolgschancen , da er den Prionics® - Check WESTERN teilweise ersetzen wird. Der Test basiert auf einem ELISA. Die Durchführung ist weniger zeitaufwendig und wird einen hohen throughput erlauben. Daneben ist die Entwicklung von BSE – Tests am lebenden Tier zur Marktreife von großer Bedeutung, da so eine umfassende Testung der Rinder in der EU möglich wird. Abbildungsverzeichnis Abb. 1 Abb. 2 Abb. 3 Abb. 4 www.integra-biosciences.com/Images/Prionen.jpg , 27.12.01 www.wellesley.edu/Chemistry/Chem101/aspirin/prion.jpg , 22.1.02 © Andreas Béguin, 21.11.01 Präsentation „TSE“ von Abbott, erhalten am 23.10.01 von Stephen Belcher ([email protected]) (übersetzt) Literatur TSEs allgemein - www.mad-cow.org/UKCJD/CJD_news65.html , 1.12.01 Cappai R, Jobling MF, Barrow CJ, Collins S: Structural Biology of Prions. Aus: Prions. A Challenge for Science, Medicine and Public Health System. Contrib. Microbio. Basel (Karger Verlag) 2001:7;32-47 Welker E, Wedemeyer WJ, Scheraga HA: A role for intermolecular disulfide bonds in prion diseases? Proceedings of the National Academy of Sciences USA 2001; 98(8);4334-4336 Knaus KJ, Morillas M, Swietnicki W, Malone M, Surewics W, Yee VC: Crystal structure of the human prion protein reveals mechanism for oligomerization. Nature Structural Biology 2001; 8(9): 770-774 Riesner D: The Prion Theory: Background and Basic Information. Aus: Prions. A Challenge for Science, Medicine and Public Health System. Contrib. Microbio. Basel 2001: 7;16 Telling GC, Scott M, Hsiao KK, Foster D, Yang SL, Torchia M, Sidle KCL, Collinge J, de Armond SJ, Prusiner SB: Transmission of Creutzfeldt-Jakob disease from humans to transgenic mice expressing chimeric human-mouse prion protein. Proceedings of the National Academy of Sciences USA 1994: 91; 9936-9940 Prionics® - Check WESTERN - Schaller O, Fatzer R, Stack M, Clark J, Cooley W, Biffinger K, Egli S, Doherr M, Vandevelde M, Heim D, Oesch B, Moser M: Validation of a Western immunoblotting procedure für bovine PrPsc detection and its use as a rapid surveillance method for the diagnosis of bovine spongiform encephalopathy (BSE). Acta Neuropathologica 1999; 98: 437-443 Platelia® BSE - www.spiegel.de/spiegel/0,1518,113335,00.html “BSE: Blindflug ins Hirn, 18.11.01, [email protected] Europäische Kommission: The Evaluation of Tests for the Diagnosis of Transmissible Spongiform Encephalopathy in bovines (europa.eu.int/comm./food/fs/bse/bse12_en.html) Deslys JP, Comoy E, Hawkins S, Simon S, Schimmel H, Wells G, Grassi J, Moynagh J: Screening slaughtered cattle for BSE. Nature 2001; 409;476-478 BSE-Schnelltests. GIT Labor-Fachzeitschrift 2001; 45;23 www.bio-rad.com , Suchbegriff „BSE testing“ Grassi J, Comoy E, Simon S, Créminion C, Frobert Y, Trapmann S, Schimmel H, Hawkins SAC, Moynagh J, Deslys JP, Wells GAH: Rapid test for the preclinical postmortem diagnosis of BSE in central nervous tissue. Veterinary Record 2001; 149; 577-582 Enfer TSE Diagnostic Kit® - PowerPoint Präsentation “TSE” von Abbott Diagnostics (Herkules, USA) Deutsche Dokumentation zum Enfer TSE Diagnostic Kit®











