2. Leseprobe - STARK Verlag
Werbung

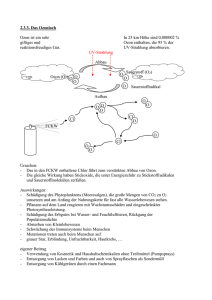
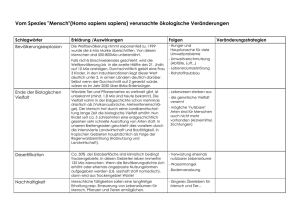
Material 3: Produkt einer säurekatalysierten Additionsreaktion H O H H C O C H H Materialgrundlage: Gordon H. Aylward, Tristan J. V. Findlay: Datensammlung Chemie in SI-Einheiten, Weinheim, 2014. Kurt Peter Christian Vollhardt, Neil E. Schore: Organische Chemie, Weinheim 2009, S. 970. Wolfgang Walter, Wittko Francke: Beyer Walter: Lehrbuch der Organischen Chemie, Stuttgart 2004, S. 248. Adalbert Wollrab: Organische Chemie, Berlin Heidelberg 2002, S. 573. http://www.intermediates.basf.com/chemicals/kundenreportage/ideen_tradition (abgerufen am 06. 07. 2015). http://www.chemie.de/lexikon/Ameisensäure.html (abgerufen am 06. 07. 2015). http://www.google.de/patents/EP0001432A1?cl=de (abgerufen am 06. 07. 2015). Aufgabe B Chemie in der Eisdiele BE Speiseeis wird vom Bundesministerium für Ernährung und Landwirtschaft in den Leitsätzen für Speiseeis und Speiseeishalberzeugnisse vom 19. Oktober 1993, zuletzt geändert am 27. November 2002, folgendermaßen definiert: „Speiseeis ist eine durch einen Gefrierprozeß bei der Herstellung in einen festen oder pastenartigen Zustand, z. B. Softeis, gebrachte Zubereitung, die gefroren in den Verkehr gebracht wird und dazu bestimmt ist, in diesem Zustand verzehrt zu werden; im aufgetauten Zustand verliert Speiseeis seine Form und verändert sein bisheriges Gefüge.“ Zur Herstellung von Speiseeis verwendet man hauptsächlich Milch, Ei, verschiedene Zucker, Früchte, Aromastoffe und färbende Lebensmittel. Um den festen oder pastenartigen Zustand des Eises stabil zu halten, werden unter anderem Emulgatoren und Verdickungsmittel zugesetzt. Der in der beliebten Speiseeissorte Vanille enthaltene Aromastoff Vanillin kommt in der Natur in der Vanilleschote vor. Im Labor lässt sich Vanillin in zwei Schritten herstellen. Damit das Speiseeis gefroren in den Verkehr gebracht werden kann, muss es gekühlt werden. In Kühlschränken wurden früher als Kältemittel hauptsächlich Fluorchlorkohlenwasserstoffe (FCKW) verwendet, die negative Auswirkungen auf die schützende Ozonschicht in der Stratosphäre haben. LK 2016-3 2.1 Bei der Herstellung von Speiseeis wird als Emulgator z. B. Glycerinmonostearat eingesetzt (Material 1). Emulgatoren ermöglichen es, nicht mischbare Flüssigkeiten zu mischen. Benennen Sie die Stoffklasse von Glycerinmonostearat sowie die Ausgangsstoffe zu seiner Synthese in der IUPAC-Nomenklatur. Erläutern Sie die Emulgatorwirkung des Glycerinmonostearats. 7 2.2 Als Verdickungsmittel für Eiscreme lässt sich Carubin verwenden, das aus dem Samen des Johannisbrotbaums gewonnen wird (Material 2). Analysieren Sie den Aufbau des Moleküls und formulieren Sie die FISCHERProjektionsformeln der beteiligten Monosaccharide. Hinweis: Die Monosaccharide müssen nicht benannt werden. 7 2.3 Der erste Schritt zur Herstellung von Vanillin im Labor findet als elektrophile Substitution statt (Material 3). Formulieren Sie den Mechanismus der elektrophilen Substitution für die Bromierung von 4-Hydroxybenzaldehyd zu 3-Brom-4-hydroxybenzaldehyd und benennen Sie die Reaktionsschritte. Begründen Sie die Position der Bromierung ohne Verwendung von Formeldarstellungen. 10 2.4 Beim zweiten Schritt der Herstellung von Vanillin (Material 3) kommt es in Gegenwart eines Katalysators zu einer Substitutionsreaktion, die von 3-Brom-4-hydroxybenzaldehyd ausgeht. Material 4 beschreibt die Reaktion und vergleicht die Reaktivität dieses Stoffes mit der Reaktivität von 3-Brom-4-nitrobenzaldehyd. Bei beiden Substitutionsreaktionen wird jeweils der erste Teilschritt bis zur Bildung des Anions betrachtet. Formulieren Sie für die Bildung dieser beiden Anionen jeweils eine Reaktionsgleichung. Erklären Sie mithilfe der relevanten mesomeren Grenzstrukturen dieser Anionen die unterschiedliche Reaktivität der beiden Brombenzaldehyde. Hinweis: Für die Erstellung der mesomeren Grenzstrukturen wird die Aldehydgruppe jeweils nicht berücksichtigt. 9 2.5 Ozon (O3) ist ein Gas, das sich im Labor auf unterschiedlichen Wegen darstellen lässt. Material 5 beschreibt einen solchen Weg. Formulieren Sie die beiden mesomeren Grenzstrukturen des Ozonmoleküls. Formulieren Sie für die beiden Gleichgewichtsreaktionen, die zur Ozonherstellung führen, jeweils die Reaktionsgleichung. Erläutern Sie auch anhand thermodynamischer Berechnungen für beide Gleichgewichtsreaktionen die geringe Ausbeute an Ozon durch die Herstellung bei hohen Temperaturen. 11 LK 2016-4 2.6 Ozon lässt sich durch Reaktion mit Iodid-Ionen nachweisen. Bei dieser Redoxreaktion wirkt nur eines der drei Sauerstoff-Atome des Ozons oxidierend. Ein weiterer Reaktionspartner ist Wasser, Produkte sind unter anderem elementares Iod und Sauerstoff; die Reaktion ist insgesamt alkalisch. Formulieren Sie die Reaktionsgleichung und zeigen Sie anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt. 6 50 Material 1: Glycerinmonostearat O H H H H H H H H H H H H H H H H H O C C C C C C C C C C C C C C C C C C C O H H H H H H H H H H H H H H H H H H C O H H H C H H H H Material 2: Ausschnitt aus einem Carubin-Molekül H2COH O HO H OH H H OH H H H H O H2 COH O H H OH OH H HO O H H O H OH HO H H OH H H H2COH H O HO O O H H H CH2 H H O HO O H H2COH H Material 3: Herstellung von Vanillin aus 4-Hydroxybenzaldehyd in zwei Schritten H O H C O H C O C + Br2 / – HBr + H3C [FeBr3] O / – Br H [Katalysator] Br H O 4-Hydroxybenzaldehyd H O O H 3-Brom-4-hydroxybenzaldehyd LK 2016-5 O Vanillin C H H Material 4: Reaktivitätsvergleich Die Substitutionsreaktion am 3-Brom-4-hydroxybenzaldehyd wird durch einen nucleophilen Angriff eines Methanolat-Ions in Gegenwart eines Katalysators gestartet. Zunächst bildet sich ein negativ geladenes Ion, das mesomeriestabilisiert ist. Die Bildung dieses Anions verläuft relativ langsam. Anschließend kommt es durch Abspaltung des Bromid-Ions zur Bildung von Vanillin. Verwendet man als Edukt für die nucleophile Substitutionsreaktion statt der Hydroxyverbindung 3-Brom-4-nitrobenzaldehyd, so verläuft die Bildung des Anions analog, allerdings insgesamt deutlich schneller. Material 5: Ozonherstellung Methode zur Herstellung von Ozon Ozonmoleküle lassen sich durch Einwirkung von Sauerstoffatomen auf Sauerstoffmoleküle (O2) herstellen. Die Spaltung der Sauerstoffmoleküle kann unter anderem mithilfe von Wärmeenergie erzwungen werden. Um Ozon zu erhalten, müssen zwei Gleichgewichtsreaktionen in direkter Abfolge ablaufen. In der ersten Gleichgewichtsreaktion reagieren Sauerstoffmoleküle zu Sauerstoffatomen. In der zweiten Gleichgewichtsreaktion reagiert ein Sauerstoffatom mit einem Sauerstoffmolekül zu einem Ozonmolekül. Molare Standardbildungsenthalpien O2 (g) molare Standardbildungsenthalpie 0 [kJ ⋅ mol −1 ] Δf H m 0 O (g) 249 O3 (g) 143 Materialgrundlage: Eberhard Breitmaier, Günther Jung: Organische Chemie, Stuttgart 2005, S. 167 ff. Kurt Peter Christian Vollhardt, Neil E. Schore: Organische Chemie, Weinheim 2011, S. 1 106 f. Arnold Frederik Hollemann, Nils Wiberg: Lehrbuch der anorganischen Chemie, Berlin 2007, S. 504 f. Arnold Frederik Hollemann, Nils Wiberg: Lehrbuch der anorganischen Chemie, Berlin 2007, S. 506 f. https://www.bmel.de/SharedDocs/Downloads/Ernaehrung/Lebensmittelbuch/ LeitsaetzeSpeiseeis.pdf?_blob=publicationFile (abgerufen am 12. 05. 2015). https://roempp.thieme.de/roempp4.0/do/data/RD-07-01480 (abgerufen am 12. 05. 2015). https://roempp.thieme.de/roempp4.0/do/data/RD-10-00132 (abgerufen am 12. 05. 2015). http://valhalla.chem.udel.edu/vanillin.pdf (abgerufen am 06. 07. 2015). LK 2016-6