Strahlentherapie - Institut für Physik
Werbung

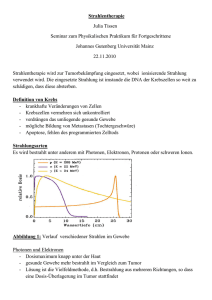
Strahlentherapie Johannes Gutenberg Universität Mainz Fortgeschrittenen Praktikum Physik – Seminar, Sommersemester 2010 Referentin: Claudia Mann, Betreuerin: Miriam Fritsch 17. Mai 2010 1. Strahlentherapie und Strahlenschäden Unter dem Begriff der Strahlentherapie versteht man die Behandlung von Krebserkrankungen mit ionisierender hochenergetischer Strahlung. Dazu zählt man vor allem Gamma-, Röntgenbremsstrahlung und Elektronen, seit der Mitte des letzten Jahrhunderts auch Protonen und schwere Ionen. Dabei zählt man Behandlungen mit Mikrowellen- oder Wärmestrahlen, Licht- und UV-Therapie sowie Ultraschallwellen nicht zur Strahlentherapie. Krebs besteht aus einzelnen Tumorzellen, welche durch drei Faktoren entstehen können: zum einen durch Strahlung(z.B. Hauttumore durch zu langes und zu intensives Sonnenbaden), zum anderen aber auch durch Chemikalien (z.B. Tabakrauch). Aktuelle Zahlen zu Krebs in Deutschland: Einen weiteren Faktor stellen die spontanen Mutationen. 2006: 426.800 Krebskranke Eine Tumorzelle zeichnet sich durch drei Hauptmerkmale aus: unkontrollierte Zellteilung, kein selbstinduzierter Zelltod und sie entgeht dem Immunsystem. Desweitern können auch noch andere Charakteristiken auftreten, wie beispielsweise eine eigene Blutversorgung und/oder Metastasierungen. für 2010 erwartet: rund 450.000 Neuerkrankungen 2006: 210.930 Krebstote (vgl. im selben Zeitraum 358.953 Menschen an Herz-Kreislauf-Erkrankungen gestorben) für 2010: etwa 1,45 Mio Menschen mit Krebserkrankung erwartet, d.h. Diagnose der Erkrankung erfolgte in den letzten 5 Jahren In der DNA befindet sich die Erbinformation , welche alle Vorgänge in der Zelle regelt. Die Bestrahlung erfolgt mit geladenen Teilchen oder Photonen. Somit können Schäden an der DNA entstehen, wie zum Beispiel Einzel- und Doppelstrangbrüche, Basenschäden (Basenverlust oder -austausch), intramolekulare Vernetzungen oder Anlagerung von Proteinen von außen. Diese Schäden sind alle reparierbar, auch von der Tumorzelle. Dieser Vorgang des Reparierens beginnt direkt nach der Bestrahlung. Somit ergibt sich das große Ziel der Strahlentherapie: die größtmögliche Schädigung der Tumorzellen und die größtmögliche Schonung des gesunden Gewebes. Eine weitere Schädigung der DNA sind die sogenannten „bulky lesions“. Dies sind denaturierte Zonen, in denen viele DNA-Schäden gleichzeitig auftreten. Dies erschwert die Reparatur, oder macht sie gar unmöglich. Sie nehmen mit höherer Ionisationsdichte zu, wie beispielsweise bei Protonen und schweren Ionen. Um das gesunde Gewebe größtmöglich zu schonen, nutzt man die Methode der Fraktionierung. Man gibt dabei dem Gewebe, egal ob Tumor- oder gesundes Gewebe, die Möglichkeit die Schäden zu reparieren. Dabei haben die beiden Gewebearten unterschiedliche „Geschwindigkeiten“, mit denen die Reparatur von statten geht. Das gesunde Gewebe kann sich schneller reparieren. Dies sieht man auch in der nebenstehenden Abbildung. Bei einmaliger Bestrahlung (schwarze gestrichelte Linie) werden beide Gewebearten Schema des Prinzips der Fraktionierung gleichermaßen geschädigt. Fraktioniert man jetzt die Gesamtdosis von 60-70 Gray auf 30-40 Einzeldosen zu je 2 Gray, so sieht man, dass sich das Tumorgewebe (rote gestrichelte Linie) wesentlich schlechter erholt, als das gesunde Gewebe (blaue gestrichelte Linie). Gegenüber der einmaligen Bestrahlung mit voller Dosis, sinkt bei der Fraktionierung die Überlebensrate der Tumorzelle, während sie für die gesunden Zellen wesentlich höher ist. Als Maß für die Ionisationsdichte benutzt man den Linear Energy Transfer (LET). Dieser ist ein Maß für die an einem Punkt der Teilchenbahn absorbierte Dosis, und entspricht somit der Bethe-BlochFormel. Vergleicht man nun die unterschiedlichen Strahlungsarten (siehe nebenstehende Abbildung), so sieht man, dass jede Strahlenart eine unterschiedliche Tiefen-DosisVerteilung besitzt. Die Photonen (gelbe Linie) weisen einen exponentiellen Abfall auf, während die Ne-Atome und Protonen einen Bragg-Peak haben. Dabei ist die aufgetragene Wassertiefe mit der Eindringtiefe in das Gewebe vergleichbar, da eine menschliche Zelle größtenteils aus Wasser besteht. In der Strahlentherapie unterscheidet man zwei Arten der Strahlenwirkung. Bei der direkten Strahlenwirkung werden DNA-Teile direkt ionisiert. Die Schäden entstehen durch DNA-Radikale. Jedoch spielt die direkte Strahlenwirkung eine untergeordnete Rolle. Die indirekte Strahlenwirkung passiert häufiger und beruht auf der Radiolyse von Wasser. Bei der Radiolyse von Wasser entstehen entweder durch Ionisation oder durch Anregung der Wassermoleküle Wasserradikale. Wasser ist in jeder menschlichen Zelle in dem Zellplasma, zusammen mit Proteinen vorhanden, sodass die DNA direkt von einer Hydrathülle umgeben ist. 2. Elektronen- und Gammastrahlen Die geschichtliche Entwicklung der Strahlentherapie beginnt 1895 mit der Entdeckung der Röntgenstrahlen durch Conrad Wilhelm Röntgen. Schon ein Jahr später gingen in ganz Europa und den USA hunderte Röntgenapparate in Betrieb. 1897 wurde dann bereits in einer Wiener MedizinFachzeitschrift ein Artikel über die erste erfolgreiche Therapie mit Strahlen veröffentlicht. Jedoch wurde auch schnell deutlich, welche Nebenwirkungen wie Haarausfall und Hautentzündungen auftreten. Somit wurde 1904 von dem US-Amerikaner William Herbert Rollins ein erstes Buch über Strahlenfolgen veröffentlicht. Zwischen 1945 und 1960 würden dann fast überall die Röntgenröhren durch 60Co- und 137Cs-Quellen ersetzt. Ab 1970 standen dann Linearbeschleuniger für die Medizin zur Verfügung und ersetzten bald daraufhin alle Co- und Cs-Strahler. Zu Beginn des Jahres 2000 gingen dann auch in Deutschland die letzten Kobaltkanonen außer Betrieb. Die Linearbeschleuniger in der Medizin besitzen ein Vakuumrohr, welches ungefähr 1,5m lang ist, und produzieren Elektronen oder Photonen im Energiebereich von 3 - 20 MeV. Mit Hilfe der nebenstehenden Abbildung wird nun ein Linearbeschleuniger der Medizin erklärt. 8) Elektronenkanone: Erzeugung einer Elektronenwolke mittels Glühemission 7) Beschleunigungseinheit: Vakuumrohr, um die Elektronen mittels hochfrequenter Schwingung auf nahezu Lichtgeschwindigkeit zu beschleunigen 6) Fokus: Ort der Entstehung divergenter Strahlung 5) Strahlführungseinheit: Elektronenstrahl über B-Felder auf Fokus zu richten (Abweichung <2%) 4) Umlenkmagnet um Elektronen mittels Magnetfeld auf einen 2mm großen Fokus zu lenken Typischer Linearbeschleuniger in der Medizin 3) Filterkarussell mit Streufolien für homogenes Elektronenfeld, Filterstärken der entsprechenden Energie angepasst 2) Ionisationskammer zur Überwachung der eingestrahlten Dosis (Abweichung von 2% der berechneten Dosis führt zur Unterbrechung der Bestrahlung) 1) Asymmetrische Blenden zur Formung von flexiblen Feldgrößen für die Bestrahlung Dabei dienen die Streufolien zur Auffächerung des Elektronenstrahls und die Blenden zur Anpassung dieses Strahles auf die Größe des Tumors. Photonenstrahlen erhält man, indem man den hochenergetischen Elektronenstrahl auf ein wassergekühltes Wolfram-Target schickt, sodass Röntgenbremsstrahlung entsteht. Die Auffächerung des Strahls erfolgt mittels eines Ausgleichskörpers. 3. Protonen- und Schwerionentherapie Die geschichtliche Entwicklung der Protonen- und Schwerionentherapie setzt 1954 ein, als es die ersten Versuche gab, elektrisch betriebene Linearbeschleuniger für die Medizin zugänglich zu machen. In dem selben Jahr wurden in Berkeley bereits Augen, genauer Netzhauttumore bestrahlt. Das erste europäische Protonentherapie-Programm gab es zwischen 1957 und 1976 in Uppsala, Schweden. 1984 wurden dann erstmals Augenmelanome in Europa am Forschungszentrum der PSI mit der Anlage OPTIS durchgeführt. Heute besteht eine Zusammenarbeit zwischen dem PSI in der Schweiz und der Rinecker-Klinik in München, wo seit 2009 Bestrahlungen durchgeführt werden. Um 1995 entstand dann das erste Protonentherapiezentrum (Klinik) in Kalifornien, das Loma Linda University Medical Center. Gleichzeitig entstand in Chiba, Japan ein Schwerionentherapiezentrum. Seit 2000 wird am Forschungszentrum der GSI in Darmstadt ebenfalls mit Schwerionen bestrahlt. Ebenfalls seit 2000 werden an der GSI auch Bestrahlungen außerhalb der Augen durchgeführt. In den letzten 10 Jahren entstand dann eine Zusammenarbeit mit dem Heidelberger-IonenTherapiezentrum (HIT), wo ebenfalls seit 2009 Bestrahlungen durchgeführt werden. Grundriss des HIT Anlage in Heidelberg besteht aus einem Synchrotron und 3 Behandlungsplätzen: 2 Gantrys und ein Fixed-beam-Platz Fixed-Beam wird zur Bestrahlung von Augenund Hirntumoren genutzt Fixed-Beam Synchrotron kann durch Zyklotron (z.B. am PSI) ersetzt werden Anlage sowohl für Protonen als auch für schwere Ionen geeignet Typische Protonenenergien: Fixed-Beam: maximal 160 MeV Gantry: maximal 250 MeV Gantry am Hit schematische Darstellung System für Ionen- bzw. Protonenstrahl: rot: Dipolmagnete; grün: Quadrupolmagnete; beides zur Strahlführung grün: Strahlrohr 360° um Patienten drehbar Radius von ca. 6m Gesamtgewicht: 160t Bestrahlungstechniken Schwarzes Kästchen symbolisiert in etwa den Teil, den der Patient von der gesamten Anlage sieht. Strahlaufweitung am Beispiel von Loma Linda Autweitung der Intensität während der einzelnen Schritte Anpassung des Protonenstrahls auf die Tumorgröße, werden immer wieder neu hergestellt Schaffung unterschiedlich energetischer Protonen mithilfe des Kammfilters lila farbige Flächen entsprechen geschonten gesundem Gewebe Tiefen-Dosis-Änderung vom BraggPeak zum Spread out Bragg-Peak Bei dieser Bestrahlungstechnik wird der Tumor in kleine Volumina eingeteilt und anschließend scheibchenweise bestrahlt. Somit ist auch klar, dass immer neue Kompensatoren gebraucht werden. Spot-Scanning Das Spot-Scanning wurde in den 90er Jahren den 20. Jahrhunderts an der GSI in Darmstadt entwickelt. Bei dieser Technik wird der Teilchenstrahl mittels schnell steuerbarer Magnetfelder gelenkt. Die Eindringtiefe der Teilchen wird über die Energie der Teilchen gesteuert. Bei dieser Methode wird das Tumorvolumen in viele Schichten gleicher Tiefe zerlegt, die dann einzeln zeilenweise abgetastet werden. Der Strahl bleibt dabei solange an einem Punkt in der Zeile, bis die berechnete Solldosis erreicht ist. Somit ist eine präzise 3-dimensionale Abtastung möglich. Des weiteren erfolgt bei dieser Technik eine geringe Strahlaufweitung. 4. Vergleich der Therapiearten Vergleicht man die bis hierhin behandelten Strahlungsarten, so stellt man fest, dass Protonen, ganz im Gegensatz zu den Photonen, eine höhere Dosis direkt im Tumor deponieren und das umliegende Gewebe stärker schonen. Aufgrund des exponentiellen Abklangs der Photonen wird ein größerer Teil des umliegenden gesunden Gewebes mit bestrahlt. Die schweren Ionen haben auch einige Vorteile gegenüber den Photonen. Gegenüber den Photonen weisen beispielsweise 12C-Ionen eine geringere seitliche Streuung auf. Desweiteren sind die Schäden besonders effektiv am Ende ihres zurückgelegten Weges. Somit ist auch klar, dass man die unterschiedlichen Teilchenstrahlen auch bei unterschiedlichen Tumoren anwendet. Desweiter ist (hoffentlich) jedem bewusst, dass es noch zwei andere medizinische Arten der Krebsbehandlung gibt: Operation und Chemotherapie. Bei der Behandlung werden in den meisten Fällen immer mindesten zwei Therapiearten miteinander kombiniert. • • • • • Elektronen zur Behandlung oberflächlich gelegener Tumore Photonen zur Behandlung tiefer gelegener Tumore mit unscharfen Grenzen Protonen und Schwerionen zur Behandlung von tiefer gelegenen Tumoren mit scharfen Grenzen Chemotherapie zur Behandlung von Metastasen Operation 5. Literaturverzeichnis • • • • • http://www.strahlentherapie-erfurt.de/physik.html http://de.wikipedia.org/wiki/Strahlantherapie http://www.krebsinformationsdienst.de http://www.psi.ch http://lomalindahealth.org • Physikalische und Strahlenbiologische Messungen zur Strahlentherapie mit Protonen, Miriam Fritsch, Diplomarbeit, Universität Erlangen, 1996 Spot-Scanning mit Protonen: Experimentelle Resultate und Therapieplanung, Stefan Georg Scheib, Dissertation, Eidgenössischen Technischen Hochschule Zürich, 1993 Informationsbroschüren des PSI und der GSI zum Thema Protonentherapie o Ionenstrahlen im Kampf gegen Krebs: Tumortherapie an der GSI, März 2006 o Errichtung einer klinischen Therapieanlage zur Krebsbehandlung mit Ionenstrahlen, Radiologische Universitätsklinik Heidelberg, dkfz, GSI, September 1998 o Die Protonentherapie am Paul Scherer Institut, Oktober 2008 • •