Lewis – Modell
Werbung

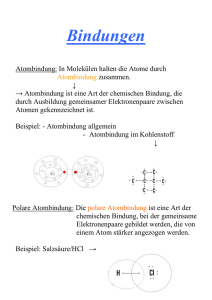
Chemische Bindungen Atombindung Das Lewis – Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile Anordnung der Elektronen (Edelgaskonfiguration) zu erreichen. Diese Art der Bindung wird auch als Elektronenpaarbindung oder kovalente Bindung bezeichnet. Kovalenz (lat), zusammenwertig: gemeinsam an der Bindung beteiligte Elektronenpaare. 1 Chemische Bindungen Atombindung Das Lewis – Modell der kovalenten Bindung Lewis – Schreibweise Chemisches Symbol und Valenzelektronen: einzelne (ungepaarte) Valenzelektronen werden durch einen Punkt symbolisiert (einfach besetztes Orbital), Elektronenpaare mit einem Doppelpunkt oder einem Strich (doppelt besetztes Orbital) H Be B C N O F He N O F He Die Zahl der ungepaarten Elektronen (Radikale) gibt an, wieviele Bindungen ein Atom bei der Bildung eines Atoms normalerweise eingeht. 2 Chemische Bindungen Atombindung Das Lewis – Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital zwischen den Atomen Beispiel: F + F F F Valenzstrich Alle Atome sind bestrebt, die Edelgaskonfiguration in der äußersten Schale (Valenzschale) zu erreichen. D. h. diese Schale mit 8 Elektronen zu besetzten. Oktettregel (Ausnahme Wasserstoff) Die bindenden Valenzelektronen werden beiden Atomen zugerechnet. 3 Chemische Bindungen Atombindung Das Lewis – Modell der kovalenten Bindung Bildung von Molekülen (Mehrfachbindungen) Es besteht die Möglichkeit, dass sich zwischen zwei Atomen mehr als ein gemeinsames Elektronenpaar ausbildet. Man spricht dann von Zweifach- oder Dreifachbindungen O + + O O C O N + N C N N 4 Chemische Bindungen Atombindung Das Lewis – Modell der kovalenten Bindung Lewis – Formeln von Molekülen Cl O H H Wassermolekül, 8 Außenelektronen Cl C Tetrachlormethan, 32 Außenelektronen N Cl N Stickstoffmolekül Cl Ethenmolekül Sauerstoffmolekül O O H H C H C H 5 Chemische Bindungen Atombindung Das Lewis – Modell der kovalenten Bindung Mesomere Grenzstrukturen Es gibt Molekülstrukturen, die sich durch die Lewis-Formeln nicht korrekt darstellen lassen. So ergeben sich mehrer Möglichkeiten wobei die tatsächliche Struktur irgendwo dazwischen liegt. Man spricht dann von mesomeren Grenzstrukturen. Beispiele sind Distickstoffmonoxid oder das Carbonat-Ion. N + Θ O N O Θ N + O N O 6 Chemische Bindungen Atombindung Probleme der Theorie von Lewis •Keine Aussage wie negative Elektronen den Zusammenhalt zwischen zwei Atomen bewirken. •Keine Aussage über das Verhalten von Nebengruppenelementen da diese mehr als 8 Valenzelektronen haben. •Kein Hinweis auf räumliche Strukturen der Moleküle. 7