Wasser – Der Dipolcharakter Der Dipolcharakter am Beispiel
Werbung

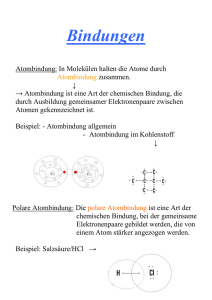
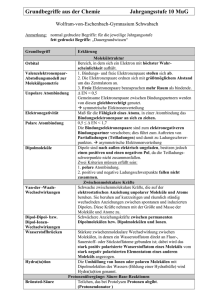
Wasser – Der Dipolcharakter Der Dipolcharakter am Beispiel Wasser Das Wassermolekül ist ein Dipolmolekül. Von einem Dipolmolekül spricht man, wenn es innerhalb eines Moleküls eine Verschiebung des negativen, bindenden Elektronenpaars hin zu einem Bindungspartners des Moleküls gibt. Durch diese Verschiebung erhält ein Bindungspartner mehr negative, der andere weniger negative Ladungsdichte. Es bilden sich Pole aus, die mit δ+ und δ- gekennzeichnet werden. Aufgrund dieser Dipoleigenschaften üben Dipolmoleküle anziehende Kräfte aufeinander aus. Die positiven Bereiche des einen Moleküls ziehen die negativen Bereiche des anderen Moleküls an. So ist es möglich einen feinen Wasserstrahl durch ein elektrisches Feld abzulenken. Durch den Dipolcharakter ergeben sich weitere Eigenschaften wie die Anomalie des Wassers. Um entscheiden zu können, ob es sich um ein Dipolmolekül handelt kann die Elektronegativität herangezogen werden. Sie gibt an, wie stark ein Atomkern Elektronenpaare in einer Elektronenpaarbindung (Atombindung) an sich zu ziehen vermag. Je elektronegativer ein Element ist, desto stärker ist diese Fähigkeit ausgeprägt. Dipolmoleküle weisen einen besonderen Bindungstyp auf - die polare Atombindung. Sie ist eine von vier Bindungsformen. Neben der polaren Atombindung gibt es die unpolare Atombindung, die Ionenbindung und die Metallbindung. Die ersten drei können ebenfalls mit Hilfe der Elektronegativität voneinander unterschieden werden. Hierzu betrachtet man die Elektronegativitätsdifferenz (ΔEN). Liegt ΔEN bei null so spricht man von einer unpolaren Atombindung. Beispiele hierfür wären das Wasserstoff-Molekül, das Sauerstoff-Molekül oder das Chlor-Molekül. Wenn ΔEN kleiner als 1,7 ist, liegt eine polare Atombindung vor, wie sie im WasserMolekül oder im Chlorwasserstoff-Molekül auftritt. Ist der ΔEN-Wert größer als 1,7 befindet sich das bindende Elektronenpaar ganz beim Partner mit der größeren Elektronegativität. Die zuletzt genannte Metallbindung tritt nur in Metallen auf. Sie ist keine Elektronenpaarbindung. Im Metallgitter liegen die positiven Atomrümpfe der Metallatome aneinander und die äußeren Elektronen bewegen sich frei im so genannten Elektronengas zwischen den Atomrümpfen. Dies ist auch die Ursache für die elektrische Leitfähigkeit der Metalle. Aufgabe: Wasserstrahl Fülle den Lückentext alleine aus und teste dadurch Dein Verständnis und Wissen zur Thematik Dipolcharakter! Tausche Dich anschließend in Deiner Gruppe aus! Elektrisch geladener Kennzeichne im Wasserstrahl und Kunststoffstab am Kunststoffstab die Ladungsverteilung mit + und - !