LE3 EPB Schalenmodell UEbersicht
Werbung

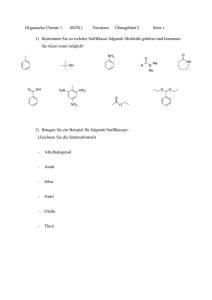
Darstellung der Elektronenpaarbindung im Schalen-Modell am Beispiel der Synthese des Wassers „Jedes Element ist bestrebt bei einer chemischen Reaktion die äußere Schale mit 8 Elektronen (Oktettregel) voll zu besetzen.“ Bildung eines H2 Moleküls Wasserstoffatom Heliumatom 1+ 2+ Bildung eines O2 Moleküls Wasserstoffmolekül 1+ Sauerstoffatom 1+ Neonatom 8+ Sauerstoffmolekül 8+ 8+ 10+ gemeinsames Elektronenpaar (Einfachbindung) zwei gemeinsame Elektronenpaare (Doppelbindung) Die Atome erreichen 8 Elektronen in der Außenschale (Edelgaskonfiguration/Oktettregel), indem sie sich Elektronen teilen. Dies erreichen sie durch die Durchdringung ihrer Elektronenhüllen. Auf diese Weise entsehen gemeinsame Elektronenpaare. Die Verbindung, die auf diese Weise zwischen den Atomen entsteht nennt man Elektronenpaarbindung. Aus einzelnen Atomen werden Moleküle. Moleküle bestehen aus Verbindungen von zwei oder mehr Atomen. „Bei einer chemischen Reaktion ist die Masse der Ausgangsstoffe (Edukte) gleich der Masse der Reaktionsprodukte.“ 1+ 1+ 1+ 1+ 1+ 8+ Vorteil: Die Strukturierung der Atomhülle ermöglicht die Herleitung der Oktettregel. 8+ 1+ 8+ 1+ 1+ 8+ Nachteil: Direkt benachbarte Elektronen können nicht begründet werden. Die SuS können selbst keine räumliche Struktur ableiten.






![Kugelwolkenmodell (KWM) der Atomhülle [c/ A. Schill]](http://s1.studylibde.com/store/data/006026842_2-f7ef645afd4f19b760ad28335b8d24ad-300x300.png)


