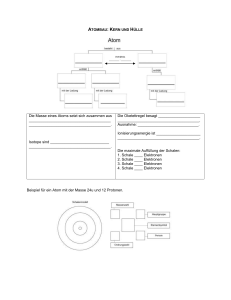
Was versteht man unter der Oktettregel? Oktettregel
Werbung

Was versteht man unter der Oktettregel? Wie wir schon wissen, besitzt ein Atom genauso viele Außenhüllen, wie die Anzahl der Periode in der es steht. (siehe Periodensystem) Die Anzahl der Elektronen auf der äußersten Hülle leitet sich von der Hauptgruppe des Atoms ab. Iod befindet sich zum Beispiel in der 7ten Hauptgruppe und in der 5ten Periode, was bedeutet, dass auf der äußersten Schale sieben Elektronen liegen. In die erste Schale des Atoms passen höchstens zwei Elektronen, in die restlichen Schalen jeweils acht. Oktettregel Erfüllt ein Atom die Voraussetzung acht Elektronen auf der äußersten Schale zu besitzen (wie ein Halogen), so ist es besonders stabil und hat die Oktettregel erfüllt. (Oktett=acht) Hat ein Atom nur eine Schale, so erfüllt es die Oktettregel schon mit 2 Elektronen in der Hülle. siehe Helium Alle Atome in der 8ten Hauptgruppe (Halogene) erfüllen die Oktettregel bereits, da sie schon 8 Außenelektronen haben, deshalb gehen sie weder eine Ionenpaarbindung, noch eine Elektronenpaarbindung ein. Der Wunsch eines jeden Atoms die Oktettregel zu erfüllen, um so besonders stabil zu sein, ist größer als der, den Ausgleich zwischen positiven Protonen im Kern und negativen Elektronen in der Hülle zu erhalten. Wäre das nicht so, würde eine Ionenbindung nicht möglich sein, da kein Austausch von Elektronen eines Metalls und eines Nichtmetalls stattfinden würde. Beispiel Radium und Dauerstoff haben die Oktettregel erfüllt, da Sauerstoff 2 Elektronen aufnimmt und Radium 2 Elektronen abgibt und so die äußerste Schale „leer“ und wegfällt und die nächste Schale wiederum 8 Außenelektronen enthällt. S auerstoff und Radium N ic htmetall und Metall O + Ra RA + O RA + O 2+ 2