Wenige Milliliter Blut genügen
Werbung

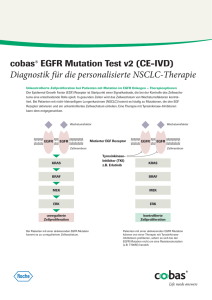
Produkte & Services | Leichterer Zugang zur zielgerichteten Therapie | Diagnostik im Dialog • Ausgabe 49 • 04/2016 Leichterer Zugang zur zielgerichteten Therapie Roche Wenige Milliliter Blut genügen Der Gesundheitszustand von Lungenkrebspatienten im fortgeschrittenen Stadium ist oft so kritisch, dass eine Lungenbiopsie nicht möglich oder das entnommene Gewebe nicht ausreichend für eine vollständige Diagnostik ist. Die molekularpathologische Differenzialdiagnose des Tumors ist aber Voraussetzung, um zielgerichtete Therapieoptionen hinreichend auszuloten. Der neue cobas® EGFR Mutation Test v2 ist eine schnelle, standardisierte und zuverlässige Methode, um therapierelevante Mutationen aus dem Blutplasma des Patienten zu bestimmen. Dieses nicht-invasive Verfahren ermöglicht somit auch schwerkranken Lungenkrebspatienten den Zugang zur individuell angepassten Therapie. Bei einem Teil der Patienten mit nichtkleinzelligem Lungenkarzinom (NSCLC) sind für das übermäßige und ungebremste Zellwachstum Mutationen verantwortlich, die den Epidermalen WachstumsfaktorRezeptor (EGFR) auf der Oberfläche von Tumorzellen aktivieren. Solche Patienten profitieren vom zielgerichteten molekularen Wirkmechanismus der TyrosinkinaseInhibitoren (TKI), z. B. Erlotinib. Diese binden an den EGF-Rezeptor, inaktivieren ihn, verhindern die weitere Proliferation und können auf diese Weise die Lebenszeit von Patienten verlängern.1 Der Mutationsnachweis erfolgt im Normalfall an den Biopsaten, die im Rahmen der Primärdiagnostik gewonnen werden. Die oft schlechte körperliche Verfassung von Patienten in fortgeschrittenen Krankheitsstadien jedoch erschwert bzw. verhindert diesen invasiven Eingriff. Bei einem von fünf Patienten mit NSCLC muss aufgrund von fehlendem, nicht ausreichendem oder qualitativ ungeeignetem Probenmaterial auf eine molekulargenetische EGFR-Testung verzichtet werden.2,3 Zuverlässige Plasmatestung Solide Tumoren setzen kontinuierlich Zellen und Zellbestandteile frei, auch Fragmente der Tumor-DNA zirkulieren in der Blutbahn. Schon wenige Milliliter Blut reichen aus, um Tumor-DNA für einen Mutationsnachweis mit hochsensitiven Methoden zu isolieren.4 Diese als „Liquid Biopsy“ (Flüssigbiopsie) bezeichnete Plasmatestung ist ein minimalinvasives Verfahren mit einfacher Probengewinnung. Sinnvolle Anwendungsbereiche sind molekularpathologische Mutationsana- Die drei Bestandteile für die EGFR-Mutationstestung aus Plasma: cobas® cfDNA Sample Preparation Kit + cobas® EGFR Mutation Tests v2 + cobas z 480 System 32 Diagnostik im Dialog • Ausgabe 49 • 04/2016 | Leichterer Zugang zur zielgerichteten Therapie | Produkte & Services fotolia/WavebreakmediaMicro Bei 20 % der NSCLC-Patienten ist die Entnahme einer geeigneten Gewebeprobe zur EGFR-Testung nicht möglich. lysen bei Patienten, bei denen kein oder nicht ausreichendes Biopsiematerial zugänglich ist. Außerdem sind Verlaufskontrollen möglich, die perspektivisch zum Therapiemonitoring eingesetzt werden können.4 Der Anteil zellfreier Tumor-DNA (cfDNA) im Blutplasma ist im Vergleich zu Normalgewebe-DNA mit maximal 10 % sehr gering.5 Eine zuverlässige Diagnostik ist daher auf die präzise, qualitätsgesicherte DNA-Isolation und Amplifikation angewiesen. Entsprechend diesen Anforderungen wurde das cobas® cfDNA Sample Preparation Kit speziell für die cfDNA-Isolation aus Plasmaproben entwickelt. Der cobas® EGFR Mutation Test ist seit Oktober 2015 in einer zweiten Version verfügbar. Neben Gewebe kann nun auch Blutplasma als Ausgangsmaterial für die EGFRTestung eingesetzt werden. Abgesehen von der DNA-Isolation werden Gewebe- und Plasmaproben identisch behandelt. Die parallele Bearbeitung beider Ausgangmaterialien ist daher auf einer PCR-Platte mit Hilfe des cobas z 480 Systems möglich. Der cobas® EGFR Mutation Test erkennt 42 Mutationen in den Exons 18 bis 21 des EGFR-Gens. Das entspricht über 99 % aller klinisch relevanten Mutationen. Resistenzmutationen wie T790M werden mit der ARMS-PCR-Technologie selbst bei geringen Mengen im Hintergrund von Wildtyp-DNA zuverlässig detektiert. Durch das Software-Upgrade wird bei der Plasmatestung zudem ein neuer Parameter, der sogenannte Semiquantitative Index (SQI) berechnet. Er gibt den relativen Anteil der 42 EGFR-Mutationen wider. Bei serieller Testung eines Patienten kann der SQI Aufschluss über die EGFR-Mutationslast im Krankheitsverlauf geben. Wie bereits bei den cobas® Mutation Tests für BRAF und KRAS ist auch beim cobas® EGFR Mutation Test der gesamte Workflow von der Probenvorbereitung bis zum automatisierten Ergebnis-Reporting CE-IVD zertifiziert. Der cobas® EGFR Mutation Test v2 verbindet die hohen Ansprüche qualitätsgesicherter Testung für die klinische Anwendung mit wegweisenden Technologien, die neue therapeutische Optionen eröffnen. Durch die minimalinvasive Probengewinnung und die Flexibilität in Bezug auf das Ausgangsmaterial eignet sich der Test für die initiale Diagnose genauso wie für therapiebegleitende Verlaufskontrollen. Der Assay ist damit eine wichtige Unterstützung für die optimierte Therapieentscheidung. Literatur 1Shepherd FA et al: N Engl J Med (2005); 353(2):123–32 2Spicer J et al: 2015 European Lung Cancer Conference (ELCC): Abstract LBA2_PR. Vorgestellt am 17. April 2015 3Davenport L: Medscape Medical News, 17. April 2015 4Packungsbeilage cobas cfDNA Sample Preparation Kit 5Diehl F et al: PNAS (2005); 102(45):16368-73 Dr. Katja Janssen Pharma Liaison Managerin Tissue Diagnostics 0173 586-1365 katja.janssen@ roche.com 33