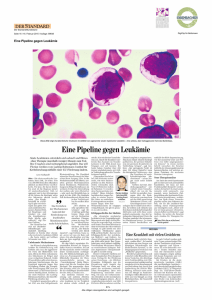
oder akute
Werbung

Kompetenznetz "Akute und chronische Leukämien" KURZPROTOKOLL AMLSG 12-09 Öffentlicher Titel Phase-II Studie zur Induktionstherapie mit Azacitidin in Kombination mit der Induktionstherapie mit Idarubicin und Etoposid sowie Erhaltungstherapie mit Azacitidin Wissenschaftl. Titel Randomisierte Phase-II Studie zur Induktionstherapie mit sequentieller oder paralleler Gabe von Azacitidin in Kombination mit der Induktionstherapie mit Idarubicin und Etoposid sowie Erhaltungstherapie mit Azacitidin. Kurztitel AMLSG 12-09 Studiennummer KN/ELN LN_AMLSGU_2009_321 Studiengruppe AMLSG Ulm Studienart randomisiert, open-label, multizentrisch Studienphase Phase II Erkrankung Akute myeloische Leukämie(AML) AML alle ausser FAB M3 Leukämiestadium de novo/non-treated Medikamente - 5-Azacitidin - Etoposid - Cytarabin - Indarubicin - Bewertung der Wirksamkeit der intensiven Induktionstherapie mit sequentieller oder paralleler Applikation von Azacitidin bei erwachsenen Patienten mit akuter myeloischer Leukämie (AML) basierend auf der kompletten Remissionsrate - Bewertung der Wirksamkeit der intensiven Induktionstherapie mit sequentieller oder paralleler Applikation von Azacitidin bei erwachsenen Patienten mit AML basierend auf dem Ereignis-freien-, Rezidiv-freien- und Gesamtüberleben - Bewertung der Wirksamkeit der Erhaltungstherapie mit Azacitidin bei Patienten mit kompletter Remission basierend auf dem Rezidiv-freien- und Gesamtüberleben - Primary Efficacy Endpoint (Hauptzielkriterium) - Event-free survival (EFS) - Relapse-free Survival (RFS), cumulative incidence of relapse (CIR) or death in CR (CID) - Overall survival (OS) - Days in hospital during each cycle and during the whole intervention - 1. Neu diagnostizierte AML gemäß den WHO 2008 Kriterien oder AML verwandte myeloische Vorläufer Neoplasien nach WHO 2008 oder Akute Leukämie mit unklarer Linienzugehörigkeit nach WHO 2008 (1-3, nicht geeignet für Genotyp-spezifische Therapiekonzepte der AMLSG) - 2. Patient ist geeignet für eine intensive Chemotherapie - 3. WHO Performance Status <=2 - 4. Alter >=18 Jahre; es besteht keine obere Altersgrenze - 5. Keine vorangehende, die Leukämie betreffende Chemotherapie, ausgeschlossen Hydroxyurea bis zu 5 Tage vor Therapiestart (während der diagnostischen Screening Phase) - 6. Keine schwangere und keine stillende Patienten: Frauen im fortpflanzungsfähigen Alter müssen einen negativen Schwangerschaftstest mit einer Sensitivität von mind. 25 mlU/mL (im Serum oder Urin) innerhalb 72 h vor der Registrierung aufweisen. Ziele Haupt- und Nebenzielkriterien Einschlusskriterien © Informationszentrum im Kompetenznetz Leukämien | Deutsches Leukämie Studienregister Ohne Gewähr für Richtigkeit oder Vollständigkeit, www.kompetenznetz-leukaemie.de | www.studienregister-online.de Stand: 20.10.2010; Seite 1 von 3 Kompetenznetz "Akute und chronische Leukämien" KURZPROTOKOLL AMLSG 12-09 Ausschlusskriterien - 7. Frauen im fortpflanzungsfähigen Alter und Männer müssen Ihr Einverständnis geben, dass Sie während Therapie und bis ein Jahr nach der letzten Chemotherapiegabe eine Schwangerschaft vermeiden oder keine Nachkommen zeugen. Frauen im fortpflanzungsfähigen Alter müssen deshalb während Therapiebeginn und bis 12 Monate nach Therapieende zwei effektive Verhütungsmethoden zur gleichen Zeit anwenden. Das bedeutet, es muss eine sehr sichere Verhütungsmethode wie z.B. Intrauterinpessar, hormonelle Kontrolle (Injektion, Implantat, Spirale) oder Zustand nach Eileiterdurchtrennung mit einer zweiten Verhütungsmethode wie z.B. Kondom, Diaphragma oder Portiokappe kombiniert werden. Frauen nach Gebärmutterentfernung oder ausgebliebener Regelblutung über 24 aufeinander folgende Monate benötigen keinen Schwangerschaftstest oder Verhütungsmethode. - 8. Männer müssen ihr Einverständnis geben, dass Sie keine Nachkommen zeugen und müssen bei Geschlechtsverkehr mit einer Frau im gebärfähigen Alter ein Kondom benutzen, selbst wenn eine erfolgreiche Samenleiterdurchtrennung stattgefunden hat - 9. Unterschriebene Informed Consent Form. - 1. AML mit folgenden rekurrenten genetischen Veränderungen (gemäß WHO Klassifikation 2008) - AML mit t(8;21)(q22;q22); RUNX1-RUNX1T1 - AML mit inv(16)(p13.1q22) oder t(16;16)(p13.1;q22); CBFB-MYH11 - AML mit t(15;17)(q22;q12); PML-RARA (oder variante Translokationen mit anderen RARA-Genfusionen) - 2. AML mit Mutationen des NPM1 Gens - 3. AML mit Mutationen des FLT3 Gens - 4. Allgemeinzustand WHO > 2 - 5. Patienten mit Ejektionsfraktion < 50% nachgewiesen durch MUGA oder ECHO (innerhalb der letzten 14 Tage vor Tag 1) - 6. Organinsuffizienz (Kreatinin > 1.5x obere Norm im Serum; Bilirubin, AST oder ALP > 2.5x obere Norm im Serum, nicht der AML zuzuordnen; Herzinsuffizienz NYHA III/IV; schwere obstruktive oder restriktive Ventilationsstörung - 7. Unkontrollierte Infektion - 8. Schwere neurologische oder psychiatrische Störung interferierend mit der Fähigkeit einen Informed Consent zu geben - 9. Patienten mit einer aktiven zweiten Neoplasie; ausgenommen sind aktive Hauttumoren vom Nicht-Melanom-Typ. Patienten nach Abschluss der Therapie für die zweite Neoplasie und einer kleiner als 30 prozentigen Rezidivwahrscheinlichkeit sind für das Protokoll geeignet. - 10. Bekannte HIV Infektion - 11. Blutungsstörung unabhängig von der Leukämie - 12. Kein Einverständnis für die Registrierung, Lagerung und Handhabung der personenbezogenen Krankheitsdaten und des Verlaufes sowie Information des Hausarztes über die Studienteilnahme - 13. Kein Einverständnis für das Biobanking im Rahmen der Studie Alter >= 18 Jahre Status Aktiv Beginn der Rekrutierung 16.11.2009 Rekrutierende Länder Österreich Deutschland © Informationszentrum im Kompetenznetz Leukämien | Deutsches Leukämie Studienregister Ohne Gewähr für Richtigkeit oder Vollständigkeit, www.kompetenznetz-leukaemie.de | www.studienregister-online.de Stand: 20.10.2010; Seite 2 von 3 Kompetenznetz "Akute und chronische Leukämien" KURZPROTOKOLL AMLSG 12-09 Fallzahl 336 Studienleiter/in Schlenk, Dr. med., Richard Universitätsklinikum Ulm III. Medizinische Klinik Albert-Einstein-Allee 23 89081Ulm Tel: +49 (0)731 500-45900 Fax: +49 (0)731 500-45905 Email: [email protected] Kontaktperson f. wissenschaftl. Anfragen (WHO) Schlenk, Dr. med., Richard (Studienleiter) Universitätsklinikum Ulm III. Medizinische Klinik Albert-Einstein-Allee 23 89081Ulm Tel: +49 (0)731 500-45900 Fax: +49 (0)731 500-45905 Email: [email protected] Ansprechpartner Studienzentrale Späth, Daniele Studienzentrale Universitätsklinikum Ulm Labore / Zentrale Diagnostik Zentrale Diagnostik Zytogenetisches und Molekulargenetisches Labor der Med.Klinik III, Universität Ulm Institut für Zell und Molekularpathologie Medizinische Hochschule Hannover Labor für Leukämieforschung der Medizinischen Hochschule Hannover Sponsoren Ulm University Hospital (Hauptsponsor) Förderer Celgene © Informationszentrum im Kompetenznetz Leukämien | Deutsches Leukämie Studienregister Ohne Gewähr für Richtigkeit oder Vollständigkeit, www.kompetenznetz-leukaemie.de | www.studienregister-online.de Stand: 20.10.2010; Seite 3 von 3