Physikalische Umwandlungen reiner Stoffe
Werbung

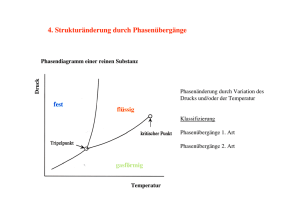
Physikalische Umwandlungen reiner Stoffe Lernziele: Phasendiagramme, die Stabilität von Phasen Phasengrenzen, typische Phasendiagramme Phasenübergänge, die TD Gleichgewichtkriterien Die Abhängigkeit der Stabilität von den Bedingungen Die Lage der Phasengrenzlinien Die Klassifikation der Phasenübergänge nach Ehrenfest P. Atkins, J. de Paula, “Physikalische Chemie”, Wiley-VCH Verlag GmbH& Co, 2013, 4.1, 4.2. G. Wedler, H-J. Freund, „Lehrbuch der Physikalischen Chemie“, Wiley-VCH Verlag GmbH& Co, 2013. Physikalische Umwandlungen reiner Stoffe Beispiele: • Verdampfen einer Flüssigkeit • Schmelzen von Eis • Umwandlung von Graphit ↓ Diamant Phasenübergänge reiner Stoffe → verlaufen ohne Aenderung der chemischen Zusammensetzung des Systems Freiwillige Zustandsänderung bei T = ct und p = ct → immer in Richtung kleiner G des Systems. 1. Phasendiagrame Phase – Materie mit homogener, chemischer Zusammensetzung und räumlich konstantem, physikalischem Zustand. Stoff → verschiedene feste Phasen Beispiel: Weisser & Schwarzer Phosphor (Allotrop) Phasenübergang – spontane Umwandlung einer Phase in eine andere Phase (gegebenen p und charakteristischen T) Beispiel: p = 1 bar → T = 0○C – Eis: die stabilste Phase von Wasser T > 0○C – Flüssigkeit: die stabilste Phase von Wasser T > 0○C → G ↓ wenn Eis schmilzt. T < 0○C → G ↓ : flüssiges Wasser gefriert. 1.a Die Stabilität von Phasen Ttrans = Phasenübergangstemperatur wenn die Gleichgewicht sich befinden (bei gegebenen Druck). beide Phasen im G erreicht ein Minimum. Phasenübergänge: Phasenübergänge mit hohen Geschwindigkeiten (Beispiel: in Gasen und Flüsigkeiten) Phasenübergänge mit geringen Geschwindigkeiten (Beispiel: GGraphit < GDiamant bei normaler T und normalen p). Metastabile Phasen 1.b Phasengrenzen Phasendiagram = graphische Darstellung der p- und Temperaturbereiche, in denen die einzelnen Phasen thermodynamisch stabil sind. Phasengrenzlinien = Wertpaare (p, T), bei denen zwei Phasen miteinander im Gleichgewicht sind. p Eine verallgemeinerte Darstellung Flüssigkeit Feststoff Dampfdruck Sublimationsdruck Siedetemperatur Tripelpunkt Gas Kritischer Punkt Beispiel: überkritisches CO2 Kritischer Punkt T Phasengrenzen Dampfdruck = der Druck der Gasphase, die sich mit der kondensierten Phase in Gleichgewicht befindet. Die Phasengrenzlinien des Gleichgewichts Flüssigkeit/Gas Die Phasengrenzlinien des Gleichgewichts Feststoff/Gas T Dampfdruck (immer mehr Moleküle besitzen genügend Energie, um die zwischenmolekularen Anziehungskräfte zu ihren Nachbarn zu überwinden). Kritischer Punkt und Siedepunkt A. Wenn die Flüssigkeit in einem offenen Gefäss erhitzt wird Sieden = die Verdampfung des gesamten, flüssigen Körpers bei eine Temperatur wo der Dampfdruck mit dem äusseren Druck übereinstimmt. Siedetemperatur (Siedepunkt) = die T bei dem der Dampfdruck der Flüssigkeit = pext z. B. Wasser TS = 99.6○ C (Standardsiedepunkt) B. Wenn die Flüssigkeit in einem geschlossenen Gefäss erhitzt wird, findet der Siedevorgang nicht statt. Der Dampfdruck und die Dichte des Dampfs nehmen mit T kontinuierlich zu. Kritischer Punkt und Siedepunkt Die Flüssigkeit dehnt sich aus, wodurch ihre Dichte geringfügig abnimmt. Tkrit : ist die Dichte des Dampfs gleich der Dichte der flüssigen Phase Die Phasengrenzfläche verschwindet Dampfdruck). T ≥ Tkrit homogene Phase T < Tkrit Flüssigkeit/Gas Phasen T > Tkrit (kritischer Grenzflächen existieren nicht mehr. z.B. Üeberkritisches Kohlendioxid Schmelzpunkt und Tripelpunkt Schmelztemperatur (Schmelz Punkt) = die T bei der sich flüssige und feste Phase miteinander im Gleichgewicht befinden. Schmelz- und Erstarrungsvorgang laufen bei derselben Temperatur ab : TSm = TErst Standardschmelztemperatur, TSm = Schmelztemperatur bei 1 bar. Tripelpunkt = bei bestimmten Werten (p, T), können 3 Phasen eines Stoffes existieren Typische Phasendiagramme CO2 Das experimentell bestimmte Phasendiagramm von Kohlendioxid. pTriple ist grösser Atmosphärendruck als der Unter normalen Bedingungen existiert kein flüssiges CO2. Zur Erzeugung der flüssigen Phase muss ein Druck von mindestens 0.52 MPa ausgeübt werden . Typische Phasendiagramme He zeigt bei tiefen Temperaturen ein ungewöhnliches Verhalten: ein Gleichgewicht zwischen fester und Gasphase existiert nicht. He Atome schwingen durch ihre geringe Masse mit sehr grosser Amplitude > ein Festkörper wäre nicht stabil ! Festes He : nur wenn man einen Druck anlegt. Man muss zwischen den Isotopen 3He und 4He unterscheiden: - Reines 4He : zwei flüssige Phasen (Flüssigkeit, und Suprafluid) - Phasenübergang zwischen zwei flüssigen Phasen > λ-linie als Grenzphase - Reines 3He hat auch eine suprafluide Phase Typische Phasendiagramme Kohlenstoff kommt in mehreren allotropen festen Phasen vor. Feststoffe auf Kohlenstoff-Basis: Diamant und Graphit Bei p = 1 bar und Temperaturen unterhalb 4000 K ist Graphit die thermodynamisch stabile Phase des Kohlenstoff. Diamant bei Raumtemperatur ist stabil und wandelt sich erst oberhalb 500 °C merklich in Graphit um. Typische Phasendiagramme Wasser : Die Wassermoleküle haben im hexagonalen Gitter einen grösseren Abstand zueinander als im flüssigen, ungeordneten Zustand Wasser hat mehr feste Phasen als jeder andere Stoff: 16 kristalline, und fünf amorphe Phase. Wasser hat als kritische Punkt: bei 647K ! Wasser ermöglicht Unterkühlung: Auch unter natürlichen Bedingungen kann es bis −23 °C flüssig bleiben. 2. Phasenübergänge 2.1. Das TD Gleichgewichtskriterium Das chemische Potenzial = die molare Freie Enthalpie Gm für reine Stoffe. µ = ein Mass für die Möglichkeit einer Zustandsänderung der betreffenden Substanz in einem System. Eine Schlussfolgerung aus dem 2. Hauptsatz der TD → Im Gleichgewicht ist das chemische Potenzial eines Stoffs überall in der Probe gleich gross, unabhängig davon, wie viele Phasen koexistieren. µ Das TD Gleichgewichtskriterium Beispiel: ein System bei dem: - µ1 an einem Ort 1 + µ2 an einem anderen Ort 2 → µ1 ≠ µ2 - Eine Stoffmenge dn von 1 → 2 transportiert Die Freie Enthalpie: µ1dn ↓ + µ2dn ↑ Die Gesamtänderung: dG = (µ2 - µ1)dn Gleichgewicht ⇒ G = Konstant ⇒ µ1 = µ2 Die Phasenübergangstemperatur Ttrans = Tµ1 = µ2 2.2. Die Abhängigkeit der Stabilität von den Bedingungen T ↓ + p ↑ : die feste Phase eines Stoffs ⇒ µ ↓ (der niedrigste Wert) ↓ die stabile Phase µ = f(T) ⇒ bei T ↑ → µ einer anderen Phase (festen / flüssigen) sinkt unter den Wert für den Festkörper ab Phasenübergang (sofern keine kinetische Hemmung vorliegt) a. Die Temperaturabhängigkeit der Stabilität von Phasen Die Freie Enthalpie G = f(T,p) µ reiner Stoff → G ∂µ ( ) p = −Sm ∂T ∂µ ( )p < 0 ∂T Sm > 0 Sm(g) > Sm(l) Sm(l) > Sm(s) b. Die Druckabhängigkeit des Schmelzpunkts TSm ↑ wenn p ↑ bei den meisten Stoffen ∂G ( )T = V ∂p µ reiner Stoff → Gm Vm > 0 ∂µ ( )T = Vm ∂p ( ∂µ )T > 0 ∂p Vm(l) > Vm(s) ⇒ steigt µ(s) weniger als µ(l) ⇒ TE↑ Die Abhängigkeit der Stabilität von den Bedingungen Wasser: Vm(l) < Vm(s) ⇒ steigt µ(s) stärker als µ(l) Beispiel: wie ändert sich µ von Wasser und Eis (0○C): p1 = 0,1 MPa → p2 = 0,2 MPa ∆µ = Vm ∆p Vm = M / ρ ∆µ = MWasser= 18,02 g ρWasser= 0,999 g mol-1 cm-3 TE M∆p ρ ∆µEis= +1,97 J mol-1 ∆µWasser= +1,80 J mol-1 ρEis= 0,917 g cm-3 Die beiden Phasen: Gleichgewicht (p1) → bei p2 ⇒ schmilzt das Eis ! c. Die Druckabhängigkeit des Dampfdrucks Auf die kondensierte Der Dampfdruck der Phase↑ Phase ausgeübter Druck Die Molekule entweichen als Gas Die Beziehung zwischen dem Dampfdruck p bei Anlegen eines Drucks ∆p und dem Dampfdruck p’ p = p '⋅ exp( Vm (l )∆p ) RT Die Zunahme des Dampfdrucks einer kondensierten Phase bei steigendem Druck 2.3. Die Lage der Phasengrenzlinien Phasengrenzlinie – die Wertpaare von p und T bei denen zwei Phasen koexistieren Die Lage der Phasengrenzlinien → µ1(pT) = µ2(pT) Lösung → eine Funktion p(T) a. Die Steigungen der Phasengrenzlinien T und p ändern sich in infinitesimalen Schritten µ1 = µ2 Bewegung: zu einem anderen Punkt der Phasengrenzlinie → die Bedingung ist immer erfüllt Die Steigungen der Phasengrenzlinien dµ1 = dµ2 dG = Vdp – SdT -S1,mdT + V1,mdp = -S2,mdT + V2,mdp Si,m – molare Entropie Vi,m – molare Volumen der jeweiliger Phase (V2,m - V1,m)dp = (S2,m – S1,m)dT dp ∆ tr S = dT ∆ trV Die Clapeyron’sche Gleichung ∆trS = S2,m – S1,m : Phasenübergangsentropie ∆trV = V2,m – V1,m : Volumenänderung während des Phasenübergangs b. Die Phasengrenzlinie fest/flüssig Der Schmeltzvorgang: T + Aenderung der molaren Enthalpie des Systems ∆H Die Clapeyron’sche Gleichung ∆SmV ∆SmH >0 (einzige Ausnahme 3He) ∆SmV >0 (und relativ klein) dp ∆ Sm H = dT T∆ SmV dp >0 dT Integration von dp/dT unter der Annahme, dass ∆SmH und ∆SmV ≠ f(T) ∆ Sm H dT = dp ∫p ' ∆ SmV T∫' T p T p = p '+ ∆ Sm H T ln ∆ SmV T ' Die Phasengrenzlinie fest/flüssig Wenn T ≅ T’ : T −T' T −T' T ln = ln1 + ≅ T' T' T' ∆ Sm H (T − T ') p = p '+ ∆ SmVT ' Die typische Phasengrenze fest/flüssig steigt steil an TSm↑ wenn p ↑ c. Die Phasengrenzlinie flüssig/gasförmig ∆V H T Verdampfungsentropie eines Stoffes bei T dp ∆V H = dT T∆V V Die Clapeyron’sche Gleichung ∆VH >0 ∆VV >0 (grosser Wert) dp >0 dT Aber kleiner als für Phasengrenze fest/flüssig Vm(g) >> Vm(l) ⇒ ∆VV ≅ Vm(g) Ein ideales Gas: Vn ( g ) = RT p ∆V V dp = dT RT T p Die Phasengrenzlinie flüssig/gasförmig Die Clausius Clapeyron’sche Gleichung für die Abhängigkeit des Dampfdrucks von T d ln ( p ) ∆V H = dT RT 2 Wie ändert sich : der Dampfdruck ↔ T und Siedetemperatur ↔ p ? ∆V H ∫p ' d ln( p ) = R p ∆V H dT ∫T ' T 2 = − R T 1 1 − T T' p’ – Dampfdruck bei Temperatur T’ Dampfdruckkurve p ∆V H ln = − R p' 1 1 − T T' p = p' e − χ wo χ = − ∆V H R Die Dampfdruckkurve endet bei der kritischen Temperatur Tkrit 1 1 − T T' d. Die Phasengrenzlinie fest/gasförmig Die Sublimationsenthalpie ∆ Sub H = ∆ Sm H + ∆V H Die Steigung der Phasengrenzlinie fest/gasförmig ist in der Nähe des Tripelpunktes steiles als diejenige der Phasengrenzlinie flüssig/gasförmig Die Sublimationsenthalpie > die Verdampfungsenthalpie TSub ≅ TV (die Clapeyron’sche Gleichung ) Pictet-Trouton’sche Regel Pictet-Trouton’sche Regel = die Standardverdampfungsentropie für viele verschiedene Flüssigkeiten liegt ungefähr bei 85 J/K mol. ∆V H θ kJmol −1 θV °C ∆V S θ JK −1mol −1 Benzol 30.8 80.1 87.2 Tetrachlorkohlenstoff 30.0 76.7 85.8 Cyclohexan 30.1 80.7 81.8 Schweffelwasserstoff 18.1 -60.4 87.9 Metan 8.18 -161.5 73.2 Wasser 40.7 100.0 109.1 Actuelle Entdeckungen "Borophen": Die Schichtstruktur und elektronischen Eigenschaften sind denen des Graphens ganz ähnlich. 2D Borophen-Schichten: ein Intermediat zwischen rein kovalent gebundenem Graphen und substrat-stabilisiertem Silicen oder Germanen. Die Bandstruktur und damit das elektronische Verhalten von Borophen kann beispielsweise leicht durch Substrat-Wechselwirkungen oder einer Funktionalisierung der Oberfläche verändert werden. 2.4. Die Klassifikation der Phasenübergange nach Ehrenfest Unterschiedliche Phasenübergänge : häufig - Schmelzen, Verdampfen seltener – verschiedene Modifikationen von Festkörper (leitend und superleitend), Flüssigkeiten (superfluide Phasen) Klassifikation nach Ehrenfest : einorden anhand der TD Ein Uebergang von einer Phase α zu einer Phase β : dµ β dp dµ β dT dµα − = Vβ ,m − Vα ,m = ∆ trV T dp T dµα ∆ tr H − S S = − + = β ,m α ,m dT Ttr p p Die Klassifikation der Phasenübergänge nach Ehrenfest Existieren Übergänge (Schmelzen, Verdampfung): ∆ tr H ≠ 0 ∆ trV ≠ 0 Die Steigerungen des chemischen Potenzials = f(p) ↓ Die beiden Seiten des Übergangs müssen verschieden sein dµ dp T dµ dT p Ändern sich am Punkt des Phasesübergangs sprunghaft Die Klassifikation der Phasenübergänge nach Ehrenfest Phasenübergang erster Ordnung: dµ → ändert sich sprunghaft dT p Cp → die Steigerung der Enthalpie: f(T) ↓ Eine Singularität der H Funktion H ändert sich bei infinitesimaler Temperatur T Temperaturänderung um einen endlichen Betrag Temperatur T Die Klassifikation der Phasenübergänge nach Ehrenfest Phasenübergang erster Ordnung: Beispiel: Wasser siedendes Wasser → T = konstant, obwohl ständig Wärme zugeführt wird ↓ Die Wärmezufuhr ist die treibende Kraft für den Übergang und nicht die Temperaturerhöhung Temperatur T Die Klassifikation der Phasenübergänge nach Ehrenfest Phasenübergang zweiter Ordnung: dµ → stetig verläuft, aber nicht dT p die zweite Ableitung µ(T) → ein stetiger Verlauf: eine Kurve, die auf beiden Seiten die gleiche Steigung besitzt Volumen und Entropie ↓ Ändern sich nicht während des Übergangs Temperatur T Cp → eine Unstetigkeit, wird aber nicht singular Temperatur T Die Klassifikation der Phasenübergänge nach Ehrenfest Phasenübergang zweiter Ordnung: Beispiel: Die Umwandlung der normalleitenden zur supraleitenden feste Phase von Metallen bei tiefem T Die Umlagerung der Kristallstruktur eines Festkörpers, die unter Änderung der Symmetrie der Struktur verläuft Die Klassifikation der Phasenübergänge nach Ehrenfest λ Übergänge: → Nicht erster Ordnung sind, Cp → unendlich Cp → steigt in der Regel bereits lange vor dem eigentlichen Phasenübergang Beispiel: Ordnungs/Unordnungsübergabe → Legierungen: Das Einsetzen ferromagnetischen Verhaltens Der Übergang vom flüssigen zum suprafluiden He Phasenübergänge zweiter Ordnung und λ-Ordnung Mikroskopische Interpretation Beispiel: Umlagerung der Kristallstruktur eines Festkörpers → Änderung der Symmetrie der Struktur T ↑ → der Kristall soll sich in derjenigen Raumrichtung mehr ausdehnen wo die kürzeren Kanten der Elementarzelle liegen Der Kristall → kubische Symmetrie. T ↑ ⇒ gleichmässige Ausdehnung in alle 3 Raumrichtungen Sowohl die Wechselwirkungsenergie der Atome als auch das Volumen des Festkörper ändert sich köntinuerlich ↓ Die Phasenübergang kann nicht 1. Ordnung sein (der ist 2. Ordnung) Phasenübergänge zweiter Ordnung und λ-Ordnung Mikroskopische Interpretation Beispiel: λ-Übergang → die Unordnung von CuZn T = 0○C → alle Atome vollständig geordnet T ↑ → der Übergang ist kooperativ ⇒ Inseln ↓ Die Inseln wechseln mit steigender T T = 742○C ⇒ vorliegen nur einen Phase (die Inseln sind zufällig im ganzen Festkörper verteilt) Bei Annährung an 742○C → Cp ↑ → kann eine zunehmende Wärmemenge zur Unordnung verbraucht werden (gespeichert als termische Bewegung) ↓ Die Phasenübergang ist λ-Ubergang Lernziele: Phasendiagramme, die Stabilität von Phasen Phasengrenzen, typische Phasendiagramme Phasenübergänge, die TD Gleichgewichtkriterien Die Abhängigkeit der Stabilität von den Bedingungen Die Lage der Phasengrenzlinien Die Klassifikation der Phasenübergänge nach Ehrenfest P. Atkins, J. de Paula, “Physikalische Chemie”, Wiley-VCH Verlag GmbH& Co, 2013, 4.1, 4.2. G. Wedler, H-J. Freund, „Lehrbuch der Physikalischen Chemie“, Wiley-VCH Verlag GmbH& Co, 2013.