6-Piazzi_Phasenuebergaenge
Werbung

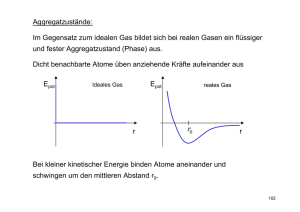
Phasenübergänge Bernhard Piazzi Didaktik der Physik WS2006/07 Übersicht • • • • • • • Mögliche Phasenübergänge Phasendiagramm Kritischer Punkt Tripelpunkt Latente Wärme Verdampfungswärme Wasser Voraussetzungen für Phasenübergang • Phasenübergänge sind von Druck und Temperatur abhängig → nur bei bestimmtem Paar (p,T) ist Übergang möglich. • Zusätzlich wird Energie freigesetzt oder muss investiert werden. Mögliche Phasenübergänge Beispiele aus dem Alltag • Schmelzen: Eis aus Kühlschrank, wird flüssig (Temperaturen oberhalb der Schmelztemperatur) • Sublimieren: feuchte Wäsche bei Frost aufhängen; trocknet obwohl gefroren (Eis geht direkt in den gasförmigen Zustand über) • Erstarren: abkühlen von Wasser; einzelne Eiskristalle werden immer größer, Wasser wird zu kompakten Masse aus Eis • Verdampfen: erhitzen von Wasser bis zu Siedetemperatur; Wasser verdampft, es sprudelt wegen Dampfblasen • Resublimieren: Windschutzscheibe im Winter; Luftfeuchtigkeit aus der Luft gefriert an der Scheibe • Kondensieren: durch Abkühlen entstehen aus gasförmigem Wasserdampf kleine Wassertröpfchen Phasendiagramm • Druck wird gegen die Temperatur aufgetragen. Bei den Grenzen treten Phasenübergänge auf. • Sublimation und Verdampfen kann auch abseits dieser Grenzen auftreten, man nennt es dann Verdunsten. Kritischer Punkt • Charakterisierung: Tc , pc , c • Gas und Flüssigkeit nicht mehr unterscheidbar → überkritisches Fluid (hohe Temperatur → hohe Energie → Gas; hoher Druck → geringer Abstand → Flüssigkeit) Weitere Eigenschaften • Verdampfungswärme verschwindet • Opaleszenz (ständiger Wechsel zwischen Flüssigkeit u. Gas – Schlierenbildung) • Bei T Tc Gas nicht mehr verflüssigbar • Beispiele: Stoff Krit. Temp. (K) Krit. Druck (MPa) Krit. Dichte (kg/m³) Wasserstoff 33,3 1,297 310 Stickstoff 126,1 3,394 311 Luft 133 3,95 Wasser 647,3 22,12 317 Anwendung 3 Vorteile: hohes Lösungsvermögen (Flüssigkeit) niedrige Viskosität (Gas) Verflüchtigung ohne Rückstände • Herstellen von Quarzkristallen (gelöstes SiO2 in H2O) • Lebensmittelkontrollen (lösen von Fleisch in H2O) • Textilfärbung (Farbe im überkritischen Zustand) • Herstellung koffeinfreien Kaffees und Tees (CO2) Tripelpunkt • auch Dreiphasenpunkt: die drei Aggregatzustände fest, flüssig und gasförmig kommen gleichzeitig vor • Wasser: Temp. des Gefrierpunktes bei Normaldruck (1013,25 mbar) nahezu gleich der Temperatur des Tripelpunkts (0,01 °C) • Gibbsches Gesetz: f = 3 – P (für Reinstoffe) Freiheitsgrad f des Systems (mit P = 3): f=0 Veränderung einer Zustandsgröße → Ungleichgewicht der Phasen • Tripelpunkt sehr scharf → Kalibrierung von Thermometern gängige Tripelpunkte: Quecksilber: 234,31560 K (−38,83440 °C) Wasser: 273,16000 K (0,01000 °C) Latente Wärme • Wärme die aufgenommen/abgegeben wird, wenn Stoffprobe von einem in einen anderen Aggregatzustand übergeht • Aufnahme/Abgabe dieser Wärme hat keine Temperaturänderung zur Folge • Verdampfungswärme (=Kondensationswärme) • Schmelzwärme • Kristallisationswärme Dampfdruck • Gefäß, teilweise mit Flüssigkeit gefüllt: Teil der Flüssigkeit verdampft, im Freiraum bildet sich Dampf mit Druck pS (T ) . • Konstante Temperatur → Sättigungsdruck, Zahl der verdampfenden Moleküle (E > Oberflächenenergie) gleich Zahl der kondensierenden Moleküle (Treffen auf Flüssigkeitsoberfläche) • Höhere Temperatur → mehr Moleküle besitzen Mindestenergie → Dampfdruck steigt Herleitung der Verdampfungswärme Carnot‘scher Kreisprozess: Zustand A(T dt, pS dpS ): gesamter Dampf kondensiert mit Volumen VFl A → B: isotherm: p = const und T = const bis alles verdampft ist B → C: adiabatisch: p und T infinitesimal verkleinert C → D: isotherm komprimiert Dampf kondensiert D → A: p und T infinitesimal erhöht Verdampfungswärme W1 ( pS dpS )(VFl VD ) W2 pS (VD VFl ) W W1 W2 dpS (VFl VD ) W dpS (VD VFl ) T dT T dT Q1 T dT T Clausius-Clapeyron: dp S T (VD VFl ) dT Wasser Multimere: • Flüssiger Zustand: Wasser geht Molekülbindungen ein, die energetisch ideal sind • Abstände zwischen Molekülen viel kleiner als bei kristalliner Bindung • Dimere: • Trimere: Anomalie des Wassers • 1. Effekt: mit T steigt die kinetische Energie → Abstand zwischen den Molekülen steigt • 2. Effekt: T steigt → platzverschwenderische Wasserstoffbrückenbindungen brechen auseinander • 0°C < T < 4°C: 2. Effekt stärker → Dichte↗ • 4° < T < 100°C: 1. Effekt stärker → Dichte ↘ T = 100°C Verdampfen von Wasser: • Energiezufuhr → Temperaturerhöhung bis 100°C → kinetische Energie der Translation steckt schon im siedenden Wasser (muss nicht mehr aufgebracht werden) • Durch die Wasserstoff-Brückenbindung ist das H2O am Rotieren gehindert • Energie wird in die Aufbrechung dieser gesteckt. Phasendiagramm von Wasser • Externer Druck → Eis schmilzt. • z.B: Eislaufen, Schneiden eines Eisblocks mit einem Draht