V - Chemie Unibas
Werbung

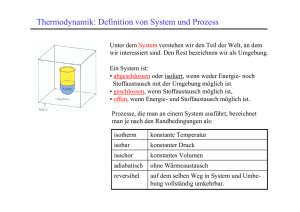
Thermodynamik (TD) Fundamentale Theorie der makroskopischen Eigenschaften der Materie: - Spontane Prozesse - Konzept der “Temperatur” - Phasenübergänge - Energetik makroskopischer Phasen und chemischer Reaktionen P. Atkins, J. de Paula, “Physikalische Chemie”, Wiley-VCH Verlag GmbH& Co, 2013. G. Wedler, H-J. Freund, „Lehrbuch der Physikalischen Chemie“, Wiley-VCH Verlag GmbH& Co, 2013. Der Erste Hauptsatz der TD- Lernziele o Einleitung o Zustandgrössen und –funktionen o Wärme, Arbeit und Energie o Innere Energie o Der erste Hauptsatz der Thermodynamik o Volumenarbeit o Wärmeübergänge o Die Enthalpie o Adiabatiche Anderung o Anderungen der Inneren Energie o Der Joule-Thomson-Effeckt oThermochemie P. Atkins, J. de Paula, “Physikalische Chemie”, WileyVCH Verlag GmbH& Co, 2013, ttt. Einleitung o Die Thermodynamik ist die Lehre von den Umwandlungen der Energie. o Beispiele für Anwendungsgebiete: - Verbrennungsenergie wird in mechanische Arbeit umgewandelt (Motoren) - Elektrische Arbeit wird durch den chemischen Transfer von Elektronen erzeugt (Batterien) - Energetische Analyse chemischer Prozesse (kann eine bestimmte Reaktion überhaupt ablaufen ?) - Bereitstellung von Energie zur Synthese komplexer Biomoleküle in Organismen Bevor wir uns der Theorie hinter diesen Fragen widmen, benötigen wir jedoch einige mathematische Hilfsmittel, die im Folgenden diskutiert werden. Zustandgrössen und - funktionen o Zustandsvariabeln (Zustandsgrössen) sind physikalische Grössen, mit denen man den Zustand eines makroskopischen Systems beschreibt, z.B. -Temperatur T - Druck p - Volumen V - Stoffmenge n - innere Energie U und andere mehr (s. später) 1. Intensive Zustandsvariablen (Zustandsgrössen) sind Eigenschaften, die von der Masse des Systems unabhängig sind. z.B. Druck p, Temperatur T, Molvolumen Vm=V/n, Viskosität. 2. Extensive Zustandsvariablen (Zustandsgrössen) sind Eigenschaften, die von der Masse von System abhängig sind. z. B. Volumen V, Stoffmenge n, innere Energie U Zustandgrössen und - funktionen o Spezifische Grösse = Dividiert man eine extensive Grösse durch die Masse m: v= V m o Molare Grösse = Dividiert man eine extensive Grösse durch die Stoffmenge, n: V - molares Volumen Vm = n H - molare Enthalpie n o Der Erfahrung nach werden für eine reine Substanz zwei intensive und eine extensive Zustandsvariable benötigt, um ein System zu beschreiben. Alle anderen Zustandsgrössen sind dann Zustandsfunktionen, die von den gewählten Zustandsvariablen abhängen. Hm = o Extensive Grössen werden in intensive Grössen überführt. o Prinzipiell hat keine der intensiven Grössen einen Vorrang vor der anderen. o Oft verwendet man die Temperatur und den Druck als unabhängige Variable das molare Volumen ist eine Funktion von p und T ! Zustandgrössen und - funktionen o Der Wert einer Zustandsvariable ist eine Funktion der anderen Zustandsvariablen, eine Zustandsfunktion. z. B. die innere Energie U kann als eine Funktion der unabhängigen Zustandsgrössen p, T und n ausgedrückt werden: U = f(T,p,n) o Zustandsgleichung = die Gleichung, die eine Beziehung zwischen den Zustandsgrössen herstellt. o Zustandfunktionen = Grössen eines Systems, gegenwärtigem Zustand des Systems abhängen die nur von o Wegfunktionen = Grössen eines Systems, die weganhängig sind. o Eine Zustandfunktion ist unabhängig davon, wie dieser Zustand erreicht wurde Partielle Ableitungen Partielle Ableitung = Steigung der Funktion entlang einer Koordinate, wobei alle anderen Koordinaten konstant gehalten werden. Beispiel: f = Funktion zweier unabhängiger Variabeln x, y f(x,y) - partielle Ableitung nach x bei konstantem y: Schnitte parallel zur (x,f) Ebene = Funktionen von x und y können abgeleitet werden. Partielle Ableitungen/ Totales Differential f - partielle Ableitung nach y bei konstantem x: x= 0 æ f ö y x æ f ö y x x= l x y Schnitte parallel zur (y,f) Ebene y y = Funktionen von x und y können abgeleitet werden. Das totale Differential df gibt die totale, infinitesimale Änderung einer Funktion f(x,y) bei einer infinitesimalen Variation dx und dy der unabhängigen Variablen x und y an. Totales Differential von f(x,y): æ ¶f ö æ ¶f ö df = dx + dy ¶x y ¶y x Gesamte Änderung des Funktionswerts > Integral über df ist unabhängig vom Weg : x1 , y1 df x2 , y 2 = f x1 , y1 - f x0 , y0 Grundbegriffe o Das System = derjenige Teil der Welt, dem unser spezielles Interesse gilt. Eine Region im Raum, die von der Umgebung durch die Systemgrenzen abgegrenzt wird. Die Systemgrenzen sind frei wählbar, aber nach der Wahl für die weitere Diskussion fixiert. o Die Umgebung = Rest des Universums (kann aber häufig auf einen kleineren Teil des Labors beschränkt werden!) o Das Weltall = System + Umgebung o Systeme: Offene Systeme, Geschlossene Abgeschlossene (Isolierte) Systeme: Umgebung Umgebung Stoffe System Energie Offen Sy. System Stoffe Energie Geschlossen Sy. Systeme und Umgebung Stoffe System Energie Abgeschlossen Sy. Arbeit, Wärme, Energie o Arbeit wird geleistet, wenn man einen Prozess dazu verwendend kann, irgendwo in der Umgebung die Höhe eines Gewichtes zu verändern. o Die Arbeit > wird von dem System geleistet, wenn das Gewicht angehoben wird > wird an dem System geleistet, wenn das Gewicht abgesenkt wird. o Energie ist die Fähigkeit, Arbeit zu leisten • wenn die Arbeit an dem System geleistet wird , nimmt seine Energie zu • wenn das System Arbeit leistet > nimmt die Energie ab o Wärmefluss = erfolgt die Änderung der Energie eines Systems aufgrund einer Temperaturdifferenz o Behälter: Wärme diathermisch Wärme adiabatisch Arbeit, Wärme, Energie Vorgänge: Wärme 1. exoterme 2. endotherme exotherm Wärme endotherm Molekularer Bild: o Wärme: Energieübertragung durch eine ungeordnete Bewegung von Molekülen (thermische Bewegung) o Arbeit: Energieübertragung durch eine Molekülen (mechanische Bewegung) Energie Wärme Energie ordnete Bewegung von Arbeit Der erste Hauptsatz der TD o Thermodynamik basiert auf vier grundlegenden Gesetzen (die Hauptsätze), aus denen sich die gesamte Theorie entwickeln lässt. o Der erste Hauptsatz der TD = Wärme und Arbeit sind equivalent, wenn es darum geht die Energie eines Systems zu ändern. o Was für eine Energie eines Systems? o Innere Energie (U) = die Gesamtenergie eines Systems (die Summe der kinetischen und potentiellen Energie seiner Moleküle). o Z. B. Die Innere Energie einatomiger Gase, die nur kinetische Energie haben, ist: Um = Um (0) + 3/2 RT Wobei Um (0) ist die molare Innere Energie bei T = 0K. o Die Aenderung der Inneren Energie , wenn ein System von Anfangszustand A (UA) in einen Endzustand E (UE) überführt wird, ist: U = UE - UA Der erste Hauptsatz der TD o Eigenschaften der Inneren Energie: - U ist eine Zustandsfunktion - Jede Änderung einer der Zustandgrössen (z.B. Druck) bewirkt eine Änderung der Inneren Energie. - U ist eine extensive Eigenschaft (hängt von der Stoffmenge ab). o 1. Hauptsatz der TD (andere Formulierung) = In einem abgeschlossenen System kann keine Aenderung der Inneren Energie auftreten (U ist konstant) Es ist noch nie gelungen ein Perpetuum Mobile zu bauen ! Einheit für Innere Energie, Arbeit und Wärme: Joule (J) 1J = 1kg m2 s-2 Der erste Hauptsatz der TD o 1. Hauptsatz der TD = Verändert sich ein System von einem Zustand A in einen anderen Zustand E auf einem beliebigen, adiabatichen Weg, so ist die geleistete Arbeit immer die gleiche. wad = Arbeitsmenge, die geleistet wird in einem adiabatischen Prozess (das System kann nicht Wärme austauschen) wad = U = U E - U A U hat die gleiche Änderung auf nicht-adiabatischen Weg, aber die geleistete Arbeit, w muss nicht dieselbe wie zuvor sein. o Die aufgenommene Wärme, Q = den Unterschied zwischen der geleisteten Arbeit und die Änderung der Inneren Energie: Q = U - w w = Arbeitsmenge, die geleistet wird in einem nicht-adiabatischen Prozess (das System kann Wärme austauschen) Der erste Hauptsatz der TD o Wärme und Arbeit sind die Möglichkeiten die Energie eines Systems zu beeinflussen. o Mathematische Formulierung des erstes Hauptsatz der TD: U = Q + w Q = Wärme die dem System zugeführte Energie w = Arbeit die an einem System verrichtet ist o Für infinitesimale Änderung des Systems: dU = dQ + dw o Makroskopisch messbare Änderungen thermodynamischer Grössen werden durch Integration über alle infinitesimalen Änderungsschritte erhalten. o Ein griechisches “ Δ” bezeichnet eine messbare makroskopische Änderung der relevanten thermodynamischen Grösse, die nach der Integration über alle infinitesimal kleinen Änderungen erhalten wird; wir lassen das “ Δ” für Q und w weg, weil der Transfer von Wärme und Arbeit immer bereits eine Veränderung impliziert. Wegfunktionen ow > 0, Q > 0 wenn dem Systems Energie zugeführt wird. o w < 0, Q < 0 wenn dem Systems Energie entnommen wird. o w und Q sind Wegfunktionen (sind nicht totale Differentiale). o Weggrössen (auch Transfergrössen) sind thermodynamische Grössen deren Wert vom Weg abhängt, in dem das System in den gegenwärtigen Zustand gelangt ist. o Möglichkeiten, einen thermodynamischen Prozess zu führen (“Wege”): • isotherm: die Temperatur bleibt konstant • isobar: der Druck bleibt konstant • isochor: das Volumen bleibt konstant • adiabatisch: kein Wärmefluss δq=0 Volumenarbeit o Volumenarbeit = der Form von Arbeit, die mit einer Volumenänderung verbunden ist. o Die allgemeine Formulierung der Volumenarbeit = die Arbeit, die erforderlich ist, um ein Objekt um eine Strecke dz gegen den Widerstand einer Gegenkraft F zu bewegen. dw = - Fdz o Das System hat eine Wand, die bildet ein masseloser, reibungsfrei, starrer, perfekt eingepasster Kolben der Fläche A. o Die entgegen der Ausdehnung wirkende Kraft ist: F = pex A pex A dz A pex Volumenarbeit o Wenn das System um die Strecke dz expandiert (gegen den äusseren Druck pex), ist die Arbeit: dw = - pex Adz dV = Adz dw = - pex dV VE o Die Arbeit die insgesamt bei der Volumenänderung von VA auf VE verrichtet ist: w = - p ex dV VA o Für andere Formen der Arbeit, die wir nicht mechanische oder zusätzliche Arbeit nennen wollen, gelten analoge Beziehungen, jeder Arbeit, w ist: w = (eine intensive Grösse) x (eine extensive Grösse) Andere Formen der Arbeit o Oberflächenarbeit (bei Emulsionen): dA o Längenausdehnung (Spannung eines Gummis): fdl = die Oberflächenspannung dA = die Oberflächenänderung f = die Spannung dl = die Längeänderung o Elektrische Arbeit: d = das elektrische Potenzial d = die Ladungsänderung Expansion eines Systems o Freie Expansion findet statt, wenn keine Gegenkraft wirkt . pex = 0 dw = - pex dV dw = 0 w=0 o Bei der freie Expansion wird folglich keine Arbeit verrichtet. o Expansion gegen einen konstanten Druck findet statt, wenn z.B. der Kolben unter Atmosphärendruck steht. pex = konst dw = - pex dV VE w = - pex dV = - pex VE - VA VA w = - pexV Reversible Expansion o Alle diese Prozesse können reversibel oder irreversibel geführt werden: - reversibel: Der Prozess kann durch eine infinitesimal kleine Änderung der relevanten Grösse wieder umgekehrt werden, d.h. das System ist ständig im thermodynamischen Gleichgewicht mit seiner Umgebung. -irreversibel: Der Prozess kann nicht umgekehrt werden (er passiert spontan) o z. B. Das thermische Gleichgewicht zweier Systeme mit gleicher Temperatur: die Wärmeaustausch zwischen beiden Systeme verläuft reversibel o z. B. Ein System im mechanischem Gleichgewicht mit seiner Umgebung (ein Gas befindet sich in einem geschlossenen Behälter). p o Wenn pex p pex Damit eine Expansion reversibel ist: pex = p Reversible Expansion o Expansionsvorgang: dw = - pex dV = - pdV o Die gesamte, bei einer reversiblen Expansion geleistete Arbeit: VE Die Zustandsgleichung: w = - pdV p = f(V) VA o z. B. Isotherme reversible Expansion eines idealen Gases. pV = nRT o Die Arbeit bei reversibler, isothermer Volumenänderung von VE nach VE bei T: VE VE dV w = - pdV = -nRT V VA VA b dx b = ln a x a w = -nRT ln VE VA Isotherme Reversible Expansion o Die Arbeit bei reversibler, isothermer Volumenänderung von VE nach VE bei T: w = -nRT ln o Expansion: VE > VA VE VA w<0 Das System verrichtetet Arbeit an der Umgebung. Die Innere Energie ist gesunken Der Betrag der Arbeit ist gleich die Fläche unter der Isotherme (reversible Expansion) Die Rechteckfläche, die man für eine irreversible Expansion gegen einen konstanten äusseren Druck erhält Die maximale Arbeit, die wir aus einen System gewinnen können, wird erhalten, wenn das System reversibel arbeitet Wärmeübergänge o Allgemein ist die Änderung der Inneren Energie eines Systems: dU = dQ + dw = dQ + dwVol + dwe dwVol = - pdV die Volumenarbeit dwe die extra-Arbeit o Wird des Volumens konstant gehalten: o Das System verrichten kann: keinerlei eines Systems andere o Für eine endliche Zustandsänderung: Arbeit dwVol = 0 dU = dQ dwe = 0 U = Q Q < 0 (die Wärmemenge die aus dem System abgeführt ist), bei V = konst. Q > 0 (die Wärmemenge die einem System zugeführt ), bei V = konst. Die Wärmekapazität o Wird die Temperatur des Systems um einen infinitesimal kleinen Betrag dT geändert, so verändert sich die innere Energie um einen Betrag dU proportional zu dT: dQ = CdT o Die Proportionalitätskonstante C wird Wärmekapazität genannt. o Die Wärmekapazität eines Stoffes ist eine extensive Eigenschaft. o Es gibt zwei verschiedene Wärmekapazitäten: • CV = Wärmekapazität bei konstantem Volumen • Cp = Wärmekapazität bei konstantem Druck o z. B. Der Index V deutet an, dass die Temperaturänderung bei konstantem Volumen stattfindet. Die Wärmekapazität o Die Wärmekapazität hängt von den Bedingungen ab, unter denen dem System Wärme zugeführt wird. o Bei konstantem Druck kann ein Teil der ausgetauschten Energie auch in Form von Arbeit mit der Umgebung ausgetauscht werden: CV C p o C ist ein Mass für die Fähigkeit (Kapazität) eines Stoffes, Energie (Wärme) bei einer Temperaturerhöhung zu speichern. o Die Innere Energie eines Stoffes nimmt mit steigender Temperatur zu. Das Ausmass dieser Energieerhöhung hängt von den Bedingungen ab, bei denen der Vorhang stattfindet. o z. B. V = konst. dU = dQ dQ = CV dT æ ¶U ö CV = ¶T V Die Wärmekapazität o Die Innere Energie in Abhängigkeit von der Temperatur die Steigung der Kurve bei beliebiger Temperatur nennt man die Wärmekapazität des Stoffes bei der betreffender Temperatur. C V A C V B o Die Innere Energie in Abhängigkeit von der Temperatur und dem Volumen: die Änderung von U mit der Temperatur bei bestimmtem konstantem V, entspricht der eingezeichneten Kurve parallel zur T-Achse – die Steigung ist CV. Die Wärmekapazität o Die molare Wärmekapazität bei konstanten Volumen: o Die molare Wärmekapazität bei konstanten Volumen eines einatomigen Gases ist: CV ,m = An Tafel: T = 25C, p= 1bar CV ,m JK -1mol -1 CV ,m CV = n He Ar N2 CO2 12.48 12.48 20.74 28.46 3 R 2 CV = m o Die spezifische Wärmekapazität bei konstanten Volumen: CV , s o Die Änderung der Inneren Energie für die Temperaturanderung eines Systems mit konstanten Volumen: dU = CV dT U = CV T Die Enthalpie o Wenn ein System bei p = konst., sein Volumen ungehindert ändern kann: U < Q w Wärme o Die zugeführte Wärme entspricht der Aenderung einer anderen TD Eigenschaft des Systems, der Enthalpie. o In der Thermodynamik definiert man eine Reihe von Hilfsgrössen, die in bestimmten Situationen eine spezielle physikalische Bedeutung annehmen. In der Chemie ist eine der wichtigsten Hilfsgrössen die Enthalpie H: H = U + pV o Die Enthalpie ist eine Zustandsfunktionen sind) Zustandsfunktion (da U, p und v Die Enthalpie o Die Änderung der Enthalpie H während eines Prozesses (wenn das System in Gleichgewicht mit der Ungebung ist und nur Volumenarbeit verrichtet) ist: An Tafel: dH = dQ + Vdp o Bei konstantem Druck, zugeführten Wärmemenge: p = konst. die Enthalpieänderung ist gleich der dH = dQ o Die Enthalpie H entspricht also der übertragenen Wärme Q bei konstantem Druck ! o Weil die meisten chemischen Reaktionen unter konstantem Druck durchgeführt werden (offenes Reaktionsgefäss), sind im Labor gemessene Reaktionswärmen üblicherweise als Enthalpie zu interpretieren ! o Eine messbare Änderung von H: H = Q Die Enthalpie ΔH < 0: Wärme wird vom System freigesetzt (exothermer Prozess) ΔH > 0: Wärme wird vom System aufgenommen (endothermer Prozess) o Wenn die Temperatur des Stoffes steigt, nimmt auch seine Enthalpie zu. o Das Verhältnis zwischen beiden Zunahmen hängt von den Bedingungen des Prozesses ab (z. B. p = konst.) o Die Wärmekapazität bei konstantem Druck = Die Steigung der Tangente an den Graphen H = f(T). æ ¶H ö Cp = ¶ T p o Cp ist eine Extensive Eigenschaft. oDie molare Wärmekapazität bei konstantem Druck : C p ,m = Cp n Die Temperaturabhängigkeit der Enthalpie o Die Enthalpieänderung für infinitesimale Temperaturänderung: dH = C p dT o Wenn Cp = konst. über den Temperaturbereich, ist die Enthalpieänderung : T2 H = C p dT = C p T T1 o Eine Erhöhung der Enthalpie kann stets der Zuführung Wärmemenge bei konstantem Druck gleichgesetzt werden: Q p = C p T einer Die Temperaturabhängigkeit der Enthalpie o Für die Fälle, bei denen Cp = f(T), hat sich die empirische Näherungsfunktion: C p,m c = a + bT + 2 T o Die empirischen Parameter a, b, und c hängen nicht von der Temperatur ab. a b/10-3 K-1 c/105 K2 C (s, Graphit) 16.86 4.77 -8.54 CO2 (g) 44.22 8.79 -8.62 H2O (l) 75.29 0 0 N2 (g) 28.58 3.77 -0.50 o In den meisten Fällen ist die Wärmekapazität eines Stoffes bei konstantem Druck grösser als die Wärmekapazität bei konstantem Volumen. o Für ideale Gase: C p - CV = nR An Tafel: Adiabatische Expansion o Adiabatische Expansion eines Gases: Das System verrichtet Arbeit ohne dass ihm von aussen Wärme zugeführt wird. o Adiabatische Expansion: die Innere Energie und die Temperatur nehmen ab. o Die Änderung der Innere Energie eines idealen Gases bei einer Temperaturänderung des Gases von TA nach TE, bei konstantem Volumen: dU = CV dT dU = dwad dU = Q + dwad Adiabatische Expansion: dwad = CV dT Q= 0 o Bei einer reversibler, adiabatischer Expansion eines idealen Gases, die Temperaturänderung hängt mit der Volumenänderung zusammen: An Tafel: æ T A ö æ VE ö = TE V A -1 wobei: = Cp CV = C p ,m CV , m Poisson‘sche Gleichung o Poison‘sche Gleichung: die Gleichung, die eine adiabatiche Expansion beschreibt: pV = konst. o Die adiabatischen Kurven (Adiabate) sind steiler als Isothermen Kurve. o Der Druck fällt steiler ab bei der Adiabate als bei der Isotherme 1 p V 1 p V Isotherme Adiabate Ursache: Die adiabatische Expansion ist auch mit der Abkühlung verbunden. Adiabatische Expansion o Bei isothermer Expansion wird mehr Arbeit gewonnen als bei adiabatischer Expansion (die zusätzlichen Temperaturabnahme der Druck nach Expansion ist im adiabatischen Fall geringer). o Vergleich der Volumenarbeit = der Fläche unter der Isotherme oder der Adiabate. o Bei Kompression ist es umgekehrt: die adiabatische Kompression führt zu einen Temperaturanstieg. w (isotherme Expansion) > w (adiabatische Expansion) w (isotherme Kompression) < w (adiabatische Kompression) Änderung der Inneren Energie o Die Innere Energie ist eine Zustandsfunktion (der Zahlenwert von U hängt nur von Anfangs- und Endzustand ab). o U ist ein totales Differential. o Die infinitezimale Änderung von V auf V+dV, bei T = konst die Änderung der Inneren Energie: æ ¶U ö U =U + dV ¶V T o Die infinitesimale Änderung von T auf T+dT, bei V = konst die Änderung der Inneren Energie: æ ¶U ö U = U + dT ¶T V Änderung der Inneren Energie o Die infinitesimale Änderung von V auf V+dV, und von T auf T+dT die Änderung der Inneren Energie: æ ¶U ö æ ¶U ö U =U + dV + dT ¶V T ¶T V U = U + dU æ ¶U ö æ ¶U ö dU = dV + dT ¶V T ¶T V o In einem geschlossenen System mit konstanter Zusammensetzung, jede infinitesimale Änderung des U ist den jeweiligen Änderungen von Volumen und Temperatur proportional. o Dir Proportionalitätsfaktoren = die partiellen Ableitungen nach den Zustandsvariablen Änderung der Inneren Energie o Partielle Ableitungen kann man in vielen Fällen direkt interpretieren: æ ¶U ö æ ¶U ö dU = dV + dT ¶V T ¶ T V o Wärmekapazität bei V = konst. æ ¶U ö CV = ¶T V o Binnendruck: dU = T dV + CV dT æ ¶U ö T = ¶V T o Wenn zwischen den Molekülen keinerlei Wechselwirkung vorhanden ist, hängt die Innere Energie nicht vom gegenseitigen Abstand der Teilchen und daher auch nicht vom Volumen der Probe ab. Änderung der Inneren Energie o Die Änderung der Inneren Energie bei konstantem Druck: dU = T dV + CV dT : dT æ ¶U ö æ ¶V ö = T + CV ¶T p ¶T p o Der Koeffizient der thermischen Ausdehnung, : 1 æ ¶V ö = V ¶T p æ ¶U ö = T V + CV ¶ T p o Für ideale Gase die Wärmekapazität bei konstantem Volumen ist gleich der Steigung des Graphen der Funktion U(T) sowohl bei konstantem Druck als auch bei konstantem Volumen. æ ¶U ö = CV ¶T p Koeffizient der thermischen Ausdehnung und isotherme Kompresibilität Joule-Thomson-Koeffizient Analoge Ueberlegungen können wir auch für die Enthalpie anstellen. æ ¶H ö æ ¶H ö dp + dH = dT ¶T p ¶p T æ ¶H ö cp = ¶T p ? Mathematisch: Euler’schen Kettenregel für die Funktion z = z(x,y) æ ¶y ö æ ¶x ö æ ¶z ¶x z ¶z y ¶y æ ¶x ö 1 = æ ¶y ö ¶y z ¶x z ö = - 1 x H = f (p, T) æ¶ H ö ¶ p T æ ¶T ö æ¶ H ö æ ¶T ö æ ¶ H ö 1 ¶ p H = = = = - c p æ ö æ ö æ ö ¶ p ¶ T ¶ T ¶ p T ¶ p H ¶ T p ¶ T H ¶ H p ¶ H p Joule-Thomson Koeffizient Def: æ ¶T ö = Joule-Thomson-Koeffizient ¶p H Wir betracthen H als Funktion von p und T: dH = - c p dp + c p dT Für ein Geschlossenen System mit Konstanter Zusammensetzung Technische Verflüssigung von Gasen! entspricht dem Verhältnis zwischen Temperatur- und Druck-änderung bei Expansions eines Gases, wenn die Bedingungen garantieren, dass sich H nicht ändert. Der Joule-Thomson-Effekt Versuchanordnung zur Messung des Effekts 1. Das Gas dehnt sich durch die pörose Trennwald (Drosselventil) aus. 2. Die gesamte Anordnung ist termisch von der Umgebung isoliert. - eine isenthalpische Expansion (Ausdehnung bei konstanter Enthalpie) - gewählten Versuchsbedingungen → erwärmt sich / kühlt sich ab das Gas bei der Ausdehnung Der Joule-Thomson-Effekt Die termodynamische Grundlage - Durch das ein- bzw. ausströmende Gas → auf beiden Seiten der Drossel ein konstanter Druck (bildlich: in Form zweier Kolben) - Auf der linken Seite der Drossel: durch pA → das Volumen von VA auf 0 reduziert. -Auf der rechten Seite der Drossel: dehnt sich das Gas isotherm (gegen den Druck pE) aus → das Volumen ändert sich von 0 auf VE - Strömt eine bestimmte Gasmenge durch die Drossel → die Enthalpie bleibt konstant Der Joule-Thomson-Effekt Begründung Die Expansion erfolgt in der angebildeten Anordnung bei konstanter Enthalpie. -alle Zustandänderungen des Gases verlaufen adiabatisch → Q = 0 und U = w. -Die Arbeit bei durchgang des Gases durch die Drossel → der Durchtritt eines festen Volumen von der Hochdruckseite w1 = - pA (0 – VA) = pAVA - Auf der rechten Seite der Drossel: dehnt sich das Gas isotherm w2 = -pE (VE – 0) = - pEVE ↓ UE – UA = w = w1 + w2 = pAVA – pEVE ↓ ändert sich die Enthalpie bei HE = UE + pEVE = UA + pAVA = HA der Expansion nicht. Der Joule-Thomson-Effekt Ideale Gase: Bei einer adiabatischen Expansion ohne aussere Arbeitsleistung weisst ein ideales Gas keine Erwärnung oder Ankühlung æ ¶U ö =0 ¶V T Ideale Gase æ ¶H ö = 0 ¶p T T = konstant Reale Gase: U und H müssen Volumen- und Druck- abhängig sein. æ ¶U ö æ ¶p ö = = T -p0 ¶V T ¶T V æ ¶H = ¶p ö æ ¶V ö = V - T 0 ¶T p T Innere Druck T Isotherme Drosseleffekt konstant Thermochemie o Der Standardzustand = deren reine Form bei der jeweiligen T und einem Druck von 1 bar (105 Pa). o Die Änderung der Standardenthalpie H = die Änderung der Enthalpie eines Prozesses, dessen Ausgangsstoffe und Endprodukte sich jeweils im Standardzustand befinden. z. B. Der Standarszustand von flüssigem Ethanol = reines, flüssiges Ethanol bei einem Druck von 105 Pa und 298ºC. Enthalpieänderung bei physikalischen Zustandsänderung o Standard-Verdampfungsenthalpie V H = molare Differenz der Enthalpie, wenn eine Flüssigkeit bei einem Druck 1 bar in ein Gas unter einem Druck von 1 bar überführt wird. z. B. H2O (l) H2O (g) V H 373K = +40.66 kJ mol Die Standardenthalpie o Standard-Schmeltzenthalpie Sm H = molare Differenz der Enthalpie, wenn eine Flüssigkeit bei einem Druck 1 bar in ein Gas unter einem Druck von 1 bar überführt wird. z. B. H2O (s) H2O (l) Sm H = 6.01 kJ mol H ist ein Zustandsfunktion < Anderungen hängen nicht von Weg ab, auf dem der Prozess verläuft. z. B. H2O (s) H2O (g) Sub H H2O (s) H2O (l) Sm H H2O (l) H2O (g) V H Sub H = Sm H + V H Enthalpieänderung bei chemischer Reaktionen o Die Thermodynamische Gleichung = die Kombination zwischen der Reaktionsgleichung und der zugehörigen Enthalpieänderung. CH4 (g) + 2 O2 (g) CO2 (g) + 2H2O (l) H = -890 kJ mol o Die Standardreaktionsenthalpie R H = Die molare Enthalpieänderung beim Übergang von den Reaktanten in ihren Standardzuständen zu den Produkten in deren Standardzuständen. o Die Standardreaktionenthalpie einer allgemeiner Reaktion: = stoichiometrisch Faktor RH = H m- Pr od . H m Re akt . Hm = molare Standarsenthalpie Enthalpieänderung bei chemischer Reaktionen z. B. Die Standarsreaktionsenthalpie einer allgemeiner Reaktion: 2A + B 2C + 3D Sub H = 2 H m C + 3H m D - 2 H m A + H m B H m J = Molare Standardenthelpie des Substanz J bei der jeweiligen Temperatur. Der Satz von Hess: Die Standardenthalpie einer Reaktion ist gleich der Summe der Standardenthalpien einer Folge von Reaktionen, in die die betreffende Reaktion formal zerlegt werden kann. Der Erste Hauptsatz der TD- Lernziele o Einleitung o Zustandgrössen und –funktionen o Wärme, Arbeit und Energie o Innere Energie o Der erste Hauptsatz der Thermodynamik o Volumenarbeit o Wärmeübergänge o Die Enthalpie o Adiabatiche Anderung o Anderungen der Inneren Energie o Der Joule-Thomson-Effeckt oThermochemie P. Atkins, J. de Paula, “Physikalische Chemie”, Wiley-VCH Verlag GmbH& Co, 2013. G. Wedler, H-J. Freund, „Lehrbuch der Physikalischen Chemie“, Wiley-VCH Verlag GmbH& Co, 2013.