Kapitel-14-16 - Physik eLearning
Werbung

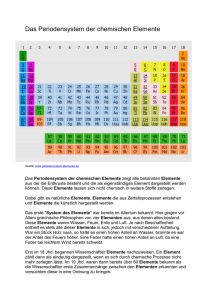
14. Experimente zur Richtungsquantelung und Drehimpuls 14.1. Einstein de Haas Effekt 14.2. Stern Gerlach Experiment 1922 Wander Johannes de Haas (1878 - 1960) Holländer, (PhD Leiden 1913-1915 in Berlin Grooningen, Delft) http://www.lorentz.leidenuniv.nl/history/explosion/dehaas.html 14. Experimente zur Richtungsquantelung und Drehimpuls Ziel: Messe ein mechanisches Drehmoment auf einen makroskopischen Körper als folge des umklappen vieler Spins Starkes B-Feld klappe die Magnetisierung vollständig um Bestimme Magnetisierung Messe den Drehimpuls (Trägheitsmoment bekannt) Ergebnis: g=2 !!! 14. Experimente zur Richtungsquantelung und Drehimpuls 14.1. Einstein de Haas Effekt 14.2. Stern Gerlach Experiment 1922 Otto Stern 1914-1922 Privatdozent bei Max Born in Frankfurt Danach – Rostock - Hamburg Walther Gerlach 1920-1925 Frankfurt 14. Experimente zur Richtungsquantelung und Drehimpuls Zeitschrift für Physik Vol 9 (1922) S. 349 14. Experimente zur Richtungsquantelung und Drehimpuls Bohrsches Atommodell: Elektronen auf Planeten Bahnen Sommerfeld: Raumquantisierung! z Quantisierungsachse ½~ 0 ms=§½ħ -½ ~ 14. Experimente zur Richtungsquantelung und Drehimpuls Arnold Sommerfeld Niels Bohr gequantelte Bahnen!!! eher NEIN! JA! 14. Experimente zur Richtungsquantelung und Drehimpuls “Sie glauben doch nicht, daß die Einstellung der Atome etwas physikalisch reelles ist; das ist eine Rechenvorschrift -Kursbuch der Elektronen.” (Debye zu Gerlach) “Ich dachte immer, daß die Richtungsquantelung eine Art symbolischer Ausdruck war für etwas, was wir eigentlich nicht verstehen. Aber das wörtlich zu nehmen wie Stern es tat, das war seine eigene Idee ...” Max Born 14. Experimente zur Richtungsquantelung und Drehimpuls Prinzip des Stern-Gerlach Experimentes: Energie eines magnetischen Dipols im magnetischen Feld: In einem inhomogenen Magnetfeld wirkt: 14. Experimente zur Richtungsquantelung und Drehimpuls Ofen erzeugt Strahl von Silberatomen Spalte, definieren einen dünnen Strahl Magnetpolschuh Photoplatte zum Nachweis inhomogenes Magnetfeld 14. Experimente zur Richtungsquantelung und Drehimpuls "Es war eine Sisyphusarbeit .... Insbesondere die Nachtwachen übernahm W. GERLACH. Er kam dann gegen 21 Uhr mit einem Packen von Sonderdrucken und Büchern. In der Nacht wurden die Korrekturen durchgelesen Rezensionen und Aufsätze geschrieben, Vorlesungen vorbereitet, viel Kakao oder Tee getrunken und sehr viel geraucht. Wenn ich dann morgens wieder in das Institut kam, das vertraute Geräusch laufender Pumpen hörte und GERLACH noch da war, war das ein gutes Zeichen: Es war über Nacht nichts zu Bruch gegangen. So kam ich eines Morgens im Februar (1922) ins Institut; es war ein herrlicher Morgen: Kaltlufteinbruch und Neuschnee! GERLACH war dabei, wieder einmal den Niederschlag eines Atomstrahls, der acht Stunden lang durch ein inhomogenes Magnetfeld gelaufen war, zu entwickeln. Erwartungsvoll verfolgten wir den Entwicklungsprozeß und erlebten den Erfolg monatelangen Bemühens: die erste Aufspaltung eines Silberatomstrahls im Magnetfeld. Nachdem Meister SCHMIDT und, wenn ich mich recht erinnere, auch MADELUNG die Aufspaltung gesehen hatten, ging es ins Mineralogische Institut zu Herrn NACKEN, um den Befund mikrophotographisch festzuhalten. Dann erhielt ich den Auftrag, eine Telegramm an Herrn Professor STERN nach Rostock aufzugeben, dessen Text lautete: 'BOHR hat doch recht!'“ (Schütz) 14. Experimente zur Richtungsquantelung und Drehimpuls Stern&Gerlach schlossen: Drehimpuls der Bohrschen Bahnen ist Richtungsquantisiert. ABER: Glück des Tüchtigen: Ag ist l=0 aber s mit l=1 hätten sie nichts gesehen! 14. Experimente zur Richtungsquantelung und Drehimpuls Wodurch werden die Spins ausgerichtet? •Klassisch: durch Kraft wie eine Kompassnadel? NEIN!! (Zeit würde bei weitem nicht reichen) Magnetisches Feld “projeziert die Wellenfunktion” auf die beiden Eigenzustände up/down Erinnerung: Klassische Mechnik Quantenmechanik Das Stern-Gerlach Experiment zeigt nicht die Rotation der Spins, sondern die Eigenschaft der Wellenfunktion Teilchen Punkt im Phasenraum Quantenmechanik, dass auch für den Drehimpuls Komplexwertig die Ψ(r,t) einzigen möglichen Messwerte einer Einzelmessung die Eigenwerte (in diesem Fall diskrete z-Komponente) der Operatoren sind Evolutions gleichung Mess grössen Hamilton Gleichungen Funktionen von r,p Schrödingergleichung Operatoren Mögliche Messwerte: Eigenwerte 15. Mehrelektronenatome 15.1. Helium, experimenteller Befund 15.2. Das Pauli Prinzip 15.3. Helium: Termschema 15.4. Zweielektronenwellenfunktion – Antisymmetrisierung 15.5. Helium: Doppeltangeregte Zustände Vernachlässige e-e Abstoßung: Z=2 Äusserstes Elektron sieht Z=1 wie Wasserstoff: Ebind = 13.6 eV Zweites Elektron: Ebind = Z2 / n2 * 13.6eV = 54 eV Experiment: 24.6 eV erste Ionisierungenergie 54 eV zweite Ionisierungenergie Elektron sieht „abgeschirmte mittlere Ladung“ Zeff=1.35 15. Mehrelektronenatome Wasserstoff Helium 15. Mehrelektronenatome •Es scheint 2 Nivauschema zu geben – keine Übergänge dazwischen Ortho - Parahelium • l Entartung aufgehoben! 1s fehlt! 15. Mehrelektronenatome 15.2. Das Pauliprinzip Wie “füllt” man mehrere Teilchen in einen Potentialtopf? Schon Bohr hatte das Problem: Warum sitzen nicht alle Elektronen in einem Atom im tiefsten Zustand?? 15. Mehrelektronenatome Wie “füllt” man mehrere Teilchen in einen Potentialtopf? Pauliprinzip: Jeder Zustand (beschrieben durch (m,l,ml,ms) kann von maximal einem Elektron besetzt werden. Die Wellenfunktion eines Systems mit mehreren Fermionen (Spin ½) ist immer antisymmetrisch gegen Vertauschung zweier Teilchen sein. 15. Mehrelektronenatome ganzahliger Spin halbzahliger Spin Pauliprinzip Vorhersage: bei ρ * λ3 = 2.612 Sammeln sich alle Teilchen in einem QM Zustand 15. Mehrelektronenatome 15.3. Das Helium Termschema Grundzustand: n1=1, l1=0, ml1=0, ms1=+1/2 n2=1, l2=0, ml2=0, ms2=-1/2 Ortswellenfunktion Spin Wellenfunktion symmetrisch gegen antisymmetrisch Vertauschung der Elektronen ms=+1 Gesamtspin 0 Gesamtspin 1 ms=0 ms=-1 Multiplizität (2S+1): Einstellmöglichkeiten des Gesamtspins im äusseren Feld Spin 0 -> Multiplizität 1 “Singulett” Spin 1 -> Multiplizität 3 “Triplett” 15. Mehrelektronenatome Grundzustand: n1=1, l1=0, ml1=0, ms1=+1/2 n2=1, l2=0, ml2=0, ms2=-1/2 Ortswellenfunktion Spin Wellenfunktion symmetrisch gegen antisymmetrisch Vertauschung der Elektronen Notation: Gesamtdrehimpuls j Grundzustand 11S0 n des höchsten Elektrons Multiplizität (2S+1) “erster Singulett S 0 Zustand” Gesamtbahndrehimpuls L L=0 -> S L=1 -> P L=2 -> D 15. Mehrelektronenatome hier weiter Übergang verboten “Metastabil” Lebensdauer 8000 sec! 13S0 existiert NICHT Pauliprinzip 15. Mehrelektronenatome •Keine Übergänge mit Spinflip Lebensdauer: 0.5 10-9s 19.6ms Termschema Haken Wolf an m n n a k ? e e ? l i i n b W e a t g s u a e t z e r e m e m o At Beispiel: 3D 2,1,0 7870s (!) (1s)1(3d)1 Elektron 1: n1=1, l1=0, ml1=0, ms1=+1/2 Elektron 2: n2=3, l2=2, ml2=0,§1,§2, ms2=+1/2 15. Mehrelektronenatome 15.4. Zweielektronenwellenfunktionen Bisher haben wir nur Quantenzahlen un Energien diskutiert, aber wie sieht der Ortsteil der Wellenfunktion aus? ee- gesucht: α Z=2 Ableitung nach Orten des 1sten (2ten) Elektrons! Es gibt keine geschlossene Lösung! 15. Mehrelektronenatome 15.4. Zweielektronenwellenfunktionen Bisher haben wir nur Quantenzahlen un Energien diskutiert, aber wie sieht der Ortsteil der Wellenfunktion aus? ee- gesucht: α Z=2 Ableitung nach Orten des Modell unabhängiger 1sten (2ten) Elektrons! Elektronen: Ansatz: Vernachlässigen oder durch F(r1)+F(r2) ersetzen 15. Mehrelektronenatome Ansatz A Elektron 1 in Zustand a (n,l,m) vertausche die Elektronen: Elektronen ununterscheidbar in Messung ! wird erfüllt von Ansatz B: Pauliprinzip: Spin-singulett & Ψsym Spin-triplett & Ψanti 15. Mehrelektronenatome Beispiel einer Antisymmetrischen Orts (Impuls) Wellenfunktion Image of |ψ(k1,k2)|2 e2 e1 r1 = -r2 e1 r1 = -r2 He 25 eV e2 e2 Direction of e1 electron 1 e-e Abstoßung 15. Mehrelektronenatome He 25 eV electron 1 Bemerkungen zum Pauliprinzip: •Pauli Prinzip folgt nicht aus der Schrödinger Gleichung (im Gegensatz zu den Erhaltungssätzen) •Zusätzliches, unabhängiges Symmetryprinzip der Natur •Keine Kraft – beeinflußt dennoch die Bewegung von Teilchen! 15. Mehrelektronenatome 15.1. Helium, experimenteller Befund 15.2. Das Pauli Prinzip 15.3. Helium: Termschema 15.4. Zweielektronenwellenfunktion – Antisymmetrisierung 15.5. Helium: Doppeltangeregte Zustände Einschub: Augereffekt Elektron trägt Überschußenergie Augerzerfall == Autoionisation Pierre Auger 1925 15. Mehrelektronenatome Floureszenzkoeffizient Augereffekt Konkurenzprozess Röntgenemission Floureszenzkoeffizient 15. Mehrelektronenatome Floureszenzkoeffizient •Z<30 Auger dominiert •Z>30 Photoemission dominiert Floureszenzkoeffizient 15. Mehrelektronenatome ESCA 15. Mehrelektronenatome 15.1. Helium, experimenteller Befund 15.2. Das Pauli Prinzip 15.3. Helium: Termschema 15.4. Zweielektronenwellenfunktion – Antisymmetrisierung 15.5. Helium: Doppeltangeregte Zustände “doppel angeregter Zustand” (n=2,n=2,...1) (n=3,n=3,... 1 ) ... Nachweis: Emissionsspektroskopie Zerfall über Augerelektron statt Licht! 15. Mehrelektronenatome Wasserstoff Absorbtionsspektrum a) Absorbtionsspektren Augerlektronen Wasserstoff Gas 15. Mehrelektronenatome “doppelt angeregter Zustand” (n=2,n=2,...1) (n=3,n=3,... 1 ) ... Absorbtionsspektroskopie! Helle Streifen!!! + Dunkle Streifen Wellenlänge Madden & Codling 1963 15. Mehrelektronenatome Energy 2s2p 1s1s Augerzerfall Energy Absorption 2s2p 1s1s Absorption direkte Photoionisation ununterscheidbarer Endzustand! Interferenz! 15. Mehrelektronenatome Destruktive Interferenz maximale Absorption! Konstruktive Interferenz 15. Mehrelektronenatome Destruktive Interferenz maximale Absorption! Konstruktive Interferenz 16. Das Periodensystem Wie “füllt” man mehrere Teilchen in einen Potentialtopf? 1. Pauliprinzip erfüllen nur 1 Elektron pro n,l,ml,ms 2. Minimale Gesamtenergie Schale K (n=1) L (n=2) maximale e in Schale 2 8 Unterschalen e Zahl 1s 2 2s, 2p 2 6 gesamt e 2 10 M (n=3) 18 3s, 3p, 3d 2 6 10 28 N (n=4) 32 4s,4p,4d,4f 2 6 10 14 60 O (n=5) 50 + 5g 18 110 16. Das Periodensystem 16.1. Elemente 1-10 16.2. Die Hundschen Regeln 16.3. Überblick Periodensystem 16.4 Hartree Fock Wieso wird zuerst 2s (n=2,l=0) und dann erst 2p gefüllt??? H-Atom: 2s,2p entartet 16. Das Periodensystem Antwort: Erinnerung an Kapitel „Aufhebung der l-Entartung Im Wasserstoff E nicht von l abhängig Gleicher Energieeigenwert! Gilt nur im Coulombpotential 16. Das Periodensystem Wieso? nicht: Hundsche Regel: Im Grundzustand maximaler mit Pauliprinzip vereinbarer Gesamtspin 16. Das Periodensystem Hundsche Regel: Im Grundzustand maximaler mit Pauliprinzip vereinbarer Gesamtspin Wieso? Pauliprinzip: ungerade unter Vertauschung von 1,2 er h c i s t ll nd i e s t s r e p rinzi useinand p i l u Pa en a n o r t lek E s s da nicht: spin 16. Das Periodensystem x1=x2 x1 x1=x2 x2 x2 Beispiel: x1 16. Das Periodensystem x2 x1=x2 x1 Ort x2 16. Das Periodensystem Hundsche Regel: Im Grundzustand maximaler mit Pauliprinzip vereinbarer Gesamtspin Wieso? nicht: Beruht auf L-S Kopplung! ->Ausnahmen bei schweren Elementen 16. Das Periodensystem Beispiel Helium Die vom Pauliprinzip diktierte antisymmetrische Ortswellenfunktion des Triplett Zustandes ist energetisch günstig, da sie für den energetisch ungünstigen Fall, dass beide Elektronen an der gleichen Stelle sind einen Knoten hat. 16. Das Periodensystem 16.2 Hundsche Regeln 1. Volle Schalen L=0 S=0 2. bei gleichem l, maximale Multiplizität (Pauliprinzip minimiert Abstoßung) 3. bei gleicher Multiplizität wird L (d.h. ml parallel) maximiert (Spin Bahn Kopplung maximal!) 4. Teilschale weniger als halb besetzt: möglichst kleines J Teilschale mehr als halb voll: möglichst grosses J <halbvolle Schale: Elektronen rotieren Wasserstoff: s j=3/2 j=1+1/2 = 3/2 j l j=1/2 16. Das Periodensystem Hundsche Regeln 1. 2. 3. 4. Volle Schalen L=0 S=0 bei gleichem l, maximale Multiplizität (Pauliprinzip minimiert Abstoßung) bei gleicher Multiplizität wird ml maximiert (Spin Bahn Kopplung maximal!) Teilschale weniger als halb besetzt: möglichst kleines J Teilschale mehr als halb voll: möglichst grosses J <halbvolle Schale: Elektronen rotieren >halbvolle Schale: Löcher rotieren “Magnetfeld umgedreht” Schale K (n=1) L (n=2) maximale e in Schale 2 8 Unterschalen e Zahl 1s 2 2s, 2p 2 6 gesamt e 2 10 M (n=3) 18 3s, 3p, 3d 2 6 10 28 N (n=4) 32 4s,4p,4d,4f 2 6 10 14 60 O (n=5) 50 + 5g 18 110 Wieso ist es günstiger eine neue Schale anzufangen? 3s 3p hohe Dichte Nahe am Kern! 3d 4s Äusserste Schale gleich besetzt chemisch ähnlich Folgen: Edelgase: •chemisch inert Schalenabschluss •keine Moleküle •hohe Ionisierung •kleiner Radius 1S 2S&2P 3S&3P 4S&4P Seltene Erden Actinide Alkali Atome 1 Äußeres Elektron “Quasi Wasserstoff” l Entartung aufgehoben sehr reaktiv Selten Actin Actinide: Auffüllen der 5f Schale Seltenen Erden: Auffüllen der 4f (5d) Schale Seltene Erden Actinide 16. Das Periodensystem 16.4. Hartree Fock Näherung 3s Elektronen schirmen den Kern ab Suche Lösung bei der die Wellenfuntkionen genau die Abschirmung produzieren zu der sie Lösungen sind. “Selbstkonsistentes Feld” 16. Das Periodensystem Vielteilchen Wellenfunktion antisymmetrisch: Slater-Determinante Beispiel Helium 16. Das Periodensystem Ist die selbstkonsistente Lösung die QM korrekte Lösung? genähert! keine Winkelkorrelation! 16. Das Periodensystem Mittels Hartree Fock werden auch Molekülwellenfunktionen berrechnet: N C H http://129.27.179.6:8000/quanten/tchflang.html