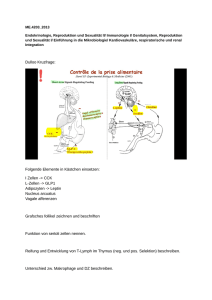
Patienteninformation und - Kompetenznetz Maligne Lymphome
Werbung

Verantwortl. Prüfarzt: PD Dr. Dreyling, Telefon 089/7095-2202 PATIENTENINFORMATION Wirksamkeit und Sicherheit von 90Y-Ibritumomab Tiuxetan (Zevalin) bei Patienten mit rezidiviertem oder refraktärem Mantelzell-Lymphom nach autologer Stamzelltransplantation/bei denen keine autologe Stammzelltransplantation vorgenommen werden kann. Kurztitel: Europäische Zevalin-Studie beim Mantelzell-Lymphom Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde kürzlich ein Mantelzell-Lymphom, d.h. ein bösartiger Tumor der Lymphknotenzellen, festgestellt, das auf die vorausgegangene Chemotherapie nur vorübergehend angesprochen hat. Im Rahmen dieser Studie möchten wir überprüfen, ob ein neues Krebsmedikament (90Y-Ibritumomab Tiuxetan oder Zevalin) speziell in Ihrer Erkrankung eine neue vielversprechende Behandlungsart darstellt. Welches Medikament oder welche Behandlung wird geprüft? Das untersuchte Medikament ist 90Y-Ibritumomab Tiuxetan (Zevalin), ein radioaktiv markierter Antikörper. Sobald sich der Antikörper im Blutkreislauf befindet, erkennt es gesunde sowie auch bösartige (”Krebs-”) B-Zellen und bindet sich an sie. Die radioaktiven Teilchen, die an den Antikörper gebunden sind, töten die markierten und die benachbarten B-Zellen ab. Im Rahmen der Studie erhalten Sie neben dem oben beschriebenen radioaktiven Antikörper (Studienmedikament) auch einen anderen Antikörper (Rituximab), der für die Behandlung von malignen Lymphomen bereits zugelassen ist. Die Therapie wird an zwei unterschiedlichen Tagen verabreicht. An beiden Behandlungstagen erhalten Sie Rituximab, am zweiten Behandlungstag (1 Woche nach der ersten Rituximab-Gabe) bekommen Sie zusätzlich den radioaktiven Antikörper (Zevalin) verabreicht. Das radioaktive Teilchen Yttrium-90 wird in einer Dosierung eingesetzt, die sich aus Ihrem Gewicht errechnet. In malignen Lymphomen wurden bereits eine Reihe von klinischen Studien mit Zevalin abgeschlossen. In diesen Studien sprachen mehr als die Hälfte der Patienten auf die Behandlung gut an und das Medikament wurde im Vergleich zu Standardkrebspräparaten gut vertragen. Was geschieht mit Ihnen, wenn Sie teilnehmen? Wenn Sie sich entschließen, an dieser Studie teilzunehmen, werden Sie bis zu 36 Monate, mindestens jedoch 12 Monate nachbeobachtet. Das bedeutet für Sie, dass Sie während dieser Zeit regelmäßig im Krankenhaus untersucht werden, um frühzeitig festzustellen, wie Ihr Körper und das Lymphom auf die Behandlung anspricht. Ihr Arzt ist mit diesen Abläufen vertraut, da sie zum Teil Routineuntersuchungen bei der Behandlung von Patienten mit Mantelzell-Lymphomen darstellen. Seite 1 von 6 amendment 2.1 (1.6.2006) Verantwortl. Prüfarzt: PD Dr. Dreyling, Telefon 089/7095-2202 Was müssen Sie beachten? Nachdem Sie die Infusion des radioaktiven Antikörpers erhalten haben, wird sich mindestens eine Woche lang messbare Radioaktivität in Ihrem Blut, Urin und Stuhl befinden. Ein Teil der Strahlung, die Sie mit der radioaktiven Substanz zugeführt bekommen haben, wird Ihren Körper verlassen. Somit könnten Mitmenschen, die mit Ihnen in dieser Zeit in engem körperlichen Kontakt stehen, geringen Mengen an Radioaktivität ausgesetzt sein, obwohl es keine Hinweise gibt, dass diese geringe Strahlenbelastung andere schädigen kann. Die gesamte Strahlung in Ihrem Körper wird nach weiteren drei Wochen vollständig abgeklungen sein. Bitte beachten Sie auch folgendes: • • • Informieren Sie Ihr/e Studienarzt/-ärztin unbedingt über alle Medikamente, die Sie während der Studie einnehmen. Spenden Sie kein Blut innerhalb der nächsten 6 Monaten nach Studienbehandlung Klären Sie Impfungen bitte vorher mit Ihrem Studienarzt ab Bei Männern kann die Zeugung eines Kindes innerhalb der ersten 12 Monate nach der Therapie mit dem radioaktiven Antikörper ein erhöhtes Risiko für das Kind mit sich bringen. Daher sollten Sie oder Ihr Partner bis 12 Monate nach der Behandlung mit dem radioaktiven Antikörper effektive Methoden zur Empfängnisverhütung anwenden. Alle anderen Lebensbereiche können Sie wie gewohnt gestalten. Was sind Nebenwirkungen der Studienteilnahme? Risiken im Zusammenhang mit der Studienbehandlung Möglicherweise können im Zusammenhang mit dem verabreichten Zevalin Nebenwirkungen auftreten, die Sie bitte Ihrem Studienarzt bei Ihrem nächsten Besuch mitteilen sollten. Nachfolgend sind einige Nebenwirkungen beschrieben, die im Rahmen von vorangegangenen Studien Zevalin aufgetreten sind. • Der radioaktive Antikörper kann die Anzahl der Blutzellen ebenso wie eine Chemotherapie in Ihrem Blut verringern – dies kann ein gewisses Risiko von Blutungen, Müdigkeit, Schwäche und Infektionen bedeuten. Wenn Sie zu niedrige Blutzell-Zahlen aufweisen, können Blut-Transfusionen erforderlich werden. Diese Effekte können bei schwerer Ausprägung lebensbedrohlich sein, jedoch waren bei den bislang behandelten Patienten alle diese Nebenwirkungen von vorübergehender Natur (reversibel). • Andere Nebenwirkungen, wie Schmerzen im Tumorbereich, Schüttelfrost, erhöhte Temperaturen (Fieber), Hitzegefühl, Nesselsucht, Hautausschlag, Juckreiz, niedriger Blutdruck, Schwäche (Asthenie), Kopfschmerzen, Bauchschmerzen, Gelenkschmerzen (Arthralgie), Brust- und Nackenschmerzen, Allgemeinschmerz, Halsentzündungen, trockener Mund, zunehmender Husten, Atemnot (Dyspnoe), Rückenschmerzen, Schwindelgefühl, Übelkeit, Erbrechen, Durchfall, Karies, niedriger/hoher Blutzuckerspiegel, Flüssigkeitsansammlung (Ödeme), Schleimhautveränderungen und Appetitlosigkeit wurden beobachtet. • Der radioaktive Antikörper und das Rituximab bestehen aus bestimmten Eiweiß-Bausteinen, sogenannten "Proteinen”. Manchmal reagiert der Körper daraufhin mit der Bildung von Seite 2 von 6 amendment 2.1 (1.6.2006) Verantwortl. Prüfarzt: PD Dr. Dreyling, Telefon 089/7095-2202 körpereigenen Antikörpern, die die Wirkung des Medikamentes vermindern können. In den amerikanischen Studien war die Häufigkeit solcher Antikörper niedrig (1,9%). • Es ist auch möglich, dass Sie auf die Eiweiß-Bausteine, aus denen der radioaktive Antikörper und das Rituximab bestehen, besonders bei der ersten Gabe sehr stark reagieren. Diese Reaktionen nennt man ”anaphylaktische Reaktion”. Ihr behandelnder Arzt wird Sie beim Auftreten dieser Reaktion umgehend mit speziellen Medikamenten behandeln. • Wird man Radioaktivität ausgesetzt, kann dies Krebs verursachen und es besteht grundsätzlich die Möglichkeit von Erbgutschädigung. Diese Risiken sind gering. Trotzdem wird Ihr Studienarzt Sie mit dem radioaktiven Antikörper nur behandeln, wenn der mögliche Vorteil der Studientherapie die damit verbundenen Risiken überwiegt. Da dies eine relativ neue Krebsbehandlung ist, könnten auch bislang unbekannte Nebenwirkungen auftreten. Daher werden Sie eng überwacht und sofort behandelt, wenn Nebenwirkungen auftreten. Risiken durch Rituximab Patienten, die mit Rituximab alleine behandelt worden sind, haben ebenfalls über Nebenwirkungen berichtet. Nachfolgend werden die am häufigsten aufgetretenden Nebenwirkungen genannt: • • Erhöhte Körpertemperatur und Schüttelfrost vor allem nach der ersten Infusion Übelkeit, Unwohlsein, Erbrechen, Hautausschlag, Ermüdungserscheinung, Kopfschmerzen, Juckreiz, laufende Nase, Erbrechen und ein Gefühl einer geschwollenen Zunge und Kehle Weniger häufige Symptome im Zusammenhang mit der Infusion sind: • • • • • • • • • Husten oder Keuchen, Schwierigkeiten beim Atmen, Asthma, Störungen der Lungenfunktion, Sauerstoffmangel niedriger und erhöhter Blutdruck, unnormale Herzfrequenz (Puls), Hautrötung Verschlechterung bereits bestehender Herzprobleme, Wiederauftreten einer Hepatitis (Leberentzündung) Schmerzen an der Stelle der Erkrankung, Gelenk- oder Brustschmerzen Verdauungsstörungen, Appetitverlust, Durchfall, Schwitzen, Konjunktivitis (Entzündung der Bindehaut des Auges), Verwirrung/Schwindel Schwellung der Hände und Füße, Gefühllosigkeit/Kribbeln, Halsentzündung, Geschmacks-störungen Nervosität, Unwohlsein, Erregungszustand, Schlafstörungen abnormale Blutwerte, Anämie (zu wenig rote Blutkörperchen), Infektionen, Bildung von Antikörper gegen Rituximab In sehr wenigen Fällen wurden schwere Hautreaktionen mit Blasenbildung (toxische epidermale Nekrolysen) beobachtet. Was sind die Alternativen für die Therapie? Ältere Patienten, die bereits vorher eine Chemotherapie erhalten haben, auf die das Mantelzell-Lymphom vorübergehend angesprochen hat, können mit einer weiteren Chemotherapie (eventuell in Kombination mit Rituximab) behandelt werden. Erfahrungsgemäß Seite 3 von 6 amendment 2.1 (1.6.2006) Verantwortl. Prüfarzt: PD Dr. Dreyling, Telefon 089/7095-2202 ist eine solche Behandlung vor allem dann sinnvoll, wenn die Erkrankung durch die erste Chemotherapie für eine längere Zeit (d.h. länger als ein Jahr) zurückgedrängt werden konnte. Was sind mögliche Vorteile und Risiken einer Studienteilnahme? Wie schon im vorigen Abschnitt erklärt, können bestimmte Nebenwirkungen im Zusammenhang mit der Studienbehandlung auftreten. Auf der anderen Seite hoffen wir, dass Sie von der Studienbehandlung profitieren, jedoch kann dies nicht garantiert werden. Die Informationen, die wir aus dieser Studie gewinnen, werden uns helfen, MCL-Patienten in der Zukunft wirksamer zu behandeln. Was geschieht, wenn neue Informationen bekannt werden? Manchmal werden während des Verlaufs einer klinischen Studie neue Informationen über das untersuchte Medikament bekannt. Wenn dies geschieht, wird Sie Ihr Studienarzt darüber informieren und mit Ihnen besprechen, ob Sie die Studie fortsetzen wollen. Falls Sie sich dazu entschließen, die Studie nach Erhalt der neuen Informationen fortzusetzen, werden Sie gebeten, eine aktualisierte Einverständniserklärung zu unterschreiben. Es kann auch vorkommen, dass Ihr Studienarzt erwägt, dass es in Ihrem besten Interesse wäre, Sie aus der Studie zu nehmen. Er wird Ihnen die Gründe erklären und für die Fortsetzung Ihrer Behandlung sorgen. Was geschieht, wenn etwas schief geht? Als Teilnehmer an dieser klinischen Prüfung besteht für Sie der gesetzlich vorgeschriebene Versicherungsschutz (Personenschaden-Versicherung nach dem Arzneimittelgesetz, maximale Deckungssumme 500.000 € pro Patient), der alle Schäden abdeckt, die an Ihrem Leben oder Ihrer Gesundheit durch die an Ihnen durchgeführten Maßnahmen der klinischen Prüfung innerhalb einer Nachbeobachtungsphase von 3 Jahren verursacht werden können; ausgenommen sind genetische Schäden. Die Versicherung wurde für Sie bei der HDI Industrie Versicherung, Wedekindstrasse 22-24, 30024 Hannover, Tel 0511-6263-0 abgeschlossen. Im Schadensfall können Sie sich direkt an den Versicherer wenden und Ihre Ansprüche selbständig geltend machen. Um den Versicherungsschutz nicht zu gefährden, dürfen Sie sich während der Dauer der klinischen Prüfung einer anderen medizinischen Behandlung nur im Einvernehmen mit Ihrem Prüfarzt unterziehen; ausgenommen davon sind Notfälle. Dies gilt auch für die zusätzliche Einnahme von Medikamenten. Auch müssen Sie eine Gesundheitsschädigung, die als Folge der klinischen Prüfung eingetreten sein könnte, dem behandelnden Prüfarzt und der oben genannten Versicherungsgesellschaft unverzüglich mitteilen. Wird Ihre Studienteilnahme vertraulich behandelt? Eine Weitergabe von Daten erfolgt - neben den gesetzlich geregelten Fällen der Weitergabe von Krankheitsdaten - nur zu Zwecken der Prüfung und nur in anonymisierter Form. Die Bestimmungen des Datenschutzes werden beachtet: Nur die Prüfer und autorisierte Personen in- und ausländischer Gesundheitsbehörden haben im Rahmen der entsprechenden gesetzlichen Vorschriften Zugang zu den vertraulichen Daten, in denen Sie namentlich genannt werden. Diese Personen unterliegen der Schweigepflicht und sind zur Beachtung des Datenschutzes verpflichtet. Seite 4 von 6 amendment 2.1 (1.6.2006) Verantwortl. Prüfarzt: PD Dr. Dreyling, Telefon 089/7095-2202 Die Weitergabe der Daten im In- und Ausland erfolgt ausschließlich zu statistischen und wissenschaftlichen Zwecken, und Sie werden ausnahmslos darin nichzt namentlich genannt. Auch in etwaigen Veröffentlichungen der Daten dieser klinisch Prüfung werden Sie nicht namentlich genannt. Seite 5 von 6 amendment 2.1 (1.6.2006) Verantwortl. Prüfarzt: PD Dr. Dreyling, Telefon 089/7095-2202 Wenn Sie sich zu einer Teilnahme an der Studie entschließen, möchten wir Sie bitten, die beigefügte Einverständniserklärung zu unterschreiben. Ihre Entscheidung, an der Studie teilzunehmen, können Sie selbstverständlich jederzeit und ohne Angabe von Gründen widerrufen. Es entstehen Ihnen dadurch keine Nachteile bei Ihrer weiteren Behandlung ! Wenn Sie noch Fragen bezüglich der Studienteilnahme haben oder später weitere Informationen über die Studie benötigen, wenden Sie sich bitte an Ihren Studienarzt Dr. __________________. .............................................. ................................................. ............................................. Name des Patienten Ort / Datum Unterschrift des Patienten .............................................. ................................................. ............................................. Name des Studienarztes Ort / Datum Unterschrift des Studienarztes Seite 6 von 6 amendment 2.1 (1.6.2006)