RT – Konzepte / päd. Neuroonkologie
Werbung
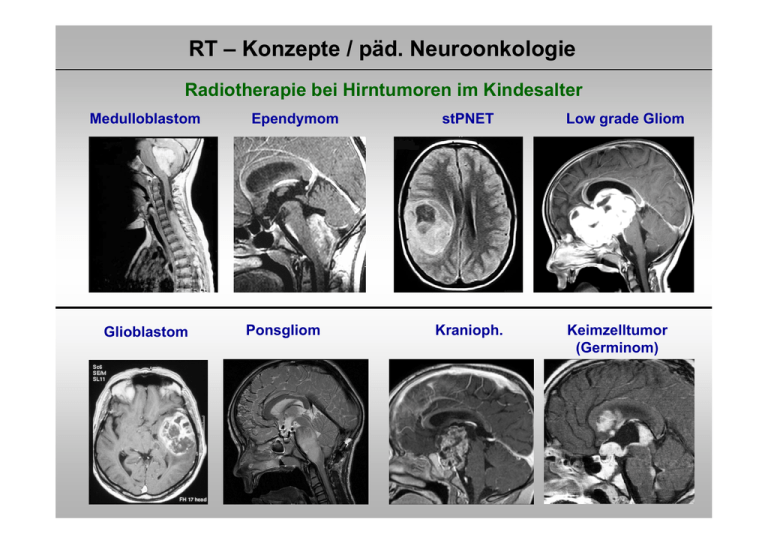
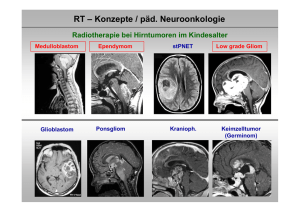
RT – Konzepte / päd. Neuroonkologie Radiotherapie bei Hirntumoren im Kindesalter Medulloblastom Glioblastom Ependymom Ponsgliom stPNET Kranioph. Low grade Gliom Keimzelltumor (Germinom) RT – Konzepte / päd. Neuroonkologie Wirkung der Strahlung Strahlung wirkt nur dort, wo sie gegeben wird (im Gegensatz zur Chemotherapie) Bestimmung des Zielgebietes (Tumorregion und Gebiete mit Tumorzellkontamination) RT – Konzepte / päd. Neuroonkologie Wirkung der Strahlung Zielvolumenkonzept 1. Liquorraum (Neuroachse) Medulloblastom ,Keimzelltumoren 2. Ganzhirn Leukämien 3. Nur Tumorregion(Aufsättigung nach Neuroachse) Ependymom, niedriggradiges Gliom, Kraniopharyngeom…… RT – Konzepte / päd. Neuroonkologie Wirkung der Strahlung Optimale Tumorkontrolle 1. Sichere Erfassung des Zielgebietes Ort und Ausbreitungsneigung des Tumors (exakte Darstellung / Bildgebung) 2. Ausreichende Dosis Gewebstyp und Tumorlast (Sichtbarer Tumor erfordert eine höhere Dosis als Gebiete mit Kontamination (= subklinischer Befall) RT – Konzepte / päd. Neuroonkologie Produktion von Strahlung / Linearbeschleuniger Feldformung durch Multi-leaf Kollimator RT – Konzepte / päd. Neuroonkologie Produktion von Strahlung / Protonen Boston PSI / Villigen Dosisverteilung Applikation RT – Konzepte / päd. Neuroonkologie Nebenwirkungen der Strahlung Reduktion von Therapiefolgen 1. Ausspaarung von Risikoorganen (geometrisch) exakte Darstellung / Bildgebung exakte Tumorerfassung („konformierend“) 2. Höhe der Einzeldosis (biologisch) niedrige Einzeldosis / viele Fraktionen 3. Höhe der Gesamtdosis möglichst gering 4. Begleittherapie (Chemotherapie) möglichst keine Chemotherapie RT – Konzepte / päd. Neuroonkologie Ziele der Strahlentherapie Verbesserung der lokalen Tumorkontrolle Reduktion der Nebenwirkungen Zielvolumen innovative Techniken Integrierung moderner Bildgebung Dosiskonzepte Neue Fraktionierungsschemata Dosiseskalationen Dosisabsenkungen Qualitätssicherung flächendeckende Standards Optimierung des therapeutischen Ergebnisses durch interdisziplinäre Behandlungskonzepte RT – Konzepte / päd. Neuroonkologie HIT – Netzwerk / Protokolle / mit Radiotherapie HIT 91 / Folgestudie HIT 2000 SIOP / GPOH –LGG 96 Folgestudie SIOP / GPOH –LGG 2004, HIT GBM A, HIT GBM B, HIT GBM C, Folgestudie HIT GBM D / Folgestudie HIT HGG HIT – REZ 97 / Folgestudie HIT – REZ 2005 Seltene Tumoren (AT/RT, spinale Tumoren) Kraniopharyngeom 2000 SIOP CNS GCT 96 Folgestudie SIOP CNS GCT RT – Konzepte / päd. Neuroonkologie Ziel : reproduzierbare und präzise Bestrahlung RT – Konzepte / päd. Neuroonkologie Anforderungen an eine optimale Radiotherapie Spannungsfeld zwischen Tumorkontrolle und Nebenwirkungen Dosis / Wirkungsbeziehungen Toleranz dosis Tumorkontrolle Risikogebiet für Rückfall Nebenwirkung Risikoorgan Vol (%) DVH Tumor Risikoorgane Dosis (%) Lagerungstechniken / 3 D konformale Radiotherapie Präzise Positionierung Lagerungstechniken / 3 D konformale Radiotherapie Präzise Positionierung Feldlicht Prospektive Studien HIT 2000 / SIOP PNET IV (Kinder ab 4 Jahren / Jugendliche) Ziele : Verbesserung der lokalen Tumorkontrolle und Überlebenszeiten durch Hyperfraktionierung Medulloblastom st PNET Lokale Dosiseskalation und Schonung von Normalgewebe + Qualitätssicherung Ependymom Kortmann, Kühl (Würzburg) Prospektive Studien HIT 2000 / SIOP PNET IV (Kinder ab 4 Jahren / Jugendliche) Radiobiologischer Hintergrund 2 x 1.0 Gy pro Tag Tagesdosis wird in zwei Sitzungen aufgeteilt, um eine bessere Erholung von Normalgewebe zu erlauben (Senkung von Therapiefolgen) (8 Std. zwischen Frakt.) biologisch höhere Tumordosis („Früh reagierendes Gewebe“) erlaubt eine Aufsättigung der Tumorregion biologisch niedrigere Normalgewebsdosis schont das gesamte ZNS bei der Neuroachsen-RT Prospektive Studien HIT 2000 / SIOP PNET IV (Kinder ab 4 Jahren / Jugendliche) Bestrahlung des Liqourraumes Prospektive Studien HIT 2000 / SIOP PNET IV (Kinder ab 4 Jahren / Jugendliche) Nutzung der modernen Bestrahlungstechniken innerhalb einer multizentrischen Studie Ziele : reproduzierbare Erfassung des Tumorgebietes Schonung von Normalgewebe Medulloblastom / „standard risk“ / MSFOP 98 Hyperfraktionierte Radiotherapie beim Medulloblastom MSFOP 98 : erkrankungsfreies Überleben 1,0 MSFOP 98 ( Std ) 3Y = 82% ,9 Überleben (%) ,8 MSFOP 98 ( Std + Meta ) 3Y = 79% ,7 12/98 → 10/01 : 55 Patienten < 19 Jahre Nachbeob. : 46 Monate Mittl. Alter : 9.9 Jahre (5.1 bis 15.8 Jahre) ,6 ,5 ,4 nur hfx (keine Chx.) standard risk MB CSA : 36 Gy / 2 x 1.0 Gy / Tag Tumorboost: 68 Gy / 2 x 1.0 Gy / Tag ,3 ,2 ,1 0,0 0 12 24 36 48 Zeit nach Beginn der Radiotherapie / Monate 60 Carrie et al., 2005 Prospektive Studien HIT 2000 / SIOP PNET IV (Kinder ab 4 Jahren / Jugendliche) SIOP / HIT PNET IV („standard risk“) Randomisierte Phase III Studie OP. Hyperfr. RT (2x1.0 Gy /Tg) CSA : 36 Gy / boost HSG 60 Gy, Tumor 68 Gy + Vincristin Random. Konv. RT (1x1.8 Gy /Tg) CSA : 23,4 Gy / boost HSG 54 Gy + Vincristin Beide Arme 8 x Cispl., CCNU, VCR alle 6 Wo. HIT 2000 / neue Konzepte Medulloblastom / 3 D Bestrahlung der hinteren Schädelgrube (Wolden et al., 2004) Rückfälle : 6 /32 Kindern, 5 ausserhalb PF, 1 Rückfall innerhalb PF, ausserhalb boost HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos M.-B., 8 Jahre, stPNET links frontal ED 04/2004 MRT-Diagnostik des Tumors links frontal / Z.n. partieller Resektion Resttumor ohne KM Anreicherung HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos HIT 2000 / Boostplanung / 68 Gy / 2 x 1,0 Gy /Tag HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos MR: 3 Wochen nach Radiatio / Rezidiv ? HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos MR: 11 Wochen nach Radiatio / Rückfall ? PET: Keine Areale erhöhter Glukoseaufnahme, damit kein Hinweis auf vitales Tm-Gewebe Tumorzelluntergang HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos 6 Monate nach Radiatio Komplette Remission Ependymom Intrakraniell (60%) Supratentoriell : 30% Infratentoriell : 70% 4-16 Jahre (ca) Supratent : 35% Infratent : 50% Spinal (30%) Intramedullär (thoracal) (10%) Extramedullär (lumbar) (20%) 4-16 Jahre (ca) Intramed : 10% Conus 5% Schiffer et al., 1991 Verteilungsmuster Metastasen Extramedullär < 5 – 10% Intrakranielle Ependymome Dosis – Wirkungsbeziehung Europäische Erfahrungen / „pooled data“ 1,0 Complete Removal (n=60) ,9 ,8 HFRT (n=44) ,7 Disease Free Survival (%) ,6 ,5 ,4 RT standard (n=16) ,3 ,2 ,1 0,0 0 12 24 36 Months after diagnosis 48 60 72 84 96 108 120 Dosis Temporallappen 100 % Volume 80 Früher 60 Heute 40 20 0 0 1000 2000 3000 4000 Dose (Gy) 5000 6000 Merchant, 2004 Intrakranielle Ependymome Bestrahlungstechnik RT der Tumorregion / 3 D RT plan Intrakranielle Ependymome Protonentherapie / Stellenwert noch unklar Gesamtdosis: 54 CGE + 6 CGE Anaplast. Ependymom M0, R+ (HIT 2000) Junge, 2.5 Jahre Timmermann, 2006, pers. comm Intrakranielle Ependymome 3 D konformale RT (59.4 Gy), boost stereotakt. 2 x 4.0 Gy, 5 Jahre, Ependymom Gr. II (INT Mailand) Boost / Dosisverteilung 7 Monate nach Bestrahlung Gandola et al., 2007, pers. comm. Niedriggradige Gliome Radiotherapie ist traditionell die Therapie der Wahl nach der Operation Erhalt der Sehkraft Tumorkontrolle Visus 0.1 MR Konf. RT 54 Gy 3 Jahre n. RT Visus 1.0 Niedriggradige Gliome SIOP – HIT LGG 96 / sof. RT versus RT nach Chx. Wahrscheinlichkeit Progressionsfreies ÜL Sof. RT : n = 91 5 Jahre PFS : 60.3% RT nach Chx. : n = 19 5 Jahre PFS : 43.8% p=n.s. Gesamt ÜL Sof. RT : n = 91 5 Jahre OS : 93.4% RT nach Chx.: n = 19 5 Jahre OS : 94.4% p=n.s. Niedriggradige Gliome Hirnleistung / moderne RT Techniken Autor Pat. Alter Dosis Ergebnis Debus 1999 10 med. 12 J. med 52.4 Gy 2/10 Lern probleme (NF 1 pos.) Hug 2002 27 n.m. 50.4 63 CGE Kein Abfall in der Lansky performance scale Fouladi 2003 36 mittl. 7.9 J. med. 52.2 Gy FSIQ : 85.9 Diagnose 5 Jahre n. RT : 91.5 Hochmaligne Gliome / Radiotherapie Rezidivtherapie bei hochmalignen Gliomen - Operation ? - Erneute Bestrahlung - Chemotherapie Rezidiv eines Glioblastoma multiforme / 17 j. Junge Rezidiv eines Glioblastoms : hypofraktionierte, stereotaktische Bestrahlung / Isodosenverteilung Komplette Remission des Rezidives 1 Jahr nach Bestrahlung Hochmaligne Gliome / Radiotherapie „Targeting“ Methionin-PET bei hochmalignem Gliom zur Definition des klinischen Zielvolumens / z.B. Rezidivbestrahlungen Hochmaligne Gliome / Radiotherapie Funktionelle Bildgebung in der Zielvolumenbestimmung Spektroskopie Radiobiologie – neurokognitive Dysfunktionen Hippocampus Leistungen Lernen Gedächtnis Aufmerksamkeit Handlungsfunktionen Neurogenese Entwicklung Regeneration Kraniopharyngeom / Radiotherapie 3 D konformale RT 3 – D konformale Radiotherapie Ependymom / 3 D RT Tumorbett, Dosiseskalation 59,4 Gy (Merchant et al, 2004) Behandlungsnetzwerk HIT Pfade für Informationstransfer / radioonkol. Fragestellungen / Qualitätssicherung Studien : HIT 2000, HIT SIOP LGG 2004, HIT GBM, HIT Kraniopharyngeom, SIOP CNS GCT, HIT AT-RT, SIOP CPT 2000, HIT REZ 2005 Teilnehmende Kinderklinik Referenzzentren Neurochirurgie Neuroradiologie Neuropathologie Oldenb. D‘dorf Bonn Teilnehmende Radioonkologie Studien-Ref.-Zentr Strahlentherapie Referenznetz Studiennetz Kliniknetz Halle Leipzig Würzburg Augsburg (Regensburg) Behandlungsnetzwerk SIOP SIOP Brain Tumour Committee, 7 Forschungsgruppen / Mitglieder aus 18 Ländern Europas Europaweite Forschungsprojekte Vernetzung der Arbeitsgruppen Translationale Forschung Klinische Forschung Umsetzung in Therapiestandards RT – Konzepte / päd. Neuroonkologie Fazit / Ausblick ¾ Hyperfraktionierung / Dosiseskalation Medulloblastom, Ependymom radiobiologische Schonung von Normalgewebe ¾ Integrierung moderner Technologien Qualitätssicherung / Standards Moderne Bildgebung zur RT - Planung Protonen ? (Arbeitsgruppe der APRO) ¾ Reduktion von Normalgewebsbelastungen Senkung von Nebenwirkungsprofilen Monitoring der Dosisbelastungen Modelle zur Risikoabschätzung / Planoptimierung ¾ Einbettung in nationale / internat. Netzwerke Optimierung durch interdiszipl. Konzepte Wir stehen Ihnen für Auskünfte jederzeit zur Verfügung