RT – Konzepte / päd. Neuroonkologie
Werbung
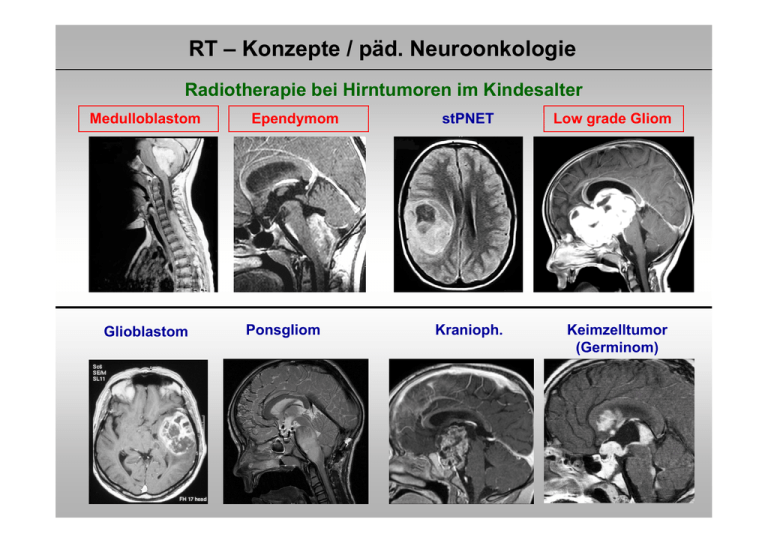
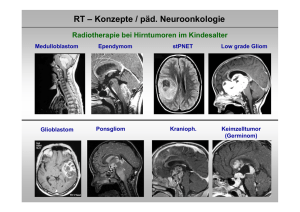
RT – Konzepte / päd. Neuroonkologie Radiotherapie bei Hirntumoren im Kindesalter Medulloblastom Glioblastom Ependymom Ponsgliom stPNET Kranioph. Low grade Gliom Keimzelltumor (Germinom) RT – Konzepte / päd. Neuroonkologie Wirkung der Strahlung Strahlung wirkt nur dort, wo sie gegeben wird (im Gegensatz zur Chemotherapie) Bestimmung des Zielgebietes (Tumorregion und Gebiete mit Tumorzellkontamination) RT – Konzepte / päd. Neuroonkologie Wirkung der Strahlung Zielvolumenkonzept 1. Liquorraum (Neuroachse) Medulloblastom ,Keimzelltumoren 2. Ganzhirn Leukämien 3. Nur Tumorregion(Aufsättigung nach Neuroachse) Ependymom, niedriggradiges Gliom, Kraniopharyngeom…… RT – Konzepte / päd. Neuroonkologie Wirkung der Strahlung Optimale Tumorkontrolle 1. Sichere Erfassung des Zielgebietes Ort und Ausbreitungsneigung des Tumors (exakte Darstellung / Bildgebung) 2. Ausreichende Dosis Gewebstyp und Tumorlast (Sichtbarer Tumor erfordert eine höhere Dosis als Gebiete mit Kontamination (= subklinischer Befall) RT – Konzepte / päd. Neuroonkologie Produktion von Strahlung / Linearbeschleuniger Feldformung durch Multi-leaf Kollimator RT – Konzepte / päd. Neuroonkologie Produktion von Strahlung / Protonen Boston PSI / Villigen Dosisverteilung Applikation RT – Konzepte / päd. Neuroonkologie Nebenwirkungen der Strahlung Reduktion von Therapiefolgen 1. Ausspaarung von Risikoorganen (geometrisch) exakte Darstellung / Bildgebung exakte Tumorerfassung („konformierend“) 2. Höhe der Einzeldosis (biologisch) niedrige Einzeldosis / viele Fraktionen 3. Höhe der Gesamtdosis möglichst gering 4. Begleittherapie (Chemotherapie) Substanzen / zeitl. Sequenz (Vermeidung d. Chx.) RT – Konzepte / päd. Neuroonkologie HIT – Netzwerk / Protokolle mit Radiotherapie HIT 91 / Folgestudie HIT 2000 SIOP / GPOH –LGG 96 Folgestudie SIOP / GPOH –LGG 2004, HIT GBM A, HIT GBM B, HIT GBM C, Folgestudie HIT GBM D / Folgestudie HIT HGG HIT – REZ 97 / Folgestudie HIT – REZ 2005 Seltene Tumoren (AT/RT, spinale Tumoren) Kraniopharyngeom 2000 SIOP CNS GCT 96 Folgestudie SIOP CNS GCT HIT – Netzwerk / Radiotherapie Pfade für Informationstransfer / radioonkol. Fragestellungen / Qualitätssicherung Studien : HIT 2000, HIT SIOP LGG 2004, HIT GBM, HIT Kraniopharyngeom, SIOP CNS GCT, HIT AT-RT, SIOP CPT 2000, HIT REZ 2005 Teilnehmende Kinderklinik Referenzzentren Neurochirurgie Neuroradiologie Neuropathologie Oldenb. Hamburg Münster Referenznetz Studiennetz Kliniknetz Halle Bonn Teilnehmende Radioonkologie Studien-Ref.-Zentr Strahlentherapie Würzburg Augsburg Leipzig RT – Konzepte / päd. Neuroonkologie Ziel : reproduzierbare und präzise Bestrahlung RT – Konzepte / päd. Neuroonkologie Anforderungen an eine optimale Radiotherapie Spannungsfeld zwischen Tumorkontrolle und Nebenwirkungen Dosis / Wirkungsbeziehungen Toleranz dosis Tumorkontrolle Risikogebiet für Rückfall Nebenwirkung Risikoorgan Vol (%) DVH Tumor Risikoorgane Dosis (%) Lagerungstechniken / 3 D konformale Radiotherapie Präzise Positionierung Lagerungstechniken / 3 D konformale Radiotherapie Präzise Positionierung Feldlicht Prospektive Studien HIT 2000 / SIOP PNET IV (Kinder ab 4 Jahren / Jugendliche) Ziele : Verbesserung der lokalen Tumorkontrolle und Überlebenszeiten durch Hyperfraktionierung Medulloblastom st PNET Lokale Dosiseskalation und Schonung von Normalgewebe + Qualitätssicherung Ependymom Kortmann, Kühl (Würzburg) Prospektive Studien HIT 2000 / SIOP PNET IV (Kinder ab 4 Jahren / Jugendliche) Radiobiologischer Hintergrund 2 x 1.0 Gy pro Tag Tagesdosis wird in zwei Sitzungen aufgeteilt, um eine bessere Erholung von Normalgewebe zu erlauben (Senkung von Therapiefolgen) (8 Std. zwischen Frakt.) biologisch höhere Tumordosis („Früh reagierendes Gewebe“) erlaubt eine Aufsättigung der Tumorregion biologisch niedrigere Normalgewebsdosis schont das gesamte ZNS bei der Neuroachsen-RT Medulloblastom / „standard risk“ / MSFOP 98 Hyperfraktionierte Radiotherapie beim Medulloblastom MSFOP 98 : erkrankungsfreies Überleben 1,0 MSFOP 98 ( Std ) 3Y = 82% ,9 Überleben (%) ,8 MSFOP 98 ( Std + Meta ) 3Y = 79% ,7 12/98 → 10/01 : 55 Patienten < 19 Jahre Nachbeob. : 46 Monate Mittl. Alter : 9.9 Jahre (5.1 bis 15.8 Jahre) ,6 ,5 ,4 nur hfx (keine Chx.) standard risk MB CSA : 36 Gy / 2 x 1.0 Gy / Tag Tumorboost: 68 Gy / 2 x 1.0 Gy / Tag ,3 ,2 ,1 0,0 0 12 24 36 48 Zeit nach Beginn der Radiotherapie / Monate 60 Carrie et al., 2005 Prospektive Studien HIT 2000 / SIOP PNET IV (Kinder ab 4 Jahren / Jugendliche) SIOP / HIT PNET IV („standard risk“) Randomisierte Phase III Studie OP. Hyperfr. RT (2x1.0 Gy /Tg) CSA : 36 Gy / boost HSG 60 Gy, Tumor 68 Gy + Vincristin Random. Konv. RT (1x1.8 Gy /Tg) CSA : 23,4 Gy / boost HSG 54 Gy + Vincristin Beide Arme 8 x Cispl., CCNU, VCR alle 6 Wo. HIT – Netzwerk / Radiotherapie HIT SIOP PNET 4 EFS According to RT vs HFRT Event Free Survival (336/339) HIT – Netzwerk / Radiotherapie PNET 4 patients stratified with criteria for PNET 5, PNET 6 and PNET-HR. Patients without biological markers included / May 2009 Dose reduction ? Dose intensification ? 0.91 ± 0.06 (PNET 5-criteria) n= 23 0.77 ± 0.06 (Patients without any biol. markers) 0.77 ± 0.06 (PNET 6-criteria; with all markers) n=128 n= 92 0.56 ± 0.08 (PNET HR-criteria) n= 64 EFS p overall = 0.03 PNET HR-criteria: LCA + Residual tumor >1.5 cm2 +/Β-catenin +/cmyc/nmyc + PNET 5-criteria: LCA No Residual tumor >1.5 cm2 Β-catenin +. cmyc/nmyc - All Residual tumors >1.5 cm2 are included in the PNET-HR group. PNET 6-critera with markers: LCA No Residual tumor >1.5 cm2 Β-catenin cmyc/nmyc - Patients without markers: LCA No Residual tumor >1.5 cm2 Biol. Markers- not complete Biol. Markers- not complete HIT – Netzwerk / Radiotherapie EFS according to metastasis stage* (HIT91) 10-y EFS (± SE) •M0 n = 114; 65 % ± 5 % •M0 therapy maintenance n = 45; 83 % ± 6 % •M1 n = 33; •M2/3 n = 40; 54 % ± 9% 36 % ± 8 % *Long term outcome and clinical prognostic factors in children with medulloblastoma treated in the prospective randomised multicentre trial HIT 91 from K.v. Hoff et.al, submitted and accepted, Eur.J.C. 2009 HIT – Netzwerk / Radiotherapie MET – HIT 2000 / EFS for RT-Duration <= 46 days vs. > 46 days, n=38 patients with 68,0 Gy, only M2/3; n = 10 relapses, Survival function Cumulative survival <= 46 days, n = 8 > 46 days; n =30 Therapy : Postop. chx (2x HIT SKK) followed by hfx RT 2 x 1,0 Gy / day, 40,0 Gy , boost 50 – 68 Gy 4x „Packer“ chx. EFS <= 46 days 3y EFS: 87,5% ±11,7% n = 1 relapses > 46 days 3y EFS: 76,4% ± 7,8% n = 9 relapses p-value of the likelihood-ratio test: p = 0,354 95% confidence intervall: [4,7;6,3] HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos M.-B., 8 Jahre, stPNET links frontal ED 04/2004 MRT-Diagnostik des Tumors links frontal / Z.n. partieller Resektion Resttumor ohne KM Anreicherung HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos HIT 2000 / Boostplanung / 68 Gy / 2 x 1,0 Gy /Tag HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos MR: 3 Wochen nach Radiatio / Rezidiv ? HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos MR: 11 Wochen nach Radiatio / Rückfall ? PET: Keine Areale erhöhter Glukoseaufnahme, damit kein Hinweis auf vitales Tm-Gewebe Tumorzelluntergang HIT 2000 / stPNET – Akuttoxizität – Tumorreaktion auf hfx / symptomlos 6 Monate nach Radiatio Komplette Remission Ependymom Intrakraniell (60%) Supratentoriell : 30% Infratentoriell : 70% 4-16 Jahre (ca) Supratent : 35% Infratent : 50% Spinal (30%) Intramedullär (thoracal) (10%) Extramedullär (lumbar) (20%) 4-16 Jahre (ca) Intramed : 10% Conus 5% Schiffer et al., 1991 Verteilungsmuster Metastasen Extramedullär < 5 – 10% Ependymom Impact of postop. RT on outcome Overall survival / infratentorial tumours / SEER data bank RT : 116 pat. 57.1% No RT : 68 pat. 48.2% P = 0.018 McGuire al., 2009 Ependymom Anapl. Ependymom / HIT 88/89/91 Rückfallfreies Überleben / Resttumor 1 0.9 83.3% 0.8 0.7 Kompl. Res. (n=28) Inkompl. Res. (n=27) 62.4% probability 0.6 0.5 0.4 0.3 p = 0.0043 0.2 38.5% 30.8% 0.1 0 0 20 40 months 60 Timmermann et al., 2000 Intrakranielle Ependymome Dosis – Wirkungsbeziehung Europäische Erfahrungen / „pooled data“ 1,0 Complete Removal (n=60) ,9 ,8 HFRT (n=44) ,7 Disease Free Survival (%) ,6 ,5 ,4 RT standard (n=16) ,3 ,2 ,1 0,0 0 12 24 36 Months after diagnosis 48 60 72 84 96 108 120 HIT – Netzwerk / Radiotherapie E-HIT 2000_AB4: Ependymome >4 Jahre: R0 vs. any R+ (vor Amendment) RT tumour site Hfx 68-72Gy <4 Jahre > 4 Jahre Gesamt R0 2/19 (11%) 2/30 (7%) 4/49 (8%) R+ 11/19 (58%)* 4/11 (36%)** 15/30 (50%) EFS p = 0.013 OS p = 0.54 Dosis Temporallappen 100 % Volume 80 Früher 60 Heute 40 20 0 0 1000 2000 3000 4000 Dose (Gy) 5000 6000 Merchant, 2004 Intrakranielle Ependymome Bestrahlungstechnik RT der Tumorregion / 3 D RT plan Niedriggradige Gliome Radiotherapie ist traditionell die Therapie der Wahl nach der Operation Erhalt der Sehkraft Tumorkontrolle Visus 0.1 MR Konf. RT 54 Gy 3 Jahre n. RT Visus 1.0 Niedriggradige Gliome SIOP – HIT LGG 96 / sof. RT versus RT nach Chx. Wahrscheinlichkeit Progressionsfreies ÜL Sof. RT : n = 91 5 Jahre PFS : 60.3% RT nach Chx. : n = 19 5 Jahre PFS : 43.8% p=n.s. Gesamt ÜL Sof. RT : n = 91 5 Jahre OS : 93.4% RT nach Chx.: n = 19 5 Jahre OS : 94.4% p=n.s. HIT – Netzwerk / Radiotherapie SIOP LGG 2004 Radiotherapy (Germany) LGG of Chiasmatic and Hypothalamic area Visual acuity: right/left eye grading from last follow up (response assessment) Worse acuity 4% No data n = 7 /25 (28%) No data 28 % no data Better acuity n = 5 / 25 (20%) better visus stable visus Stabel acuity n = 12 / 25 (48%) Worse acuity n = 1 / 25 (4%) 48% Stable acuity worse visus 20% Better acuity Niedriggradige Gliome der supratentoriellen Mittellinie Moderne Bestrahlungstechniken / Ergebnisse Autor Dosis Pat. Ergebnis Nachb Debus et al., 1999 Median 52.4 Gy / 1.6-2.0 Gy Sicherheitssaum 7 mm 10 5 J. PFÜ : 90%, 5 J. Gesamt-ÜL : 100% Keine Akuttoxizität 12-72 Mon. Merchant et al., 2002 Median 54 – 59.4 Gy / 1.8 Gy Sicherheitssaum 15 mm 38 4 Rückfälle (3 innerhalb CTV, 1 Feldrandrezidiv 17 Mon. Saran et al., 2002 Median 50 – 55 Gy / 30 – 33 Fr. Sicherheitssaum 5 bis 10 mm 14 3 J. PFÜ : 87%, 3 J. Gesamt-ÜL : 100% 1 Rückfall innerhalb GTV 33 Mon. Hug et al., 2002 Protonen 50.4 – 63.0 CGE 1,8 Gy Sicherheitssaum : k.A. 27 Lokale Kontrolle Hemisph. 71% Dienceph. 87% Hirnstamm 60% 3,3 Jahre Marcus et al., 2005 Stereotaktische Konvergenztechnik Median 52,2 Gy / 1,8Gy 2 mm Sicherheitssaum 81 Überleben 86 % 93% 60% 5 J./ 8 J PFÜ : 82,5% / 65% 5 J./ 8 J. Gesamt-ÜL : 97,8% / 82% 6 lokale Rückfälle Alle innerhalb RT-Feld 6,9 Jahre Niedriggradige Gliome der supratentoriellen Mittellinie Event-free survival (EFS; gold line) and overall survival (OS; blue line) for pediatric patients with low-grade glioma Merchant, T. E. et al. J Clin Oncol; 27:3598-3604 2009 Low grade glioma / concepts for clinical trials / children Radiosurgery 5 year progression free survival, 49 patients (21 pat. pilocyt. Astrocytoma) Gamma - knife : 15 Gy periph. dose 5 year PFS : 41% Heppner et al., 2002 Spätfolgen nach Therapie von Tumoren des ZNS RT CSA Anapl. Ependymom Eineiige Zwillinge M. Bamberg Spätfolgen nach Therapie von Tumoren des ZNS 6 Jahre alt Eineiige Zwillinge Kraniopharyngeom Z.n. mehrf. Op.‘s Keine Bestrahlung Spätfolgen nach Therapie von Tumoren des ZNS Wachstumsverzögerung / SDH Substitution Regression der Endgröße Abhängigkeit von Zielvolumen und zusätzlicher Chemotherapie Ogilvy et al., 1995 Jahre Spätfolgen nach Therapie von Tumoren des ZNS Ependymom / alleinige 3 D RT nur Tumorgebiet / IQ 120 110 100 IQ 90 80 70 All patients Age > 3 years Age < 3 years Baseline (p=0.034) Age < 3 vs. Age > 3 60 50 0 12 24 Time (months) 36 48 Merchant et al., 2004 Spätfolgen nach Therapie von Tumoren des ZNS Abfall neurokog. Leistungen Medulloblastom / CSI 23.4 / 36 Gy + Chemotherapie „Older age“ / 23.4 Gy „Younger age“ / 23.4 Gy „Older age“ / 36- 39.4 Gy „Younger age“ / 36- 39.4 Gy Mulhern et al., 2004 Radiobiologie – neurokognitive Dysfunktionen Hippocampus Leistungen Lernen Gedächtnis Aufmerksamkeit Handlungsfunktionen Neurogenese Entwicklung Regeneration Kraniopharyngeom / Radiotherapie 3 D konformale RT Spätfolgen / Zweittumoren (nicht nur ZNS) Inzidenz und Risiko für Zweittumoren bei Kindern mit therapierten Tumorerkrankungen (0 bis 17 Jahre) SEER 1973 bis 2002 / USA (Inskip et al., 2007) (Bisher einzige publ. Serie mit „Beobachtet / Erwartet“ Kalkulation) Das relative Risiko A ) für eine soliden Tumor (2. Tumor) nach alleiniger RT : 2,8 fach nach alleiniger Chx : 2,1fach nach Chx./RT : 3,2 fach B) für eine akute nicht-lymphatische Leukämie (2.Tumor) nach alleiniger RT : 2,5 fach nach alleiniger Chx : 13,9 fach Bestrahlung mit Chemotherapie und alleinige Chx. : hohes Risiko für 2. Malignom RT – Konzepte / päd. Neuroonkologie Fazit / Ausblick ¾ Hyperfraktionierung / Dosiseskalation Medulloblastom, Ependymom radiobiologische Schonung von Normalgewebe ¾ Integrierung moderner Technologien Qualitätssicherung / Standards Moderne Bildgebung zur RT - Planung ¾ Reduktion von Normalgewebsbelastungen Senkung von Nebenwirkungsprofilen Monitoring der Dosisbelastungen Modelle zur Risikoabschätzung / Planoptimierung ¾ Einbettung in nationale / internat. Netzwerke Optimierung durch interdiszipl. Konzepte Wir stehen Ihnen für Auskünfte jederzeit zur Verfügung