pH Wert - lehrer.uni
Werbung

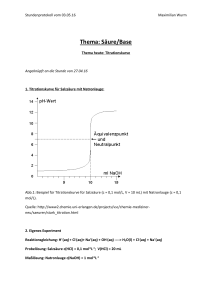
CH / Bs PRAKTIKUM SÄURECHARAKTER DER CARBONSÄUREN CARBONSÄUREN -2- Seite 1 Geräte Reagenzgläser, Reagenzglasgestell, Netzgerät (Wechselspannung), 2 Vielfachmessgeräte, pH-Meter, Stativmaterial, Vollpipetten 10 mL, Messkolben 100 mL, Pipettierhilfe, Bechergläser Chemikalien Salzsäure (c = 1 mol∙L-1), Essigsäure (c = 1 mol∙L-1), dest. Wasser Durchführung Bauen Sie die Anordnung für die Messung der elektrischen Leitfähigkeit und die Anordnung für die Messung des pH-Wertes nebeneinander auf. 1. Aufbau der Leitfähigkeitsmessung Befestige dabei den Leitfähigkeitsprüfer so an einem Stativ, dass du das Reagenzglas (wie abgebildet) unter den Leitfähigkeitsprüfer bringen und wieder entfernen kannst. Stelle das Voltmeter auf den Messbereich 30 V Wechselspannung und das Ampèremeter auf 200mA Wechselstrom. Lasse die Schaltung vom Lehrer prüfen. 2. Aufbau der pH-Messung Nimm die pH-Elektrode aus der Aufbewahrungsflüssigkeit und befestige die Elektrode so an einem Stativ, dass du das Reagenzglas (wie abgebildet) unter die Elektrode bringen und wieder entfernen kannst. Lasse den Aufbau vom Lehrer prüfen. 3. Durchführung der Messung mit Essigsäure ▫ Gib in ein Reagenzglas ca. 3 mL Essigsäure der Konzentration c0 = 1 mol∙L-1 , bringe das Reagenzglas unter die Anordnung zur Leitfähigkeitsmessung und notiere Strom und Spannung in unten stehender Tabelle. ▫ Führe mit derselben Essigsäure-Lösung eine pH-Messung durch und notiere das Ergebnis ebenfalls in unten stehender Tabelle. ▫ Verdünne nun die Essigsäure-Lösung auf c1 = 0,1 mol∙L-1 indem du V = 10 mL der EssigsäureLösung mit c0 = 1 mol∙L-1 abpipettierst und in den Messkolben (V = 100 mL) überführst. Verdünne bis zur Eichmarke mit dest. Wasser und vermische durch mehrmaliges Umschütteln. ▫ Führe nun mit dieser Essigsäure-Lösung (c1 = 0,1 mol∙L-1) wieder eine Strom-Spannungs- und eine pH-Messung durch. Notiere die Werte in der Tabelle. ▫ Gieße die Lösung in ein Becherglas, entnimm wiederum 10 mL und stelle im Messkolben (vorher gründlich mit dest. Wasser gespült) eine Essigsäure-Lösung der Konzentration c2 = 0,01 mol∙L-1 her........ usw. 4. Durchführung der Messung mit Salzsäure ▫ Führe die Messreihe analog der Anleitung zur Messung mit der Essigsäure durch. D:\841124516.doc Seite 1 CH / Bs PRAKTIKUM CARBONSÄUREN SÄURECHARAKTER DER CARBONSÄUREN -2- Seite 2 Messtabelle Konzentration U c in mol∙L-1 in V I in mA in S pH c(H3O+) in mol∙L-1 Essigsäure 1 Salzsäure 1 Essigsäure 0,1 Salzsäure 0,1 Essigsäure 0,01 Salzsäure 0,01 Nachbereitung und Entsorgung ▫ ▫ ▫ ▫ Gib alle Lösungen in den Entsorgungsbehälter "Säuren ohne Schwermetalle". Alle Glasgeräte gründlich reinigen, mit dest. Wasser nachspülen und auf das Trockengestell hängen. Alle anderen Geräte an ihren Platz zurückbringen. TISCH REINIGEN nicht vergessen. Auswertung ▫ ▫ ▫ Formuliere für die Reaktion von Essigsäure mit Wasser und für die Reaktion von Chlorwasserstoff mit Wasser jeweils eine Reaktionsgleichung unter Verwendung von Strukturformeln. Kennzeichne Säure bzw. Base. Berechne für die Lösungen von Essigsäure bzw. Salzsäure jeweils die Konzentration der OxoniumIonen in der Lösung aus der Definition des pH-Wertes pH = - log c(H3O+) und trage die Werte in die Tabelle ein. Interpretiere die Ergebnisse deiner Messung. Gehe dabei auf die Vollständigkeit der Reaktion der entsprechenden Säure mit Wasser ein. D:\841124516.doc Seite 2