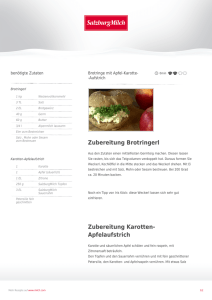
DISS pdf letzte - TiHo Bibliothek elib
Werbung

Tierärztliche Hochschule Hannover Institut für Tierernährung Untersuchungen zu Effekten der Vermahlungsintensität (fein/grob) sowie von Futteradditiven (Ameisen- und Propionsäure/Kaliumdiformiat) im pelletierten Alleinfutter unter den Bedingungen einer experimentellen Infektion von Absetzferkeln mit Salmonella Derby und Escherichia coli INAUGURAL – DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin - Doctor medicinae veterinariae (Dr. med. vet.) Vorgelegt von Yasmin Hassan aus Hamm Hannover 2008 Wissenschaftliche Betreuung: Univ.-Prof. Dr. J. Kamphues 1. Gutachter: Univ.-Prof. Dr. J. Kamphues 2. Gutachter: Univ.-Prof. Dr. K.-H. Waldmann Tag der mündlichen Prüfung: 16.05.2008 Diese Arbeit wurde dankenswerter Weise durch Mittel der BASF-AG Ludwigshafen gefördert. Meiner Mutter und Christian Wissenschaftliche Veröffentlichungen: HASSAN, Y., M. NEU, V. TAUBE, J. VERSPOHL u. J. KAMPHUES (2007): Effects of feed particle size (coarse/fine) and addition of organic acids or potassium diformate on counts of E. coli and Salmonella in chyme after an experimental infection of weaned pigs. Proceedings, S. 329 13th International Conference on Production Diseases in Farm Animals Leipzig, Deutschland, 29.07. – 04.08.2007 TAUBE, V., M. NEU, Y. HASSAN u. J. KAMPHUES (2007): Einflüsse von Futterstruktur und verschiedenen Additiven (organische Säuren, KDF) auf den pH-Wert im Mageninhalt von Absetzferkeln. Kurzfassung im Tagungsband der Veranstaltung, S. 7-12 bpt-Kongress Bremen, Deutschland, 11. – 14.10.2007 HASSAN, Y., M. NEU, V. TAUBE u. J. KAMPHUES (2007): Investigations on counts of E. coli in weaned pigs experimentally infected with E. coli related to grinding intensity and use of additives (organic acids, potassium diformate). Proceedings, S. 131 11th Conference of the European Society of Veterinary and Comparative Nutrition Leipzig, Deutschland, 01. – 03.11.2007 Inhaltsverzeichnis Tabellenverzeichnis Abbildungsverzeichnis 1 Einleitung ................................................................................................................................ 1 2 Schrifttum................................................................................................................................ 3 2.1 Gesundheitliche Probleme in der Absetzphase ................................................................ 3 2.2 Escherichia coli................................................................................................................ 4 2.2.1 Eigenschaften und Nachweismöglichkeiten von E. coli ........................................... 5 2.2.1.1 Gattungsmerkmale ............................................................................................. 5 2.2.1.2 Antigenstruktur................................................................................................... 5 2.2.1.3 Morphologische Eigenschaften .......................................................................... 6 2.2.1.4 Kulturelle Eigenschaften .................................................................................... 6 2.2.1.5 Serologische Eigenschaften................................................................................ 7 2.2.1.6 Biochemische Eigenschaften.............................................................................. 7 2.2.2 Die Kolidiarrhoe........................................................................................................ 7 2.2.2.1 Pathogenese........................................................................................................ 7 2.2.2.2 Klinisches Bild und Verlauf............................................................................... 9 2.2.2.3 Pathologisch-anatomische Veränderungen ...................................................... 10 2.2.2.4 Diagnose........................................................................................................... 10 2.2.2.5 Therapie............................................................................................................ 11 2.2.2.6 Prophylaxe........................................................................................................ 11 2.3 Salmonellen.................................................................................................................... 13 2.4 Leistungsförderer ........................................................................................................... 13 2.4.1 Antibiotische Leistungsförderer.............................................................................. 14 2.4.2 Nicht-antibiotische Leistungsförderer..................................................................... 15 2.4.2.1 Wirkungsweise organischer Säuren ................................................................. 17 2.4.2.2 Wirkungsweise der Salze organischer Säuren ................................................. 20 2.5 Futterstruktur.................................................................................................................. 21 3 Material und Methoden ......................................................................................................... 26 3.1 Versuchsziel ................................................................................................................... 26 3.2 Versuchsablauf ............................................................................................................... 27 3.3 Versuchstiere.................................................................................................................. 30 3.4 Haltung ........................................................................................................................... 31 3.5 Versuchsfutter und Fütterung......................................................................................... 32 3.6 Experimentelle Infektion mit Salmonella Derby ........................................................... 35 3.6.1 Infektionsstamm ...................................................................................................... 35 3.6.2 Herstellung der Infektionsbouillon.......................................................................... 35 3.6.3 Orale Infektion der Tiere......................................................................................... 36 3.7 Experimentelle Infektion mit E. coli .............................................................................. 36 3.7.1 Infektionsstamm ...................................................................................................... 36 3.7.2 Herstellung der Infektionsbouillon.......................................................................... 36 3.7.3 Orale Infektion der Tiere......................................................................................... 37 3.8 Sektion............................................................................................................................ 37 3.9 Mikrobiologische Untersuchungen ................................................................................ 39 3.10 Sonstige Untersuchungen ............................................................................................. 41 3.10.1 Analyse der Versuchsfutter .................................................................................. 41 3.10.2 Untersuchung von Chymusproben ........................................................................ 45 3.10.2.1 Parameter........................................................................................................ 45 3.10.2.2 Probenaufbereitung und -untersuchung ......................................................... 45 3.11 Berechnungen............................................................................................................... 47 3.12 Statistische Methoden .................................................................................................. 48 4 Ergebnisse ............................................................................................................................. 49 4.1 Futteraufnahme, Tageszunahmen und Futteraufwand ................................................... 50 4.2. Untersuchung der Rektaltupfer auf Salmonellen .......................................................... 51 4.3.1 Klinische Symptome nach der ersten experimentellen E. coli- Infektion................... 55 4.3.2 Untersuchung der Rektaltupfer auf E. coli.................................................................. 56 4.4 Chymus........................................................................................................................... 57 4.4.1 Füllung des Verdauungskanals................................................................................ 58 4.4.2 TS-Gehalte .............................................................................................................. 58 4.4.3 pH-Werte................................................................................................................. 59 4.4.4 Laktat-Gehalte......................................................................................................... 60 4.4.5 Formiat-Gehalte ...................................................................................................... 61 4.4.6 Flüchtige Fettsäuren ................................................................................................ 61 4.5 Qualitativer Salmonellennachweis in verschiedenen Organen ...................................... 63 4.6 E. coli-Keimzahlen im Chymus ..................................................................................... 64 4.6.1 Quantitativer E. coli-Nachweis im Chymus von Tieren nach erstmaliger Infektion .......................................................................................................................................... 65 4.6.2 Quantitativer E. coli-Nachweis im Chymus von Tieren nach der zweiten experimentellen Infektion ................................................................................................ 65 5 Diskussion ............................................................................................................................. 67 5.1 Kritik der Methode ......................................................................................................... 68 5.1.1 Alter und Immunstatus der Tiere ............................................................................ 68 5.1.2 Infektionen mit E. coli-Keimen............................................................................... 69 5.1.3 Futterstruktur........................................................................................................... 71 5.2 Diskussion der Ergebnisse ............................................................................................. 72 5.2.1 Leistung................................................................................................................... 72 5.2.1.1 Einfluss der Futterstruktur................................................................................ 72 5.2.1.2 Einfluss der Futteradditive ............................................................................... 74 5.2.2 Chymusqualität und –zusammensetzung ................................................................ 76 5.2.2.1 Einfluss der Futterstruktur................................................................................ 76 5.2.2.2 Einfluss der Futteradditive ............................................................................... 81 5.2.3 Experimentelle Infektion mit Salmonella Derby .................................................... 87 5.2.4 Experimentelle Infektion mit E. coli ....................................................................... 87 5.2.4.1 Klinische Symptomatik nach Erstinfektion...................................................... 87 5.2.4.2 Fäkale Ausscheidung nach Erstinfektion ......................................................... 88 5.2.4.3 Keimzahlen im Chymus unter dem Einfluss der Futterstruktur....................... 89 5.2.4.4 Keimzahlen im Chymus unter dem Einfluss der Futteradditive ...................... 92 6 Zusammenfassung................................................................................................................. 95 7 Summary ............................................................................................................................... 98 8 Literaturverzeichnis............................................................................................................. 101 9 Anhang ................................................................................................................................ 112 Tabellenverzeichnis Tabelle 1: Mindest-/Maximalgehalte der bis 2006 zugelassenen Leistungsförderer in der Schweineproduktion................................................................................................................. 15 Tabelle 2: Effekte von Leistungsförderern auf Tageszunahmen und Futteraufwand (in %) ............................................................................................................................................. 15 Tabelle 3: Überblick zum Einsatz freier Säuren in der Schweineproduktion .......................... 18 Tabelle 4: Effekte von Ameisensäure und Calciumformiat auf die Keimzahlen im Duodenum von Ferkeln (modifiziert nach KIRCHGESSNER et al. 1992)............................ 21 Tabelle 5: Vergleich der vier verschiedenen eingesetzten Mischfutter in den eigenen Untersuchungen........................................................................................................................ 26 Tabelle 6: Versuchsablauf........................................................................................................ 30 Tabelle 7: Zur Verteilung der Partikelgrößen (Angaben = Massenprozente) im pelletierten Mischfutter auf der Basis fein bzw. grob vermahlener Ausgangskomponenten ............................................................................................................ 33 Tabelle 8: pH-Werte und Pufferkapazitäten der eingesetzten Alleinfutter .............................. 34 Tabelle 9: Abschnitte des MDT und entsprechende Untersuchungsparameter post mortem ..................................................................................................................................... 45 Tabelle 10: Durchschnittliche Tageszunahmen (Angaben in kg) der Tiere in beiden Durchgängen ............................................................................................................................ 50 Tabelle 11: Futteraufwand (kg/kg KM-Zunahme) der verschiedenen Gruppen beider Durchgänge .............................................................................................................................. 51 Tabelle 12: Anteil Salmonellen-positiver Rektaltupferproben (n) an der Gesamtprobenzahl (n) nach experimenteller Infektion mit S. Derby (Durchgang 1) .............. 52 Tabelle 13: Anteil Salmonellen-positiver Rektaltupferproben (n) an der Gesamtprobenzahl (n) nach experimenteller Infektion mit S. Derby (Durchgang 2) .............. 53 Tabelle 14: Anteil Salmonellen-positiver Tupferproben an der Gesamtprobenzahl nach experimenteller Infektion (Summe Durchgang 1+2) ............................................................... 54 Tabelle 15: Anteil Salmonellen-positiver Tupferproben an der Gesamtprobenzahl nach experimenteller Infektion getrennt nach primär bzw. sekundär infizierten Tieren (in %)....... 55 Tabelle 16: Ausprägung klinischer Symptome (nur in Durchgang 1 beobachtet) nach experimenteller Erstinfektion mit E. coli (Tag 1 und 2 post infectionem) .............................. 56 Tabelle 17: Qualitativer Nachweis von hämolysierenden E. coli nach experimenteller Erstinfektion mittels Rektaltupfer (positive Proben/Gesamtprobenzahl), Durchgang 1 und 2......................................................................................................................................... 57 Tabelle 18: Füllung der verschiedenen Abschnitte des Magen-Darm-Trakts (g TS/kg KM) von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter ............................................................................................................................... 58 Tabelle 19: TS-Gehalte im Chymus (in %) der verschiedenen Abschnitte des MagenDarm-Trakts von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter............................................................................................................. 59 Tabelle 20: pH-Werte im Chymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter ................................................................................ 60 Tabelle 21: Laktat-Gehalte (mmol/kg uS) im Chymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter........................................ 60 Tabelle 22: Formiat-Gehalte (mg/l uS) im Chymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter........................................ 61 Tabelle 23: Gehalte an flüchtigen Fettsäuren (mmol/kg uS) im Magenchymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter ..... 62 Tabelle 24: Gehalte an flüchtigen Fettsäuren (mmol/kg uS) im Dünndarmchymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter ..... 62 Tabelle 25: Gehalte an flüchtigen Fettsäuren (mmol/kg uS) im Caecumchymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter ..... 63 Tabelle 26: Anteil Salmonellen-positiver Organproben an der Gesamtprobenzahl (ca. 45 Tage nach experimenteller oraler Infektion mit S. Derby)....................................................... 64 Tabelle 27: E. coli-Keimzahlbestimmung KBE (log/g uS) im Chymus von Absetzferkeln (4 Tage nach experimenteller oraler Erstinfektion) bei Einsatz unterschiedlicher pelletierter Mischfutter ................................................................................ 65 Tabelle 28: E. coli-Keimzahlbestimmung KBE (log/g uS) im Chymus von Absetzferkeln (4-5 h nach experimenteller oraler Zweitinfektion) bei Einsatz unterschiedlicher pelletierter Mischfutter ................................................................................ 66 Tabelle 29: Vergleichende Darstellung der Partikelgrößenverteilung (Anteil in %) des jeweils "grob vermahlenen" Versuchsfutters der eigenen Untersuchung mit PAPENBROCK (2004), OFFENBERG (2007) und VISSCHER (2006)................................ 71 Tabelle 30: Vergleichende Darstellung der Partikelgrößenverteilung (Anteil in %) des in den eigenen Untersuchungen verwendeten "fein vermahlenen" und "grob vermahlenen" Versuchsfutters......................................................................................................................... 72 Abbildungsverzeichnis Abbildung 1: Chronologischer Versuchsablauf (schematisch) vereinfacht dargestellt ........... 29 Abbildung 2: Stallgrundriss und Verteilung der Tiere............................................................. 32 Abbildung 3: Einteilung der Darmabschnitte zur Sektion (modifiziert nach: KÖNIG u. LIEBICH 1999)........................................................................................................................ 39 Abkürzungsverzeichnis ±s Aqua dest. AS Cae Co 1 Co 2 d D DüD E. coli Essigs. exp. Fa. fein + KDF fein + freie Säuren fl. FS GIT h i.c. i.m. i-Butters. i-Valerians. KBE KDF KM Kontrolle Lnn. M MDT ME MW n n.n. NfE n-Butters. n-Valerians. OD p PBS pH pKs p.i. Standardabweichung Aqua destillata Ameisensäure Caecum Colonanfang Colonende bis Rektum Tage Versuchsdurchgang Dünndarm Escherichia coli Essigsäure experimentell Firma fein gemahlenes Futter mit Zusatz von Kaliumdiformiat fein gemahlenes Futter mit Zusatz von freien Säuren flüchtige Fettsäuren Gastro-Intestinal-Trakt Stunde intracardial intramuskulär i-Buttersäure i-Valeriansäure Kolonie bildende Einheit Kaliumdiformiat Körpermasse Kontrollgruppe Lymphonodi Magen Magen-Darm-Trakt umsetzbare Energie Mittelwert Anzahl nicht nachgewiesen Stickstoff-freie Extraktstoffe n-Buttersäure n-Valeriansäure optische Dichte Irrtumswahrscheinlichkeit Phosphatgepufferte Kochsalzlösung potentia Hydrogenii Säuredissoziationskonstante post infectionem PS ppr Ra Rfa Rfe Rp S. Sr. Tab. TS u. uS VO vs. vRp Propionsäure postprandial Rohasche Rohfaser Rohfett Rohprotein Salmonella Säuren Tabelle Trockensubstanz und ursprüngliche Substanz Verordnung versus verdauliches Rohprotein 1 Einleitung ___________________________________________________________________________ 1 Einleitung Für Ferkel ist die Zeit des Absetzens eine besonders kritische Phase: zum einen verlieren die Tiere durch die räumliche Trennung von der Muttersau und neue Gruppenzusammenstellungen ihr gewohntes Umfeld, zum anderen werden abrupt sowohl die Flüssigkeitszufuhr als auch die Nährstoffversorgung verändert, da anstelle der Sauenmilch dann nur noch Tränkwasser und Festfutter zur Verfügung stehen. Diese Faktoren bedeuten einen erheblichen Stress, und das Tier wird krankheitsanfälliger (BÖLCSKEI et al. 1996). Dies äußert sich oft in gastrointestinalen Störungen, die enterale Kolibazillose und Ödemkrankheit spielen dabei eine große Rolle (GLOCK u. WHIPP 1986). Um diese kritische Phase möglichst verlustarm zu überstehen, wurden in der Vergangenheit häufig antibiotische Leistungsförderer als Futterzusatzstoffe eingesetzt. Dieses Vorgehen birgt jedoch sowohl Risiken für das Tier als auch für den Verbraucher (Resistenzbildungen), so dass es 2006 zum Verbot antibiotischer Leistungsförderer kam (Verordnung 1831/2003 der EG). Vor diesem Hintergrund bieten im Wesentlichen nur noch das Management, die Haltung und vor allem die Fütterung der Tiere entsprechende Ansätze zur Prophylaxe der oben genannten verlustreichen Erkrankungen. In der vorliegenden Studie sollten mögliche Einflüsse der Futterstruktur sowie eines Zusatzes organischer Säuren und deren Salz zum Mischfutter auf ein experimentelles Infektionsgeschehen mit enterotoxischen E. coli geprüft werden. Hierzu standen vier Versuchsfutter in pelletierter Form zur Verfügung: ein Mischfutter herkömmlicher Vermahlung, ein Mischfutter herkömmlicher Vermahlung mit Zusatz eines Säurengemisches bzw. mit Zusatz von Kaliumdiformiat sowie ein Mischfutter grober Vermahlung ohne die vorher genannten Zusätze. Allen Ferkeln wurden nach einer vorangegangenen Infektion mit Salmonella Derby pathogene E. coli-Keime mit dem Futter verabreicht. Hierbei interessierte insbesondere die Wirkung der unterschiedlichen Futterstruktur bzw. der Zusätze auf den Infektionsverlauf nach experimenteller Exposition mit E. coli (klinische Symptomatik, Ausscheidung) und auf die Keimzahlen im Chymus (Passage, Haftung und Vermehrung des Erregers im Gastrointestinaltrakt). Weiterhin wurden Auswirkungen auf die 2 Einleitung ___________________________________________________________________________ Chymusqualität und -zusammensetzung untersucht, um mögliche Veränderungen der Darmflora bzw. ihrer Aktivität, d. h. mögliche Wirkungsmechanismen zu erkennen. Außerdem war die Leistung der Tiere (Futteraufwand) unter dem Einfluss der verschiedenen Versuchsfutter von Interesse. Letztlich zielten diese Untersuchungen mit abgesetzten Ferkeln auf entsprechende diätetische Empfehlungen, mit denen Risiken der o. g. Infektionen minimiert werden können. 3 Schrifttum ___________________________________________________________________________ 2 Schrifttum 2.1 Gesundheitliche Probleme in der Absetzphase Die Schweineproduktion hängt maßgeblich von einer rentablen Ferkelerzeugung ab. Die Rentabilität in der Ferkelerzeugung wiederum beruht auf einer möglichst hohen Zahl an abgesetzten Tieren und deren möglichst problemlosen und zügigen Entwicklung. Deshalb ist es unter anderem ein Ziel der postnatalen Ernährung, ernährungsbedingte Verluste auf ein Mindestmaß zu reduzieren (KIRCHGESSNER 1997). Eine weitere Konsequenz dieser ökonomischen Zwänge ist das Frühabsetzen mit ca. 4 Wochen, welches zu den meist praktizierten Produktionsformen gehört (DIAL et al. 1992). Dies geschieht, um die Muttersau vor einem zu starken „Absaugen“ zu schützen, da ein zu großes Energiedefizit in der Laktation den Östrus der Sau negativ beeinflussen würde. Außerdem kann das abgesetzte Ferkel sein Wachstumspotential mit Starterfutter besser entfalten als mit der fettreichen Sauenmilch, da diese eine schnelle Sättigung bewirkt (BÖLCSKEI et al. 1996). Das Enzymsystem der Ferkel ist zum Zeitpunkt des Absetzens auf die Verwertung von Sauenmilch eingestellt und entwickelt sich erst nach weiteren 3-4 Wochen derart, dass andere Nährstoffe effektiv aufgeschlossen werden können. Dazu fällt die anfangs noch sehr hohe Lactase-Aktivität (laktoseabbauend), wohingegen der Gehalt und die Aktivität von Pepsin, Trypsin (beide proteinabbauend) und Amylase (stärkeabbauend) ansteigen. Weiterhin ist in den ersten 3-4 Lebenswochen eines Ferkels die Salzsäureproduktion im Magen noch sehr begrenzt, sie erreicht ihre volle Funktion erst mit der 7.-10. Lebenswoche (KIRCHGESSNER 1997). Beim Saugferkel entsteht infolge der mikrobiellen Fermentation des Milchzuckers durch Laktobacillen im Magen insbesondere Milchsäure, welche den pH-Wert senkt und so einer überhöhten Bakterienbesiedlung entgegenwirkt (SCHULZE u. BATHKE 1977). Mit dem Absetzen wird aber die Ernährung der Ferkel grundlegend verändert. Die Tiere werden von Sauenmilch auf ausschließlich feste pflanzliche Nahrung umgestellt, während die Aktivität von Amylase und Trypsin nur langsam ansteigen (LINDEMANN et al. 1986). Das noch nicht ausgereifte Enzymsystem der Ferkel reagiert mit einem Anstieg des Magen pHWertes, da die Milchsäureproduktion der Laktobacillen nun wegfällt und die körpereigene HCl-Produktion dies noch nicht kompensieren kann. Dadurch ist die Aktivierung von 4 Schrifttum ___________________________________________________________________________ Pepsinogen zu Pepsin eingeschränkt und so die Proteinverdauung milchfremder Futtermittel reduziert (KIRCHGESSNER 1997). Weiterhin weisen herkömmliche Prestarterfutter aufgrund ihrer relativ hohen Rohprotein- und Mengenelementgehalte eine hohe Säurebindungskapazität auf (EIDELSBURGER 1997). Die Konsequenzen eines erhöhten pHWertes im Magen sind ein verminderter Schutz des Gastrointestinaltraktes gegenüber pathogenen Mikroorganismen sowie eine verminderte Leistung durch die beeinträchtigte Proteinverdauung (KIRCHGESSNER 1997). Hinzu kommt, dass das Absetzen die größte Stresssituation im Leben eines Schweines darstellt: Das abgesetzte Tier wird meist in ein anderes Stallabteil versetzt und verliert seine Mutter. Oft findet sich das Ferkel mit der neuen Tränkesituation anfangs nicht zurecht und trinkt dementsprechend wenig. Diese Veränderungen verursachen dem jungen Tier großen Stress und machen es so besonders krankheitsanfällig (BÖLCSKEI et al. 1996). Bei den Absetzferkeln zählen die E. coli-bedingten Durchfälle und Colienterotoxämien zu den häufigsten Erkrankungen (GLAWISCHNIG 1990). BÖLCSKEI et al. (1996) stellten in ihrem Klientenkreis (große Schweinezuchtbestände in Ost- und Westeuropa) sogar fest, dass die größten finanziellen Verluste durch E. coli-bedingte Faktorenkrankheiten verursacht werden. Nach wie vor stellt der Erreger ein aktuelles Problem in der Schweineproduktion dar, das besonders vor dem Hintergrund des Verbots von Leistungsförderern antibiotischer Art neuer Lösungsansätze bedarf, die sich vor allem auf die Prophylaxe dieser Erkrankung konzentrieren. 2.2 Escherichia coli Escherichia coli (E. coli) ist der wichtigste Vertreter der Gattung Escherichia und als normaler Bewohner des Dickdarms von Menschen und warmblütigen Tieren, mit Ausnahme von Meerschweinchen und Chinchilla, ein Erreger, der im Zustand der Eubiose einen Anteil von maximal 1 % an der Gesamtdarmflora ausmacht. Bestimmte pathogene Stämme, die vom Dünndarm ausgehende Jungtiererkrankungen auslösen, haben dabei eine große wirtschaftliche Bedeutung (ROLLE u. MAYR 2002). Dies betrifft neben Kälbern vor allem Saug- und Absetzferkel. E. coli gehört zu den fakultativ anaeroben Erregern. Die meisten der gramnegativen Stäbchen sind durch eine peritriche Begeißelung beweglich. Man unterscheidet zwei 5 Schrifttum ___________________________________________________________________________ Wachstumsformen: Die S-Form wächst in mittelgroßen, leicht gewölbten, grau-weißen, feucht glänzenden Kolonien mit glattem Rand, die R-Form hingegen in kleineren Kolonien mit matter Oberfläche und gezähntem Rand. Eine weitere fakultative Eigenschaft ist die ßHämolyse auf Blutagar, die vor allem für Ferkel pathogene Serovaren betrifft, wobei diese Eigenschaft nicht unbedingt mit der Pathogenität gekoppelt ist (ROLLE u. MAYR 2002). 2.2.1 Eigenschaften und Nachweismöglichkeiten von E. coli 2.2.1.1 Gattungsmerkmale Escherichia coli gehört zu den gramnegativen fakultativ anaeroben Stäbchenbakterien, d. h. dass sie neben dem Gramverhalten sowohl zu aerobem als auch zu anaerobem Stoffwechsel fähig sind, die beide im Oxidations-Fermentations-Medium nachgewiesen werden. Es gibt eine Vielzahl von E. coli-Stämmen, die zur normalen Darmflora von Mensch und Tier gehören oder aber auch wichtige Krankheitserreger darstellen können. 2.2.1.2 Antigenstruktur Die Bestimmung der Antigenstruktur dient der Typisierung der verschiedenen Serovare. Man unterscheidet O-, H- und K-Antigene (KAUFFMANN 1944). Das O-Antigen ist ein Lipopolysaccharid, das alle Stämme der S-Form besitzen. Es ist thermostabil. Die H-Antigene bezeichnen thermolabile Geißel-Antigene, die sich entsprechend nur bei beweglichen Stämmen finden. Das K-Antigen ist das sogenannte Kapsel- oder Hüllen-Antigen. Es besitzt thermostabile und –labile Untergruppen, die mit den Buchstaben A, B und C unterschieden werden. Oft ist auch von F-Antigenen die Rede. Diese bezeichnen die Fimbrien-Antigene, die für die Adhäsion des Keimes verantwortlich sind; sie werden nach dem Kauffmann-Schema auch oft als K-Antigene benannt. In der praktischen Diagnostik genügt die Feststellung einer bestimmten O-Gruppe. Vor Nachweis des O-Antigens muss das K-Antigen allerdings durch Hitzeeinwirkung zerstört werden, da es die O-Agglutination hemmt. Innerhalb der O-Gruppe wird durch den Nachweis von Fimbrien-Antigenen und einer Enterotoxinbildung zwischen apathogenen und pathogenen Stämmen unterschieden. 6 Schrifttum ___________________________________________________________________________ Als Virulenzmerkmale werden die Fimbrien für die organspezifische Anheftung und die Fähigkeit zur Bildung von Hämolysinen und/oder Enterotoxinen angesehen. Die Enterotoxine erlauben eine Unterteilung in verschiedene Subtypen innerhalb eines Stammes: • EPEC: enteropathogene E. coli • ETEC: enterotoxische E. coli • EIEC: enteroinvasive E. coli • EHEC: enterohaemorrhagische E. coli • EAEC: enteroadhaerente E. Coli • UPEC: uropathogene E. Coli • SEPEC: sepsiserregerende E. coli (BISPING 1979). 2.2.1.3 Morphologische Eigenschaften Es handelt sich um gerade, etwa 2,0 bis 6,0 µm lange und 1,1 bis 1,5 µm breite Stäbchen. Die Mehrzahl der Stämme ist beweglich (ROLLE u. MAYR 2002). 2.2.1.4 Kulturelle Eigenschaften Die Anzüchtung von E. coli gelingt meist leicht auf einfachen Nährböden und Blutagar innerhalb von 24 Stunden bei 37 °C. Phänotypische Merkmale sind Hämolyse (bei hämolysierenden Stämmen), schleimiges Wachstum, auf Blutagar relativ große (2-4 mm), graue, feucht-glänzende Kolonien. Die Kolonien sind durch Nachweis der Lactosespaltung auf Selektivnährböden, wie z. B. Kauffmann-Platte oder Gassner-Platte von anderen Spezies zu differenzieren. Selektive chromogene Nährböden erlauben anhand der ß-Glucuronidase- und der ß- Galactosidasereaktion die Differenzierung von anderen lactosepositiven coliformen Bakterien. 7 Schrifttum ___________________________________________________________________________ 2.2.1.5 Serologische Eigenschaften Die bakteriologische Diagnose besitzt aufgrund der Zugehörigkeit von E. coli zur normalen Darmflora nur eine Aussagekraft in Verbindung mit dem Nachweis von Virulenzmarkern. Um diese zu bestimmen, stehen O:K-Testseren für Objektträgeragglutinationen zur Verfügung. Eine Bestimmung der kompletten O:K:H-Seroformel ist meist nicht notwendig, da vor allem die Fimbrienantigene und Shigatoxine von praktischer Bedeutung sind (ROLLE u. MAYR 2002). 2.2.1.6 Biochemische Eigenschaften Vor allem die Abgrenzung von anderen Enterobakterien erfolgt anhand von biochemischen Reaktionen, wobei die oben bereits genannte Laktosespaltung eine Schlüsselreaktion darstellt. Weitere Möglichkeiten bieten miniaturisierte Testsysteme wie Api®, Enterotube ® oder eine Differenzierung anhand des Verhaltens in der „bunten Reihe“ (Indikator-Verfahren zur Prüfung biochemischer Leistungen von Bakterien). 2.2.2 Die Kolidiarrhoe 2.2.2.1 Pathogenese Das klinische Bild einer enteralen E. coli-Erkrankung („Kolidiarrhoe“) entsteht, wenn sich der physiologische Dickdarmbewohner E. coli im oberen Dünndarm um das 1000- bis 10.000fache des Normalwertes von 10.000 Keimen pro 1 g Darminhalt vermehrt (WALDMANN u. WENDT 2001) und sich die Anzahl und das Verhältnis zugunsten hämolysierender zu nicht-hämolysierenden E. coli im oberen Dünndarm verschiebt (KENWORTHY u. CRABB 1963). Eine typische E. coli-Darminfektion ist streng auf den Dünndarm beschränkt und führt primär zu funktionellen Störungen in den Enterozyten. Nach oraler Aufnahme und Anheftung am Epithel vermehren sich die E. coli-Keime auf der Oberfläche der Enterozyten und bedecken ca. 20 Stunden p. inf. vollständig die Dünndarmzotten (BALJER u. WIELER 1993). 8 Schrifttum ___________________________________________________________________________ Es handelt sich dabei um eine Faktorenkrankheit, d.h. es wirken verschiedene Faktoren am Zustandekommen der Erkrankung begünstigend mit, wobei es sich um Faktoren ausgehend vom Infektionserreger (Virulenzfaktoren) oder auch vom Wirtstier handeln kann (BISPING 1979). Als obligate Virulenzfaktoren sind die speziesspezifischen Fimbrien (Anheftung der Erreger an das Dünndarmepithel) sowie die Fähigkeit zur Toxinbildung (Beeinflussung der Sekretionsleistung von Darmzellen) zu nennen (BALJER u. WIELER 1993). Prinzipiell wird zwischen enteralen (Durchfallerkrankungen) und nicht enteralen (z.B. Septikämien) Infektionen unterschieden. Die wirtschaftlich bedeutenden Jungtiererkrankungen sind enterale Erkrankungen, die im Besonderen den Dünndarm betreffen. Die E. coli bedingten enteralen Erkrankungen der Ferkel werden in eine enterotoxische und eine enterotoxämische Enteropathie eingeteilt. Diese Einteilung erfolgt entsprechend der Wirkung der vom Erreger produzierten Toxine. Diese können sich auf das Darmepithel beschränken (= enterotoxisch) oder aber sie gelangen durch das Darmepithel in den Blutkreislauf und verursachen systemische Krankheitsbilder. Die vom Erreger abgesonderten Toxine wirken im Falle einer enterotoxischen Erkrankung unmittelbar und konzentriert auf die Membran der Darmepithelzellen. Diese werden dabei nicht beschädigt, jedoch zu einer massiven Absonderung von Flüssigkeit in das Darmlumen angeregt. Dieser Hypersekretion ist die Rückresorptionsfähigkeit des Dünn- und Dickdarms nicht gewachsen. WALDMANN (2001) spricht bei einer gesteigerten Sekretion mit erhaltener Resorptionsleistung ohne Schädigung der Zellen von einem Katarrh und unterscheidet innerhalb der Enterotoxine zwischen einem temperaturlabilen Enterotoxin (LT) und einem temperaturstabilen Enterotoxin (ST). Handelt es sich um eine enterotoxämische Erkrankung, spricht man von Endotoxinen. Sie werden vom Wirtstier über den Darm in den Blutkreislauf aufgenommen. Diese Art von Toxinen verursacht bei Absetzferkeln vor allem das Bild der Ödemkrankheit bzw. des Schocks. Die Empfindlichkeit des Wirtes für eine ETEC-Infektion hängt von dem genetisch festgelegten Vorhandensein von fimbrienspezifischen Epithelrezeptoren im Dünndarm ab (BALJER 1986). Weiterhin wird die Empfindlichkeit/Empfänglichkeit eines Ferkels davon bestimmt, inwieweit es eine passive oder aktive Immunisierung durchgemacht hat (BALJER 1986). 9 Schrifttum ___________________________________________________________________________ Häufig handelt es sich auch um Mischinfektionen mit anderen enteropathogenen Erregern (BALJER 1986). In einem hohen Prozentsatz von Fällen einer Kolidiarrhoe nach dem Absetzen fanden FITZGERALD et al. (1988) neben E. coli-Erregern auch Rotaviren. 2.2.2.2 Klinisches Bild und Verlauf Die Kolidiarrhoe betrifft drei Altersgruppen von Schweinen: neugeborene bis 4 Tage alte Saugferkel, 3 Wochen alte Tiere und typischerweise abgesetzte Ferkel etwa 7-10 Tage nach dem Absetzen (COOPER 2000). Bei den neugeborenen Ferkeln ist der klinische Verlauf grundsätzlich schwerer, Dünndarmepithels die da bei ihnen die Enterotoxinaufnahme ausgeprägte fördert sowie Resorptionsfähigkeit die Regeneration des des Dünndarmepithels wesentlich langsamer erfolgt (BALJER 1986). Neugeborene Ferkel können schon wenige Stunden nach oraler Infektion einen hochgradigen Durchfall entwickeln und setzen dabei wässrig-gelben bis braunen Kot ab. Die Tiere wirken trotz erhaltener Sauglust schnell exsikkotisch, struppig und abgemagert (WALDMANN u. WENDT 2001). Oft kann eine Rötung im Perinealbereich festgestellt werden (COOPER 2000). 12-24 (max. 48) Stunden nach Einsetzen des Durchfalls verenden die Tiere häufig infolge einer Exsikkose, metabolischen Azidose und Hypoglykämie (ULLRICH et al. 1985). Die Mortalität kann bis zu 70 % erreichen (COOPER 2000). Tritt die Erkrankung in der Zeit nach dem Absetzen auf, so kann die klinische Ausprägung sehr unterschiedlich sein und von einem perakuten tödlichen Verlauf bis zum symptomlosen Ausscheiden von Erregern reichen (SARMIENTO et al. 1988). Eine Sonderform ist die hämorrhagische Gastroenteritis. Auch sie betrifft vor allem Ferkel kurz nach dem Absetzen und verursacht häufig perakute Todesfälle, oder die Tiere versterben nach kurzer Krankheit mit gelb-braunem Durchfall und peripherer Zyanose (FAIRBROTHER 1992; WALDMANN u. WENDT 2001). Neben Tierverlusten und den Kosten einer notwendigen Medikierung von Absetzferkeln sind E. coli- Infektionen auch für ein späteres Erreichen des Schlachtgewichts als Spätfolge verantwortlich (HAMPSON 1994). Als Spätfolge einer gleichzeitig abgelaufenen Enterotoxämie kümmern viele Ferkel nach einer überstandenen Kolidiarrhoe (WALDMANN u. WENDT 2001). 10 Schrifttum ___________________________________________________________________________ 2.2.2.3 Pathologisch-anatomische Veränderungen Zu den pathologisch-anatomischen Veränderungen bei einer Kolidiarrhoe der Saugferkel zählt ein stark erweiterter Magen, der mit geronnener Milch gefüllt ist. Der Darminhalt von Dünndarm und Colon ist von gelber Farbe und flüssig, die Schleimhäute dieser Abschnitte können blaß bis blutig sein. Entzündungssymtome sind in der Regel nicht festzustellen (ULLRICH et al. 1985). Im Falle der hämorrhagischen Gastroenteritis können außerdem venöse Infarkte im Bereich der großen Kurvatur des Magens sowie eine Dilatation des Dünndarms beobachtet werden (FAIRBROTHER 1992). 2.2.2.4 Diagnose Eine alleinige klinische Diagnose ist nicht möglich, da das Krankheitsbild unspezifisch ist, und es sich häufig um Mischinfektionen mit beispielsweise Rota- oder Coronaviren handelt (BALJER 1986). Für den Erregernachweis eignen sich nur Kotproben von frühen Krankheitsstadien, da im fortgeschrittenen Stadium der Erreger nur noch sporadisch ausgeschieden wird (BALJER 1986). Auch der bakteriologische Nachweis des Erregers aus dem Darminhalt ist ohne den gleichzeitigen Nachweis von Virulenzfaktoren nicht aussagekräftig, da E. coli zu den natürlichen Mikroorganismen der Darmflora zählt (FAIRBROTHER 1992). Um eine exakte Diagnose zu erhalten ist es wichtig, die Toxizität, d.h. die Fimbrien und die Toxine, des isolierten E. coli-Stammes zu bestimmen. Die Fimbrien lassen sich durch Hämagglutination mit aufgeschwemmten Schaferythrozyten bestimmen, die Toxine sind im Tierversuch oder in der Zellkultur nachweisbar (ROLLE u. MAYR 2002). Weiterhin ist eine Bestimmung der Antigen-Struktur u. a. mittels PCR, ELISA und Agglutinationstests möglich (FAIRBROTHER 1992). Ein weiterer Hinweis auf eine E. coli-bedingte Diarrhoe kann ein alkalischer pH-Wert im Kot sein, denn er weist auf eine sekretorische Diarrhoe und ein bakteriell bedingtes Geschehen hin. Viral bedingte Durchfälle hingegen, die durch eine Malabsorption mit sekundärer Fermentation charakterisiert sind, weisen einen sauren pH-Wert im Kot auf (FAIRBROTHER 1992). 11 Schrifttum ___________________________________________________________________________ Da die Kolidiarrhoe als eine Faktorenkrankheit anzusehen ist, sollte für eine exakte Diagnosestellung auch eine Vielzahl von möglichen Stressfaktoren, wie Futter und Fütterungsregime, Tierbewegungen und andere Umwelteinflüsse überprüft und gegebenenfalls korrigiert werden (WILLS 2000). 2.2.2.5 Therapie Der Therapieansatz ist in drei Bereiche aufzuteilen: Flüssigkeitsersatz, Chemotherapie und Kontrolle sowie gegebenenfalls Anpassung der Umweltfaktoren. Da die Tiere an massiver Dehydration leiden, steht der Volumenersatz durch orale Gaben von Elektrolytlösungen mit Glucosezusatz an erster Stelle (FAIRBROTHER 1992). Initial kann ein Breitspektrumantibiotikum verabreicht werden (FAIRBROTHER 1992), allerdings wurden in den letzen Jahren zunehmend resistente Colistämme nachgewiesen. Gegenüber Ampicillin und Tetracycline ist beispielsweise der überwiegende Teil der in Deutschland geprüften Isolate resistent (ROLLE u. MAYR 2002), so dass der Einsatz von Antibiotika sich an den Ergebnissen von Resistenztests orientieren sollte. Dabei kommen vor allem Fluorchinolone, Colistin, Gentamycin und Cefquinom in Frage (ROLLE u. MAYR 2002). Bei der Überprüfung möglicher Stressfaktoren sollte besonders auf eine altersangepasste Umgebungstemperatur sowie die Vermeidung von Zugluft Wert gelegt werden (FAIRBROTHER 1992). Auch eine orale Gabe von Lactobacillus acidophilus-haltiger Milch kann sinnvoll sein und die Genesung beschleunigen (COOPER 2000). 2.2.2.6 Prophylaxe Unter der Voraussetzung einer optimalen Stallhygiene und Fütterung kommt der Immunprophylaxe eine entscheidende Rolle bei der Bekämpfung der E. coli-Darminfektionen zu. Mittels aktiver oder passiver oraler Immunisierung werden hier spezifische lokale Abwehrmechanismen stimuliert (BALJER u. WIELER 1993). Die passive orale Immunisierung kann bei Saugferkeln mittels der maternalen Kolostral- oder Milchantikörper erfolgen oder über eine orale Verabreichung von Immunglobulinpräparaten, wobei diese Art der Immunisierung nur erfolgreich ist, wenn die Milchantikörper bzw. 12 Schrifttum ___________________________________________________________________________ Immunglobuline während der kritischen Lebensabschnitte, d. h. in der Saugferkelphase ab dem Zeitpunkt der Zufütterung und in der Phase direkt nach dem Absetzen, täglich verabreicht werden. Diese Lebensabschnitte sind deshalb kritisch bzgl. Erkrankungen des Magen-Darm-Traktes, weil die Versorgung mit maternalen Antikörpern nicht mehr gegeben ist, die Entwicklung des ferkeleigenen darmassoziierten Immunsystems aber frühestens in der siebten Lebenswoche abgeschlossen wird (STOKES et al. 2004). Zwar ist der Übertritt von Antikörpern aus dem Darmlumen in das Serum der Ferkel nur am ersten Lebenstag möglich, die tägliche Verabreichung bietet aber zumindest lokalen Schutz für den Magen-Darm-Trakt. Impft man die Muttersau im letzten Drittel der Trächtigkeit oral oder parenteral, so kann durch diese aktive Immunisierung der Immuntransfer verbessert werden. In einer Studie wurde eine positive Korrelation zwischen dem Antikörper-Gehalt im Kolostrum und dem Antikörper-Gehalt im Ferkelserum festgestellt, nachdem das Muttertier aktiv immunisiert wurde (STELLJES 2000). Es gibt auch die Möglichkeit, Absetzferkel aktiv zu immunisieren, z. B. mittels einer E. coli- Schluckvakzine, die über 14 Tage über das Trinkwasser oder das Futter aufgenommen werden muss (BALJER u. WIELER 1993). Ein Schwachpunkt der Immunisierung sind die nicht sicher polyvalent belastbaren OralVakzinen, die häufig zu einem Misserfolg in der Prophylaxe führen, besonders vor dem Hintergrund, dass bereits ein einziges Ferkel 3-4 unterschiedliche E. coli-Stämme ausscheiden kann (GLAWISCHNIG 1990). Diese Tatsache sowie die unterschiedliche Empfindlichkeit der zahlreichen Stämme gegenüber Antibiotika macht GLAWISCHNIG (1990) für die Misserfolge in der Prophylaxe verantwortlich und hält es für sinnvoller, durch eine rohfaserreiche Fütterung dem Durchfallgeschehen vorzubeugen. Der Gedanke durch einen Futterzusatz das Auftreten der E. coli-Diarrhoe zu verhindern bzw. zu vermindern, liegt auch dem Konzept des Säurezusatzes zugrunde. Mitte der 70er Jahre wurden erste Fütterungsversuche mit Absetzferkeln durchgeführt, nachdem organische Säuren bereits seit Jahrzehnten zur Konservierung von Mischfuttermitteln eingesetzt wurden. Diese Versuche belegten eindeutig, dass verschiedene organische Säuren die Leistungen positiv beeinflussen (EIDELSBURGER 1997). Diese Leistungssteigerungen beruhen zu einem erheblichen Teil auf der bakteriziden und bakteriostatischen Wirkung der Säuren (EIDELSBURGER 1998). 13 Schrifttum ___________________________________________________________________________ 2.3 Salmonellen Da die Tiere der vorliegenden Untersuchungen sowohl einer experimentellen Salmonellenals auch einer E. coli-Infektion unterzogen wurden, soll an dieser Stelle kurz auf die Problematik der Salmonellen-Infektion in Schweinebeständen eingegangen werden. Ein Großteil der Schweinebestände ist als Salmonellen-belastet anzusehen (STEINBACH u. KROELL 1999). Infektionen mit Salmonellen sind weniger ein klinisches Problem in der Schweinehaltung, sondern vielmehr bezüglich der Fleischhygiene von besonderer Bedeutung. E. coli-Infektionen werden als typische Erkrankung der Absetzphase angesehen, wohingegen die Salmonellen-Prävalenz als ein Problem der Masttiere gilt. Verschiedene Untersuchungen haben jedoch gezeigt, dass die Ursache in einem früheren Zeitraum festzulegen ist. Im Rahmen einer Feldstudie schieden Tiere mehrere Wochen nach dem Absetzen, am Ende der Flatdeckphase, Salmonellen mit dem Kot aus (OFFENBERG 2007). Eine weitere Feldstudie identifizierte die Läufer als entscheidende Eintragsquelle für Salmonellen in die Mast (VISSCHER 2006). Die in der vorliegenden Arbeit gewählte Erstinfektion mit Salmonellen war eingebunden in ein größeres Versuchsprojekt, dessen wesentliche Ergebnisse und Erkenntnisse in der Dissertation NEU (2007) bereits publiziert vorliegen. 2.4 Leistungsförderer Mit der Ausbreitung von multiresistenten human- und tierpathogenen Bakterien in den letzten Jahren kamen auch antibiotisch wirksame Leistungsförderer zunehmend in die Kritik (KAMPHUES 1999). Die Kritik an dieser Form der Leistungssteigerung bezieht sich auf die früher übliche niedrige Dosierung (so genannte „nutritive“ Dosierungen) dieser Antibiotika und ihre teilweise Resorbierbarkeit, da diese beiden Faktoren mögliche Resistenzbildungen unter Umständen fördern. Als Konsequenz wurden mit der „Verordnung (EG) Nr. 1831/2003 des europäischen Parlaments und des Rates vom 22. September 2003 über Zusatzstoffe zur Verwendung in der Tierernährung“ mit Wirkung zum 1. Januar 2006 Antibiotika als Futtermittelzusatzstoffe verboten. Auf der Suche nach Alternativen gewannen so genannte 14 Schrifttum ___________________________________________________________________________ nicht-antibiotische Leistungsförderer wie organische Säuren und deren Salze schnell an Interesse. 2.4.1 Antibiotische Leistungsförderer Das Wirkprinzip der antibiotischen Leistungförderer beruht auf einer Reduzierung der Mikroflora im Darm durch ihre antibakterielle Wirkung, welche eine verbesserte Ausnutzung der Nährstoffe der Futtermittel bedingt. Durch eine Reduzierung der Nahrungskonkurrenz durch Enterokokken und Bifidobakterien, also einer reduzierten mikrobiellen Verdauung von Nährstoffen wie Zucker und Aminosäuren, stehen erstens mehr Nährstoffe dem ferkeleigenen Stoffwechsel zur Verfügung (GEDEK 1987), und zweitens hat der tierische Organismus geringere Konzentrationen an bakteriellen Stoffwechselprodukten, wie Ammoniak, Amine und Milchsäure abzubauen, und es kommt dadurch zu einer reduzierten Belastung der Leber (KAMPHUES 1999). Durch diesen entlastenden Effekt wird wiederum Energie gespart, die dem Tier für die eigene Verwertung zur Leistungserbringung zur Verfügung bleibt. Ein weiterer Effekt antibiotischer Leistungsförderer ist eine Entlastung des lymphatischen Systems des Darms durch die geringere Dichte an (potentiell) pathogenen Keimen. Hieraus resultiert eine dünnere Darmwand (durch weniger lymphatisches Gewebe), was die Resorption von Nährstoffen erleichtert (GREIFE u. BERSCHAUER 1988). Es wird außerdem angenommen, dass weniger Energie und Protein für den Erhalt einer funktionsfähigen Darmschleimhaut aufgebracht werden müssen (KAMPHUES 1999). Schweden war 1986 das erste Land, das den Einsatz aller antibiotischer Leistungsförderer in der Schweineproduktion verbot, ihm folgten 1999 die Schweiz und 2000 Dänemark. Die EU begann in den späten 90er Jahren bereits einen Teil der antimikrobiellen Futterzusatzstoffe zu verbieten. Durch die Verordnung 1831/2003 der EG, die ab dem 01.01.2006 in Kraft trat, wurden mit Flavophospholipol, Salinomycin und Avilamycin die letzten drei antibiotischen Leistungsförderer in der Schweineproduktion verboten, deren Wirkung allerdings auf grampositive Erreger beschränkt war. Bis zu diesem Zeitpunkt unterlag der Umgang mit diesen Substanzen strengen Restriktionen: die Reinsubstanzen durften vom Hersteller nur an anerkannte Vormischbetriebe abgegeben werden und von diesen nur als Vormischung an amtlich anerkannte Mischfutterbetriebe, so dass der Tierhalter Leistungsförderer dieser Art 15 Schrifttum ___________________________________________________________________________ nur über das fertige Mischfutter und keine Reinsubstanzen oder Vormischungen beziehen konnte. Ohne Involvierung des Tierarztes entschied sich also der Tierhalter selbst für oder gegen diese Zusatzstoffe. Weiterhin durfte ein Mischfutter grundsätzlich nur einen einzigen Leistungsförderer enthalten. Die untenstehende Tabelle gibt Auskunft über die Mindest- und Maximalgehalte der bis 2006 zugelassenen Leistungsförderer in der Schweineproduktion. Tabelle 1: Mindest-/Maximalgehalte der bis 2006 zugelassenen Leistungsförderer in der Schweineproduktion Mindest-/Maximalgehalte in mg/kg Futter Avilamycin Flavophospholipol Salinomycin-Na Aufzucht Mast 20/40 10/25 30/60 10/20 1/20 15/30 Die folgende Tabelle stellt die Effekte der Leistungsförderer (nach BIRZER und GROPP 1991) auf Tageszunahmen und Futteraufwand dar (kg Futter je kg Zunahme). Tabelle 2: Effekte von Leistungsförderern auf Tageszunahmen und Futteraufwand (in %) Tierart: Tageszunahmen Futteraufwand Schwein in % in % + 16 -9 < 25 kg +9 - 5,5 25-50 kg + 3,5 -3 > 50 kg 2.4.2 Nicht-antibiotische Leistungsförderer Als mögliche Alternativen zu den seit 2006 verbotenen antibiotischen Leistungsförderern wurden verschiedene Wirkstoffe Säuerungsmittel untersucht. wie Pre- und Probiotika, Enzymzusätze oder 16 Schrifttum ___________________________________________________________________________ Pre- und Probiotika Die Verabreichung von Probiotika mit dem Futter, also lebenden Bakterienkulturen, geschieht vor dem Hintergrund, dass diese Mikroorganismen die Darmflora stabilisieren und durch einen Verdrängungseffekt einer Besiedlung mit pathogenen Darmbakterien vorgebeugt werden kann (FERKET 2003). Vor allem Laktobazillen und Bifidobakterien können Nischenräume besetzen, die in der Regel auch von pathogenen Keimen zur Kolonisation benötigt werden (GEDEK 1993; FULLER u. GIBSON 1997). Weiterhin bildet der Großteil der eingesetzten Keime Milchsäure und niedere flüchtige Fettsäuren und trägt so zu einer Absenkung des pH-Wertes bei (GEDEK 1992), die wiederum die Vermehrung pathogener Mikroorganismen hemmt. Prebiotika hingegen dienen der Ernährung dieser nützlichen Darmflora (FERKET 2003). Verschiedene Poly- bzw. Oligosaccharide haben eine spezifische Wirkung im Verdauungstrakt, da sie nicht durch körpereigene Enzyme des Wirtstieres gespalten werden, sie können jedoch durch bestimmte Bakterien abgebaut werden. Da nur bestimmte Mikroorganismen über geeignete Enzyme verfügen, können also durch die Auswahl eines geeigneten Prebiotikums bestimmte erwünschte Keime gezielt gefördert werden (KÜHN et al. 2000). Enzymzusätze Die positiven Effekte eines Enzymzusatzes ergeben sich aus einer schnelleren Verdauung und Aufnahme der Nährstoffe (Stärke, Eiweiß, Fett) im Dünndarm und damit einer Begrenzung der Verfügbarkeit dieser Stoffe für Mikroorganismen im Darm (FERKET 2003). Der Entzug von Stärke und Eiweiß geht mit der Produktion exogener Enzyme für Oligomere auf der Basis von Rohfaser einher, die bestimmte Bakterienpopulationen mit vermutlich positiver Wirkung auf das Wirtstier als Substrat dienen (BEDFORD 2000). Säuren Organische Säuren werden bereits seit Jahrzehnten zur Konservierung von Futtermitteln eingesetzt, um deren Hygiene und Haltbarkeit zu verbessern. In den 70er Jahren des vorigen Jahrhunderts gab es erste Erkenntnisse, dass organische Säuren auch direkt die Leistung positiv beeinflussen können. In ersten Versuchen zeigte vor allem Ameisensäure eine deutliche Wirkung (KIRCHGESSNER u. ROTH 1988). Das Risiko von möglichen 17 Schrifttum ___________________________________________________________________________ Resistenzbildungen ist bei diesen Produkten im Vergleich zu antibiotischen Zusatzstoffen nicht gegeben. 2.4.2.1 Wirkungsweise organischer Säuren Zum Zeitpunkt des Absetzens ist die HCl-Produktion im Ferkelmagen noch nicht ausgereift und auch hinsichtlich der Menge auf einem vergleichsweise sehr niedrigem Niveau. Da die Aktivierung der eiweißspaltenden Enzyme Pepsinogen und Trypsin maßgeblich von der im Magen produzierten Salzsäure abhängt, ist die Eiweißverdauung und damit -verwertung zu diesem Zeitpunkt stark eingeschränkt. Die herkömmlichen Ferkelfutter sind jedoch reich an Rohprotein und haben zudem oft eine hohe Säurebindungskapazität, so dass die Wirkung der tiereigenen Salzsäure noch weiter eingeschränkt wird. Die Wirkung von zugesetzten organischen Säuren erstreckt sich nach ROTH und KIRCHGESSNER (1995) über drei Bereiche: 1. Wirkung im Futtermittel 2. Wirkung im Verdauungstrakt des Tieres 3. Wirkung im Intermediärstoffwechsel des Tieres. Im Futtermittel haben organische Säuren einen konservierenden und antimikrobiellen Effekt. Durch den reduzierten Keimgehalt im Futter wird auch die mit dem Futter vom Tier aufgenommene Keimzahl vermindert. Weiterhin wird der pH-Wert des Futtermittels und damit auch seine Säurebindungskapazität gesenkt, so dass die oben beschriebene eingeschränkte Wirkung der Salzsäure im Magen verbessert wird. Als Effekt der Säuren im Verdauungstrakt des Tieres ist an erster Stelle die direkte Ansäuerung zu nennen, welche vor allem im Magen von Bedeutung ist und hier den MagenpH-Wert schneller in den Bereich um ~3,5 absenkt als bei Aufnahme eines Futters ohne Säurezusatz. Damit vermindert sich auch die Überlebensmöglichkeit der wenig säuretoleranten Keime, so dass diese nicht in den weiteren Verdauungstrakt, also Dünn- und Dickdarm, gelangen können. Als weiterer wichtiger Punkt ist die Wirkung des Säureanions auf die Mikroflora im Dünndarm zu ungunsten von pathogenen Keimen zu nennen (EIDELSBURGER 1998). Weiterhin wirken die Anionen als Komplexbildner für kationische Mengen- und Spurenelemente, deren Verdaulichkeit und Retention damit erhöht wird (KIRCHGESSNER u. ROTH 1988). 18 Schrifttum ___________________________________________________________________________ Der Intermediärstoffwechsel, also der Aufbau, Umbau und Abbau der Substrate (WIESNER u. RIBBECK 2000), wird durch organische Säuren vor allem hinsichtlich des Proteinstoffwechsels beeinflusst. Durch die schnelle pH-Wert-Absenkung im Magen und die verminderte Säurebindungskapazität wird die Aktivierung von Pepsinogen und Trypsin erheblich erleichtert und somit die Proteinverdaulichkeit erhöht (EIDELSBURGER 1998). Als weitere Wirkung ist die Reduzierung der Desaminierung von Aminosäuren zu nennen, so dass letztlich mehr Aminosäuren für die Absorption und Verwertung durch das Tier zur Verfügung stehen. Auch wird somit die Umwandlung von Ammoniak zu Harnstoff in der Leber reduziert, was sich in einem verminderten Energieaufwand bemerkbar macht (EIDELSBURGER et al. 1992b) Generell ist zu sagen, dass Säuren mit einem niedrigen Molekulargewicht (wie z.B. Ameisen- oder Propionsäure) bei gleichem Anteil stärker nutritiv wirksam sind als organische Säuren mit einem höheren Molekulargewicht (z.B. Fumar- oder Zitronensäure; EIDELSBURGER 1998). Die Anionen anorganischer Säuren haben im Gegensatz zu denen organischer Säuren keinen positiven Einfluss auf die Verdauungsprozesse und führen damit auch nicht zu einer verbesserten Futterverwertung (EIDELSBURGER 1998). Die folgende Tabelle gibt einen Überblick über einige wichtige freie Säuren als Additive, die im Schweinefutter verwendet werden. Tabelle 3: Überblick zum Einsatz freier Säuren in der Schweineproduktion Säure Ameisensäure (einfachste gesättigte Carbonsäure: HCOOH) Mindest-/ Höchstgehalte je kg Alleinfutter Keine Einschränkungen (Ausnahme: darf nicht zur Konservierung von feuchtem unbehandeltem Getreide mit einem Wasser-Gehalt von mehr als 15% verwendet werden) Wirkung(smechanis mus) Ergebnisse (beispielhaft) Antimikrobielle v.a. Wirkung gegen Hefen, E. coli, Salm. spp.; Laktatbildner und Schimmelpilze sind deutlich weniger sensibel Leistungsfördernd bei Konzentrationen von 1,8% im Futter nach CANIBE et al. (2005) Keine wesentlichen Leistungssteigerungen nach EISEMANN und VAN HEUGTEN (2007) 19 Schrifttum ___________________________________________________________________________ Milchsäure (H3C-CHOHCOOH) Keine Beschränkungen Antibakteriell; Hefen und Schimmelpilze können Milchsäure metabolisieren Nach PIERCE et al. (2005) konnte durch Zusatz von 1,6 % Milchsäure zum Futter Tageszunahmen und Futterverwertung in der 1. Woche nach dem Absetzen signifikant verbessert werden Butansäure (=Buttersäure; einfachste Fettsäure) H3C-(CH2)2COOH Keine Beschränkungen Hauptenergiequelle für die Epithelzellen des terminalen Ileums und des Dickdarms → trophische Funktion →evtl.leistungsfördernde Eigenschaften; beeinflusst Interaktion von Salm. enterica sp. und den Epithelzellen des Darms→reduzierte Invasionskapazität der Salmonellen Nach BIAGI et al. (2007) steigt die Körpermassenentwicklung bei Zusatz von 4000 ppm NaButyrat/kg Futter PIVA et al. (2002) beobachtete eine Leistungsverbesserung in den ersten 2 Wochen nach dem Absetzen bei Zusatz von 0,8g Na-Butyrat/kg Futter: Steigerung der Zunahmen (+20%) und der Futteraufnahme (+10%) jedoch einen Abfall der Futterverwertung (-14%) Benzoesäure (aromatische Carbonsäure C6H5COOH Mastschweine: 0,51,0% des Futters Absetzferkel: bis 0,5% des Futters Antibakteriell und antimykotisch 0,5%iger Einsatz bei Absetzferkeln: Steigerung der täglichen Zunahmen auf 110,7% (BROZ und PAULUS 2006) 0,5%iger Einsatz bei Mastschweinen: Steigerung der Tageszunahmen, Abnahme des Futteraufwandes/kg Zuwachs (GUINGAND et al. 2005) Schlecht resorbierbar→erreicht den Dickdarm→dort von best. Bakterien (Lactobacillus renteri und L. mucosae) zu Butyrat fermentiert Der Einsatz von 3000 bzw. 6000 ppm Glukonsäure kann eine Steigerung der Zunahmen bewirken (BIAGI et al. 2006) Glukonsäure 20 Schrifttum ___________________________________________________________________________ 2.4.2.2 Wirkungsweise der Salze organischer Säuren Ein großer Vorteil der Salze ist ihre fehlende Korrosivität im Gegensatz zu den freien Säuren. Dies begünstigt den Einsatz in der Praxis enorm, da erstens der Anwender nicht durch eine ätzende Wirkung gefährdet wird, und zweitens die Stalleinrichtung, Mischtechnik usw. (praktisch alle Gegenstände, die mit dem Zusatzstoff in Berührung kommen) keiner korrosiven Wirkung ausgesetzt sind (FREITAG et al. 1998). Die nutritiven Effekte von Salzen sind nach KIRCHGESSNER und ROTH (1987) allein auf die Wirkung des Säureanions zurückzuführen. Ihm fehlen die Wirkungen der Ansäuerung sowie des Absenkens der Pufferkapazität. Aus diesem Grund erzielen sie nur etwa die Hälfte der Leistungsverbesserung, die mit den entsprechenden Säuren erzielt werden. So haben KIRCHGESSNER und ROTH (1987) einen Vergleich der Wirkung von Ameisensäure und ihrem Salz Natrium-Formiat auf die Leistung von Ferkeln durchgeführt, wobei im Ferkelfutter jeweils die identische Menge an Säureanionen vorhanden war. Das Salz erreichte hierbei etwa die Hälfte der Leistungsverbesserung der Säure (Kontrolle:100%): tägliche Zunahmen: Ameisensäure 111,1%, Na-Formiat 107,1%; Futterverwertung: Ameisensäure 95,5%, Na-Formiat: 97,7%. Die stärkere Wirkung der Säure beruht auf der zusätzlich vorhandenen Ansäuerung. Die Wirkung auf die Keime der Darmflora scheint jedoch allein von dem Anteil an Säureanionen abzuhängen, so dass Säuren und Salze mit gleichem Säureanionanteil in Bezug auf ihre antimikrobielle Wirkung eine vergleichbare Wirkung erzielen wie Versuche von KIRCHGESSNER et al. (1992) zeigen. Hierbei wurden die Effekte von Ameisensäure und Calcium-Formiat bei identischem Anteil an Säureanionen im Futter auf Keimzahlen im Duodenum von Ferkeln (3 Stunden postprandial) untersucht. Das Salz zeigte dabei die annähernd gleiche Wirkung auf Keime der Begleitflora wie die freie Säure. 21 Schrifttum ___________________________________________________________________________ Tabelle 4: Effekte von Ameisensäure und Calciumformiat auf die Keimzahlen im Duodenum von Ferkeln (modifiziert nach KIRCHGESSNER et al. 1992) Keimzahlen im Duodenum (log 10/g Inhalt) Keim Kontrolle Calciumformiat Ameisensäure E. coli 5,5 3,7 3,3 Enterokokken 3,2 2,4 2,3 Bacteriodaceae 4,1 2,5 2,1 GEDEK et al. (1992) verglichen u. a. die Wirkung von Fumarsäure respektive Natriumformiat auf Keimzahlen in verschiedenen Abschnitten des Gastrointestinaltraktes und konnten dabei einen geringeren Einfluss von Natriumformiat auf die Keimzahlen feststellen als von KIRCHGESSNER et al. (1992) für Calciumformiat nachgewiesen wurde, in der Tendenz wiesen sie jedoch in dieselbe Richtung. In den eigenen Untersuchungen wurde das Salz Kalium-Diformiat als Produkt Formi LHS® eingesetzt. Kalium-Diformiat wird seit 2002 als erster und bis heute einziger zugelassener nicht-antibiotischer Wachstumsförderer (FMVO, Anlage 3) durch die BASF-AG (Ludwigshafen/Deutschland) europaweit vertrieben. Es besteht nach Firmenangaben zu 98% aus K-Diformiat, 1,5% Silikaten und 0,5% Wasser. Der Ameisensäureanteil beträgt 70%. Dieses Produkt hatte in vorangegangenen Untersuchungen eindeutig eine antimikrobielle und leistungssteigernde Wirkung (KULLA 2001; PAPENBBROCK 2004). In einer weiteren Studie konnte ein deutlicher antimikrobieller Effekt von Kaliumdiformiat nicht nur auf Salmonellen und E. coli sondern auch auf Aerobier, Anaerobier, Laktobazillen, Streptokokken und Enterokokken im Verdauungstrakt von Absetzferkeln nachgewiesen werden (HEBELER et al. 2000). 2.5 Futterstruktur Der Gedanke nicht (nur) durch Futteradditive, sondern (auch) durch eine veränderte Futterstruktur möglichen Erkrankungen des Verdauungstrakts vorzubeugen, rückt mehr und mehr ins wissenschaftliche Interesse. Unter der Futterstruktur versteht man im Bereich der 22 Schrifttum ___________________________________________________________________________ Schweinenfütterung in erster Linie die Verteilung von Partikelgrößen – also den Vermahlungsgrad - der Komponenten eines Mischfutters (KAMPHUES 2007). Allerdings ist die tatsächliche Futterstruktur zum Zeitpunkt der Aufnahme durch das Tier zusätzlich wesentlich von weiteren Faktoren, wie die Angebotsform oder die Konfektionierung, beeinflusst. So kommt es z. B. beim Pelletierungsvorgang zu einem erheblichen Nachzerkleinerungseffekt. Vorteile durch eine gröbere Futterstruktur ließen sich in verschiedenen Studien beobachten. So konnten hinsichtlich von Salmonellen-Prävalenzen in Feldstudien (VISSCHER 2006; OFFENBERG 2007), aber auch unter experimentellen Bedingungen einer SalmonellenInfektion (PAPENBROCK 2004) positive Effekte verzeichnet werden. Auch die Kotbeschaffenheit bei Sauen lässt sich durch eine gröbere Vermahlung dahingehend positiv beeinflussen, dass sie weicher und bröseliger wird und damit die Chymuspassage fördert (WARZECHA 2006). Ernährungsbedingte Einfüsse scheinen weiterhin eine ursächliche Rolle bei der Entstehung von Magenulcera bei Schweinen zu spielen: eine auffällig feine Futterstruktur begünstigt das Auftreten dieser Erkrankung (WOLF u. KAMPHUES 2007). MIKKELSEN et al. (2004) haben in ihren Versuchen mit Schweinen grob vermahlenes Futter und fein vermahlenes Futter unterschiedlicher Konfektionierung hinsichtlich verschiedener Parameter bzgl. eines antimikrobiellen Effektes untersucht. Vor allem im Magen der Tiere konnte ein deutlich höherer Gehalt an Laktobazillen und organischen Säuren bei Einsatz des grob vermahlenen Futters festgestellt werden. Diese Tendenz spiegelte sich, wenn auch weniger deutlich, ebenso in den hinteren Abschnitten des Verdauungstraktes wider. Auch der Trockensubstanz-Gehalt und die Wasser-Bindungskapazität im Magen wurden durch grob vermahlenes Futter erhöht. Auch REGINA et al. (1999) konnten in den Mägen der Tiere, die ein grob vermahlenes schrotförmiges Futter bekamen, einen erhöhten Gehalt an Essig- und Milchsäure feststellen. Ebenso war bei diesen Tieren der TS-Gehalt im Magenchymus höher als bei den Probanden, die fein vermahlenes pelletiertes Futter bekamen. Trotz des erhöhten Gehalts an organischen Säuren im Magen konnte in dieser Studie keine Tendenz zu einer möglichen erhöhten Anfälligkeit für Ulcera beobachtet werden, wohingegen bei den Tieren der Gruppe „fein vermahlenes Futter“ ein erhöhter Gehalt an Pepsin im vorderen Magenabschnitt mit dem vermehrten Auftreten von Ulcera in diesem Bereich in 23 Schrifttum ___________________________________________________________________________ Zusammenhang gebracht wurde. Ein Erklärungsansatz ist eine vermehrte Mischung der verschiedenen Phasen im Magen (REGINA et al. 1999). Größere Futterpartikel reduzieren die praecaecale Verdaulichkeit der Stärke und erhöhen damit den Futteraufwand (JǾRGENSEN et al. 1999). Diese Aussage konnte durch PAPENBROCK (2004) allerdings nicht bestätigt werden. Zwar waren die Stärkegehalt in Caecum und Colon höher als bei der Kontrollgruppe, jedoch konnte kein erhöhter Futteraufwand festgestellt werden. Hierbei ist allerdings zu beachten, dass bei diesen Untersuchungen ein gröber vermahlenes Futter immer in Kombination mit dem Salz KaliumDiformiat gegeben wurde (leistungssteigernde Wirkung des Salzes?). Eine grobe Futterstruktur scheint ähnliche Effekte auf die Chymusqualität zu haben wie ein schrotförmiges Mischfutter: die TS-Gehalte steigen, eine Entmischung von fester und flüssiger Phase wird reduziert (HANSEN et al. 2001). In den gleichen Untersuchungen wurde allerdings auch eine leicht negative Beeinflussung der Leistung der Tiere festgestellt, wenn ein schrotförmiges Futter statt eines pelletierten gefüttert wurde. Eine grobe Vermahlung des Futters in pelletierter Form in Kombination mit KaliumDiformiat zeigte in verschiedenen Untersuchungen synergistische Effekte hinsichtlich der Reduzierung der Salmonellen-Prävalenz (PAPENBROCK 2004; VISSCHER 2006). Allerdings ist nicht gesichert, in welchem Umfang die gröbere Futterstruktur bzw. der Zusatz von Kalium-Diformiat diese Effekte bestimmt. Eine Theorie zur Wirkung einer gröberen Futterstruktur gegen pathogene Mikroorganismen besagt, dass durch die höheren TS-Gehalte und die geringere Entmischung der Phasen im Chymus laktatbildende Mikroorganismen günstigere Bedingungen vorfinden und durch einen Verdrängungsmechanismus die Darmflora des Tieres günstig beeinflussen (HANSEN et al. 2001). Futterstruktur aus technischer Sicht Neben den oben beschriebenen tierärztlichen Aspekten gilt es jedoch auch oder gerade in der Futtermittelindustrie die technischen Vor- und Nachteile einer veränderten Futterstruktur zu beachten. Eine feine Partikelstruktur begünstigt die Mischungshomogenität und –stabilität, das Fett- und Flüssigkeitsaufnahmevermögen und verringert den Verschleiß der Kompaktieranlagen. Andererseits wird durch eine feine Vermahlung die Staubbildung 24 Schrifttum ___________________________________________________________________________ gefördert, was sich wiederum negativ auf die Tiergesundheit und die Futteraufnahme auswirken kann, und die Explosionssicherheit verringert (LÖWE 2007). Die Herstellung gröberer Strukturen diente bis jetzt hauptsächlich dazu, die Fließ- und Dosierfähigkeit für nicht zu kompaktierende Futtermittel, also Futtermittel in mehl- oder schrotförmigem Zustand zu sichern. So stellt sich neben der Struktur auch die Frage nach der passenden Konfektionierung eines Schweinemischfutters (LÖWE 2007). 26 Material und Methoden ___________________________________________________________________________ 3 Material und Methoden 3.1 Versuchsziel Ziel der hier beschriebenen Versuche (Nummer des von der zuständigen Behörde genehmigten Tierversuchs: 33-42502-06/1089) waren Aussagen zur Bedeutung und zu den Effekten der Futterstruktur (feine bzw. grobe Vermahlung) sowie eines Zusatzes von Säuren (Mischung aus Ameisen- und Propionsäure bzw. KDF) bei Absetzferkeln unter den Bedingungen einer experimentellen Infektion mit S. Derby und E. coli. Für die Untersuchungen standen 40 abgesetzte Ferkel zur Verfügung, die vor der experimentellen Infektion mit E. coli bereits experimentell mit Salmonella Derby infiziert wurden. Diese Infektion war ohne jegliche gesundheitliche Beeinträchtigung verlaufen und lag zum Zeitpunkt der Infektion mit E. coli mindestens 37 Tage zurück. Die Ausscheidung von Salmonellen war abgeschlossen. Vor der Nutzung im darauf folgenden Versuch (= Infektion mit E. coli) wurde zudem eine antibiotische Behandlung vorgenommen, mit der mögliche Feldinfektionen mit E. coli-Keimen eliminiert werden sollten. Erst nach wiederholter bakteriologischer Untersuchung von Kotproben - die eine physiologische Flora erkennen ließen - kamen die Tiere in die hier vorgestellten Versuche. Alle Tiere erhielten das Mischfutter in pelletierter Form ad libitum. Die pelletierten Mischfutter unterschieden sich dabei wie folgt: Tabelle 5: Vergleich der vier verschiedenen eingesetzten Mischfutter in den eigenen Untersuchungen Gruppe Vermahlungsgrad1) 1 (n = 10) fein (2 mm – Sieb) - 2 (n = 10) fein (2 mm – Sieb) 0,9 % Säuregemisch (75 % AS Zusatz + 25 % PS) 3 (n = 10) fein (2 mm – Sieb) 4 (n = 10) grob (6 mm – Sieb) 1) Konfektion pelletiert (Durchmesser: 1,2 % KDF (Kaliumdiformiat) - Angaben: Durchmesser der Löcher im Sieb der Hammermühle ca. 4 mm) 27 Material und Methoden ___________________________________________________________________________ Während nach der ersten Infektion mit Salmonellen das Interesse auf der Ausscheidung (Zeitpunkt und Dauer) und der Translokation (ermittelt am Versuchsende) lag, stand bei der „Superinfektion“ mit E. coli die klinische Symptomatik (1. E. coli-Infektion) bzw. die Passage oral aufgenommener Keime (2. E. coli-Infektion: Ermittlung der Keimzahlen 4 bzw. 5 Stunden nach oraler Aufnahme im Chymus von Magen, Dünndarm und Caecum) im Vordergrund des Interesses. Ein direkter Vergleich von Luprocid® (freie Säuren) und Formi LHS® (Salz der Säure) sollte Aufschluss über die Abhängigkeit der möglichen positiven Wirkung von der vorliegenden chemischen Struktur geben, insbesondere vor dem ökonomischen Hintergrund der erheblichen Preisunterschiede zwischen diesen beiden Produkten (Luprocid® = günstiger, Formi LHS® = teurer). Weiterhin sollte die Leistung der Tiere unter den verschiedenen Fütterungsbedingungen beurteilt und verglichen werden. 3.2 Versuchsablauf Der Versuch gliedert sich in zwei Durchgänge, pro Durchgang wurden 20 Tiere verwendet. Die Aufstallung wird im Kapitel „Haltung“ beschrieben. Die Tiere wurden in den ersten fünf Tagen mit dem gewohnten Ferkelfutter aus dem Lehrund Forschungsgut Ruthe versorgt, bis sie dann nach dieser Adaptation auf die entsprechenden Versuchsfutter umgestellt wurden, so dass sie ab Tag -3 (d.h. drei Tage vor der experimentellen Infektion mit Salmonella Derby) nur dieses Futter aufnahmen. Die vier Versuchsfutter sind im Kapitel „Fütterung“ genauer beschrieben. Die Tiere wurden einer fünftägigen Antibiose (Tag -8 bis -4) mit Marbofloxacin (Marbocyl® 2,5 %, 1 ml pro Tier und Tag i.m.) zur Schaffung gleicher Ausgangsbedingungen bzgl. der Keimbesiedelung im Darm und zum Ausschluss einer evtl. erfolgten Feldinfektion mit Salmonellen oder E. coli unterzogen. Es erfolgte eine zweimalige Entnahme von Rektaltupfern (Tag -8 und -3) zur qualitativen Untersuchung auf Salmonellen, bevor die Tiere auf das Versuchsfutter umgestellt wurden. Diese vorangestellten Tupferuntersuchungen sollten eine mögliche Vorbelastung mit Salmonellen ausschließen. Nach einer 28 Material und Methoden ___________________________________________________________________________ Adaptationsphase von drei Tagen wurden die Tiere am Tag 0 oral mit Salmonella Derby infiziert. Dies erfolgte über das Futter mittels einer hinzugefügten Infektionsbouillon von definierter Menge (10ml/Tier) und Keimgehalt (Durchgang 1: 2,7×107, Durchgang 2: 8,2×108 KBE/ml). Im Anschluss wurde die Erregerausscheidung mittels Rektaltupfer verfolgt. Dies erfolgte von Tag 1 bis Tag 10 täglich und an den Tagen 12, 14, 16, 20, 24, 28 und 32. Im zweiten Durchgang musste aufgrund einer Feldinfektion mit E. coli mit teils hochgradigen klinischen Symptomen, die mittels einer Antibiose aller Tiere behandelt wurde, von diesem Schema abgewichen werden. Daher wurden den Tieren des zweiten Durchganges an den Tagen 1 bis 10 sowie 12, 14, 16, 25, 29 und 32 Rektaltupferproben entnommen. Einmal in der Woche wurden an einem festgelegten Tag je zwei Umgebungsproben aus dem Stall genommen und qualitativ auf Salmonellen untersucht. Dazu wurde in den beiden leeren Buchten - jeweils zwischen zwei belegten Buchten liegend - mit einem sauberen Handfeger und Kehrblech eine ca. 10 g schwere Probe des Staubs vom Boden genommen. Die an Tag 32 entnommenen Rektaltupfer wurden neben der qualitativen Untersuchung auf Salmonellen zusätzlich qualitativ auf hämolysierende E. coli untersucht. Die Tiere wurden dann einer dreitägigen Antibiose mit Marbofloxacin (Marbocyl® 2,5 %, 2 ml pro Tier und Tag i.m.) unterzogen, die im Durchgang 1 von Tag 33 bis Tag 35, im Durchgang 2 von Tag 32 bis Tag 34 stattfand, um für alle Tiere vergleichbare Ausgangsbedingungen hinsichtlich der darmeigenen Mikroflora zu schaffen sowie um evtl. vorhandene E. coli-Keime zu minimieren. An Tag 38 (Durchgang 1) bzw. Tag 37 (Durchgang 2) wurden die Tiere einzeln aufgestallt und mittels eines flüssigen Infektionsmediums mit hämolysierenden E. coliKeimen infiziert. Jedem Tier wurden 20 ml der Bouillon verabreicht, ihr Keimgehalt betrug im ersten Durchgang 1,5×1011 Keime/ml und im zweiten Durchgang 1,9×109 Keime/ml. Während der folgenden sechs Tage wurde die klinische Symptomatik beobachtet sowie eine tägliche Rektaltupferkontrolle durchgeführt, um den Verlauf der Erkrankung sowie die Erregerausscheidung protokollieren zu können. Am Tag 42 (Durchgang 1) bzw. Tag 41 (Durchgang 2) wurden je vier Tiere, eines aus jeder Gruppe, euthanasiert und seziert. Eine nähere Beschreibung der Vorgehensweise findet sich im Kapitel „Sektion“. Die restlichen Tiere wurden von Tag 45-48 (D1) bzw. Tag 44-47 (D2) nach vorangegangener Zweitinfektion mit E. coli durch eine zweite orale Verabreichnung eines flüssigen 29 Material und Methoden ___________________________________________________________________________ Infektionsmediums (allerdings mit nur 10 ml der Bouillon) getötet und seziert, wobei täglich vier Tiere, eines aus jeder Gruppe, getötet wurden. Während der Sektionen wurden von jedem Tier Chymusproben jeweils aus Magen, Dünndarm und Caecum genommen, die quantitativ auf E. coli-Keime untersucht wurden. Es wurden außerdem Schleimhautproben von Magen, Dünndarm und Caecum sowie Proben der Tonsillen und Darmlymphknoten (Lnn. ileocaecales) qualitativ auf Salmonellen geprüft. Weiterhin wurde Chymus aus Magen, Dünndarm, Caecum und dem ersten und zweiten Abschnitt des Colons auf verschiedene Parameter untersucht, die im Kapitel „Untersuchungsparameter“ beschrieben werden. Die Körpermasse jedes einzelnen Tieres wurde in beiden Durchgängen jeweils am Tag -3, am Tag 21 und am Tag der Sektion bestimmt. Klinische Symptomatik ? Passage der Keime nach oraler Aufnahme1) ? Salmonellen-Ausscheidung ? t Einstallung Tag -8 Infektion mit S. Derby Tag 0 1. Infektion mit E. coli Tag 37 bzw. 38 Sektion von je 4 Tieren ohne 2. Infektion mit E. coli Tag 41 bzw. 42 = qualitative Untersuchung von Rektaltupfern auf Salmonellen = qualitative Untersuchung von Rektaltupfern auf E. coli 1) d. h. quantitative Untersuchung des Keimgehaltes im Chymus Abbildung 1: Chronologischer Versuchsablauf (schematisch) vereinfacht dargestellt 2. Infektion mit E. coli und Sektion ab Tag 44 bzw. 45 30 Material und Methoden ___________________________________________________________________________ Tabelle 6: Versuchsablauf Versuchstag D1 -8 -3 0 1-10 12, 14, 16, 20, 24, 28 21 32 33-35 38 39-44 42 45, 46, 47 48 1 D2 Vorgang -8 Einstallung, Beginn der 5-tägigen Antibiose Rektaltupferentnahme zum Ausschluss einer Salmonelleninfektion (qualitative Untersuchung), Einsatz des gewohnten Ferkelfutters bis Tag -3 -3 Beginn der Fütterung mit Versuchsfutter, Rektaltupferentnahme zur qualitativen Untersuchung auf Salmonellen, Wiegen der Tiere 0 Infektion mit Salmonella Derby 1-10 Rektaltupferentnahme, qualit. Untersuchung auf Salmonellen 12, 14, 16, 25, 29 s.o. 21 Wiegen der Tiere 32 s.o. + qualitative Untersuchung auf E. coli 32-34 Antibiose 37 Einzel-Aufstallung, 1.Infektion mit E. coli 38-43 Rektaltupferentnahme, qualit. Untersuchung auf E. coli 41 Wiegen und Sektion von 4 Tieren 44, 45, 46 Wiegen, 2. Infektion mit E. coli und Sektion von je 4 Tieren 1 47 Wiegen, 2. Infektion mit E. coli und Sektion von 4 bzw. 2 Tieren in Durchgang 2 wurden am Tag 47 nur zwei Tiere seziert, da durch eine vorangegangene Feldinfektion mit E. coli zwei Tiere weniger zur Verfügung standen (drei Tiere verendeten und konnten nur durch ein einziges Tier ersetzt werden) 3.3 Versuchstiere Für den Versuch, bestehend aus zwei Durchgängen, wurden insgesamt 40 Absetzferkel der Dreirassenkreuzung Deutsches Edelschwein × Deutsche Landrasse × Piétrainschwein aus dem Lehr- und Forschungsgut Ruthe der Stiftung Tierärztliche Hochschule Hannover verwendet. Es handelte sich um 20 weibliche und 20 männliche Tiere im Alter zwischen 33 und 37 Tagen, wovon die männlichen Tiere in der ersten Lebenswoche kastriert worden waren. Die Tiere stammten von zehn verschiedenen Muttersauen ab und hatten am Tag der Einstallung im Institut für Tierernährung der Tierärztlichen Hochschule Hannover eine mittlere Körpermasse von ca. 8,7 kg (Variationsbreite: 6,5 - 12,5 kg). Pro Versuchsdurchgang wurden 20 Tiere verwendet. 31 Material und Methoden ___________________________________________________________________________ 3.4 Haltung Die Ferkel wurden sofort nach Ankunft im Tierhaus des Instituts für Tierernährung in vier Gruppen zu je fünf Tieren eingeteilt. Bei der Einteilung wurden Alter, Geschlecht, Körpermasse sowie das Muttertier derart berücksichtigt, dass in sich heterogene, untereinander jedoch weitgehend homogene Gruppen entstanden. Jede Gruppe wurde in zwei miteinander verbundenen Buchten mit einer Gesamtgröße von ca. 8 m2 eingestallt. Jeweils zwei Gruppen waren auf einer Seite, getrennt durch eine weitere ca. 4 m2 große Bucht, untergebracht und standen den beiden anderen Gruppen, getrennt durch einen Mittelgang, gegenüber. Für den zweiten Versuchsdurchgang wurden die Standorte der Gruppen einmal rotiert gewechselt. Die Tiere wurden in der letzten Woche vor Sektionsbeginn einzeln aufgestallt. Dazu wurden die miteinander verbundenen Buchten wieder voneinander getrennt, so dass auf jeder Seite fünf ca. 4 m2 große Einzelbuchten entstanden. Die Buchten waren untereinander durch Metallgitter, die den Tieren eine Kontaktaufnahme mit ihren Nachbarn ermöglichten, abgegrenzt. Um alle vier Gruppen so unterbringen zu können, wurde zu diesem Zeitpunkt der unmittelbar angrenzende Stall mit gleichem Grundriss mitbelegt, welcher durch eine Verbindungstür des bisher alleinig genutzten Stalles begehbar war. Die Tiere einer Gruppe wurden derart aufgestallt, dass sie sich im gleichen Stall und auf der gleichen Seite befanden. In den ersten Wochen der Gruppenhaltung wurde pro Gruppe eine Infra-Rotlichtlampe in ca. 1 m Höhe über der mit einer Gummimatte ausgelegten ca. 1 m2 großen Liegefläche angebracht, die bis Versuchsende im Betrieb war, ausgenommen sehr warme Tage im August und September. Im hinteren Bereich der Buchten war ein ca. 0,5 m breiter Kotrost in den Boden eingelassen. Die Tiere hatten durch die Selbsttränken im hinteren Bereich der Bucht permanent freien Zugang zu Wasser, die Futtertröge aus Steingut waren unterhalb der Buchtentüren zum Mittelgang angebracht, so dass sie von hier aus auch zu befüllen waren. Die Beleuchtungsdauer wurde mit zwölf Stunden pro Tag eingestellt. Die Innentemperatur betrug in den ersten vier Wochen etwa 25 °C, danach etwa 22 °C. Der Stall wurde mit dem Tag der Infektion derart verschlossen, dass er nur noch durch eine Tür von außen mit Schlüssel zu betreten war. Hinter dieser Tür sowie hinter der 32 Material und Methoden ___________________________________________________________________________ Verbindungstür zu dem in letzten zwei Versuchswochen ebenfalls belegten Stall wurden mit Desinfektionsmittel getränkte Matten ausgelegt. Im Stall selbst standen Einweg- Überschuhe sowie Einweg-Plastikkittel zur Verfügung, weiterhin feste Gummi- Schürzen, welche im Stall verblieben. Derart sollte gewährleistet werden, dass die Tiere ausschließlich mit dem experimentellen Keim in Berührung kamen und sich keine Feldinfektion zuziehen konnten, sowie dass eine Exposition anderer Räumlichkeiten mit den verwendeten Keimen verhindert wurde. Die untenstehende Abbildung zeigt einen Stallgrundriss mit der Verteilung der Tiere auf die vier Buchten während der Gruppenhaltung. Tür leere Bucht Bucht a Tür Bucht b Gang Bucht c Eingang leere Bucht Bucht d Tür Tür n=5 Tiere pro Bucht Abbildung 2: Stallgrundriss und Verteilung der Tiere 3.5 Versuchsfutter und Fütterung Für jeden Durchgang im Institut für Tierernährung der Stiftung Tierärztliche Hochschule Hannover wurden neue Versuchsfutter gemischt und pelletiert (Pelletdurchmesser ca. 4 mm). Die botanische sowie die nährstoffliche Zusammensetzung der Versuchsfutter ist dem Tabellenanhang zu entnehmen. Der Kontrollgruppe (=Gruppe: fein ohne Zusätze) wurde jeweils in beiden Durchgängen ein Futter ohne Zusätze und von herkömmlicher Partikelgröße, das heißt vergleichsweise fein gemahlen (2 mm-Sieb), angeboten. Für jeweils 33 Material und Methoden ___________________________________________________________________________ eine Gruppe (=Gruppe: grob ohne Zusätze) in beiden Durchgängen wurde der Getreideanteil sehr grob gemahlen (Weizen gehackt, Gerste grob zerkleinert: 6 mm-Sieb in der Hammermühle). Diesem Futter wurden keine Zusätze beigegeben. Wiederum jeweils eine Gruppe (=Gruppe: fein + KDF) in beiden Durchgängen erhielten ein fein vermahlenes Futter, dem 1,2 % Formi LHS® zugesetzt war. Formi LHS® besteht zu 98 % aus K-Diformiat, zu 1,5 % aus Silikaten und zu 0,5 % aus Wasser; der Ameisensäureanteil liegt bei 70 %. Es handelt sich um einen von der Firma BASF-AG Ludwigshafen vertriebenen nicht-antibiotischen Leistungsförderer. Einer weiteren Gruppe (=Gruppe fein + freie Säuren) pro Versuchsdurchgang wurde ein fein vermahlenes Futter mit einem Zusatz von Lupro-Cid® (75 % Ameisensäure, 25 % Propionsäure) in einer Dosierung von 9 g pro ein kg Futter angeboten. Auch hierbei handelte es sich um einen nicht-antibiotischen Leistungsförderer der Firma BASF-AG Ludwigshafen. Die folgenden Tabellen zeigen die Futterstruktur sowie pH-Werte und Pufferkapazität der verschiedenen Futter. Tabelle 7: Zur Verteilung der Partikelgrößen (Angaben = Massenprozente) im pelletierten Mischfutter auf der Basis fein bzw. grob vermahlener Ausgangskomponenten Partikelgröße in feines Futter grobes Futter mm (Mittelwert, n = 12) (Mittelwert, n = 4) > 3,2 > 2,0 > 1,4 > 1,0 > 0,8 > 0,6 > 0,4 > 0,2 < 0,2 Summe 0,07 0,43 4,77 15,81 7,31 10,79 6,92 8,09 45,81 100,00 0,91 7,67 10,33 13,46 4,93 8,65 5,97 6,55 41,53 100,00 > 1,4 > 1,0 < 0,4 < 0,2 5,26 21,07 53,90 45,81 18,91 32,37 48,08 41,53 Differenz 13,65 11,30 5,82 4,28 34 Material und Methoden ___________________________________________________________________________ Tabelle 8: pH-Werte und Pufferkapazitäten der eingesetzten Alleinfutter Zusammensetzung fein ohne Zusätze fein plus KDF fein plus freie Säuren grob ohne Zusätze pH-Wert 5,99 5,34 4,92 6,02 390,41 362,48 263,16 365,35 597,34 638,23 546,16 562,47 Pufferkapazität (mmol HCl, pH 4) Pufferkapazität (mmol HCl, pH 3) Während einer Adaptionsphase von fünf Tagen bekamen die Ferkel das gewohnte Ferkelfutter, das auf dem Lehr- und Forschungsgut Ruthe verwendet wurde. An Tag -3 (= 3 Tage vor der ersten Infektion) wurden die Tiere auf die verschiedenen Versuchsfutter umgestellt, mit denen sie während der gesamten Versuchsdauer gefüttert wurden. Die Fütterung erfolgte einmal täglich (7.30 Uhr) von Hand, nachdem die Menge des nicht konsumierten Futters quantifiziert wurde. Die Tiere wurden gruppenweise und ad libitum gefüttert, so dass der tatsächliche Futterverbrauch nur pro Gruppe und nicht je Individuum zu ermitteln war. Diese Vorgehensweise wurde auch in der Zeit, in der die Tiere einzeln aufgestallt waren, beibehalten. Lediglich am Tag vor der experimentellen Infektion und der Superinfektion eines jeden Tieres wurde das restliche im Trog befindliche Futter um 15.00 Uhr entfernt, so dass die jeweiligen Probanden bis zum nächsten Morgen fasteten. Die jeweiligen Tiere wurden am Tag der ersten Infektion um 7.30 Uhr, am Tag der Zweitinfektion um 6.00 Uhr bzw. 9.00 Uhr gefüttert. Es wurde vor einer oralen Infektion zunächst eine geringe Menge von 50-100 g Futter angeboten, um so einem zu sauren Magen-Milieu vorzubeugen, da dieses eine erhebliche Keimreduktion bereits im Magen zur Folge gehabt haben könnte. Nach Aufnahme dieses Futters wurden die Tiere mit weiteren 100 g des Futters mit zugesetzter Infektionsbouillon einer definierten Menge gefüttert. Nachdem die Tiere 35 Material und Methoden ___________________________________________________________________________ dieses vollständig aufgenommen hatten, erhielten sie weiteres Futter ohne zugesetzte Erreger ad libitum. Jeweils eine Stunde vor ihrer Tötung wurde den Tieren das restliche Futter entzogen. 3.6 Experimentelle Infektion mit Salmonella Derby 3.6.1 Infektionsstamm Bei dem zur Infektion verwendeten Bakterienstamm handelte es sich um einen Einsendungsstamm (Salmonella Derby A 147/85) aus dem Institut für Mikrobiologie und Tierseuchen der Stiftung Tierärztliche Hochschule Hannover. Er lag nach Konservierung in lyophilisierter Form vor. 3.6.2 Herstellung der Infektionsbouillon Zur Herstellung der Infektionsbouillon wurde der konservierte Salmonellen-Stamm aktiviert und auf Blutagarplatten ausgestrichen. Anschließend wurden diese bei 37 °C für 24 Stunden bebrütet. Das entstandene Koloniematerial wurde mittels eines sterilen Tupfers entnommen und derart in ein PBS-Medium (phosphatgepufferte Kochsalzlösung) suspendiert, dass ein Dichtegrad von 1 erreicht wurde. Der gewünschte Dichtegrad wurde mit Hilfe eines Densimaten der Firma BioMérieux, Nürtingen ermittelt. Dann wurde 1 ml der Bouillon entnommen, um eine Verdünnungsreihe herzustellen. Sie diente der Ermittlung der Keimzahl in der Lösung. Zur experimentellen Infektion mit Salmonella Derby erhielten die Tiere 10 ml der Infektionsbouillon. Die Infektionsdosis betrug im ersten Durchgang 2,7 × 107 KBE/ml, im zweiten Durchgang 8,2 × 108 KBE/ml. 36 Material und Methoden ___________________________________________________________________________ 3.6.3 Orale Infektion der Tiere Etwa eine Woche nach der Einstallung (Tag 0) erfolgte die experimentelle Infektion von je zwei Tieren pro Gruppe und Durchgang mit Salmonella Derby. Dazu wurde den Tieren am Vortag um 15 Uhr das Futter entzogen, um so am nächsten Morgen eine zügige und vollständige Aufnahme der Infektionsbouillon zu gewährleisten. Um 7.30 Uhr des nächsten Tages wurde den Tieren erst eine geringe Menge (ca. 50 g) Futter angeboten, um nach längerer Nüchterungsphase vor Aufnahme der Keime den Magen-pH-Wert anzuheben. Danach wurde den Tieren eine geringe Menge Futter mit 10 ml der Infektionsbouillon angeboten. Diese wurde immer zügig und vollständig von den Tieren aufgenommen. 3.7 Experimentelle Infektion mit E. coli 3.7.1 Infektionsstamm Zur experimentellen Infektion wurde ein E. coli-Stamm aus dem Einsendungsbereich des Instituts für Mikrobiologie und Tierseuchen der Stiftung Tierärztliche Hochschule Hannover verwendet. Dieser pathogene Wildstamm verursachte vorberichtlich hochgradige Durchfälle. Der Stamm wurde kulturell und anhand einer Multiplex-PCR durch die Abteilung Diagnostik des Instituts für Mikrobiologie und Tierseuchen der Stiftung Tierärztliche Hochschule Hannover unter Leitung von Frau Dr. Verspohl untersucht. Er zeichnet sich durch die Virulenzmerkmale F4, LT1, ST1, ST2 aus. Bei dem zur Infektion verwendeten Stamm handelt es sich um einen enterotoxischen Subtyp. 3.7.2 Herstellung der Infektionsbouillon Zur Herstellung der zur oralen Infektion verwendeten Nährlösung wurde der im Kapitel „Infektionsstamm“ beschriebene tiefgekühlte E. coli-Stamm drei Tage vor dem Infektionszeitpunkt auf Schafblutagar ausgestrichen und für 24 Stunden bei 37 °C bebrütet. Von den enstandenen Kolonien wurden fünf Ösen Material in 50 ml Brain and Heart Infusion 37 Material und Methoden ___________________________________________________________________________ („BHI“; hergestellt im Institut für Mikrobiologie nach Angaben der Fa. Becton Dickison, Nr. 237500) verrieben, welche dann für 24 Stunden bei 37 °C bebrütet wurde. 18 Stunden vor dem gewählten Zeitpunkt der experimentellen Infektion wurden 500 µl aus den 50 ml BHI in weitere 200 ml BHI pipettiert. Diese 200 ml wurden wiederum bei 37 °C bebrütet. Nach 18 Stunden konnte die benötigte Menge für die Infektion entnommen werden. Für die erste Infektion wurden jedem Tier 20 ml mit dem Futter verabreicht, für die Zweitinfektion lediglich 10 ml. 3.7.3 Orale Infektion der Tiere Die Tiere wurden am Tag vor der Infektion, wie im Kapitel „Fütterung“ beschrieben, restriktiv gefüttert, um dann am nächsten Morgen zuerst etwa 50 g des Futters zur Anhebung des pH-Wertes im Mageninhalt zu erhalten. Zur ersten Infektion mit nachfolgender klinischer Beobachtungsphase wurde den Tieren nun wiederum 50-100 g Futter versetzt mit 20 ml der Infektionsbouillon angeboten. Zum Zeitpunkt der Zweitinfektion wurden dem Futter nur 10 ml der Infektionsbouillon beigefügt. Nach vollständiger Aufnahme des Futters mit dem Erreger wurden die Tiere mit dem jeweiligen Versuchsfutter ad libitum gefüttert. Am Tag der Zweitinfektion und damit am Tag der Tötung wurde den Tieren eine Stunde vor der Euthanasie das Futter entzogen. 3.8 Sektion Nachdem die Tiere den Erreger mit dem Futter (mit Ausnahme von vier Tieren je Durchgang, die ohne unmittelbar vorangegangene Zweitinfektion getötet wurden) aufgenommen und ad libitum Futter zur Verfügung hatten, wurde ihnen eine Stunde vor ihrer Tötung das Futter entzogen. Zum Zeitpunkt der Euthanasie lag somit die orale Infektion vier bzw. fünf Stunden zurück. Den entsprechenden Tieren wurde in ihrer Bucht zunächst eine Ketamin- (Ketavet®) Azaperon- (Stresnil®) Kombinations-Narkose intramuskulär verabreicht, bevor sie gewogen und in den Sektionsraum verbracht wurden. Dort wurden sie mit einer intracardialen Injektion von T61® (10 ml) euthanasiert. Nachdem der Tierkörper in Rückenlage verbracht sowie 38 Material und Methoden ___________________________________________________________________________ gründlich gewaschen und desinfiziert wurde, insbesondere im Bereich der Schnittlinien, wurde die Bauchhöhle von Höhe des Xyphoids bis zum Anus eröffnet sowie die Tonsillen durch einen V-förmigen Schnitt entlang der Unterkieferäste freipräpariert, so dass eine Probenentnahme der Tonsillen erfolgen konnte. Nach Öffnen der Bauchhöhle wurden zuerst Proben der Darmlymphknoten (Lnn. ileocaecales) entnommen. Im Anschluss wurden die verschiedenen Ligaturen im Magen-Darmkonvolut gesetzt: im Bereich der Cardia und des Pylorus des Magens, am Beginn des Duodenums und zur Abgrenzung des Caecums sowohl zum Ileum als auch zum Colon hin. Weiterhin wurde das Colon im Bereich der Spitze des Colonkegels ligiert und damit das Colon in einen Anfangs- und einen Endabschnitt unterteilt. Letztlich wurde das Rectum nach Durchtrennung der Beckensymphyse so weit wie möglich kaudal abgebunden. Waren alle Ligaturen gesetzt, wurden die Verbindungen von Rectum und Magen kaudal bzw. kranial der Ligaturen durchtrennt und das Konvolut in toto aus dem Tierkörper entnommen und auf einen zweiten sauberen und desinfizierten Tisch verbracht, auf dem die ligierten Abschnitte voneinander getrennt und ihr Chymus vollständig entnommen wurde. Die benötigten Schleimhautproben aus Magen, Dünndarm und Caecum wurden nach Spülen mit klarem Wasser und Abflammen sowie Anschneiden mit einem sterilen Skalpell, ebenso wie die Tonsillen und Lymphknotenproben, direkt in bereitgestellte Nährmedien (Rappaport-Vassiliadis-Medium und Tetrathionat-Brilliantgrün-Galle-Bouillon) gegeben. 39 Material und Methoden ___________________________________________________________________________ Abbildung 3: Einteilung der Darmabschnitte zur Sektion (modifiziert nach: KÖNIG u. LIEBICH 1999) 3.9 Mikrobiologische Untersuchungen Qualitative Untersuchungen Zur Beprobung der Tiere wurden trockene sterile Rektaltupfer verwendet. Die Tiere wurden morgens zum Zeitpunkt der Fütterung beprobt; die Tupfer gelangten innerhalb von 30 Minuten in das institutseigene Labor. Zum qualitativen Nachweis von Salmonellen wurden die Tupfer in Rappaport-Vassiliadis-Medium geschwenkt und anschließend zur Herstellung einer Anreicherungskultur in Tetrathionat-Brilliantgrün-Galle-Βouillon verbracht, welche nach einer Bebrütungsdauer von 24 Stunden bei 42 °C und ein zweites Mal nach 48 Stunden auf Selektivnährböden ausgestrichen wurden. Dazu wurden Brilliantgrün-Phenolrot-LaktoseAgar nach Christensen-Kauffmann („Kauffmann-Platte“) sowie Rambach-Agar verwendet. Die Kauffmann-Platte ist unbeimpft von oranger Farbe und hemmt durch Zugabe von Brilliantgrün die grampositive Begleitflora. Eventueller Laktoseabbau wird durch den pHIndikator Phenolrot angezeigt (orange→gelb), der bei den Laktoseabbau-negativen 40 Material und Methoden ___________________________________________________________________________ Salmonellen zu einer roten Farbe des Nährbodens führt. Die Zugabe von Propylenglykol zum Rambach-Agar führt zur Säurebildung bei Salmonellen, welche auf diesem Nährboden mit einem pH-Indikator (Neutralrot) in Form von kirschroten Kolonien wachsen (Ausnahme: S. Paratyphi und S.Typhi). Andere Enterobakterien wachsen mit grünen Kolonien auf diesem Agar. Die grampositive Begleitflora wird durch Natrium-Desoxycholat gehemmt. Dieses Verfahren wurde ebenso zur qualitativen Untersuchung der Organ- und Schleinhautproben angewendet. Um die Tupfer qualitativ auf hämolysierende E. coli-Keime zu untersuchen, wurden diese auf Schafblutagarplatten ausgestrichen. Um nach der ersten experimentellen E.coli-Infektion sicher zu gehen, dass der ausgeschiedene Keim identisch mit dem applizierten war, wurden von verdächtigen Kulturen eines jeden Tieres Subkulturen angelegt und diese mittels einer PCR im Institut für Mikrobiologie und Tierseuchen der Stiftung Tierärztliche Hochschule Hannover auf ihre Virulenzmerkmale untersucht und mit denen des verwendeten Infektionskeimes verglichen. Es kam in allen Fällen zu einer Übereinstimmung. Keimzahlbestimmung Eine Keimzahlbestimmung wurde sowohl bei der Infektionsbouillon (S. Derby und E. coli) als auch bei den Chymusproben aus den Sektionen angewendet. Hierzu wurde eine Verdünnungsreihe der zu untersuchenden Probe angelegt. Dies geschah, indem 1 ml der Bouillon, bzw. 1 g der Chymusprobe in 9 ml PBS (phosphatgepufferte Kochsalzlösung) gegeben und gut durchmischt wurde. Aus dieser Verdünnung wurde wiederum 1 ml in 9 ml PBS pipettiert usw. Von den verschiedenen Stufen wurden jeweils im Doppelansatz 100 µl auf vorgetrockneten Nährböden ausgespatelt. Nach 24stündiger Bebrütungsdauer wurden die Kolonien des zu ermittelnden Erregers ausgezählt. Um die Keimdichte der Infektionsbouillon zu bestimmen, wurden die auf Gassner-Nährböden ausgespatelten Verdünnungsstufen 10 bis 10 -9 -5 ausgezählt. Es wurden nur Platten ausgewertet, die eine bis 100 koloniebildende Einheiten („KBE“) aufwiesen. E. coli wachsen auf Wasserblau-Metachromgelb-Laktose-Agar nach Gassner als relativ große, blaue, feucht-glänzende Kolonien, deren Laktoseabbau durch den pH-Indikator Wasserblau in Form einer blauen Färbung des Nährbodens angezeigt wird. Die Infektionsbouillon des ersten Durchganges zur Erstinfektion aller Tiere mit E. coli wies eine ermittelte Keimzahl von 1,5×1011 KBE/ml auf, die des zweiten Durchganges 1,9×109 41 Material und Methoden ___________________________________________________________________________ KBE/ml. Die zur Zweitinfektion mit E. coli angewendete Bouillon hatte im Mittel einen Keimgehalt von 2,5×1010 KBE/ml im ersten Durchgang und von 3,5×109 KBE/ml im zweiten Durchgang. Die quantitative Keimzahlbestimmung aus den Chymusproben unterschied sich dadurch, dass eine definierte Menge (100 µl) aller Verdünnungsstufen der Verdünnungsreihe (10-3 bis 10-9) auf Schafblutagar ausgespatelt wurde. Auch bei dieser Untersuchung wurden nur Platten mit einer Anzahl von einer bis 100 KBE ausgewertet. 3.10 Sonstige Untersuchungen 3.10.1 Analyse der Versuchsfutter Partikelgröße im Futter/Futterstruktur Zur Bestimmung der Partikelgrößen im pelletierten Futter wurden nasse Siebanalysen mit Siebgrößen von 0,2-3,2 mm durchgeführt. Dazu wurden etwa 50 g Pellets mit 1000 ml Wasser (ca. 30 °C) in ein Becherglas gegeben und für eine Stunde bei Raumtemperatur eingeweicht. Danach wurde die Futter-Wasser-Suspension auf das oberste Sieb eines zuvor im Trockenschrank bei 103 °C auf Gewichtskonstanz gebrachten, in Exsikkatoren abgekühlten und anschließend gewogenen Siebturm gegeben. Die Probe wurde mit 10 l kaltem destillierten Wasser durchgespült. Nach Trocknung über Nacht im Trockenschrank bei 103 °C wurde der Siebturm in den Exsikkator gestellt und ausgewogen. Die Berechnung der prozentualen Anteile der einzelnen Siebfraktionen wurde unter Berücksichtigung des Trockensubstanzgehaltes durchgeführt. Alle durch den Waschvorgang herausgelösten, d. h. wasserlöslichen Substanzen wurden der Fraktion <0,2 mm zugerechnet. Rohnährstoffe im Futter Die Rohnährstoffe wurden nach den Vorschriften der Weender Futtermittelanalyse in der Fassung nach (NAUMANN u. BASSLER 1993) bestimmt. 42 Material und Methoden ___________________________________________________________________________ Trockensubstanz im Futter (TS-Gehalt) Die Futterproben wurden in gewichtskonstante Aluminiumschälchen eingewogen, bei 105 °C bis zur Gewichtskonstanz getrocknet und nach erneuter Ermittlung des Gewichts der TSGehalt errechnet (siehe auch TS-Bestimmung im Chymus). Die zweite TS-Bestimmung wird vor weiteren Analysen des Untersuchungsgutes durchgeführt und dient der Korrektur der Analysenergebnisse bzgl. des entsprechenden Restwassergehaltes auf den absoluten TS-Gehalt. Zur Bestimmung der zweiten TS-Substanz werden 3 g gemahlenes Untersuchungsmaterial in einem gewichtskonstanten Tiegel für sechs Stunden bei 105 °C im Trockenschrank bis zur Gewichtskonstanz getrocknet. Rohprotein (Rp) Die Bestimmung des Rp-Gehaltes erfolgte mittels der DUMAS-Verbrennungsmethode. Dazu wurde die Probe homogenisiert und vermahlen. Dann wurden 0,3 g der Probe in einen Edelstahltiegel eingewogen. Die Probe wurde anschließend im Analysator bei 1000 °C unter Sauerstoffzugabe verbrannt. Die sich dabei bildenden Stickoxide wurden zu molekularem Stickstoff reduziert. Nach der Entfernung anderer Verbrennungsprodukte durch selektive Absorption wurde der molekulare Stickstoff mit einem Wärmeleitfähigkeitsdetektor bestimmt. Mit einer geräteeigenen Software wurde der Stickstoffgehalt berechnet. Durch Multiplikation mit dem Umrechnungsfaktor 6,25 (N-Gehalt im Protein: 16 %) wurde der Rohproteingehalt errechnet. Rohfett (Rfe) Nach Säureaufschluss durch Kochen mit konzentrierter HCl für 30 Minuten erfolgten die Filtration, Trocknung und 6-stündige Extraktion mit Petrolether im Soxhletapparat. Nach Abdampfen des Petrolethers wurde das im Kolben verbliebene Fett gravimetrisch bestimmt. Rohfaser (Rfa) Nach jeweils 30minütigem Kochen mit 1,25%iger H2SO4 und anschließend mit 1,25%iger NaOH wurde der Rückstand im Trockenschrank bei 105 °C getrocknet und ausgewogen, dann 43 Material und Methoden ___________________________________________________________________________ bei 450 °C im Muffelofen verascht. Die Subtraktion des Ra-Gewichtes vom RfaTrockengewicht ergab den Rfa-Gehalt. Rohasche (Ra) Die Ermittlung des Ra-Gehaltes schließt sich an die zweite TS-Bestimmung an, wobei die Proben im Tiegel sechs Stunden im Muffelofen bei 600 °C verascht und nach dem Abkühlen im Eksikkator ausgewogen wurden. Mit Hilfe der Rohasche lässt sich der Anteil der organischen Substanz (oS) an der TS errechnen (oS = TS – Ra). Stärke Die Bestimmung der Stärke erfolgte nach Säurehydrolyse polarimetrisch (Verbandsmethode nach VDLUFA). Zucker Nach Inversion des Zuckers wurde der Gehalt auf jodometrischem Wege bestimmt (Verbandsmethode nach VDLUFA). Pufferkapazität Die Bestimmung der Pufferkapazität erfolgte durch Titration einer wässrigen Futtersuspension (10 g Futter und 40 ml Aqua dest.) mit 0,5 N HCl auf pH-Stufen 5, 4, 3 und 2 (d. h. Erfassung der notwendigen Säuremenge zum Erreichen dieser genannten pH-Werte). Mineralstoffe Zur Bestimmung der Mineralstoffe wurde die Probe im Mikrowellengerät (MLS MEGA Firma: MLS-Gmbh/Milestone®) unter Zusatz von HNO3 und H2O2 naßverascht. Calcium Vor der Messung der Ca-Konzentration in der Aschelösung mittels Atomabsorptionsspektrometrie nach (SLAVIN 1968) werden die die Proben mit 0,5 %iger 44 Material und Methoden ___________________________________________________________________________ Lanthanchloridlösung (DUMJOVIC 1976) verdünnt, um Störionen auszuschalten. Die Calciumkonzentration wurde mit einem Atomabsorptionsspektrometer (Fa. Unicam, Gerät Solaar 969, Cambridge, UK) gemessen. Phosphor Bei 365 nm erfolgte die photometrische Bestimmung eines gelben Farbkomplexes (Reaktion von Orthophosphorsäure mit Ammoniumvanadat und Ammoniummolybdat in salpetersaurer Lösung, nach (GERICKE u. KURMIES 1952)). Ammoniumvanadat und Ammoniummolybdat reagieren mit der in den Aschelösungen enthaltenen Orthophosphorsäure im salpetersauren Milieu zu einem gelben Farbkomplex. Die Extinktion der Probelösung wurde mit einem Spektralphotometer (Cadas 100, Firma Lange, Berlin) gegen zwei Standardlösungen gemessen. Natrium, Kalium Die Natrium- bzw. Kaliumgehalte in den Aschelösungen wurden im Flammenemissionsverfahren nach (SCHUHKNECHT u. SCHINKEL 1963)) mit Hilfe des Flammenphotometers (M8 D-Acetylen; Firma Lange) ermittelt. Als Verdünnungslösung diente eine Caesiumchlorid-Aluminiumnitrat-Pufferlösung, um Störungen zu eliminieren. Als Kalibrierungslösung dienten Standards mit Konzentrationen von 2 ½, 5 und 10 mg/l. Chlorid Nach Aufschlämmen der vermahlenen Futterprobe in destilliertem Wasser wurden die Chloridgehalte mit coulometrischer Titration im Chlordi Analyser (Firma Corning, Art.-Nr. 925, Halsteadt, UK) ermittelt. 45 Material und Methoden ___________________________________________________________________________ 3.10.2 Untersuchung von Chymusproben 3.10.2.1 Parameter Neben der im Kapitel 3.8 beschriebenen Keimzahlbestimmung wurden in den Chymusproben weitere Parameter untersucht. Zu unterscheiden sind hierbei fünf Chymus-Lokalisationen: Magen, Dünndarm, Caecum, Colon 1 (=kranialer Abschnitt des Colons bis zur Colonkegelspitze) und Colon 2 (=kaudaler Abschnitt von Colonkegelspitze bis einschließlich Rektum). Die jeweilig erhobenen Parameter sind in einer Übersicht in Tabelle 9 dargestellt. Tabelle 9: Abschnitte des MDT und entsprechende Untersuchungsparameter post mortem Menge (US) TS-Gehalt Chymuslokalisation Magen Dünndarm Caecum Colon 1 Colon 2+Rektum 1 = flüchtige Fettsäuren X X X X X X X X X X Untersuchungsparameter pH-Wert Laktat-Gehalt Formiat-Gehalt Gehalt an fl. FS1 X X X X X X X X X X X X X 3.10.2.2 Probenaufbereitung und -untersuchung Menge (US) Der gesamte Chymus eines Magen-Darm-Abschnittes wurde direkt nach Entnahme in Plastikbecher gefüllt und gewogen. Vor der Entnahme von Chymus für weitere Untersuchungen wurde auf eine homogene Durchmischung der Proben geachtet. Nach Entnahme der benötigten Proben wurden die Becher mit Deckeln verschlossen und bis auf weiteres als Rückstellproben in die institutseigenen Tiefkühlräume verbracht. Dort wurden sie bei -20 °C gelagert. 46 Material und Methoden ___________________________________________________________________________ Trockensubstanz im Chymus (TS-Gehalt) Zur Bestimmung des Trockensubstanzgehaltes wurde eine Chymusmenge von ca. 100 g in zuvor im getrockneten, abgekühlten Zustand ausgewogene Aluminiumschalen gefüllt und für mindestens 24 Stunden bei 105 °C in einen Trockenschrank verbracht. Nach dieser Zeit wurden die Schalen im Exsikkator abgekühlt und ausgewogen. So konnte rechnerisch die Bestimmung des TS-Gehaltes anhand der Differenz von Ein- und Auswaage (=Rohwasser) erfolgen. pH-Wert Der pH-Wert wurde direkt nach Entnahme des Chymus mit einem digitalen pH-Meter (Gerät Firma WTW, Modell pH 526, Williams) über eine ionensensitive Elektrode, die zuvor geeicht worden war, gemessen. Laktat- und Formiat-Gehalte Um den Laktat- und Formiatgehalt der Proben zu bestimmen, mussten diese vorher in derselben Art und Weise aufbereitet werden. Dazu wurde der Chymus im Verhältnis 1:1 mit Perchlorsäure versetzt und anschließend für 15 Minuten bei 4 °C und 18650×g zentrifugiert. Der Überstand wurde auf zwei weitere Reagenzgläser verteilt und bei -20 °C gelagert, bis er mittels kommerzieller Testsätze (Firma Boehringer, Mannheim) auf seinen Laktat- und Formiatgehalt untersucht wurde. L-Laktat wird in Gegenwart von Nicotinamid-adenin-dinucleotid (NAD) durch LaktatDehydrogenase (L-LDH) zu Pyruvat umgewandelt. Bei dieser Reaktion fallen NADH und H+ an. Das Gleichgewicht liegt auf der Seite des Laktats. Es kann jedoch durch Abfangen des Pyruvats mit Hilfe einer nachgestellten Reaktion mit dem Enzym Glutamat-PyruvatTransaminase (GPT)in Gegenwart von L-Glutamat auf die Seite von Pyruvat und NADH verschoben werden. Die während dieser Reaktion gebildete NADH-Menge ist der LMilchsäure-Menge äquivalent und wird photometrisch bei 340 nm bestimmt. Formiat wird in Gegenwart von Formiat-Dehydrogenase (FDH) durch NAD zu Bicarbonat oxidiert. Da hier wiederum NADH entsteht, das quantitativ äquivalent zum Formiat ist, wird es ebenfalls photometrisch bei 340 nm bestimmt und gibt somit indirekt den Formiatgehalt der Probe an. 47 Material und Methoden ___________________________________________________________________________ Gehalt an flüchtigen Fettsäuren Zur Bestimmung des Gehaltes an flüchtigen Fettsäuren wurde ein Teil der frischen Probe (ca. 7 g) für 15 Minuten bei 18650 x g zentrifugiert. 1000 µl des Überstandes wurden mit 100 µl internen Standards versetzt und bei -20 °C eingefroren. Der interne Standard ist ein Ansatz von 10 ml Ameisensäure (89-91%ig) und 0,1 ml 4-Methylvaleriansäure. Der Gehalt an flüchtigen Fettsäuren wurde im Anschluss mittels eines Gaschromatographen bestimmt, an dem eine Säulentemperatur von 155 °C, eine Injektortemperatur von 175 °C und eine Detektortemperatur von 180 °C eingestellt waren. Innerhalb von 25 Minuten wurden die flüchtigen Fettsäuren an einer zwei Meter langen gepackten Säule aufgetrennt und mittels eines Flammenionisationsdetektors bestimmt. Die Reihenfolge der Detektion lautete: Essigsäure, Propionsäure, iso-Buttersäure, n-Buttersäure, iso-Valeriansäure, n-Valeriansäure. 3.11 Berechnungen Energiegehalt des Futters Die umsetzbare Energie (ME) des Versuchsfutters wurde nach folgender Formel bestimmt (Futtermittelrecht, Anlage 4 der Futtermittelverordnung): ME (MJ/kg) = 0,0223 × g Rohprotein + 0,0341 × g Rohfett + 0,017 × g Stärke + 0,0168 × g Zucker – 0,0109 × g Rohfaser + 0,0074 × g organischer Rest;1) 1) wobei oR = oS – Rp – Rfe – Stärke – Zucker – Rfa Futteraufnahme Die Futteraufnahme wurde, bedingt durch die Gruppenhaltung und somit gruppenweise Fütterung pro Durchgang, für je fünf Tiere einer Gruppe berechnet. Dazu wurde jeden Morgen eine Rückwaage des restlichen Futters aus den Trögen vorgenommen und diese jeweils von der Einwaage subtrahiert: Summe Einwaage – Summe Rückwaage = Futteraufnahme. In der jeweils letzten Woche der Durchgänge, in der die Tiere einzeln aufgestallt waren, wurde die Futteraufnahme für jedes Tier einzeln berechnet und je nach Gruppenzugehörigkeit zum Gruppenwert hinzu addiert. Die Futteraufnahme wurde für den gesamten Zeitraum, in dem die Tiere das Versuchsfutter bekamen, berechnet. 48 Material und Methoden ___________________________________________________________________________ Tageszunahmen Die Tiere wurden am Tag -3 (= Beginn Fütterung mit Versuchsfutter), am Tag 21 des Versuches und am Tag ihrer Sektion gewogen. So konnte für jedes Einzeltier eine durchschnittliche Tageszunahme für den Zeitraum, in dem es mit dem Versuchsfutter gefüttert wurde, berechnet werden. Futteraufwand Der Futteraufwand konnte aufgrund der oben beschriebenen Berechnung der Futteraufnahme nur gruppenweise und nicht für die Einzeltiere berechnet werden. Dazu wurde in jedem Durchgang die errechnete Futteraufnahme pro Gruppe durch die Summe der Körpermassenzunahmen von allen Tieren einer Gruppe dividiert, um so einen Futteraufwand in kg pro Zuwachs von 1 kg Körpermasse zu erhalten: Futteraufnahme (pro Gruppe) : Körpermassezunahme (Summe aller Tiere einer Gruppe) = Futteraufwand (kg Futter/ 1 kg Körpermassezunahme) Keimzahlbestimmung Zur Keimzahlbestimmung wurden entsprechende Nährböden mit 1-100 KBE ausgezählt. Aus den Werten der verschiedenen Verdünnungsstufen einer Probe wurde rechnerisch das arithmetische Mittel bestimmt. 3.12 Statistische Methoden Zur Auswertung der Versuchsergebnisse kam das Programm SAS® („Statistical Analysis System“) zum Einsatz. Die quantitativen Ergebnisse wurden bei vorliegender Normalverteilung einer zweifaktoriellen Varianzanalyse unterzogen. Waren die Daten auch logarithmiert nicht als normal verteilt anzusehen, so wurde der Kruskal-Wallis-Test bzw. der Wilcoxon-Test angewandt. Bei qualitativen Daten wie den Organ- und Schleimhautproben kam der Chi-Quadrat-Homogenitätstest zum Einsatz. Die Signifikanzen wurden entsprechend mit Signifikanzniveau wurde auf 5 % (p<0,05) festgelegt. Buchstaben gekennzeichnet, das 49 Ergebnisse ___________________________________________________________________________ 4 Ergebnisse Die Ergebnisse sollen hier entlang der zeitlichen Abfolge des Versuchs dargestellt werden. Der Versuch bestand aus zwei Durchgängen, in denen jeweils fünf Kontrolltiere (= Kontrollgruppe) und fünf Versuchstiere pro Gruppe (drei Versuchsgruppen) zeitgleich gehalten wurden (20 Tiere pro Durchgang). Die beiden Durchgänge wurden zusammengefasst sowie die Kontrollgruppe und die drei Versuchsgruppen nebeneinander dargestellt, um so eine übersichtliche Darstellung zu ermöglichen. Bezüglich der Signifikanzen wurde die Kontrollgruppe (=fein vermahlenes Futter ohne Zusätze) zum einen mit den Versuchsgruppen „fein + KDF“ (=fein vermahlenes Futter + KDF [1,2% Formi LHS®]) sowie „fein + freie Säuren“ (=fein vermahlenes Futter + freie Säuren [0,9% Lupro-Cid®]) und zum anderen mit der Gruppe „grob ohne Zusätze“ (=grob vermahlenes Futter ohne die o. g. Zusätze) verglichen. Es werden zwar alle vier Gruppen gegeneinander auf Signifikanzen geprüft, jedoch ist zu beachten, dass die beiden Versuchsgruppen „fein + KDF“ und „fein + freie Säuren“ nicht direkt mit der Versuchsgruppe „grob ohne Zusätze“ verglichen werden können, da hier der Einfluss der Futterstruktur nicht eindeutig vom Einfluss der Futteradditiva abgegrenzt werden kann. Die Adaptationsphase und die Futterumstellung bereiteten den Tieren keinerlei Probleme. Während des zweiten Durchgangs kam es allerdings zu einer Infektion mit einem Feldstamm hämolysierender E. coli, in deren Verlauf Tiere aller Gruppen Fieber, Apathie, Ödeme im Bereich der Augen und eine verminderte Futteraufnahme zeigten. Zwei Tiere der Kontrollgruppe und ein Tier einer Versuchsgruppe (fein + KDF) mussten aufgrund der massiven Ausprägung der Symptome euthanasiert werden. Die Kontrollgruppe wurde mit einem Tier, das bisher ebenfalls ausschließlich mit dem Kontrollfutter gefüttert worden war, nachträglich ergänzt. Mit Ausnahme dieses Tieres wurden alle Tiere beider Durchgänge im Alter von ca. 4 Wochen einer oralen Infektion mit Salmonella Derby unterzogen (Dissertation NEU 2007). Diese Infektion hatte keinerlei nachteilige Auswirkungen auf das Allgemeinbefinden der Tiere. Die Ergebnisse sollen hier nur soweit dargestellt werden, wie es im Zusammenhang mit der späteren Infektion mit E. coli von Bedarf sein könnte. 50 Ergebnisse ___________________________________________________________________________ 4.1 Futteraufnahme, Tageszunahmen und Futteraufwand Die mittlere Körpermasse der Tiere unterschied sich zu Versuchsbeginn nur wenig voneinander. So waren die Tiere der Versuchsgruppe „fein + freie Säuren“ mit einer mittleren Körpermasse von 10,46 ± 0,62 kg nur geringgradig schwerer als die Tiere der anderen Gruppen (Kontrollgruppe: 10,30 ± 1,09 kg, Versuch: „fein + KDF“: 10,38 ± 1,27 kg, „grob ohne Zusätze“: 10,18 ± 1,27 kg). Das Endgewicht der Tiere wurde am Tag der Sektion bestimmt. Aufgrund der unterschiedlichen Tötungszeitpunkte sind die Körpermassen am Ende des Versuchs unterschiedlich. Die durchschnittlichen Tageszunahmen wurden für jedes einzelne Tier berechnet und daraus ein Gruppen-Mittelwert ermittelt. Die Werte sollen hier getrennt nach Durchgängen beschrieben werden, da sich die Ergebnisse im zweiten Durchgang – bedingt durch eine E. coli-Feldinfektion der Tiere - von denen des vorangegangenen unterschieden. Tabelle 10: Durchschnittliche Tageszunahmen (Angaben in kg) der Tiere in beiden Durchgängen Kontrolle fein + KDF fein + freie grob ohne n=9 n=9 Säuren, n = 10 Zusätze, n = 10 MW ±s MW ±s MW ±s MW ±s D1 0,64 0,07 0,74 0,06 0,72 0,10 0,67 0,12 D2 0,61 0,04 0,48 0,14 0,55 0,05 0,59 0,12 Im ersten Durchgang zeichneten sich die Tiere der Versuchsgruppe „fein + KDF“ durch eine gegenüber der Kontrollgruppe im Mittel um 100 g höhere, gegenüber der Versuchsgruppe „grob ohne Zusätze“ im Mittel um 70 g höhere Tageszunahmen aus. Gegenüber der Versuchsgruppe „fein + freie Säuren“ war der Unterschied nur gering. Während des zweiten Durchgangs waren die durchschnittlichen Tageszunahmen insgesamt deutlich niedriger. Die Kontrollgruppe hatte die höchsten Zunahmen, gefolgt von den Versuchsgruppen „grob ohne Zusätze“ und der Gruppe „fein + freie Säuren“. Die dritte Versuchsgruppe „fein + KDF“ hatte die mit Abstand niedrigsten Zunahmen. Die durchschnittliche Futteraufnahme pro Tier und Tag konnte aufgrund der Art der Fütterung (gruppenweise) nicht für die Individuen berechnet werden. Aus dem 51 Ergebnisse ___________________________________________________________________________ Gesamtfutterverbrauch einer Gruppe über den gesamten Versuchszeitraum und der Summe der Körpermassezunahmen aller Tiere einer Gruppe bis zum Tag ihrer Sektion lässt sich der Futteraufwand berechnen. Er gibt an, wieviel Futter (kg) durchschnittlich pro Tier für 1 kg Körpermassenzuwachs verbraucht wurden und ist somit ein Parameter für die Leistung der Tiere. Aus den gleichen Gründen wie bei der vergleichenden Darstellung der Tageszunahmen ist es auch hier sinnvoll, die Ergebnisse für die beiden Durchgänge getrennt darzustellen. Tabelle 11: Futteraufwand (kg/kg KM-Zunahme) der verschiedenen Gruppen beider Durchgänge Kontrolle (fein fein + KDF fein + freie grob ohne Zusätze ohne Zusätze) Säuren Durchgang 1 1,84 1,75 1,79 1,77 Durchgang 2 1,85 1,83 1,72 1,79 4.2. Untersuchung der Rektaltupfer auf Salmonellen Wie in früheren Untersuchungen auch hatte die experimentelle Infektion mit Salmonellen keinerlei klinisch erkennbare Auswirkungen auf das Allgemeinbefinden der Tiere. Die Ergebnisse der bakteriologischen Untersuchung der Rektaltupfer hinsichtlich der Salmonellenausscheidung sollen getrennt nach Durchgängen dargestellt werden, da hier unterschiedliche Tendenzen erkennbar werden. Während des ersten Durchgangs zeigten die Versuchsgruppen „fein + freie Säuren“ und „grob ohne Zusätze“ in der Summe die niedrigste Zahl an positiven Proben, gefolgt von der Versuchsgruppe „fein + KDF“. Die Kontrollgruppe wies die größte Zahl an positiven Proben auf. Die Tiere der Kontrollgruppe und der Versuchsgruppen „fein + KDF“ und „fein + freie Säuren“ hatten jeweils um den Tag 8 die höchste Ausscheiderfrequenz mit 5 bzw. 2 von 5 Tieren. In der Versuchsgruppe „grob ohne Zusätze“ ließ sich eine solche Tendenz (zeitliche Häufung) nicht feststellen. 52 Ergebnisse ___________________________________________________________________________ Tabelle 12: Anteil Salmonellen-positiver Rektaltupferproben (n) an der Gesamtprobenzahl (n) nach experimenteller Infektion mit S. Derby (Durchgang 1) Tag post fein + freie grob ohne Kontrolle fein + KDF infectionem Säuren Zusätze -8 -3 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 1 2 3 4 5 6 7 8 9 10 12 14 16 20 24 28 32 36 41 2/5 2/5 2/5 2/5 2/5 1/5 3/5 5/5 2/5 3/5 1/5 3/5 3/5 0/5 1/5 2/5 1/5 0/5 1/5 2/5 1/5 2/5 2/5 2/5 2/5 2/5 2/5 1/5 1/5 0/5 0/5 1/5 0/5 1/5 0/5 0/5 0/5 1/5 2/5 2/5 0/5 0/5 0/5 1/5 2/5 2/5 1/5 2/5 0/5 1/5 0/5 0/5 0/5 0/5 1/5 0/5 0/5 2/5 2/5 1/5 1/5 2/5 0/5 1/5 1/5 0/5 1/5 1/5 0/5 0/5 0/5 0/5 0/5 2/5 0/5 0/5 36/105 20/105 14/105 14/105 Summe In Bezug auf den zweiten Durchgang ist zu beachten, dass sich die Gesamtprobenanzahl zwischen den Gruppen unterschied, da aufgrund einer E. coli-Feldinfektion drei Tiere euthanasiert werden mussten. Aus diesem Grund ist eine relative Betrachtung (Summe der positiven Tupfer an der Gesamtprobenzahl) sinnvoller. Die Kontrollgruppe unterschied sich mit ca. 34 % kaum von der Versuchsgruppe „grob ohne Zusätze“ mit ca. 33 % positiver Proben. Die beiden anderen Versuchsgruppen „fein + KDF“ und „fein + freie Säuren“ zeigten deutlich niedrigere Anteile mit 23 % bzw. ca. 25 %. Ein Maximum der Ausscheidung ließ sich nur bei der Kontrollgruppe und der Versuchsgruppe „fein + KDF“ feststellen. Es liegt in der Zeit um den Tag 12 des Versuchs. 53 Ergebnisse ___________________________________________________________________________ Tabelle 13: Anteil Salmonellen-positiver Rektaltupferproben (n) an der Gesamtprobenzahl (n) nach experimenteller Infektion mit S. Derby (Durchgang 2) fein + freie grob ohne Tag post Kontrolle fein + KDF infectionem Säuren Zusätze -8 -3 1 2 3 4 5 6 7 8 9 10 12 14 16 19 25 29 32 35 40 Summe 0/5 0/5 2/5 2/5 2/5 2/5 2/5 2/5 2/5 2/5 2/5 3/5 3/5 2/5 2/5 2/5 0/3 1/3 0/3 0/3 1/3 32/95 0/5 0/5 2/5 2/5 2/5 2/5 2/5 1/5 2/5 1/5 1/5 2/5 3/5 2/5 1/5 0/5 0/4 0/4 0/4 0/4 0/4 23/100 0/5 0/5 2/5 2/5 1/5 1/5 2/5 2/5 1/5 1/5 1/5 3/5 1/5 2/5 2/5 4/5 0/5 1/5 0/5 0/5 0/5 26/105 0/5 0/5 2/5 2/5 1/5 5/5 2/5 2/5 2/5 2/5 3/5 2/5 2/5 4/5 2/5 3/5 0/5 0/5 1/5 0/5 0/5 35/105 Fasst man beide Durchgänge hinsichtlich der Frequenz Salmonellen-positiver Rektaltupfer zusammen, so waren in der Kontrollgruppe ca. 34 % aller Proben positiv, deutlich niedriger waren die Werte der drei Versuchsgruppen (19/21/23,3 %). 54 Ergebnisse ___________________________________________________________________________ Tabelle 14: Anteil Salmonellen-positiver Tupferproben an der Gesamtprobenzahl nach experimenteller Infektion (Summe Durchgang 1+2) Kontrolle 36/105 Summe D 1 32/95 Summe D 2 Summe D1+2 68/200 34,00 in % fein + KDF 20/105 23/100 43/205 21,00 fein + freie Säuren 14/105 26/105 40/210 19,00 grob ohne Zusätze 14/105 35/105 49/210 23,30 Um eine differenziertere Darstellung der Salmonellenausscheidung zu ermöglichen, sollen hier die positiven Tupferproben in % an der Gesamtprobenanzahl dargestellt werden. Die Darstellung erfolgt dabei getrennt nach primär und sekundär infizierten Tieren. Die primär infizierten Tiere wurden separat aufgestallt und mit einer Infektionsbouillon oral über das Futter mit Salmonellen infiziert. Sobald ihre Rektaltupferproben erstmalig positiv waren, wurden sie wieder zusammen mit den Tieren ihrer jeweiligen Gruppe untergebracht. Diese Tiere steckten sich also sekundär, d. h. an den primär infizierten Gruppenmitgliedern an. In die Berechnungen als „sekundär infiziert“ wurden nur Tiere einbezogen, die mindestens einmal Salmonellen ausschieden, also mindestens eine positive Tupferprobe zeigten. Die Proben der primär infizierten Tiere der Kontrollgruppe zeigten den höchsten positiven Anteil mit fast 79 % und hatten damit einen signifikant höheren Anteil positiver Proben als die Tiere der Versuchsgruppen „fein +KDF“, „fein + freie Säuren“ und „grob ohne Zusätze“. Den niedrigsten prozentualen Anteil an positiven Proben der primär infizierten Tiere hatten die Tiere der Versuchsgruppe „fein + freie Säuren“. Anders sieht es jedoch hinsichtlich der sekundär infizierten Tiere aus: hier zeigte die Versuchsgruppe „fein + freie Säuren“ einen relativ hohen Anteil positiver Proben mit fast 23 %. Die Versuchsgruppe „grob ohne Zusätze“ und die Kontrollgruppe unterschieden sich mit 15,00 bzw. 15,63 % kaum voneinander, und die Versuchsgruppe „fein + KDF“ hatte den geringsten Anteil mit 8,33 % positiver Proben. 55 Ergebnisse ___________________________________________________________________________ Tabelle 15: Anteil Salmonellen-positiver Tupferproben an der Gesamtprobenzahl nach experimenteller Infektion getrennt nach primär bzw. sekundär infizierten Tieren (in %) % positiver Kontrolle Proben/Gesamtproben -zahl primär infiziert sekundär infiziert 1 fein + KDF fein + freie grob ohne Säuren Zusätze n1 MW ±s MW ±s MW ±s MW ±s 4 78,95a 19,70 56,96b 19,60 38,16b 21,20 51,32b 20,30 6 15,00 16,30 8,33 3,61 22,92 13,01 15,63 11,97 = Tierzahl; Zahl der untersuchten Rektaltupfer pro Gruppe in beiden Durchgängen = 190 4.3.1 Klinische Symptome nach der ersten experimentellen E. coliInfektion Während des ersten Durchgangs kam es in den ersten zwei Tagen nach der erstmaligen experimentellen Infektion mit E. coli (Dosis = 1,5 × 1011 KBE/ml) zu deutlichen klinischen Symtomen bei mehreren Tiere. Diese Symtome sind unten anteilsmäßig aufgeführt. Insgesamt erholten sich jedoch alle betroffenen Tiere sehr schnell und waren nach 3 Tagen wieder klinisch unauffällig. Die Tiere des zweiten Durchgangs zeigten zu keinem Zeitpunkt klinische Symptome (Dosis = 1,9 × 109 KBE/ml), allerdings erkrankten diese Tiere etwa drei Wochen vor der experimentellen Infektion an einer Feldinfektion mit E. coli-Erregern, so dass zum Zeitpunkt der experimentellen Infektion evtl. schon eine gewisse Immunität vorlag. 56 Ergebnisse ___________________________________________________________________________ Tabelle 16: Ausprägung klinischer Symptome (nur in Durchgang 1 beobachtet) nach experimenteller Erstinfektion mit E. coli (Tag 1 und 2 post infectionem) Tiere mit klinischen Kontrolle fein + KDF fein + freie Symptomen/ Säuren Gesamttierzahl Tag 1 post infectionem 3/5 1/5 3/5 Diarrhoe 1/5 0/5 0/5 Vomitus gestörtes 3/5 0/5 1/5 Allgemeinbefinden Tag 2 post infectionem 1/5 0/5 1/5 Diarrhoe 0/5 0/5 1/5 Vomitus gestörtes 0/5 0/5 0/5 Allgemeinbefinden grob ohne Zusätze 4/5 1/5 2/5 1/5 0/5 0/5 4.3.2 Untersuchung der Rektaltupfer auf E. coli Aus den an sechs aufeinander folgenden Tagen nach der experimentellen Infektion mit hämolysierenden E. coli genommenen Rektaltupfer konnte bis auf drei Ausnahmen bei allen Tieren des ersten Durchgangs durchgehend der applizierte Keim nachgewiesen werden. Die Tiere des zweiten Durchgangs schieden insgesamt über einen kürzeren Zeitraum hämolysierende E. coli aus. 57 Ergebnisse ___________________________________________________________________________ Tabelle 17: Qualitativer Nachweis von hämolysierenden E. coli nach experimenteller Erstinfektion mittels Rektaltupfer (positive Proben/Gesamtprobenzahl), Durchgang 1 und 2 Tag post infectionem Kontrolle fein + fein + freie grob ohne KDF Säuren Zusätze Durchgang 1 1 5/5 5/5 5/5 5/5 2 5/5 5/5 5/5 5/5 3 5/5 5/5 5/5 5/5 4 5/5 5/5 4/5 4/5 5 4/4 4/4 4/4 4/4 6 4/4 4/4 3/4 4/4 Durchgang 2 1 4/4 4/4 5/5 5/5 2 4/4 4/4 4/5 4/5 3 4/4 2/4 0/5 2/5 4 3/4 2/4 3/5 2/5 5 3/3 1/3 2/4 2/4 6 2/3 1/3 4/4 3/4 4.4 Chymus Bei der Sektion erfolgte – wie in Kapitel 3.8 beschrieben- die Entnahme des gesamten Verdauungstraktes, um den Chymus für die in Tabelle 9 aufgeführten Untersuchungen zu gewinnen. 58 Ergebnisse ___________________________________________________________________________ 4.4.1 Füllung des Verdauungskanals Die Füllung des Magens (g TS/kg KM) wies im Vergleich zu den anderen Abschnitten des Verdauungstrakts bei allen Tieren beider Durchgänge immer die höchsten Werte auf. Innerhalb der Gruppen zeigten die Tiere der Gruppe „grob ohne Zusätze“ den höchsten Füllungsgrad des Magens, die Tiere der Gruppe „fein + freie Säuren“ den niedrigsten. Es finden sich jedoch weder bzgl. des Magens noch bzgl. der anderen Lokalisationen signifikante Unterschiede zwischen den Gruppen. Der geringste Füllungsgrad findet sich bei allen Tieren im Caecum. Die Füllung der beiden Colonabschnitte weist durchweg geringere Werte als die des Dünndarms auf. Tabelle 18: Füllung der verschiedenen Abschnitte des Magen-Darm-Trakts (g TS/kg KM) von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter Füllung in g TS/kg KM Magen Dünndarm Caecum Colon 1 Colon 2 Kontrolle n MW ±s 9 5,80 3,51 9 2,57 0,63 9 0,54 0,18 9 1,79 0,61 9 1,35 0,78 fein + KDF fein + freie Säuren grob ohne Zusätze n MW ±s n MW ±s n MW ±s 9 4,75 3,22 10 3,19 2,18 10 6,03 3,64 9 2,25 0,75 10 2,27 0,59 10 2,31 0,61 9 0,45 0,24 10 0,33 0,29 10 0,50 0,24 9 1,90 0,68 10 2,24 0,62 10 2,20 0,46 9 1,73 0,64 10 1,96 0,84 10 1,66 0,55 4.4.2 TS-Gehalte Die Versuchsgruppe „grob ohne Zusätze“ hatte einen signifikant höheren Anteil an Trockensubstanz im Magenchymus als die Versuchsgruppe „fein + freie Säuren“. Der Dünndarmchymus wies hinsichtlich des TS-Gehaltes zwischen den Gruppen keine signifikanten Unterschiede auf. Im Bereich des Caecums ist ein statistisch abzusichernder Unterschied zwischen der Kontrollgruppe mit einem relativ hohen Wert und den Versuchsgruppen „fein + KDF“ und „fein + freie Säuren“ mit vergleichsweise niedrigeren Werten zu erkennen. Den höchsten TS-Gehalt hat - wie zu erwarten - bei allen Tieren der Chymus des Abschnittes Colon 2 (= Colonspitze bis Rektum). Mit Ausnahme des Magenchymus hatten die Tiere der Kontrollgruppe tendenziell höhere Werte, allerdings waren die Unterschiede zwischen den Gruppen nicht immer statistisch abzusichern. 59 Ergebnisse ___________________________________________________________________________ Tabelle 19: TS-Gehalte im Chymus (in %) der verschiedenen Abschnitte des Magen-Darm-Trakts von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter TS-Gehalt des Kontrolle Chymus in % n MW ±s Magen Dünndarm Caecum Colon 1 Colon 2 ab 9 20,92 9 13,26 a 9 13,32 9 17,79 9 26,17 fein + KDF n MW ±s ab 8,94 9 18,81 2,19 9 11,89 b 3,17 9 11,47 2,33 9 16,81 2,77 9 25,82 fein + freie Säuren grob ohne Zusätze n MW ±s n MW ±s a 5,06 10 15,20 1,22 10 12,55 b 1,50 10 11,41 1,93 10 16,17 2,85 10 25,63 6,35 1,39 1,47 2,02 4,42 b 10 23,02 10 13,08 ab 10 12,00 10 17,14 10 25,05 8,34 1,32 1,39 3,47 4,99 4.4.3 pH-Werte Die pH-Werte im Chymus der verschiedenen Abschnitte des Verdauungstrakts wurden direkt nach ihrer Entnahme aus dem Tierkörper bestimmt. Mit einem Mittelwert von 3,75 hatten die Tiere der Versuchsgruppe „fein + freie Säuren“ einen signifikant niedrigeren pH-Wert im Magenchymus als die Tiere der Kontrollgruppe mit 5,02 und als die Tiere der Versuchsgruppe „grob ohne Zusätze“ mit 4,81. Auch der pH-Wert des Magenchymus der Versuchsgruppe „fein + KDF“ war höher als der der Versuchsgruppe „fein + freie Säuren“. Weiterhin ist festzustellen, dass der Dünndarmchymus der Gruppe „grob ohne Zusätze“ signifikant niedrigere pH-Werte aufwies als die Gruppen „fein + KDF“ und „fein + freie Säuren“. Ebenso war der Caecumchymus in der Gruppe „grob ohne Zusätze“ signifikant niedriger als in der Kontrollgruppe und tendenziell niedriger als in den Gruppen „fein + KDF“ und „fein + freie Säuren“. Die Unterschiede zwischen den pH-Werten waren in beiden Colonabschnitten sehr gering, d. h. statistisch nicht gesichert. 60 Ergebnisse ___________________________________________________________________________ Tabelle 20: pH-Werte im Chymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter pH-Werte im Chymus n Kontrolle MW ±s Magen 5,02 Dünndarm Caecum Colon 1 Colon 2 8 a 0,84 ab 8 6,49 a 8 6,20 8 6,27 8 6,94 0,15 0,29 0,45 0,38 fein + KDF n MW ±s ab 9 4,41 0,87 b 9 6,65 0,29 ab 9 6,02 0,31 9 6,11 0,25 9 6,83 0,34 fein + freie Säuren grob ohne Zusätze n MW ±s n MW ±s 10 10 3,75 b 1,13 6,64 b 0,37 ab 10 5,91 10 6,07 10 6,74 0,34 0,30 0,30 a 10 4,81 a 10 6,30 0,96 b 0,34 0,42 0,46 10 5,86 10 6,14 10 6,74 0,48 4.4.4 Laktat-Gehalte Die Laktat-Werte im Mageninhalt lagen bei den Tieren der Versuchgruppe „grob ohne Zusätze“ im Durchschnitt deutlich höher als bei den Tieren der übrigen Gruppen, wobei die Tiere der Versuchsgruppe „fein + KDF“ mit 0,86 mmol/kg uS den niedrigsten Wert aufwiesen. Auch im Dünndarmchymus der Tiere der Gruppe „grob ohne Zusätze“ war der Laktatgehalt sehr hoch, jedoch war dieser Wert in der Kontrollgruppe ähnlich hoch. Die beiden übrigen Versuchsgruppen unterschieden sich untereinander kaum, zeigten jedoch wiederum deutlich niedrigere Werte. Der Caecumchymus wies bei den Tieren der Versuchsgruppen „fein + freie Säuren“ und „grob ohne Zusätze“ mit jeweils 6,52 mmol/kg uS deutlich höhere Werte auf als bei den Tieren der Versuchsgruppe „fein + KDF“ und der Kontrollgruppe. In der Kontrollgruppe war der Mittelwert mit 1,39 mmol/kg uS am niedrigsten. Tabelle 21: Laktat-Gehalte (mmol/kg uS) im Chymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter Laktat in mmol/kg uS Magen Dünndarm Caecum n 7 8 7 Kontrolle MW ±s 2,94 2,84 23,23 12,02 1,39 1,94 fein + KDF fein + freie Säuren grob ohne Zusätze n MW ±s n MW ±s n MW ±s 9 0,86 0,95 10 1,24 2,63 10 7,62 15,39 9 16,57 10,88 10 14,69 12,83 10 26,34 19,46 7 2,18 2,05 9 6,52 11,24 6 6,52 6,16 61 Ergebnisse ___________________________________________________________________________ 4.4.5 Formiat-Gehalte Die Tiere der Versuchsgruppen „fein + KDF“ und „fein + freie Säuren“ (im Futter beider Gruppen war Ameisensäure/Formiat enthalten) wiesen signifikant höhere Formiat-Gehalte im Magen auf als die Tiere der Kontrollgruppe und der Gruppe „grob ohne Zusätze“. Die Formiat-Gehalte des Dünndarmchymus (Chymusmischprobe des gesamten Dünndarms) unterschieden sich nicht signifikant voneinander. Sie sind mit einem Durchschnittswert von ca. 612 mg/l uS in der Kontrollgruppe am höchsten und mit einem Wert von ca. 488 mg/l uS in der Versuchsgruppe „grob ohne Zusätze“ am niedrigsten. Tabelle 22: Formiat-Gehalte (mg/l uS) im Chymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter Kontrolle Formiat in n=8 mg/l uS MW ±s a 158 Magen Dünndarm 612 368 236 fein + KDF n=9 MW ±s 1054 609 b 597 350 fein + freie Säuren grob ohne Zusätze n = 10 n = 10 MW ±s MW ±s b 681 510 542 220 24,7 489 a 6,69 316 4.4.6 Flüchtige Fettsäuren Im Magenchymus zeigten sich bzgl. des Propionsäuregehaltes signifikante Unterschiede zwischen der Gruppe „fein + freie Säuren“ mit dem höchsten Wert (6,66 mmol/kg uS) und der Gruppe „grob ohne Zusätze“ mit dem niedrigsten Wert (3,67 mmol/kg uS). Die Gehalte an i-Buttersäure, n-Buttersäure, i-Valeriansäure und n-Valeriansäure waren sehr gering im Magenchymus und ohne signifikante Unterschiede zwischen den Gruppen. 62 Ergebnisse ___________________________________________________________________________ Tabelle 23: Gehalte an flüchtigen Fettsäuren (mmol/kg uS) im Magenchymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter Magen Essigs. n=9 MW ±s fein + freie Säuren n = 10 MW ±s grob ohne Zusätze n = 10 MW ±s 7,36 17,21 6,47 17,88 7,67 19,69 8,26 2,61 0,23 0,98 0,17 0,28 ab 4,49 0,12 1,31 0,15 1,04 a 3,49 0,15 1,20 0,11 0,27 b 1,62 0,08 0,55 0,00 0,09 Kontrolle fein + KDF n=9 MW ±s 22,51 ab 5,01 PS 0,12 i-Butters. 1,70 n-Butters. 0,56 i-Valerians. n-Valerians. 0,18 5,40 0,04 1,77 0,08 0,41 6,66 0,07 1,56 0,04 0,26 3,67 0,03 0,99 0,00 0,03 Der Dünndarmchymus zeigte wiederum signifikante Unterschiede des Propionsäuregehaltes zwischen der Gruppe „fein + freie Säuren“ mit einem relativ hohen Wert (4,11 mmol/kg uS) und der Kontrollgruppe sowie der Versuchsgruppe „grob ohne Zusätze“ mit vergleichsweise niedrigen Werten (1,39/1,24 mmol/kg uS). Die weiteren Fettsäurengehalte unterschieden sich nicht signifikant voneinander. Die i-Butter-, i-Valerian- und n-Valeriansäure waren nur bei Tieren der Gruppe „fein + freie Säuren“ in sehr geringer Menge nachzuweisen. Tabelle 24: Gehalte an flüchtigen Fettsäuren (mmol/kg uS) im Dünndarmchymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter n=9 MW ±s n=9 MW ±s fein + freie Säuren n = 10 MW ±s Essigs. 20,80 6,53 20,56 6,67 25,54 14,97 21,33 8,20 PS i-Butters. n-Butters. i-Valerians. n-Valerians. 1,39a 0,00 0,70 0,00 0,00 0,89 0,00 0,66 0,00 0,00 1,55ab 0,00 0,84 0,00 0,00 0,61 0,00 0,63 0,00 0,00 4,11b 0,06 1,56 0,06 0,23 5,32 0,19 2,32 0,17 0,49 1,24a 0,00 0,59 0,00 0,00 0,71 0,00 0,83 0,00 0,00 Dünndarm Kontrolle fein + KDF grob ohne Zusätze n = 10 MW ±s 63 Ergebnisse ___________________________________________________________________________ Im Caecumchymus konnten signifikante Unterschiede bzgl. des Essigsäuregehaltes festgestellt werden. Hier hatten die Tiere der Gruppe „grob ohne Zusätze“ mit 103,61 mmol/kg uS einen signifikant höheren Gehalt als die Tiere der Gruppe „fein + freie Säuren“ mit 86,95 mmol/kg uS. Ähnlich verhielt es sich bzgl. des i-Buttersäuregehaltes: Die Gruppe „grob ohne Zusätze“ hatte signifikant höhere Werte als die Gruppe „fein + freie Säuren“. Auch der n-Buttersäuregehalt sowie der n-Valeriansäuregehalt waren im Caecumchymus der Tiere der Gruppe „grob ohne Zusätze“ signifikant höher als in den drei anderen Gruppen. Der höchste i-Valeriansäuregehalt fand sich ebenfalls bei den Tieren der Gruppe „grob ohne Zusätze“. Er ist mit 0,87 mmol/kg uS signifikant höher als in den Gruppen „fein + KDF“ und „fein + freie Säuren“. Tabelle 25: Gehalte an flüchtigen Fettsäuren (mmol/kg uS) im Caecumchymus von Absetzferkeln (4-5 h postprandial) bei Einsatz unterschiedlicher pelletierter Mischfutter Caecum Kontrolle fein + KDF n=9 MW ±s n=9 MW ±s fein + freie Säuren n = 10 MW ±s grob ohne Zusätze n = 10 MW ±s Essigs. PS 87,63ab 17,16 81,69a 29,43 86,95ab 31,12 6,50 29,70 6,95 32,58 20,53 11,36 103,61b 45,25 25,72 29,87 i-Butters. 0,53ab 0,82 0,13a 0,38 0,36ab 0,68 0,85b 0,94 n-Butters.1) i-Valerians. 9,56a 0,78ab 4,27 0,51 9,52a 0,39a 3,30 0,36 10,30a 0,34a 3,04 0,42 17,46b 0,87b 6,22 0,58 n-Valerians. 2,12a 0,94 1,94a 0,98 1,38a 0,72 4,18b 2,25 1) Werte der n-Buttersäure verdienen besondere Hervorhebung im Zusammenhang mit dem Stärkegehalt, hierzu siehe Kapitel 5.2.2.1.5 4.5 Qualitativer Salmonellennachweis in verschiedenen Organen Zum Zeitpunkt der Sektion lag die Salmonellen-Infektion schon 44 bzw. 45 Tage zurück. Die diesbezügliche Befunderhebung diente insbesondere der Klärung eines möglichen Fütterungseinflusses auf die Translokation. Der qualitative Nachweis von Salmonellen 64 Ergebnisse ___________________________________________________________________________ erfolgte in verschiedener Organproben, die unmittelbar nach der Tötung der Tiere entnommen wurden. In der untenstehenden Tabelle ist jeweils der Anteil der positiven Proben an der Gesamtprobenzahl dargestellt. Der größte positive Anteil findet sich an allen Lokalisationen mit Ausnahme der Lymphknoten in der Gruppe „grob ohne Zusätze“. Der geringste Anteil positiver Proben an der Lokalisation Magenschleimhaut wurde in den Gruppen „fein + KDF“ und „fein + freie Säuren“ gefunden. An der Lokalisation Dünndarmschleimhaut wurde der geringste Anteil positiver Proben in der Gruppe „fein + KDF“ gefunden. In der Caecumschleimhaut und den Tonsillen wies die Kontrollgruppe mit drei positiven von elf genommenen bzw. zwei von elf genommenen Proben den geringsten Anteil auf. Bezüglich der Lymphknotenproben verhielt es sich allerdings umgekehrt: hier zeigte die Kontrollgruppe den größten Anteil positiver Proben, die Versuchsgruppen „grob ohne Zusätze“ und „fein + KDF“ den geringsten Anteil. Tabelle 26: Anteil Salmonellen-positiver Organproben an der Gesamtprobenzahl (ca. 45 Tage nach experimenteller oraler Infektion mit S. Derby) Kontrolle fein + KDF fein + freie Säuren grob ohne Zusätze 2/11 1/11 0/10 0/10 0/10 2/10 3/10 3/10 1 3/11 4/10 3/10 5/10 Tonsillen Lnn.ileocaecales 2/11 3/11 2/10 0/10 2/10 1/10 4/10 0/10 1 Magen 1 Dünndarm Caecum 1 -Schleimhaut 4.6 E. coli-Keimzahlen im Chymus Die E. coli-Keimzahlen wurden im Chymus von drei verschiedenen Lokalisationen des Verdauungstrakts bestimmt. Dies geschah nach einer zweiten experimentellen E. coliInfektion mit Ausnahme von insgesamt acht Tieren, welche ohne Zweitinfektion seziert wurden. 65 Ergebnisse ___________________________________________________________________________ 4.6.1 Quantitativer E. coli-Nachweis im Chymus von Tieren nach erstmaliger Infektion In beiden Durchgängen wurde jeweils ein Tier jeder Gruppe vier Tage nach der Erstinfektion mit E. coli, d. h. vor der Zweitinfektion seziert, um in den Chymusproben noch Keimghalte zu bestimmen, die nur auf die erstmalige Infektion zurückgeführt werden können. Die Keimzahlen der verschiedenen Lokalisationen der Tiere finden sich in logarithmierter Form in untenstehender Tabelle. Im Magenchymus wurde bei den Tieren der Kontrollgruppe ein signifikant höherer Wert festgestellt als bei den Tieren der Versuchsgruppen. Im Bereich des Dünndarms und des Caecums konnten keine statistisch abzusichernden Unterschiede festgestellt werden. Die höchste Keimzahl im Dünndarmchymus zeigten die beiden Tiere der Gruppe „fein + KDF“, die niedrigste die Tiere der Gruppe „fein + freie Säuren“. Der höchste Wert im Caecumchymus trat in der Kontrollgruppe auf, der niedrigste in der Versuchsgruppe „fein + freie Säuren“. Tabelle 27: E. coli-Keimzahlbestimmung KBE (log/g uS) im Chymus von Absetzferkeln (4 Tage nach experimenteller oraler Erstinfektion) bei Einsatz unterschiedlicher pelletierter Mischfutter KBE (log/g uS) n MW n MW fein + freie Säuren n MW Magen Dünndarm Caecum 2 2 2 3,81a 2,87 4,84 2 2 2 2,50b 4,10 4,31 2 2 2 Kontrolle fein + KDF 2,00b 2,65 2,96 grob ohne Zusätze n MW 2 2 2 2,00b 3,52 3,68 4.6.2 Quantitativer E. coli-Nachweis im Chymus von Tieren nach der zweiten experimentellen Infektion In der folgenden Tabelle 28 finden sich die E. coli-Keimzahlen in logarithmierter Form pro Gramm Chymus aus drei verschiedenen Lokalisationen des Verdauungstraktes. Im Magenchymus der Kontrollgruppe und der Versuchsgruppe „grob ohne Zusätze“ wurden signifikant höhere Keimzahlen nachgewiesen als in den Versuchsgruppen mit den Zusätzen. Hierbei ist allerdings zu beachten, dass es in der Gruppe „grob ohne Zusätze“ einen 66 Ergebnisse ___________________________________________________________________________ „Ausreißer“ mit einem deutlich höheren Wert als die anderen Tiere dieser Gruppe gab. Der Dünndarmchymus wies bei den Tieren der Versuchsgruppe „grob ohne Zusätze“ signifikant höhere Keimzahlen auf als bei den Tieren der Versuchsgruppen „fein + KDF“ und „fein + freie Säuren“. Der Caecumchymus enthielt bei den Tieren der Kontrollgruppe signifikant mehr Keime als bei den Tieren der Versuchsgruppe „fein + KDF“. Die Tiere der Versuchsgruppe „grob ohne Zusätze“ wiesen in diesem Abschnitt signifikant höhere Keimzahlen auf als die Tiere der beiden anderen Versuchsgruppen „fein + KDF“ und „fein + freie Säuren“. Tabelle 28: E. coli-Keimzahlbestimmung KBE (log/g uS) im Chymus von Absetzferkeln (4-5 h nach experimenteller oraler Zweitinfektion) bei Einsatz unterschiedlicher pelletierter Mischfutter KBE (log/g uS) Kontrolle n MW ±s Magen 7 7,68 a ab 0,40 Dünndarm 7 8,60 0,58 ac 7 9,04 0,48 Caecum 1) fein + KDF n MW ±s b 7 4,91 b 0,61 7 7,89 1,19 b 7 8,41 0,48 fein + freie Säuren grob ohne Zusätze n MW ±s n MW ±s 8 8 8 bei Verzicht auf den Ausreißer (n = 7): MW = 7,08 5,23 b b 8,01 ab 8,45 1,44 a1) 1,43 a 1,16 8 7,52 0,89 8 0,56 8 9,30 c 8,99 0,90 67 Diskussion ___________________________________________________________________________ 5 Diskussion Im Rahmen dieser Dissertation sollte untersucht werden, ob und inwieweit sich die Futterstruktur oder die eingesetzten Futteradditive (freie Säure bzw. ihr Salz), abhängig vom Vermahlungsgrad des Getreideanteils, auf - die Leistung der Tiere, - die Chymusqualität und –zusammensetzung, insbesondere mikrobiell gebildete Substanzen wie L-Laktat und Formiat, - den Infektionsverlauf und die klinische Ausprägung einer E. coli-Infektion sowie - die Adhäsion, Passage, Vermehrung und Ausscheidung der applizierten E. coli-Keime nach einer experimentellen Infektion auswirken. Die Ausscheidung der Salmonellen nach einer experimentellen Infektion sowie ihre Passage und Translokation wurden im Rahmen der Dissertation NEU (2007) diskutiert. Von besonderem Interesse sind nach dem Verbot aller antibiotischen Leistungsförderer im Jahr 2006 (Verordnung EG Nr. 1831/2003) Säurezusätze als leistungsfördernde und gleichzeitig gegen Krankheitserreger prophylaktisch wirksame Substanzen in der Schweineaufzucht. Escherichia coli ist dabei nicht als Zoonoseerreger, sondern vielmehr als Problemkeim einzustufen, der besonders bei Absetzferkeln zu hohen Verlusten führt. Eine erfolgreiche Prophylaxe in diesem Bereich ist also sowohl hinsichtlich der Tiergesundheit als auch bezüglich der Wirtschaftlichkeit von größtem Interesse. Es ist zu beachten, dass die eingesetzten Futtermittel sich zwar in ihrem Vermahlungsgrad 2 mm- bzw. 6 mm-Sieb in der Hammermühle), nicht jedoch in ihrer Konfektionierung (alle Futtermittel waren pelletiert) unterschieden. Ein direkter Vergleich im Rahmen der Diskussion ist zwischen der Kontrollgruppe („fein ohne Zusätze“) und der Gruppe „grob ohne Zusätze“ möglich, um so die spezifischen Auswirkungen der Futterstruktur auf die oben beschriebenen Parameter einschätzen zu können; ebenso zwischen der Kontrollgruppe und den beiden Versuchsgruppen mit Futterzusätzen „fein + KDF“ bzw. „fein + freie Säuren“ (auch untereinander), um getrennt die 68 Diskussion ___________________________________________________________________________ Wirkungen der Säurezusätze zu erfassen. Nicht erlaubt bzw. sinnvoll ist hingegen eine Gegenüberstellung der Versuchsgruppe „grob ohne Zusätze“ und der Versuchsgruppen mit Zusätzen, da hier nicht differenziert werden kann, in welchem Maß dann die Struktur oder der Säure-Zusatz die Wirkung bestimmt haben (Interaktionen sind dabei zu erwarten). 5.1 Kritik der Methode 5.1.1 Alter und Immunstatus der Tiere Die Tiere beider Durchgänge durchliefen im Rahmen des Dissertationsvorhaben NEU (2007) vor der E. coli- Infektion einen Versuch, der auf eine experimentelle Infektion mit Salmonella Derby fokussiert war. Diese Infektion wurde im Alter von ca. vier Wochen durchgeführt, der Infektionsverlauf wurde nachfolgend über ca. fünf Wochen beobachtet und dokumentiert (NEU 2007). Die experimentelle Infektion mit E. coli erfolgte also bei Tieren, die zunächst einer Salmonellen-Infektion ausgesetzt waren und erst danach, d. h. im Alter etwa neun Wochen mit E. coli infiziert wurden. Dieses Alter entspricht jedoch nicht dem Alter der kritischen Phase (Absetzphase = ca. 4. Lebenswoche), in der eine erhöhte Anfälligkeit für diesen Erreger gegeben ist, welcher für hohe Tierverluste in der Praxis verantwortlich gemacht wird. Das höhere Alter der Probanden könnte als ein Schwachpunkt für die Übertragung der Ergebnisse in die Praxis angesehen werden. Allerdings sprechen die ausgeprägten klinischen Symptome mehrerer Tiere im ersten Durchgang ebenso wie die massiven Auswirkungen einer E. coli-Feldinfektion im zweiten Durchgang, in deren Verlauf drei Tiere euthanasiert werden mussten, für eine immer noch ausgeprägte Empfindlichkeit der Tiere gegenüber dem Erreger. Der Aspekt einer möglichen Immunsuppression durch die vorangegangene Salmonelleninfektion kann nicht ausgeschlossen werden. Dass es sich bei dem verwendeten E. coli-Stamm um einen pathogenen Wildstamm aus dem Einsendungsbereich des Instituts für Mikrobiologie und Tierseuchen der Stiftung Tierärztliche Hochschule handelte, der 69 Diskussion ___________________________________________________________________________ vorberichtlich hochgradige Durchfälle verursachte und nach einer Multiplex-PCR als enterotoxisch eingestuft wurde, erhöht wiederum die Praxisnähe der Bedingungen. 5.1.2 Infektionen mit E. coli-Keimen Die Tiere wurden im Verlauf der hier beschriebenen Untersuchungen zweimalig einer oralen Belastung mit E. coli ausgesetzt. Das erste Mal geschah dies zur nachfolgenden Befundung der klinischen Symptomatik und der fäkalen Aussscheidung. Danach wurden über einen Zeitraum von vier Tagen jeweils vier Tiere pro Tag, eines aus jeder Gruppe, nach einer zweiten Infektion mit E. coli getötet. Ziel dieser Zweitinfektion war es, die Passage und die bevorzugten Rückzugsorte des Erregers im Magen-Darmtrakt sowie sein Überleben im Verdauungstrakt verfolgen zu können. Hierzu wurden aus verschiedenen Abschnitten des Verdauungstrakts Chymusproben entnommen und diese auf ihre Keimdichte (KBE) untersucht. Bei diesem Vorgehen hätte es als Schwierigkeit angesehen werden können, dass die Tiere schon einer Infektion mit E. coli ausgesetzt worden waren, und die ermittelten Keimzahlen nach ihrer Tötung nicht eindeutig auf die Zweitinfektion und damit auf die hierzu oral verabreichte Keimzahl zurückgeführt werden können. Zur Absicherung der ermittelten Ergebnisse unter diesem Aspekt wurden in jedem Durchgang vier Tiere, eines aus jeder Gruppe, vier Tage nach der Erstinfektion ohne Zweitinfektion getötet und die E. coliKeimzahlen im Chymus bestimmt. Diese Keimzahlen waren so gering (siehe Kapitel 4.11.2), dass ein wesentlicher Einfluss der Erstinfektion auf die Keimzahluntersuchung nach der Zweitinfektion nahezu ausgeschlossen werden kann. Es stellt sich auch die Frage nach der Praxisrelevanz der verabreichten Infektionsdosis. Die Infektionsbouillon enthielt zwischen 7,8×108 und 1,5×1011 KBE/ml. Diese Streuung wurde trotz einheitlicher Herstellungsweise der Bouillon erreicht. Den Tieren wurden zur Erstinfektion 20 ml, zur Zweitinfektion 10 ml der Bouillon oral verabreicht. Als Mindestinfektionsdosis unter Feldbedingungen werden 1010 KBE/Tier in der Literatur genannt (BALJER 1986). Allerdings ist nicht die Infektionsdosis für die Ausprägung einer E. coli-Infektion ausschlaggebend, sondern die Erregervermehrung im Darm (BILKEI 1996). Ziel dieser in der eigenen Studie hohen Dosen war es, relativ kurzfristig ausgeprägte klinische Symptome zu erzielen und quantitative Vorstellungen von der Passage oral aufgenommener 70 Diskussion ___________________________________________________________________________ Keime zu gewinnen. Die Simulation einer Feldinfektion mit nur einigen experimentell infizierten Tieren, welche dann die Infektionsquelle für weitere Tiere darstellen, birgt die Schwierigkeit, dass eine standardisierte Verabreichung einer bestimmten Keimzahl nicht möglich ist. Da die Tiere erst nach dem Absetzen im Alter von ca. 3,5 Wochen in den Versuchsstall verbracht wurden und somit eine vorherige Feldinfektion mit E. coli nicht ausgeschlossen werden kann und die Tiere in einem vorangegangenen Versuchsvorhaben einer Infektion mit S. Derby ausgesetzt waren, wurden sie, um möglichst identische Ausgangsbedingungen für alle Tiere zu erzielen, einer fünftägigen antibiotischen Behandlung zu Versuchsbeginn und einer weiteren dreitätigen antibiotischen Behandlung zwei Tage vor der Erstinfektion mit E. coli unterzogen. Nach der Behandlung wurden Rektaltupfer von den Tieren genommen und diese qualitativ auf E. coli und Salmonellen untersucht. Es konnten zu keinem Zeitpunkt bei den Tieren E. coli-Erreger oder Salmonellen nachgewiesen werden. Die Befürchtung, dass die zeitnahe antibiotische Behandlung die Vermehrung und Passage der Erreger beeinträchtigt haben könnte, erwies sich als unbegründet, da der qualitative Erregernachweis nach der E. coli-Erstinfektion eine Ausscheidung über mindestens sechs Tage ergab und die Tiere z. T. deutliche klinische Symptome zeigten. In beiden Durchgängen wurden nach der Erstinfektion mit E. coli die Keime aus den Tupferproben mittels PCR im Institut für Mikrobiologie und Tierseuchen der Stiftung Tierärztliche Hochschule untersucht und näher charakterisiert. Diese Keime stimmten in allen Fällen mit dem applizierten Keim überein. Obwohl eine semiquantitative Tupferprobenuntersuchung (HAGEMANN 2006) den Vorteil mit sich bringt, dass die Intensität einer Infektion, ihr Verlauf und die Vermehrung der Erreger besser beurteilt werden können, wurde hier die qualitative Untersuchung bevorzugt, da die Kotmenge, die mit einem Tupfer entnommen wird, stark variieren kann und eine Anhaftung von Darmschleimhautzellen nicht ausgeschlossen werden kann, so dass die quantitative Bestimmung der Keime unter Umständen nicht der tatsächlichen Zahl entspricht. Weiterhin interessierte nach der E. coli-Erstinfektion vor allem die Keimausscheidung, d. h. die Frage, ob die oral aufgenommenen Keime vermehrungsfähig und damit kultivierbar passieren. den gesamten Verdauungstrakt 71 Diskussion ___________________________________________________________________________ 5.1.3 Futterstruktur Die strukturbestimmenden Anteile des Mischfutters (also die Partikelgrößenverteilung im Futter) sollen hier noch einmal kritisch angesprochen werden, um ihren Effekt vergleichend einschätzen zu können. In Kapital 3.5 (Tab. 6) findet sich die Tabelle der Ergebnisse einer nassen Siebanalyse der Versuchsfutter. Auffällig ist hier – wider Erwarten und nicht angestrebt - der hohe Anteil feiner Partikel (< 0,20 mm) im grob vermahlenen pelletierten Versuchsfutter. Vergleicht man die Anteile der verschieden großen Partikel der eigenen Untersuchungen mit dem grob vermahlenen Futter, das von PAPENBROCK (2004) verwendet wurde, so ist festzustellen, dass sowohl der Anteil grober Partikel (> 3,15 mm) größer als auch der Anteil feiner Partikel (< 0,56 mm) kleiner ist. Auch in anderen Untersuchungen (OFFENBERG 2007; VISSCHER 2006) zum Effekt der Futterstruktur auf das Infektionsgeschehen bei Schweinen war das grob vermahlene Futter allgemein gröber als das in der hier vorliegenden Studie. Ein Grund für diese Abweichung ist im Pelletierungsvorgang an sich zu sehen, da dieser durch eine Nachzerkleinerung eine nicht zu unterschätzende Auswirkung auf die verschiedenen Partikelfraktionen hat. Bei der Diskussion der Ergebnisse soll auf diese Tatsache ebenfalls eingegangen werden. Es ist allerdings zu beachten, dass in den eigenen Untersuchungen eine nasse Siebanalyse, in den Untersuchungen von PAPENBROCK (2004) jedoch eine trockene Siebanalyse durchgeführt wurde, so dass die Ergebnisse – methodisch bedingt - nicht unmittelbar vergleichbar sind. Es steht jedoch keine amtliche Methode zur Verfügung (KAMPHUES et al. 2007), mit der pelletierte Mischfutter einer Siebanalyse unterzogen werden könnten. Sowohl in den eigenen Untersuchungen als auch in den Untersuchungen von OFFENBERG (2006) und VISSCHER (2006) wurde die nasse Siebanalyse mit pelletiertem Futter durchgeführt. Tabelle 29: Vergleichende Darstellung der Partikelgrößenverteilung (Anteil in %) des jeweils "grob vermahlenen" Versuchsfutters der eigenen Untersuchung mit PAPENBROCK (2004), OFFENBERG (2007) und VISSCHER (2006) Partikelgröße in mm HASSAN PAPENBROCK OFFENBERG ≥ 3,15 0,91 3,56 2,50 2-3,15 7,67 20,91 19,90 ≤ 0,2 41,53 4,61 28,00 1) Varianz: Daten von 4 Betrieben und 2 Durchgängen VISSCHER 1) 3,37-10,58 12,47-24,55 29,26-37,61 72 Diskussion ___________________________________________________________________________ Tabelle 30: Vergleichende Darstellung der Partikelgrößenverteilung (Anteil in %) des in den eigenen Untersuchungen verwendeten "fein vermahlenen" und "grob vermahlenen" Versuchsfutters Partikelgröße in mm ≥ 3,15 2-3,15 ≤ 0,2 grob 0,91 7,67 41,53 fein 0,07 0,43 45,81 5.2 Diskussion der Ergebnisse 5.2.1 Leistung Die mögliche Beeinflussung der Leistung stand nicht im Zentrum des Interesses bei der eigenen Versuchsplanung, dieser Aspekt kann jedoch nicht unberücksichtigt bleiben, wenn es um diätetische Empfehlungen für betroffene Betriebe geht. 5.2.1.1 Einfluss der Futterstruktur Durch die gröbere Vermahlung der Getreidekomponenten im Mischfutter der Versuchsgruppe „grob ohne Zusätze“ bei gleicher Konfektionierung (pelletiert) wie in den anderen Gruppen wurde zwar eine gröbere Struktur dieses Futters erzielt (Tab. 30), leider war aber der Feinanteil höher als angestrebt. Die täglich aufgenommene Futtermenge konnte bedingt durch die Gruppenhaltung und – fütterung nur gruppenweise ermittelt werden. Die Tiere einer Gruppe erhielten das jeweilige Futter ad libitum. Anhand der Rückwaage am folgenden Tag konnte der Futterverbrauch also nur pro Gruppe errechnet werden. Einen durchschnittlichen Futterverbrauch pro Tier und Tag zu errechnen scheint nicht sinnvoll aufgrund der unterschiedlichen Tötungszeitpunkte und Endgewichte der Tiere. Der Futterverbrauch in Relation zur Körpermassenzunahme der gesamten Gruppe gibt jedoch Aufschluss über die Leistung der Tiere, wobei sowohl die Futteraufnahme als auch die Körpermassen-Entwicklung berücksichtigt werden. 73 Diskussion ___________________________________________________________________________ Die Leistung der Tiere wurde anhand des Futteraufwands beurteilt, welche sich aus dem gruppenweise ermittelten Futterverbrauch und den Körpermassezunahmen einer Gruppe ergab. Dieser Parameter gibt an, wie viel kg Futter für ein kg Körpermassezuwachs benötigt wurden und ist getrennt nach Durchgängen zu betrachten, da im zweiten Durchgang eine E. coli-Feldinfektion die Leistung aller Tiere stark beeinträchtigte und somit eine Vereinigung beider Durchgänge nicht sinnvoll ist. Während des ersten Durchganges betrug der Futteraufwand der Kontrollgruppe 1,84 und war somit weniger günstig als der in der Gruppe „grob ohne Zusätze“ mit 1,77. Diese Tendenz wurde auch im zweiten Durchgang bestätigt. Die Futterverwertung der Kontrollgruppe betrug hier 1,85, die der Versuchsgruppe „grob ohne Zusätze“ 1,79. Diese Ergebnisse widersprechen anderen Untersuchungen. Eine gröbere Struktur reduziert demnach die praecaecale Verdaulichkeit, was sich in einer reduzierten praecacalen Verdaulichkeit der Stärke und somit erhöhten Stärkegehalten in den distalen Verdauungsabschnitten (Caecum/Colon) widerspiegelt. Diese Vorgänge erhöhen somit den Futteraufwand (JǾRGENSEN et al. 1999). Die erhöhten Stärkegehalte in den distalen Abschnitten des Verdauungstraktes wurden auch von PAPENBROCK (2004) beobachtet, nicht jedoch der erhöhte Futteraufwand. Andererseits bestätigten auch verschiedene Untersuchungen die eigenen Ergebnisse. So ermittelte NEU (2007) in ihren Untersuchungen (Fütterungsgruppen äquivalent zu vorliegenden Untersuchungen) einen Futteraufwand von 1,89 für die Kontrollgruppe und von 1,92 – und somit nur geringgradig höher - für die Versuchsgruppe „grob ohne Zusätze“. In der Studie von OFFENBERG (2007) zeigte eine grobe Vermahlung (wesentlich gröber als der Vermahlungsgrad für die eigenen Untersuchungen) einen günstigeren Futteraufwand (1,60) als die Kontrollgruppe mit fein vermahlenem Futter (1,62). PAPENBROCK führt als Erklärungsansatz für die wider Erwarten gute und relativ günstige Futterverwertung der Gruppe mit dem gröber vermahlenem Futter im Vergleich zur Gruppe mit fein vermahlenem Futter eine Kompensation der negativen Auswirkung einer groben Futterstruktur durch den Zusatz von KDF auf, welches dem Futter dieser Tiere zugesetzt war. Hier ließ sich also der Effekt der Struktur nicht getrennt von einem Futteradditiv bewerten. Da die Anfangskörpermasse der Tiere zum Zeitpunkt der Einstallung in den Versuchsstall keine Vorteile für die Gruppe „grob ohne Zusätze“ erkennen ließen und bei der Zusammenstellung der Gruppen auf eine vergleichbare genetische Herkunft geachtet wurde, 74 Diskussion ___________________________________________________________________________ kann man positive Effekte aufgrund einer unterschiedlichen genetischen Kapazität ausschließen. Eine Erklärung für die wider Erwarten nicht höhere Leistung der Kontrollgruppe könnten mögliche negativen Effekte einer zu feinen Struktur auf die Beschaffenheit der Magenschleimhaut (Ulcera), die Chymusdurchsäuerung (schlechtere Durchsäuerung durch „Klumpenbildung“ und somit höherer pH-Wert und günstigeres Milieu für pathogene Keime) und somit die Keimzahlen sein. Weitere Untersuchungen zum Einfluss der Futterstruktur auf die Leistung der Tiere sind notwendig, um diesbezüglich genauere Aussagen treffen zu können. 5.2.1.2 Einfluss der Futteradditive Der Futteraufwand der beiden Versuchsgruppen mit den Futteradditiven wird hier nur im Vergleich zueinander und im Vergleich zur Kontrollgruppe diskutiert. Im ersten Durchgang zeigten die Tiere der Gruppe „fein + KDF“ mit einem Wert von 1,75 eine leicht höhere Leistung als die Tiere der Gruppe „fein + freie Säuren“ mit 1,79 und eine deutlich günstigere Leistung als die Tiere der Kontrollgruppe mit 1,84. Das Verhältnis der beiden Versuchsgruppen stellte sich im zweiten Durchgang invers dar. Die Gruppe „fein + freie Säuren“ hatte mit einem Wert von 1,72 eine deutlich günstigere Futterverwertung als die Gruppe „fein + KDF“ mit 1,83 und als die Kontrollgruppe mit 1,85. Im Mittel über beide Durchgänge betrug der Futteraufwand der Kontrollgruppe 1,85, der Versuchsgruppe „fein + KDF“ 1,79 und der Versuchsgruppe „fein + freie Säuren“ 1,76. In beiden Durchgängen zeigten jedoch die Versuchsgruppen eine deutlich oder zumindest tendenziell bessere Leistung als die Kontrollgruppe ohne diese beiden Futteradditive. Kaliumdiformiat (KDF) ist seit dem Verbot antibiotischer Leistungsförderer in der Schweinehaltung der einzige zugelassene Leistungsförderer. Aus verschiedenen Untersuchungen ist eine leistungsfördernde Wirkung organischer Säuren auf Schweine bekannt und bestätigt (KIRCHGESSNER u. ROTH 1988) bzw. ist sie im Rahmen der Zulassung erwiesen worden (ØVERLAND et al. 2003). 75 Diskussion ___________________________________________________________________________ Auch für freie Säuren als Zulage zum Mischfutter für Schweine ist eindeutig eine Verbesserung der Leistung, u. a. infolge einer höheren Proteinverdaulichkeit nachgewiesen worden (EIDELSBURGER et al. 1992a). So konnte in einer Studie mit Dosierungen von 0,6 oder 1,2 % Ameisensäure eine signifikante Steigerung der Zunahmen um 21 bzw. 22 % erzielt werden (ECKEL et al. 1992). Die mögliche leistungssteigernde Wirkung beider Zusätze ist daher unbestritten, wird also allgemein erwartet. Doch es stellt sich vor dem Hintergrund der nicht unerheblichen Preisunterschiede (freie Säuren sind im Vergleich zu Kaliumdiformiat deutlich günstiger) die Frage nach einer Wertung. In den eigenen Untersuchungen verhielten sich die in den beiden Durchgängen ermittelten Ergebnisse in dieser Hinsicht gegenläufig zueinander, wie bereits oben dargestellt. In den Versuchen von NEU (2007) ergab sich aus beiden Durchgängen ein Wert von 1,76 für den Futteraufwand der Gruppe „fein + KDF“ und ein Wert von 1,80 für die Gruppe „fein + freie Säuren“ (Fütterungsgruppen identisch zu den eigenen Untersuchungen). Hier ist also ein Vorteil für den Gebrauch des Salzes zu erkennen. Diese Tendenz wurde auch von VISSCHER (2006) bestätigt. Er registrierte tendenziell höhere Zunahmen, wenn bei einem grob vermahlenem Mischfutter die freie Säure (Ameisen- und Propionsäure) durch 1,2 % KDF ersetzt wurden. Andererseits sind nach EIDELSBURGER (1998) die nutritiven Effekte von Formiat und anderen Salzen organischer Säuren und damit auch eine Leistungssteigerung einzig auf die Wirkung des Säureanions zurückzuführen. KIRCHGESSNER und ROTH (1987) haben Ameisensäure in dieser Hinsicht mit dem Salz Natriumformiat verglichen und festgestellt, dass sowohl bei den täglichen Zunahmen als auch bezüglich des Futteraufwands mit dem Salz nur etwa die Hälfte der Verbesserung der Ameisensäure erzielt werden konnte. Neben ökonomischen Aspekten ist auch das Handling der Zusätze von Bedeutung für die Wahl des Produkts. Das Salz einer Säure ist deutlich weniger korrosiv als die freie Säure und weniger stechend im Geruch. Dies erschwert die Lagerung und Einmischung einer freien Säure ins Futter und könnte auch zu einer verminderten Futteraufnahme bei den Tieren führen. 76 Diskussion ___________________________________________________________________________ Es konnten in dieser Untersuchung keine signifikanten Unterschiede bzgl. des Futteraufwands zwischen der Gruppe „fein + KDF“ und „fein + freie Säuren“ festgestellt werden. Die eigenen Ergebnisse beziehen sich allerdings nur auf Absetzferkel. Es ist unklar, inwiefern sich diese Ergebnisse z. B. auf Mastschweine übertragen lassen. 5.2.2 Chymusqualität und –zusammensetzung Wie aus vorangegangenen Untersuchungen am Institut für Tierernährung der Stiftung Tierärztliche Hochschule Hannover bekannt, können sowohl aus einer unterschiedlichen Struktur des Mischfutters als auch aus den getätigten Zusätzen an Säuren bzw. KDF Effekte auf die Chymusqualität und –zusammensetzung resultieren. 5.2.2.1 Einfluss der Futterstruktur 5.2.2.1.1 TS-Gehalte Der TS-Gehalt im Chymus, insbesondere im Magen, ist von tierärztlichem Interesse, da ein Zusammenhang mit Magenulcera festgestellt werden konnte, was sich unmittelbar auf die Leistung der Tiere auswirkt (REGINA et al. 1999). Der TS-Gehalt ist neben dem Zeitabstand zur Futteraufnahme (MAXWELL et al. 1970) im Wesentlichen abhängig von der Magenfüllung und dem Vermahlungsgrad des Futters (KAMPHUES 1988). In den eigenen Untersuchungen konnten in keinem Abschnitt signifikante Unterschiede im TS-Gehalt des Chymus zwischen der Kontrollgruppe und der Versuchsgruppe „grob ohne Zusätze“ festgestellt werden. Es liegen jedoch Studien vor, in denen ein Einfluss der Struktur auf den TS-Gehalt erkennbar wurde. MIKKELSEN et al. (2004) ermittelten bei Tieren, die mit einem gröber vermahlenen Futter (pelletiert und nicht pelletiert) gefüttert wurden, einen signifikant höheren TS-Gehalt im Magenchymus als bei Tieren, die ein Futter herkömmlicher Vermahlung (pelletiert und nicht pelletiert) erhielten. Es wurden jedoch keine Unterschiede im Chymus des Dünndarms, Caecums oder Colons gefunden. Auch PAPENBROCK (2004) fand niedrigere TS-Gehalte im Magenchymus der mit fein vermahlenem Futter gefütterten 77 Diskussion ___________________________________________________________________________ Tiere als im Magenchymus der mit grob vermahlenem Futter gefütterten Tiere. Diese Beobachtungen konnten von anderen Autoren bestätigt werden (CANIBE et al. 2005; OFFENBERG 2007). Andere Studien verglichen fein vermahlenes pelletiertes Futter mit grob vermahlenem schrotförmigem Futter. Auch hier wurde ein höherer TS-Gehalt im Magenchymus der mit grob vermahlenem Futter gefütterten Tiere festgestellt, doch lässt sich der Einfluss der Struktur nicht getrennt vom Einfluss der Konfektionierung betrachten (REGINA et al. 1999). In den Untersuchungen von NEU (2007) wurden gegenteilige Beobachtungen gemacht. Hier wiesen die Tiere der Kontrollgruppe höhere TS-Gehalte im Mageninhalt auf als die Tiere der Versuchsgruppe „grob ohne Zusätze“. In den weiteren Darmabschnitten konnten auch hier keine Unterschiede festgestellt werden. 5.2.2.1.2 pH-Werte Die pH-Werte im Inhalt aller fünf Lokalisationen (Magen, Dünndarm, Caecum, Colon 1, Colon 2) wiesen in der Gruppe „grob ohne Zusätze“ niedrigere Werte auf als in der Kontrollgruppe. Der Magen-pH-Wert war mit 4,81 deutlich (wenn auch nicht signifikant) niedriger als in der Kontrollgruppe mit 5,02. Der Unterschied zwischen den Dünndarmwerten war mit 6,30 bzw. 6,49 minimal. Ein signifikanter Unterschied war zwischen den Caecumwerten zu registrieren. Hier war der Mittelwert der Tiere der Versuchsgruppe (grob ohne Zusätze) mit 5,86 signifikant niedriger als der Wert der Tiere der Kontrollgruppe mit 6,20. Die Unterschiede im Colonbereich waren nur gering. Die beobachtete Tendenz einer intensiveren Durchsäuerung des Chymus im Magen durch eine gröbere Futterstruktur wurde auch von NEU (2007) beobachtet. KAMPHUES (2006) untersuchte den Magen-pH-Wert von Ferkeln, die ein grob vermahlenes Futter ohne Zusätze bekamen, mit dem Magen-pH-Wert von Ferkeln, die ein fein vermahlenes Futter erhielten. Es konnte ein um eine Einheit niedrigerer pH-Wert im Magen der Gruppe mit dem grob vermahlenen Futter festgestellt werden. Auch OFFENBERG (2007) stellte in der Versuchsgruppe im Mittel um 0,3-0,4 pH-Einheiten niedrigere Werte in Magen- und Dünndarmchymus fest als in der Kontrollgruppe. Jedoch kann nicht zwischen dem Einfluss der Struktur und dem Säurezusatz unterschieden werden, da die beiden Aspekte nicht getrennt 78 Diskussion ___________________________________________________________________________ voneinander untersucht wurden. PAPENBROCK (2004) untersuchte in einem ihrer Versuche Tiere, die ein grob vermahlenes Futter bekamen, und Tiere, die ein grob vermahlenes Futter plus Kaliumdiformiat erhielten. Die Tiere der Kontrollgruppe, also ohne Additiv im Futter, wiesen signifikant niedrigere Werte auf als die Versuchsgruppe. Hier ist allerdings von einer puffernden Wirkung des KDF auszugehen, so dass eine alleinige Beurteilung des Einflusses der Struktur ebenfalls nicht möglich ist. In Untersuchungen von MIKKELSEN et al. (2004) wurden Werte für vier verschiedene Mischfutterqualitäten ermittelt (fein, nicht pelletiert/ fein, pelletiert/grob, nicht pelletiert/ grob, pelletiert). Dabei konnte bei Tieren, die ein grob vermahlenes schrotförmiges Futter bekamen, ein signifikant niedrigerer Magen-pH-Wert festgestellt werden als bei den Tieren, die ein grob vermahlenes pelletiertes Futter erhielten. Die Futtergruppen mit dem fein vermahlenen Futter beider Konfektionierungen wiesen niedrigere pH-Werte im Magenchymus auf als die Gruppe „grob, pelletiert“. Hier lag offensichtlich ein entscheidender Einfluss der Konfektionierung vor. Eine gute Durchsäuerung des Chymus ist deshalb erstrebenswert, da dies einen Schutz vor möglichen Krankheitserregern in Form einer Magenbarriere bietet. Gerade für Absetzferkel ist dies ein überaus wichtiger Aspekt, insbesondere vor dem Hintergrund der zu diesem Zeitpunkt noch nicht ausgereiften Salzsäureproduktion des Magens und der somit eingeschränkten Proteinverdaulichkeit. Der niedrigere pH-Wert im Dünndarmchymus kann – zumindest teilweise - als eine Folge der erhöhten Chymusacidierung im Magen angesehen werden, so dass in diesem Darmabschnitt der Schutz vor Krankheitserregern erhöht ist, andererseits wird der pH-Wert im Dünndarmchymus von Absetzferkeln ganz erheblich von dem hier gebildeten Laktat beeinflusst (KAMPHUES 1988). Der signifikante Unterschied im Caecumchmyus ist in der Literatur auch beschrieben. So stellte VISSCHER (2006) in seiner Feldstudie einen signifikant niedrigeren Caecum-pH-Wert bei Tieren aus Betrieben fest, in denen ein grob vermahlenes Futter zum Einsatz kam, als in Betrieben, die ein Futter mit herkömmlicher Partikelgröße verwendeten. Dies bestätigte auch eine Studie von HANSEN et al. (2001), in der beim Vergleich von Futtermitteln mit unterschiedlichen Vermahlungsgraden niedrigere Caecuminhalten bei Einsatz grob vermahlener Futtermittel festgestellt wurden. pH-Werte in 79 Diskussion ___________________________________________________________________________ Allerdings konnten NEU (2007) und PAPENBROCK (2004) keine pH-Unterschiede aufgrund einer veränderten Futterstruktur in den untersuchten Darmabschnitten feststellen. Es gibt Hinweise auf einen entscheidenden Einfluss der Struktur auf die Acidierung des Chymus und damit auf die Effizienz der Magenbarriere. Auch oder gerade im Zusammenhang mit der Konfektionierung ergeben sich hier Möglichkeiten prophylaktischer Maßnahmen, die weiterer Forschung bedürfen. 5.2.2.1.3 Formiatgehalte Beim Vergleich der Formiatgehalte im Magen- und Dünndarmchymus lassen sich keine signifikanten Unterschiede zwischen der Kontrollgruppe und der Versuchsgruppe „grob ohne Zusätze“ feststellen. Allerdings ist der Gehalt im Magen mit ca. 158 mg/l uS (± 368 mg/l uS) in der Kontrollgruppe höher als in der Versuchsgruppe mit etwa 25 mg/l uS (± 6,7 mg/l uS). In der Arbeit von NEU (2007) lassen sich ebenfalls keine signifikanten Unterschiede feststellen beim Vergleich dieser beiden Gruppen. Bei einer erhöhten mikrobiellen Aktivität wären erhöhte Formiatgehalte zu erwarten gewesen. Durch eine gröbere Vermahlung steigen die Substratgehalte für die darmeigenen Bakterien, zu deren Stoffwechselprodukten unter anderem Formiat zählt. Hier ist ein eventuell nicht ausreichender Strukturunterschied in Betracht zu ziehen, bedingt durch eine Nachzerkleinerung bei der Pelletierung des Futters. MIKKELSEN et al. (2004) konnten einen deutlichen Effekt der Konfektionierung auf den Formiatgehalt im Ileum von Schweinen feststellen. Mehlförmiges Futter bedingte, unabhängig vom Vermahlungsgrad der Komponenten, höhere Werte als pelletiertes Futter. 5.2.2.1.4 Laktatgehalte Die Laktatgehalte im Chymus sind deshalb interessant, weil sie entscheidend die Milieubedingungen beeinflussen, d. h. insbesondere den pH-Wert. Dieser ist wiederum für die Haftung und Vermehrung von säureempfindlichen Krankheitserregern von Bedeutung. Die Zahl der Milchsäurebakterien ist somit ein wichtiger Faktor für die Darmgesundheit der Tiere. 80 Diskussion ___________________________________________________________________________ Die Lakatgehalte zeigten im Chmyus aller drei Lokalisationen (Magen, Dünndarm, Caecum) keine signifikanten Unterschiede zwischen der Kontrollgruppe und der Versuchsgruppe „grob ohne Zusätze“. Allerdings waren die Werte der Versuchsgruppe an allen Lokalisationen um 3,11-5,13 mmol/kg uS höher als die der Kontrollgruppe. Der maximale Unterschied (∆ 5,13 mmol/kg uS) fand sich im Caecumchymus. Der minimale Unterschied (∆ 3,11 mmol/kg uS) war im Dünndarmchymus zu beobachten. In den Versuchen von NEU (2007) konnte lediglich im Dünndarmchymus der Versuchsgruppe ein tendenziell höherer Laktatgehalt als in der Kontrollgruppe nachgewiesen werden. Der Chymus der beiden anderen Lokalisationen zeigte keine Unterschiede hinsichtlich der Laktatgehalte. MIKKELSEN et al. (2004) konnten im Magenchymus von Tieren, die ein grob vermahlenes Futter erhielten, einen signifikant höheren Lakatgehalt im Vergleich zu Tieren, die ein fein vermahlenes Futter erhielten, verzeichnen. Gleichzeitig stieg mit der gröberen Struktur des Futters die Zahl der Anaerobier im Magen an. Dies ist nach MIKKELSEN et al. (2004) bedingt durch eine langsamere Magenpassage, die veränderte Konsistenz des Chymus (Trockensubstanz↑) und der dadurch erhöhten Wasserbindungskapazität. All diese Faktoren begünstigen das Wachstum der Anaerobier und damit die Produktion ihrer Stoffwechselprodukte. Ein erhöhtes Auftreten von Laktatbildnern konnte auch im caudalen Abschnitt des Dünndarms nachgewiesen werden, wenn ein grob vermahlenes Futter gefüttert wurde (CANIBE et al. 2005). Ein erhöhter Laktatgehalt im Magen konnte auch von REGINA et al. (1999) bei Vorlage eines grob vermahlenen Mischfutters festgestellt werden. PAPENBROCK (2004) wies bei Einsatz eines grob vermahlenen Futters mit Zusatz von KDF im Colonchymus signifikant höhere Keimzahlen von grampositiven Kokken nach. Eine erhöhte Anflutung von unverdauter Stärke in Caecum und Colon konnte von verschiedenen Studien beobachtet werden (PAPENBROCK 2004; CANIBE et al. 2005; VISSCHER 2006). Das somit erhöhte Substratangebot fördert das Wachstum von Laktatbildnern (insbesondere Laktobazillen und diverse Kokken). 5.2.2.1.5 Gehalt flüchtiger Fettsäuren Die Gehalte an flüchtigen Fettsäuren (Essig-, Propion-, i-Butter-, n-Butter-, i-Valerian-, nValeriansäure) wiesen sowohl im Magen- als auch im Dünndarminhalt weder signifikante noch tendenzielle Unterschiede zwischen der Kontrollgruppe und der Gruppe „grob ohne 81 Diskussion ___________________________________________________________________________ Zusätze“ auf. Im Caecuminhalt hingegen liegen alle Werte der Versuchsgruppe (grobe Vermahlung) tendenziell höher, der Gehalt an n-Butter- und n-Valeriansäure ist sogar signifikant höher als in der Kontrollgruppe. Diese Beobachtung konnte von NEU (2007) nicht bestätigt werden. VISSCHER (2006) hingegen stellte bei Einsatz grob vermahlenen Futters einen erhöhten Gehalt an flüchtigen Fettsäuren im Caecuminhalt fest, insbesondere Propionsäure und Buttersäure. Er führt dies auf eine erhöhte Stärkeanflutung im Caecum als Folge der gröberen Struktur des Futters zurück und wies die höchsten Stärkegehalte im Caecuminhalt von Tieren der Versuchsgruppe (grobes Futter) nach. Eine Erhöhung der Stärkegehalte durch eine gröbere Vermahlung des Futters konnten auch PAPENBROCK (2004) und CANIBE et al. (2005) beobachten. Bei erhöhten Stärkegehalten im Dickdarm konnten erhöhte Konzentrationen an flüchtigen Fettsäuren nachgewiesen werden (BRUNSGAARD 1998; MENTSCHEL 2004; HEDEMANN u. BACH KNUDSEN 2006). Die unverdaute Stärke steht in hinteren Abschnitten des Verdauungstrakts der dort angesiedelten anaeroben Mikroflora (Lactobazillen, Bifidobacterien, Bacteroides etc.) zur Verfügung, welche aus ihr flüchtige Fettsäuren produziert (AMTSBERG 1984). Erhöhte Fettsäurenkonzentrationen lassen also auf eine erhöhte Zahl und/oder Aktivität dieser Mikroorganismen schließen, wie es in verschiedenen Studien bestätigt werden konnte (PAPENBROCK 2004; CANIBE et al. 2005). Dass es sich bei den Ergebnissen der eigenen Untersuchungen z. T. lediglich um tendenzielle Unterschiede handelt, könnte an der nicht ausreichenden „Grobheit“ des Futters liegen, oder aber es konnte aufgrund eines postprandialen Abstands von nur 4-5 Stunden bis zur Sektion nicht genügend Stärke anfluten und so die Produktion flüchtiger Fettsäuren erhöhen. 5.2.2.2 Einfluss der Futteradditive 5.2.2.2.1 TS-Gehalt Vergleicht man die TS-Gehalte im Chymus der Kontrollgruppe und der beiden Versuchsgruppen mit den Futterzusätzen miteinander, so ist einzig im Caecumchymus ein signifikanter Unterschied zu finden. Die beiden Versuchsgruppen „fein + KDF“ und „fein + freie Säuren“ weisen hier signifikant niedrigere Werte auf als die Kontrollgruppe. In den 82 Diskussion ___________________________________________________________________________ übrigen Abschnitten sind weder zwischen Versuchsgruppen und Kontrollgruppe noch zwischen den Versuchsgruppen untereinander statistisch abzusichernde Unterschiede zu finden gewesen. PAPENBROCK (2004) konnte einen niedrigeren TS-Gehalt in Magen- und Dünndarmchymus bei einer KDF-Supplementierung des Futters feststellen (jedoch keine statistisch abzusichernden Unterschiede) und führte dies auf eine erhöhte Speichelsekretion zurück. Auch eine gesteigerte Wasseraufnahme würde den TS-Gehalt derart verändern, wurde jedoch weder in den Untersuchungen von PAPENBROCK (2004) noch in den eigenen gemessen. Eine erhöhte Kaliumaufnahme führt jedoch zu einer gesteigerten Wasseraufnahme der Tiere (SILBERNAGEL u. DESPOPOULOS 1991). Auch könnte der höhere Wassergehalt im Magenchymus der Tiere mit KDF-Supplementierung dadurch bedingt sein, dass das Kalium in hydratisierter Form vorlag und somit die Wasserabsorption im Magen verlangsamt wurde. Auch in anderen Studien stellte man eine Verflüssigung des Magenchymus bei Zusatz von Kaliumdiformiat bzw. anderen Ameisensäuresalzen fest (ROTH et al. 1992b; KULLA 2001). EIDELSBURGER et al. (1992b) konnten hingegen in ihren Untersuchungen in keinem der Darmabschnitte inkl. Magen einen signifikanten Einfluss auf den TS-Gehalt von Ameisensäure oder ihrem Salz (Calciumformiat) nachweisen. Andere Autoren verglichen die TS-Gehalte verschiedener Abschnitte des Verdauungstraktes einer Kontrollgruppe mit vier Versuchsgruppen, die in steigender Dosierung eine Ameisensäurezulage zum Futter erhielten (0,6; 1,2; 1,8; 2,4 %). Im Dünndarm, Caecum und Colon nahmen mit steigender Ameisensäurekonzentration auch die TS-Gehalte im Chymus zu, was aber nur im Colon statistisch abzusichern war (ROTH et al. 1992a). 5.2.2.2.2 pH-Werte Die pH-Werte im Magenchymus der Versuchsgruppen mit den Futteradditiven stellten sich im Vergleich mit der Kontrollgruppe unterschiedlich dar. Die Gruppe „fein + freie Säuren“ wies wie erwartet einen signifikant niedrigeren Wert (3,75) auf als die Kontrollgruppe. Die Gruppe „fein + KDF“ unterschied sich von keiner der beiden anderen Gruppen signifikant, hat jedoch mit 4,41 einen tendenziell niedrigeren Wert als die Tiere der Kontrollgruppe 83 Diskussion ___________________________________________________________________________ (5,02). Dass die Zulage einer freien Säure den pH-Wert im Mageninhalt wesentlich senkt, ist zu erwarten. Vom Salz der Säure wird eine puffernde Wirkung und damit ein eher erhöhter pH-Wert ausgehen. Bei einer Dissoziation des KDF werden Formiationen frei, die eine puffernde Wirkung haben. Ergebnisse, die dieser Erwartung entsprechen, liegen so auch in anderen Untersuchungen vor (KULLA 2001; PAPENBROCK 2004). Hier werden auch andere Aspekte wie eine erhöhte Tränkwasseraufnahme und ein erhöhter Speichelfluss als Folge der KDF-Supplementierung mit puffernder Wirkung in Betracht gezogen. Es liegen jedoch auch Studien vor, die keine signifikante Wirkung bzgl. des pH-Wertes in allen Abschnitten des Magen-Darm-Trakts erkennen lassen (CANIBE et al. 2001) oder aber einen niedrigeren Wert im Mageninhalt bei Konzentrationen von 0,9 und 1,8 % KDF verzeichnen konnten (MROZ et al. 2001). Auch NEU (2007) fand signifikante Unterschiede zwischen dem niedrigeren pH-Wert im Magenchymus der Gruppe „fein + KDF“ und der Kontrollgruppe mit höheren Werten. EIDELSBURGER et al. (1992b) bestätigten eine schnellere und deutlichere Magen pHAbsenkung durch die freie Säure (Ameisensäure) als durch das Salz (Calciumformiat). Diesen Effekt bestätigten sowohl die eigenen Untersuchungen als auch die Studie von NEU (2007). In einer Untersuchung von FRANCO et al. (2004) wurde der pH-Wert im Mageninhalt der Kontrollgruppe mit dem einer Versuchsgruppe verglichen, die eine Zulage von 200 mEq/kg an Ameisensäure erhielt. Die Versuchsgruppe wies mit 2,19 niedrigere Werte auf als die Kontrollgruppe mit 3,16 und signifikant niedrigere Werte als die Versuchsgruppe, die eine Zulage an Ameisensäure und Fumarsäure in gleicher Dosierung (im Verhältnis 1:1) erhielt (5,19). In den anderen untersuchten Abschnitten des Magen-Darm-Trakts ließen sich keine signifikanten Unterschiede feststellen. Wie auch in den eigenen Untersuchungen erkennbar, ist die acidierende Wirkung der freien Säuren allerdings auf den Magenchymus beschränkt. In die weiteren Darmabschnitte gelangt keine oder nur noch sehr wenig Säure. Ihr Großteil wird im vorderen Verdauungstrakt absorbiert. 84 Diskussion ___________________________________________________________________________ 5.2.2.2.3 Formiatgehalte Die Formiatgehalte im Magenchymus der beiden Versuchsgruppen mit den Zusätzen waren signifikant höher als der Gehalt im Magenchymus der Kontrollgruppe („fein + KDF“: 1054,60 mg/l uS, „fein + freie Säuren“: 681,40 mg/l uS, Kontrolle: 157,90 mg/l uS). Dies ist ein zu erwartender Effekt, welcher auf die direkte Supplementierung zurückzuführen ist und nicht Folge mikrobieller Aktivität. Verschiedene Studien können diesen Effekt bestätigen (ROTH et al. 1992a; EIDELSBURGER et al. 1992b; NEU 2007). Im Dünndarmchymus lassen sich keine signifikanten Unterschiede zwischen den Gruppen erkennen. Dies lässt sich durch eine sehr schnelle Absorption des Formiats bereits im Magen erklären (MALORNY 1969). KULLA (2001) untersuchte die Formiatgehalte des cranialen, mittleren und caudalen Dünndarms getrennt (und nicht als Mischprobe des gesamten Dünndarminhalts wie in den eigenen Untersuchungen). Er konnte im cranialen Abschnitt des Dünndarms der Tiere der Versuchsgruppe (Mischfutter + 1,8 % KDF) einen noch 3,5-mal höheren Formiatgehalt feststellen, als es in der Kontrollgruppe der Fall war. Im mittleren und caudalen Abschnitt wurde eine signifikante Verminderung der Formiatgehalte in der Versuchsgruppe im Vergleich zur Kontrollgruppe ermittelt. KULLA (2001) begründet die niedrigen Werte mit der verminderten Keimzahl in diesem Bereich und der damit einhergehenden verminderten mikrobiellen Stoffwechselaktivität. EIDELSBURGER et al. (1992b) konnten bei Zulage von 1,25 % Ameisensäure einen signifikant höheren Formiatgehalt und bei Zulage von 1,8 % Calciumformiat eine gesicherte Erhöhung des Gehalts im Dünndarmchymus im Vergleich zur Kontrollgruppe feststellen und führen dies auf die direkte Zulage zum Futter zurück. ROTH et al. (1992a) fanden erst bei einer Zulage von 1,8% Ameisensäure einen signifikant erhöhten Formiatgehalt im Dünndarmchymus. Andere Konzentrationen (0,6 %, 1,2 %, 2,4%) und andere Lokalisationen (Magen, Caecum, Colon) ließen keine Unterschiede erkennen. 5.2.2.2.4 Laktatgehalte Es ließen sich weder im Magen- noch im Dünndarm- oder Caecumchymus signifikante Unterschiede zwischen der Kontrollgruppe, der Versuchsgruppe „fein + KDF“ und der 85 Diskussion ___________________________________________________________________________ Versuchsgruppe „fein + freie Säuren“ hinsichtlich des Laktatgehaltes feststellen. Der Mageninhalt der Gruppe „fein + KDF“ wies den geringsten Wert mit 0,86 mmol/kg uS auf. Der Laktatgehalt im Mageninhalt der Gruppe „fein + freie Säuren“ ist mit 1,24 mmol/kg uS ebenfalls niedriger als in der Kontrollgruppe (2,94 mmol/kg uS). Auch im Dünndarmchymus ist der Wert der Kontrollgruppe deutlich höher (23,23 mmol/kg uS) als in den beiden Versuchsgruppen, die sich hier nur sehr gering voneinander unterscheiden („fein + KDF“: 16,57 mmol/kg uS; „fein + freie Säuren“: 14,69 mmol/kg uS). Im Bereich des Caecums hingegen weist die Versuchsgruppe „fein + freie Säuren“ einen deutlich höheren Gehalt an Laktat auf als die beiden anderen Gruppen. Eine Verminderung des Laktatgehalts im Magenchymus durch Zusatz von Säuren oder deren Salz wurde in zahlreichen anderen Studien ebenfalls beobachtet (BOLDUAN et al. 1988; ROTH et al. 1992a; NEU 2007). Dies spricht (leider) für einen negativen Einfluss der Zusätze auf grampositive Laktatbildner. PAPENBROCK (2004) konnte beim Vergleich eines grob vermahlenen Mischfutters mit einem grob vermahlenem Mischfutter mit KDF-Zusatz einen Einfluss der KDF-Supplementierung auf Laktatgehalte im Chymus nicht bestätigen. Die höchsten Laktatgehalte fanden sich in der eigenen Studie im Dünndarmchymus, wie es auch aus anderen Untersuchungen bekannt ist (KULLA 2001; PAPENBROCK 2004; NEU 2007). Der hemmende Einfluss der Zusätze auf laktatbildende Mikroorganismen scheint sich im Dünndarm fortzusetzen. KULLA (2001) stellte bei einem Zusatz von 1,8 % KDF zum Futter eine signifikante Verminderung der Laktobazillen im caudalen Dünndarm fest. FRANCO et al. (2004) sahen jedoch keine Verminderung der Laktobazillen durch Zulage von Ameisensäure oder –Mischungen. EIDELSBURGER et al. (1992b) konnten keine Veränderung der Laktatgehalte in Magen und Dünndarm bei Zulage von 1,8 % Calciumformiat oder 1,25 % Ameisensäure beobachten. Der Effekt von organischen Säuren auf Milchsäurebakterien ist umstritten. So wurde in einigen Untersuchungen eine relative Resistenz dieser Mikroorganismen gegenüber Säurezusätzen festgestellt (SUTTON et al. 1991; KNARREBORG et al. 2002), andere Studien sprechen jedoch auch für eine gewisse Sensitivität (GEDEK et al. 1992b). In dieser Studie war auffällig, dass der Laktatgehalt im Caecuminhalt in der Gruppe „fein + freie Säuren“ höher war als in den beiden anderen Gruppen. Eine schnelle Absorption der zugesetzten freien Säuren kann nicht die Erklärung sein, da der Wert der Kontrollgruppe ohne 86 Diskussion ___________________________________________________________________________ Zusätze ebenfalls gering war. Ein eventuell Laktatbildner-fördernder Effekt ist unwahrscheinlich, kann aber durch die eigenen Untersuchungen nicht mit Sicherheit ausgeschlossen werden. 5.2.2.2.5 Gehalt flüchtiger Fettsäuren Vergleicht man die Gehalte der oben genannten flüchtigen Fettsäuren in Magen-, Dünndarmund Caecuminhalt der Kontrollgruppe, der Versuchsgruppe „fein + KDF“ und der Versuchsgruppe „fein + freie Säuren“ miteinander, so ist einzig im Dünndarminhalt ein signifikanter Unterschied bzgl. des Gehalts an Propionsäure zwischen der Kontrollgruppe und der Gruppe „fein + freie Säuren“ festzustellen. Mit 4,11 mmol/kg uS ist der Gehalt an Propionsäure in der Versuchsgruppe signifikant höher als in der Kontrollgruppe mit 1,39 mmol/kg uS. Nicht einmal tendenziell waren ansonsten Unterschiede zu verzeichnen. NEU (2007) stellte in ihren Untersuchungen ebenfalls an nur einer Lokalisation einen signifikanten Unterschied bzgl. nur einer Fettsäure fest (Lokalisationen und gemessene Fettsäuren sind identisch zu den eigenen Untersuchungen): Der Gehalt an i-Buttersäure im Caecuminhalt zeigte einen signifikanten Unterschied zwischen der Kontrollgruppe und der Gruppe „fein + freie Säuren“. VISSCHER (2006) beobachtete signifikant höhere Werte an Propion- und Buttersäure im Caecuminhalt, wenn die Tiere ein mit KDF versetztes Futter erhielten. FRANCO et al. (2005) konnten signifikant höhere Buttersäuregehalte im Dünndarm feststellen, wenn die Tiere ein mit Ameisensäure angereichertes Futter bekamen. Diese Erhöhung des Buttersäuregehaltes vollzog sich auf Kosten des Essigsäuregehaltes. Hier ist also mehr von einer Verschiebung des Verhältnisses zu sprechen. Dies konnte VISSCHER (2006) in seiner Studie nur tendenziell bestätigen. PAPENBROCK (2004) konnte keinen Einfluss einer KDF-Supplementierung auf die Gehalte an flüchtigen Fettsäuren beobachten. Ebenso konnte in einer weiteren Untersuchung dieses Parameters unter Einsatz von gekapselten organischen Säuren kein Unterschied festgestellt werden (STUKE 2003). ROTH et al. (1992a) untersuchten die Gehalte an flüchtigen Fettsäuren in Magen-, Dünndarm-, Caecum- und Coloninhalt unter dem Einfluss einer Ameisensäurezulage zum Futter in verschiedenen Konzentrationen (0,0 %; 0,6 %; 1,2 %; 1,8 %; 2,4 %). Statistisch abgesicherte Aussagen konnten lediglich hinsichtlich der n-Buttersäure getroffen werden. Hier verminderte 87 Diskussion ___________________________________________________________________________ sich ihr Gehalt durch alle Ameisensäuredosierungen. Weiterhin konnte eine Verschiebung des Fettsäurenmusters zugunsten von Essigsäure auf Kosten von Propion- und Buttersäure verzeichnet werden. Dieser Effekt ist invers zu den oben beschriebenen Beobachtungen des Einflusses des KDF auf das Fettsäuremuster. Zusammenfassend lässt sich aus den eigenen Untersuchungen also kein eindeutiger Effekt der freien Säuren oder des KDF auf den Gehalt an flüchtigen Fettsäuren des Chymus und damit auf die Aktivität der Fettsäuren produzierenden Mikroorganismen feststellen. Ebenso sind die Angaben in der Literatur sehr unterschiedlich. Hier bedarf es weiterer Forschungen. 5.2.3 Experimentelle Infektion mit Salmonella Derby Die Ergebnisse der experimentellen Infektion mit S. Derby wurden im Rahmen der Dissertation NEU (2007) vorgestellt und eingehend diskutiert, so dass hier – zur Vermeidung von Wiederholungen – auf eine nähere Erörterung verzichtet wird. 5.2.4 Experimentelle Infektion mit E. coli 5.2.4.1 Klinische Symptomatik nach Erstinfektion Die klinische Symtomatik in Folge der experimentellen E. coli-Infektion in beiden Durchgängen wurde in Kapitel 4.3.1 beschrieben. E. coli-bedingte Durchfallerkrankungen werden meistens bei Saugferkeln oder Absetzferkeln beobachtet (BALJER 1986; WILLS 2000). Umso erstaunlicher war die ausgeprägte, wenn auch zeitlich sehr begrenzte klinische Symptomatik der Tiere im ersten Durchgang, obwohl sie zu diesem Zeitpunkt bereits in der 11. Lebenswoche waren. Begünstigende Faktoren wie Stress durch das Absetzen, die noch nicht ausgereifte Magensäureproduktion oder eine massive Futterumstellung kommen bei diesen Tieren also nicht als begünstigende Faktoren in Frage, wie es bei 3-4 Wochen alten Ferkeln der Fall ist. Bei einer Untersuchung in einem Ferkelerzeugerbetrieb, der gehäuft auftretende Verluste durch die Enterotoxämie zu verzeichnen hatte, konnte beobachtet werden, dass eine antibiotische Behandlung die Symptome zeitlich versetzt (4-5 Wochen nach 88 Diskussion ___________________________________________________________________________ dem Absetzen) auftreten ließ (WENDT et al. 2000). Auch in den eigenen Untersuchungen wurden die Tiere mehrfach einer antibiotischen Medikierung unterzogen und zur experimentellen Infektion einer relativ hohen Dosis an Keimen ausgesetzt, so dass eine klinische Reaktion wahrscheinlicher ist oder eher zu erwarten ist als unter Feldbedingungen. HAGEMANN (2006) untersuchte u. a. den Infektionsverlauf bei Absetzferkeln (28-33 Tage bzw. 47-60 Tage alt) nach experimenteller E. coli-Infektion (gleicher Stamm wie in den eigenen Untersuchungen) unter dem Einfluss einer Antikörper-Applikation (produziert in transgenen Hefen und Futtererbsen). Er beobachtete nach der Applikation von E. coli-Keimen ebenfalls eine deutliche Verschlechterung des Allgemeinbefindens der Tiere, eine Reduktion der TS-Gehalte im Kot und eine nachteilige Veränderung der Konsistenz sowie einen Anstieg der Na- und Cl-Konzentrationen in der Kot-TS. In anderen Untersuchungen, die sich u. a mit dem Infektionsverlauf nach einer experimentellen E. coli-Infektion beschäftigten, wurde eine uneinheitliche klinische Symptomatik der Tiere beobachtet. So erkrankte im ersten Durchgang anteilig die gleiche Tierzahl aus Versuchs- und Kontrollgruppe, jedoch – trotz nahezu gleicher Infektionsdosis – kein Tier im zweiten Durchgang (BOLLMANN 2002). Die Tiere des zweiten Durchgangs in der vorliegenden Untersuchung erkrankten etwa zweieinhalb Wochen vor der geplanten experimentellen Infektion an einer Infektion mit einem anderen E. coli-Feldstamm. Diese Tiere zeigten im Verlauf der nachfolgenden experimentellen Infektion keinerlei klinische Symtome. Alle Anheftungsfimbrien der ETECStämme sind gute Immunogene und provozieren eine typspezifische Immunität (GAASTRA u. DE GRAAF 1982). Die aktive orale Immunisierung von Ferkeln nach dem Absetzen führt ebenso wie eine Infektion des Verdauungstraktes zur Bildung von antikörperbildenden Vorläuferzellen in der Darmschleimhaut (BALJER 1986). Diese Vorgänge erklären vermutlich die fehlende Symptomatik im zweiten Durchgang und weisen auf eine vorhandene Immunität der Tiere hin. 5.2.4.2 Fäkale Ausscheidung nach Erstinfektion Die Ausscheidung des applizierten Keims wurde nach der erstmaligen experimentellen Infektion mittels Rektaltupfer über eine Dauer von sechs Tagen beobachtet. Ein Unterschied 89 Diskussion ___________________________________________________________________________ zwischen den Gruppen konnte nicht festgestellt werden. Insgesamt schieden im ersten Durchgang fast alle Tiere über sechs Tage den Erreger aus (Ausnahme: zwei Tiere an Tag 4, jeweils eines aus der Gruppe „fein + freie Säuren“ und der Gruppe „grob ohne Zusätze“ und ein Tier an Tag 6, aus der Gruppe „fein + freie Säuren“ waren negativ). Mittels einer PCR wurden die aus den Rektaltupfern isolierten Keime mit dem applizierten Stamm verglichen. In allen Fällen lag eine Übereinstimmung vor, d. h. die applizierten E. coli-Keime hatten den Verdauungstrakt passiert, ohne die Kultivierbarkeit zu verlieren. Betrachtet man die fäkale Ausscheidung von E. coli im zweiten Durchgang, so ist eine insgesamt kürzere Ausscheidungsdauer zu beobachten. Bereits am zweiten Tag konnte nicht mehr bei allen Tieren der applizierte Keim festgestellt werden, wobei es hier keine Gruppenunterschiede gab. Dies deckt sich mit der fehlenden klinischen Symptomatik wie oben beschrieben und könnte ebenfalls ein Effekt der erworbenen Immunität durch die vorangegangene E. coli-Feldinfektion sein. HAGEMANN (2006) nahm bei Absetzferkeln nach einer experimentellen E. coli-Infektion über vier Tage Rektaltupferproben, welche semiquantitativ ausgewertet wurden. Er beobachtete, dass die Intensität der Ausscheidung kontinuierlich abnahm, unabhängig davon, ob es sich um Tiere der Versuchs- oder Kontrollgruppe (Versuch: Zusatz von Antikörpern) handelte. Weiterhin schloss er von der erheblichen Standardabweichung bei seinen Ergebnissen auf eine Inhomogenität des Infektionsverlaufs. BOLLMANN (2002) stellte bei der Auswertung der Keimzahlen im Kot nach einer experimentellen E. coli-Infektion bei Schweinen im ersten Versuchsdurchgang einen Anstieg der Zahlen vom zweiten auf den vierten Tag p. i. fest, gefolgt von einer kontinuierlichen Reduktion der Keimmenge bis zum achten Tag p. i. Im zweiten Versuchsdurchgang verhielt es sich anders, hier fielen vom zweiten auf den vierten Tag die Keimzahlen ab, um später wieder anzusteigen. Sie konnte diesbezüglich keine Unterschiede zwischen Versuchs- und Kontrollgruppe (Versuch: Zusatz einer gekapselten Säurenmischung) verzeichnen. 5.2.4.3 Keimzahlen im Chymus unter dem Einfluss der Futterstruktur Im Rahmen dieser Untersuchung wurden jeweils acht Tiere aus der Kontroll- und der Versuchsgruppe „grob ohne Zusätze“ seziert. Diese Tiere wurden vier bzw. fünf Stunden 90 Diskussion ___________________________________________________________________________ nach der letzten Futteraufnahme und damit nach erfolgter Superinfektion beprobt. Zur Bestimmung der E. coli-Keimzahlen wurden aus dem gut durchmischten Magen-, Dünndarmund Caecuminhalt Proben genommen und diese, wie in Kapitel 3.8 beschrieben, untersucht. Die Auswertung ergab weder signifikante, noch tendenzielle Unterschiede zwischen den beiden Gruppen. Prophylaktische Maßnahmen zur Reduktion von pathogenen Keimen im Verdauungstrakt beruhen auf verschiedenen Mechanismen. Zum einen kann indirekt durch die Stärkung der darmeigenen Flora und dem dadurch bedingten „Verdrängungsmechanismus“ eine Ansiedlung und Vermehrung von exogenen, potenziell schädlichen Mikroorganismen verringert werden. Im Englischen als „competetive exclusion“ bezeichnet, wird dieses Prinzip schon lange erfolgreich in der Putenmast angewendet, wo durch die Gabe von Bestandteilen der normalen Darmflora die Ansiedlung von Salmonella-Serovaren vermindert wird (NURMI u. RANTALA 1973). Zum anderen wird durch eine Verringerung des von den pathogenen Keimen benötigten Substrats oder durch eine Veränderung der Viskosität des Chymus oder der Darmmotilität (so dass die Zugänglichkeit der entsprechenden Rezeptoren erschwert wird) die Kolonisation durch pathogene Keime beeinflusst (HAMPSON et al. 2001). Der Einsatz von grob vermahlenem Futter und die Supplementierung des Futters mit organischen Säuren sind zwei Strategien, um gesunde Schweine zu produzieren und dabei auf antibiotische Leistungsförderer zu verzichten (JENSEN 1998; HANSEN et al. 2001; PARTANEN et al. 2002). BRUNSGAARD (1998) konnte eine Beeinflussung der Mucosa durch grob vermahlenes Futter beobachten. Er stellte fest, dass die Zellproliferation sowie die Produktion und Zusammensetzung der Darmsekrete so verändert wird, dass eine Ansiedlung von pathogenen Keimen erschwert wird und damit ein besserer Infektionsschutz besteht. Eine Studie an Meerschweinchen ergab, dass der Einsatz einer Komponente aus gekochtem Reis das Erscheinungsbild einer sekretorischen Diarrhoe, wie sie z. B. durch E. coli verursacht wird, vermindern kann (MATHEWS et al. 1999). McDONALD et al. (1997,1999) verglichen nach einer experimentellen Infektion von Schweinen mit hämolysierenden E. coli die Keimzahlen zweier Versuchsgruppen (hochverdauliche Diät aus gekochtem Reis und tierischem Protein ohne bzw. mit Zusatz von Guaran als eine Quelle für lösliche Nicht-Stärke-Polysaccharide). Die Tiere der 91 Diskussion ___________________________________________________________________________ Versuchsgruppe mit Zusatz von Guaran wiesen signifikant höhere Keimzahlen im Dünndarm auf als die Tiere der anderen Versuchsgruppe. MIKKELSEN et al. (2004) verglichen die Mikroflora des Magen-Darmtrakts bei Schweinen in Abhängigkeit von der Struktur (grob versus fein) und der Konfektionierung (pelletiert versus schrotförmig). Ohne die Tiere experimentell infiziert zu haben, wurden die E. coli-Keimzahlen im Chymus bestimmt. Der Dünndarm-, Caecum- und Coloninhalt der mit fein vermahlenem Futter gefütterten Tiere wies generell signifikant höhere Keimzahlen auf als der Chymus der mit grob vermahlenem Futter gefütterten Tiere - unabhängig von der Konfektionierung. Weiterhin wurde im Rahmen dieser Studie von MIKKELSEN et al. (2004) die in-vitro-Todesrate von Salmonella enterica bestimmt. Sie wies eine enge Korrelation zum Gehalt an Laktat im Chymus auf und war im Chymus der Schweine, die das grobe schrotförmige Futter erhielten, am höchsten. Auch andere Studien bestätigen einen Anstieg des Laktatgehaltes durch eine grobe Futterstruktur (CANIBE et al. 2005). In diesem Zusammenhang wird von einer Reduzierung der Keimzahlen von Enterobacterien ausgegangen, wie verschiedene Untersuchungen bestätigen (VAN WINSEN et al. 2001; CANIBE u. JENSEN 2003). Eine weitere dänische Studie beschäftigte sich mit dem Einfluss von fermentiertem Flüssigfutter auf die Aktivität und Zusammensetzung der Mikroflora im Darm von Schweinen und stellte eine Verringerung der E. coli-Keimzahlen im Dünndarm fest (MIKKELSEN u. JENSEN 2000). Fermentiertes Flüssigfutter enthält eine hohe Zahl an Laktobazillen und damit einen hohen Laktatgehalt und als Folge dessen einen niedrigen pH-Wert (GEARY et al. 1996). Zwar sind auch in der eigenen Untersuchung die Laktatgehalte der Versuchsgruppe „grob ohne Zusätze“ tendenziell höher als in der Kontrollgruppe, jedoch konnte kein Zusammenhang zu den Keimzahlen hergestellt werden. Wie in Kapitel 5.1.3 erwähnt, könnten eine gröbere Struktur bzw. schrotförmige Konfektionierung wahrscheinlich deutlichere Unterschiede der Laktatgehalte und damit pH-Werte im Chymus bedingen. Ein Einfluss auf den Keimgehalt wäre damit eher zu erwarten. Auch die TS-Gehalte können einen Einfluss auf die Keimzahlen im Chymus ausüben. REGINA et al. (1999) konnten bei Einsatz von grob vermahlenem Futter erhöhte TS-Gehalte und Acetat- und Laktatgehalte im Magen feststellen, was sich wiederum ungünstig auf pathogenen Keime auswirken. In der eigenen Untersuchung konnten jedoch ebenfalls keine 92 Diskussion ___________________________________________________________________________ Unterschiede bzgl. des TS-Gehaltes im Chymus zwischen der Kontroll- und der Versuchsgruppe „grob ohne Zusätze“ beobachtet werden. Ein direkter Einfluss der groben Vermahlung des Futters auf die Keimzahlen war in den eigenen Untersuchungen nicht zu beobachten. Jedoch konnte, wie oben bereits beschrieben, in anderen Studien durchaus ein positiver Effekt durch eine veränderte Futterstruktur auf ein Infektionsgeschehen festgestellt werden. Der Laktatgehalt scheint hierbei eine große Rolle zu spielen, dieser wurde in den eigenen Untersuchungen durch eine gröbere Futterstruktur erhöht. Dass hierdurch kein Effekt auf die Keimzahlen zu beobachten war, kann in Zusammenhang mit dem geringen Anteil grober Partikel im Futter (im Vergleich zu anderen Studien, s. Kapitel 5.1.3) stehen. 5.2.4.4 Keimzahlen im Chymus unter dem Einfluss der Futteradditive Eine selektive Unterdrückung pathogener Keimen im Verdauungstrakt von Schweinen kann u. a. durch die Futtersupplementierung mit organischen Säuren (HAMPSON et al. 2001) erreicht werden. In den eigenen Untersuchungen wurde eine Mischung aus freien Säuren (Ameisen- und Propionsäure) mit dem Salz einer Säure (Kaliumdiformiat) sowie diese beiden Gruppen gegen die Kontrollgruppe hinsichtlich ihrer Wirksamkeit auf das Infektionsgeschehen mit E. coli verglichen. Im Magenchymus konnte - im Vergleich zur Kontrollgruppe - durch beide Futterzusätze die Keimzahl nach experimenteller Infektion signifikant gesenkt werden. Im Dünndarminhalt war dieser Effekt nicht in diesem Maß zu beobachten, hier gab es keine signifikanten Unterschiede zu verzeichnen, jedoch waren die Keimzahlen der beiden Versuchsgruppen tendenziell niedriger (Kontrollgruppe: 8,60, „fein + KDF“: 7,89, „fein + freie Säuren“: 8,01 log/g uS). Im Caecuminhalt wiederum waren die Keimzahlen der Gruppe „fein + KDF“ mit 8,41 log/g uS signifikant niedriger als in der Kontrollgruppe mit 9,04 log/g uS. Der Keimgehalt der Gruppe „fein + freie Säuren“ war mit 8,45 log/g uS nur geringgradig höher als in der anderen Versuchsgruppe und tendenziell niedriger als in der Kontrollgruppe. Diese Beobachtungen decken sich mit den Ergebnissen von KULLA (2001), der nach Zusatz von 1,8 % Kaliumdiformiat zum Futter eine um eine Zehnerpotenz verminderte E. coli-Keimzahl im caudalen Dünndarm- und Colonchymus feststellen konnte. Dieser Effekt wurde in weiteren Studien bestätigt (ØVERSTRAND et al. 93 Diskussion ___________________________________________________________________________ 1999). Die Keimzahlen im Magenchmyus der eigenen Untersuchungen differierten sogar um fast drei Zehnerpotenzen (Kontrollgruppe: 7,68, „fein + KDF“: 4,91, „fein + freie Säuren“: 5,23 log/g uS). GEDEK et al. (1992b) stellten nach Zulage von 1,2 % Ameisensäure ebenfalls eine Reduzierung der E. coli-Keimzahlen fest. Auch 1,8 % Fumarsäure zeigte im Ileumchymus einen keimreduzierenden Effekt auf E. coli (GEDEK et al. 1992a). Im Gegensatz zu oben genannten und der eigenen Untersuchung stellten SUTTON et al. (1996) einen Anstieg der E. coli-Keimzahlen bei Ferkeln nach Zulage von 1,2 %Propionsäure und 1 % Fumarsäure im Vergleich zur Kontrollgruppe fest. Eine andere Studie konnte nach Zulage einer gekapselten Säuremischung zum Futter einen signifikanten Anstieg der E. coliKeimzahlen verzeichnen (WINKENWERDER 1999). BOLLMANN (2002) konnte keine signifikanten Unterschiede durch die Zulage gekapselter Säuren auf die Keimzahlen von E. coli im Magen-Darm-Trakt beobachten. NEU (2007) prüfte die in der eigenen Untersuchung verwendeten Zusätze auf ihre Wirksamkeit hinsichtlich einer Infektion mit S. Derby und konnte in Magen- und Dünndarmchymus signifikant niedrigere Keimzahlen als in der Kontrollgruppe beobachten, in beiden Fällen zeigte der Zusatz von KDF eine stärker keimhemmende Wirkung als die freien Säuren. Im Caecumchymus verminderte der Zusatz von KDF signifikant, der Zusatz der freien Säuren nur noch tendenziell die Keimgehalte im Vergleich zur Kontrollgruppe. Dies entspricht den Beobachtungen der eigenen Studie bezüglich E. coli. KIRCHGESSNER et al. (1992) verglichen die keimhemmende Wirkung von Calciumformiat und Ameisensäure in formiatäquivalenter Dosis und stellten eine nahezu gleiche Wirkung fest, wobei die freie Säure tendenziell etwas besser wirkte. EIDELSBURGER (1998) sieht einen Vorteil in der Wirkungsweise einer freien Säure im Vergleich zu ihrem Salz darin, dass sie zusätzlich zum Einfluss des Säureanions eine Ansäuerung und Absenkung der Pufferkapazität im Mageninhalt bewirken. Er betont jedoch, dass die Wirkung auf die Mikroflora im Dünndarm überwiegend auf das Säureanion zurückzuführen sei. GEDEK (1993a) führte in vitro-Studien durch, in denen sie nach steigenden Zulagen von LUPRO® zum Futter die Anhaftungsfähigkeit von fimbrientragenden E. coli-Stämmen an die Darmwand gemessen hat. Diese nahm mit steigender Zulage ab. Die Anhaftungsfähigkeit ist von entscheidender Bedeutung für das Krankheitsgeschehen einer E. coli-Infektion, da erst mit dem Anbinden an die Darmwand des Tieres die Toxine freigesetzt werden. 94 Diskussion ___________________________________________________________________________ FRANCO et al. (2004) konnten keine keimhemmende Wirkung durch eine Zulage von Ameisensäure oder Mischungen mit Fumar- oder Milchsäure feststellen. Laktatbildner scheinen relativ resistent gegenüber der Wirkung von organischen Säuren zu sein, wie verschiedene Studien zeigen (SUTTON et al. 1991; KNARREBORG et al. 2002). Eine andere Studie kann dies nicht bestätigen (RISLEY et al. 1992). Eine keimreduzierende Wirkung organischer Säuren und ihrer Salze konnte vielfach bestätigt werden. Die Frage, inwieweit das Salz oder die freie Säure einen entscheidenden Vorteil bieten, konnte mit der eigenen Untersuchung nicht geklärt werden. In der Literatur sind diesbezüglich verschiedene Angaben zu finden, wobei der freien Säure meist der Vorzug gegeben wird. Diese Tendenz konnte nicht beobachtet werden, im Gegenteil – in der vorliegenden Arbeit scheint das Salz Kaliumdiformiat tendenziell eine bessere Wirkung bezüglich E. coli zu haben. 95 Zusammenfassung ___________________________________________________________________________ 6 Zusammenfassung Yasmin Hassan Untersuchungen zu Effekten der Vermahlungsintensität (fein/grob) sowie von Futteradditiven (Ameisen- und Propionsäure/Kaliumdiformiat) im pelletierten Alleinfutter unter den Bedingungen einer experimentellen Infektion von Absetzferkeln mit Salmonella Derby und E. coli Ziel dieser Untersuchung war es zu prüfen, inwieweit die Futterstruktur (fein versus grob vermahlenes Getreide im Mischfutter) und der Zusatz von organischen Säuren oder Kaliumdiformiat das Infektionsgeschehen nach einer experimentellen Salmonella Derbybzw. E. coli-Infektion beeinflussen. Dazu wurden in zwei Durchgängen je 20 Absetzferkel im Alter von ca. 4 Wochen, aufgeteilt in vier Gruppen, aufgestallt. Die Kontrollgruppe bekam Futter herkömmlicher Art (Weizen/Gerste/Soja) und üblicher Vermahlung (2 mm Sieb in der Hammermühle) ohne besondere Zusätze. Das Mischfutter der Versuchsgruppe „fein + KDF“ enthielt einen Zusatz von 1,2 % Kaliumdiformiat, das Futter der Gruppe „fein + freie Säuren“ 0,9 % eines Säurengemischs aus 75 % Ameisensäure und 25 % Propionsäure. Die Mischfutter dieser beiden Versuchsgruppen wiesen den gleichen Vermahlungsgrad wie das Kontrollfutter auf. Im Futter der Gruppe „grob ohne Zusätze“ war der Getreideanteil nur grob vermahlen worden (6 mm Sieb in der Hammermühle). Der Anteil mit einer Partikelgröße ≥2 mm betrug im feinen Futter 0,50 % und im groben Futter 8,58 %, der Anteil von Partikeln ≤0,2 mm betrug im feinen Futter 45,8 % und im groben Futter 41,5 %. Die geringen Unterschiede zwischen den Mischfuttern mit herkömmlicher Vermahlung und dem grob vermahlenen Futter hinsichtlich der Fraktion ≤0,2 mm sind der Pelletierung zuzuschreiben (Nachzerkleinerung). Die durchschnittlichen Nährstoffgehalte des Futters (g/kg TS) sind nachfolgend aufgeführt: Rohprotein 186, Rohfett 34, Rohfaser 42, Stärke 406. Alle vier Mischfutter wurden ausschließlich in pelletierter Form eingesetzt. Den Tieren standen das jeweilige Futter sowie Tränkwasser stets ad libitum zur Verfügung. Nachdem die Tiere einmalig experimentell mit Salmonella Derby (Keimgehalt der Infektionsbouillon: 2,7 × 107 bzw. 8,2 × 108 KBE/ml, 10 ml/Tier) infiziert worden waren (Ergebnisse sind Bestandteil 96 Zusammenfassung ___________________________________________________________________________ der Dissertation NEU 2007), wurden die Schweine anschließend, d. h. im Alter von ca. elf Wochen, nach 3-tägiger antibiotischer Behandlung experimentell mit E. coli infiziert (20 ml einer Infektionsbouillon mit 1,5 × 1011 im ersten Durchgang und 1,9 × 109 KBE/ml im zweiten Durchgang). In den folgenden sechs Tagen wurde die klinische Symptomatik dokumentiert sowie mittels Rektaltupfern die Ausscheidung bestimmt. Vier Tage nach der Erstinfektion wurde jeweils ein Tier jeder Gruppe seziert und die benötigten Proben entnommen. Die verbliebenen Tiere wurden einer zweiten Infektion mit dem gleichen Keim (E. coli) unterzogen. Ab dem sechsten Tag post infectionem wurde täglich wiederum je ein Tier pro Gruppe seziert. Hierzu wurden den Tieren jeweils vier bzw. fünf Stunden vor der Sektion 10 ml einer Infektionsbouillon mit einem Keimgehalt zwischen 7,8 × 108 und 7,1 × 1010 KBE/ml mit dem Futter verabreicht. Nach Aufnahme der Bouillon stand den Tieren bis eine Stunde vor der Sektion Futter ad libitum zur Verfügung. Im Chymus verschiedener Abschnitte des Magen-Darm-Traktes wurden folgende Parameter bestimmt: pH-Wert, Gehalte an TS, Laktat, Formiat und flüchtigen Fettsäuren sowie die E. coli-Keimzahlen. Schließlich wurde auch der Einfluss des Futters auf die Leistung der Tiere beurteilt (Körpermassen-Entwicklung, Futteraufwand). Die wesentlichen Ergebnisse sind wie folgt zusammenzufassen: 1. Effekte der unterschiedlichen Vermahlung: - Die gröbere Futter-Struktur hatte keinen negativen Einfluss auf die Leistung der Tiere, sondern bewirkte sogar tendenziell bessere Ergebnisse als in der Kontrollgruppe (Futteraufwand: Kontrollgruppe: 1,85 / grob ohne Zusätze: 1,78 kg/kg Zuwachs). - Die gröbere Struktur hatte signifikant niedrigere pH-Werte im Caecumchymus (Kontrollgruppe: 6,20 / grob ohne Zusätze: 5,86) zur Folge. Außerdem bewirkte die gröbere Vermahlung tendenziell höhere Laktatwerte in Magen-, Dünndarm- und Caecumchmyus, andererseits tendenziell niedrigere Formiatwerte im Magenchymus . Zusätzlich hatte die gröbere Struktur im Caecumchymus signifikant höhere Gehalte an n-Butter(Kontrollgruppe: 9,56 / grob ohne Zusätze: 17,46 mmol/kg uS) und n-Valeriansäure (Kontrollgruppe: 2,12 / grob ohne Zusätze: 4,18 mmol/kg uS) zur Folge. - Auf die Frequenz und Intensität klinischer Symptome und die Ausscheidungsdauer von E. coli hatte die gröbere Futterstruktur keinen Einfluss. - Die Keimzahlen von E. coli im Chymus blieben vom Vermahlungsgrad unbeeinflusst. 97 Zusammenfassung ___________________________________________________________________________ 2. Effekte der verschiedenen Futteraddititve: - Beide Versuchsgruppen mit Futterzusätzen zeigten tendenziell günstigere Leistungen, der Zusatz der freien Säure deutlicher als der von Kaliumdiformiat (Futteraufwand: Kontrollgruppe: 1,85 / fein + KDF: 1,79 / fein + freie Säuren: 1,76 kg/kg Zuwachs). - Die Zusätze reduzierten den pH-Wert im Magenchymus (Kontrollgruppe: 5,02 / fein + KDF: 4,41 / fein + freie Säuren: 3,75) sowie die Laktatgehalte in Magen- (Kontrollgruppe: 2,94 / fein + KDF: 0,86 / fein + freie Säuren: 1,24 mmol/kg uS) und Dünndarmchymus (Kontrollgruppe: 23,2 / fein + KDF: 16,6 / fein + freie Säuren: 14,7 mmol/kg uS); die Formiatgehalte im Magenchymus zeigten wie erwartet signifikant höhere Werte als die Kontrollgruppe (Kontrollgruppe: 158; fein + KDF: 1054, fein + freie Säuren: 681 mg/l uS). - Auf die Frequenz und Intensität klinischer Symptome und die Ausscheidungsdauer von E. coli hatten die Zusätze keinen Einfluss. - Die beiden Futterzusätze reduzierten (KDF > freie Säuren) im Magenchymus signifikant – an anderen Lokalisationen nur tendenziell – die Keimzahlen von E. coli (Kontrollgruppe: 7,68 / fein + KDF: 4,91 / fein + freie Säuren: 5,23 KBE log/g uS), nach vorangegangener experimenteller E. coli-Infektion. Schlussfolgerungen: Der Zusatz von freien Säuren oder Kaliumdiformiat steigerte die Effizienz der Magenbarriere gegenüber oral aufgenommenen E. coli-Keimen. Bedingt durch die Absorption der Säure im Dünndarm verlieren die Additive im weiteren Verdauungstrakt jedoch an Wirkung. Die gröbere Struktur des Futters führte zu veränderten Milieubedingungen (Laktatbildner ↑, flüchtige Fettsäuren ↑), die eine positive Wirkung auf die darmeigene Flora erkennen lassen. Da durch den Pelletierungsvorgang offensichtlich die „Grobheit“ der Struktur vermindert wurde (Nachzerkleinerung), waren die Effekte der Partikelgrößen im Futter weniger deutlich. Es ist zu erwarten, dass mit noch gröberer Futterstruktur deutlichere Auswirkungen zu beobachten gewesen wären. Eine Kombination aus gröberer Futterstruktur und dem Zusatz von freien Säuren oder Kaliumdiformiat dürfte eine ergänzende Maßnahme zur Entschärfung E. coli-bedingter Probleme darstellen. 98 Summary ___________________________________________________________________________ 7 Summary Yasmin Hassan Investigations on effects of grinding intensity (fine/coarse) and feed additives (formic and propionic acid/potassium diformate) to pelleted diets under the conditions of an experimental infection of weaned piglets with Salmonella Derby and E. coli Aim of these investigations was to examine to what extent the structure of feed (finely versus coarsely ground cereals) and the addition of organic acids (formic and propionic acid) and potassium diformate affect the development of an experimental infection with E. coli. For this purpose 2 trials with 20 pigs in each were performed. The pigs aged approximately 4 weeks were allotted into 4 groups. Animals of the control group were fed with a finely ground diet (2 mm screen in hammer mill) without any special additions. Group “fine + KDF” received a diet with 1.2 % potassium diformate. The diet of group “fine + free acids” contained 0.9 % of an acid mix (75 % formic acid and 25 % propionic acid). These two experimental diets were as finely ground as the control diet, whereas cereals of the diet group “coarse without addition” were coarsely ground (6 mm screen in hammer mill). The fraction of particles ≥2 mm in the finely ground diet was 0.50 % and in the coarsely ground diet 8.58 %, the fraction of particles ≤0.2 mm in the finely ground diet averaged 45.8 % and in the coarsely ground diet 41.5 %. The small differences concerning the fraction of particles ≤0,2 mm between the diets with finely and coarsely ground cereals occurred in consequence of pelleting (further milling process). The average nutrient contents (g/kg dry matter) are listed below: crude protein: 186, crude fat: 34, crude fibre: 42, starch: 406. All diets were exclusively offered as pellets. Feed and drinking water were always available ad libitum. Initially the animals were experimentally infected with Salmonella Derby (liquid medium: 2.7 × 107 or 8.2 × 108 cfu/ml; the results of this infection are published in the doctoral thesis of NEU 2007). Afterwards, at the age of approximately eleven weeks, the animals were medicated with antibiotics for three days. In the following a first experimental oral infection with E. coli (20 ml of a liquid medium: 1.5 × 1011 or 1.9 × 109 cfu/ml) was performed. During 99 Summary ___________________________________________________________________________ the next six days the clinical symptoms were investigated and the excretion of E. coli was determined by rectal swabs. Four days after the primary infection with E. coli four piglets – one of each group – were dissected and the necessary samples were taken. From the sixth day after the primary infection the remaining animals were reinfected with the same pathogen (E. coli) –one animal of each group daily – and dissectioned. For this reinfection the pigs got 10 ml of a liquid medium (7.8 × 108 and 1.5 × 1011 CFU/ml) combined with their usual diet 4 or 5 hours before dissection. After this infection the pigs were fed ad libitum until one hour before the piglets were sacrificed. The following parameters were determined in the chyme of different sections of the gastrointestinal tract: pH value, contents of dry matter, l-lactate, formic acid, volatile fatty acids and counts of E. coli. Additionally the influence of the different diets on the performance (body weight gain, feed conversion rate) was evaluated. The results observed in this study can be summarised as follows: 1. Results concerning grinding intensity: - The coarse structure of feed showed no negative influence on the performance of the animals. It even tended to have better results (feed conversion rate: control group: 1.85 / coarsely ground without addition: 1.78 kg/kg gain). - Coarse structure of feed resulted in significantly decreased pH values in the caecal content (control group: 6.20 / coarsely ground without addition: 5.86). Furthermore the coarse structure tends to result in increased values of l-lactate in the chyme of stomach, small intestine and caecum and decreased values of formic acid in the chyme of stomach. In the caecal contents significantly increased values of n-butyric acid (control group: 9.56 / coarsely ground without addition: 17.5 mmol/kg chmye) and n-valeric acid (control group: 2.12 / coarsely ground without addition: 4.18 mmol/kg chyme) were measured. - Different grinding intensities of cereals had no influence on counts of E. coli in chyme. - Coarse structure of feed did not affect clinical symptoms and excretion period of E. coli. 2. Results concerning the addition of free acids or potassium diformate: - Diets with additives tend to result in a better feed conversion rate (free acids > KDF: control group: 1.85 / finely ground + KDF: 1.79 / finely ground + free acids: 1.76 kg/kg gain). 100 Summary ___________________________________________________________________________ - The additives reduced pH values in chyme of stomach (control group: 5.02 / finely ground + KDF: 4.41 / finely ground + free acids: 3.75) as well as l-lactate concentrations in chyme of stomach (control group: 2.94 / finely ground + KDF: 0.86 / finely ground + free acids: 1.24 mmol/kg chyme) and small intestine (control group: 23,2 / finely ground + KDF: 16,6 / finely ground + free acids: 14.7 mmol/kg chyme). Formic acid contents in chyme of stomach turned out to be significantly higher than in the control group as it was expected (control group: 158 / finely ground + KDF: 1054 / finely ground + free acids: 681 mg/l chyme). - Both additives tend to result in reduced counts of E. coli (KDF > free acids) – in chyme of stomach even significantly (control group: 7.68 / finely ground + KDF: 4.91 / finely ground + free acids: 5.23 cfu log/g chyme). - The additives did not influence clinical symptoms and excretion period of E. coli. Conclusions: The addition of free acids (formic and propionic acid) or potassium diformate increased the efficiency of the stomach barrier and improves the protection from pathogens. Because of their absorption in the small intestine their effect was less obvious in more distal parts of the digestive tract. The coarse structure of feed results in a positive effect on the micro flora in the hindgut (llactate ↑, volatile fatty acids ↑) and its stabilization in the caudal part of the gastrointestinal tract. Due to the pelleting process coarseness of feed was reduced (unintended further milling process) and the effects of different grinding intensities were more difficult to recognize. Using an even coarser structure of feed would probably cause still stronger effects. A combination of coarser feed structure (i. e. higher proportions of particles with larger diameter) and addition of free acids or potassium diformate could be an additional step to mitigate problems caused by E. coli. 101 Literaturverzeichnis ___________________________________________________________________________ 8 Literaturverzeichnis AMTSBERG, G. (1984): Die Darmflora des Schweines: Zusammensetzung und Wirkungsmechanismen. Prakt. Tierarzt 12, 1097-1111 BALJER, G. (1986): E. coli-Diarrhoe der Saug- und Absatzferkel. Der praktische Tierarzt 5, 388-398 BALJER, G. u. L. H. WIELER (1993): E.-coli-Diarrhoe der Saug- und Absetzferkel: aktueller Stand immunprophylaktischer Möglichkeiten. Praktischer Tierarzt, coll. vet. So. Nr. 75, 87-91 BEDFORD, M. R. (2000): Removal of antibiotic growth promoters from poultry diets: implications and strategies to minimize subsequent problems. Poult. Sci. 56, 347-365 BILKEI, G. (1996): Ferkelverluste nach dem Absetzen. Kraftfutter 10, 436-440 BISPING, W. (1979): Kompendium der veterinärmedizinischen Mikrobiologie. Schaper, Alfeld-Hannover BÖLCSKEI, A., G. BILKEI, O. BIRO, E. CLAVADETSCHER, T. GOOS, P. ORBAN, C. WALLER u. P. STELZER (1996): Management der E. coli-bedingten Faktorenkrankheiten nach dem Absetzen der Ferkel. Berliner- und Münchener Tierärztliche Wochenschrift 109, 108-111 BOLDUAN, G., H. JUNG, R. SCHNEIDER, J. BLOCK u. B. KLENKE (1988): Influence of propionic and formic acids on piglets. J. Anim. Physiol. Anim. Nutr. 59, 72-78 BOLLMANN, S. (2002) Untersuchungen zur Wirkung nichtantibiotischer Futterzusätze auf die Darmflora sowie den Verlauf einer experimentellen Escherichia coli- bzw. Salmonella Derby- Infektion bei Schweinen. Hannover, Tierärztl. Hochsch., Diss. 102 Literaturverzeichnis ___________________________________________________________________________ BRUNSGAARD, G. (1998): Effects of cereal type and feed particle size on morphological characteristics, epithelial cell proliferation and lectin binding patterns in the large intestine of pigs. J. Anim. Sci. 76, 2787-2798 CANIBE, N., O. HOJBERG, S. HOJSGAARD u. B. B. JENSEN (2005): Feed physical form and formic acid addition to the feed affect, the gastrointestinal ecology and growth performance of growing pigs. J. Anim. Sci. 83, 1287-1302 CANIBE, N. u. B. B. JENSEN (2003): Fermented and non-fermented liquid feed to growing pigs-Effect on aspects of gastrointestinal ecology and on growth performance. J. Anim. Sci. 81, 2019-2031 CANIBE, N., S. H. STEIEN, M. ØVERLAND u. B. B. JENSEN (2001): Effect of K-diformate to starter piglet diets on digesta and faecal microbial profile and on stomach alterations. J. Anim. Sci. 79, 2123-2133 COOPER, V. L. (2000): Diagnosis of neonatal pig diarrhea. W. B. Saunders Company, Philadelphia DIAL, G. D., W. E. MARSH, D. D. POLSON u. J.-P. VAILLANCOURT (1992): Reproductive Failure: Differential Diagnosis. Iowa State University Press, Iowa DUMJOVIC, M. (1976): Die Bestimmung von Calcium, Kalium, Lithium, Magnesium, Eisen, Kupfer und Zink im Blutplasma und Blutserum. Beckmann Report 1 und 2. Beckmann Instruments Gmbh, München ECKEL, B., M. KIRCHGESSNER u. F. X. ROTH (1992): Zum Einfluss von Ameisensäure auf tägliche Zunahmen, Futteraufnahme, Futterverwertung und Verdaulichkeit. 1. Mitteilung: Untersuchungen zur nutritiven Wirksamkeit von organischen Säuren in der Ferkelaufzucht. J. Anim. Physiol. a. Anim. Nutr. 67, 93-100 EIDELSBURGER, U. (1997): Optimierung der Futterqualität ist nur ein Teilaspekt. Schweinewelt 1, 18-21 103 Literaturverzeichnis ___________________________________________________________________________ EIDELSBURGER, U. (1998): Organische Säuren in der Schweinefütterung -Wirkungsweise als Basis für die richtige Produktwahl-. In: Themen zur Tierernährung, Neuenkirchen-Vörden, 24-40 EIDELSBURGER, F. X. ROTH u. M. KIRCHGESSNER (1992a): Zum Einfluß von Ameisensäure, Calciumformiat und Natriumhydrogencarbonat auf tägliche Zunahmen, Futteraufnahme, Futterverwertung und Verdaulichkeit. 7. Mitteilung: Untersuchungen zur nutritiven Wirksamkeit von organischen Säuren in der Ferkelaufzucht. J. Anim. Physiol. a. Anim. Nutr. 67, 258-267 EIDELSBURGER, U., M. KIRCHGESSNER u. F. X. ROTH (1992b): Zum Einfluss von Ameisensäure, Calciumformiat und Natriumhydrogencarbonat auf pHWert, Trockenmassegehalt, Konzentrationen an Carbonsäure und Ammoniak in verschiedenen Segmenten des Gastrointestinaltraktes. 8. Mitteilung: Untersuchungen zur nutritiven Wirksamkeit von organischen Säuren in der Ferkelaufzucht. J. Anim. Physiol. a. Anim. Nutr. 68, 20-32 FAIRBROTHER, J. M. (1992): Enteric colibacillosis. Iowa State University Press, Iowa FERKET, P. R. (2003): Gesunderhaltung des Darms ohne Antibiotika. Großtierpraxis 4, 5-11 FREITAG, M., H.-U. HENSCHE, H. SCHULTE-SIESENBECK u. B. REICHELT (1998): Kritische Betrachtung des Einsatzes von Leistungsförderern in der Tierernährung. Forschungsber. Fachber. Agrarwirtsch. Soest, Univ.-Gesamthochschule Paderborn Bd. 8, FULLER, R. u. G. R. GIBSON (1997): Modification of the intestinal microflora using probiotics and prebiotics. Scand. J. Gastroenterol. 32, Suppl.222: 228-231 GAASTRA, W. u. F. K. DE GRAAF (1982): Host specific fimbrial adhesins of non-invasive enterotoxigenic E.coli strains. Microbiol. Rev. 46, 129 GEARY, T. M., P. H. BROOKS, D. T. MORGAN, A. CAMPELL u. P. J. RUSSEL (1996): Performance of weaner pigs fed ad libitum with liquid feed at different dry matter concentrations. Journal of Science of Food and Agriculture 72, 17-24 GEDEK, B. (1987): Darmflora im Zustand der Eubiose. Feed Magazine 22 104 Literaturverzeichnis ___________________________________________________________________________ GEDEK, B. (1992): Mikroorganismen als Leistungsförderer beim Ferkel. Kraftfutter 2, 55-60 GEDEK, B. (1993): Probiotika zur Regulierung der Darmflora. Tierärztl. Umschau 48, 97-104 GEDEK, B., M. KIRCHGESSNER, U. EIDELSBURGER, S. WIEHLER, A. BOTT u. F. X. ROTH (1992b): Zum Einfluss von Ameisensäure auf die Keimzahlen der Mikroflora und deren Zusammensetzung in verschiedenen Segmenten des Gastrointestinaltraktes: 5. Mitteilung. Untersuchungen zur nutritiven Wirksamkeit von organischen Säuren in der Ferkelaufzucht. J. Anim. Physiol. a. Anim. Nutr. 67, 206-214 GEDEK, B., F. X. ROTH, M. KIRCHGESSNER, S. WIEHLER, A. BOTT u. U. EIDELSBURGER (1992a): Zum Einfluß von Fumarsäure, Salzsäure, Natriumformiat, Tylosin und Toyocerin auf die Keimzahlen der Mikroflora und deren Zusammensetzung in verschiedenen Segmenten des Gastrointestinaltraktes. J. Anim. Physiol. a. Anim. Nutr. 68, 209-217 GERICKE, S. u. B. KURMIES (1952): Die kolorimetrische Phosphorsäurebestimmung mit Ammonium-Vanadat-Molybdat und ihre Anwendung in der Pflanzenanalyse. Z. Pflanzenernähr., Düngung u. Bodenkunde 59, 235-247 GLAWISCHNIG, E. (1990): Ein Beitrag zum antibiotikafreien Absetzen der Ferkel. Deutsche Tierärztliche Wochenschrift 97, 48-51 GLOCK, R. D. u. S. C. WHIPP (1986): Digestive System. In: Leman et al., Disease if Swine 6thed. Ames: Iowa State Universtity Press, S. 144-152 GREIFE, H. A. u. F. BERSCHAUER (1988): Leistungsförderer in der Tierproduktion: Stand und Perspektiven. Übersichten Tierernährung 16, 27-78 HAGEMANN, M. (2006) Untersuchungen zur Wirksamkeit oral applizierter Antikörper (produziert in transgenen Hefen und Erbsen) gegen enterotoxische Escherichia coli (ETEC) bei experimentell infizierten Absetzferkeln. Hannover, Tierärztl. Hochsch., Diss. 105 Literaturverzeichnis ___________________________________________________________________________ HAMPSON, D. J. (1994): Postweaning Escherichia coli diarrhoea in pigs. In: Escherichia coli in Domestic Animals and Humans CAB International, Wallingford, England, S. 171-191 HAMPSON, D. J., J. R. PLUSKE u. D. W. PETHICK (2001): Dietary manipulation of enteric disease. Pig News and Information 22, 21N-28N HANSEN, C. F., K. E. BACH KNUDSEN, B. B. JENSEN u. H. D. KJǼRSGAARD (2001): Effect of meal feed and coarser grinding of pelleted feed on productivity, microbiology and physio-chemical properties in the gastro-intestinal tract of finishers. In: Proc. 4th Salinpork, Leipzig, Germany, 106-108 HEBELER, D., S. KULLA, F. WINKENWERDER, J. KAMPHUES, J. ZENTEK u. G. AMTSBERG (2000): Influence of a formic acid-potassiumformate-complex on chyme composition as well as on the intestinal microflora of weaned piglets. Proc. Soc. Nutr. Physiol. 9, 63 HEDEMANN, M. S. u. E. BACH KNUDSEN (2006): Resistant starch for weaning pigs- effect on concentration of short chain fatty acids in digesta and intestinal morphology. In: Proc. 10th International Symposium on Digestive Physiology in Pigs, Vejle, Denmark, 22, JENSEN, B. B. (1998): The impact of feed additiveson the microbiological ecology of the gut in young pigs. J. Anim. Feed Sci. 7, 45-64 JǾRGENSEN, L., J. DAHL u. A. WINGSTRAND (1999): The effect of feeding pellets, meal and heat treatment on the salmonella-prevalence in finishing pigs. In: Proc. of the 3rd International Symposium on the epidemiology and control of Salmonella in pork, Washington, USA, 358-361 KAMPHUES, J. (1988) Untersuchungen zu Verdauungsvorgängen bei Absetzferkeln in Abhängigkeit von Futtermenge und -zubereitung sowie von Futterzusätzen. Hannover, Tierärztl. Hochsch., Habil.-Schr. KAMPHUES, J. (1999): Leistungsförderer mit antibiotischer Wirkung aus Sicht der Tierernährung. Berliner- und Münchener Tierärztliche Wochenschrift 112, 370-379 KAMPHUES, J. (2007): Die "Struktur" im Mischfutter für Schweine: Charakterisierung und Bedeutung. In: Tierernährung für Tierärzte Im Fokus: Die Fütterung von Schweinen, Hannover, 13.04.2007, Tagungsband, 37-45 106 Literaturverzeichnis ___________________________________________________________________________ KAMPHUES, J., A. WARZECHA, I. BRÜNING, S. OFFENBERG, M. NEU, Y. HASSAN, V. TAUBE u. C. VISSCHER (2007): Untersuchungen zu Effekten eines unterschiedlichen Vermahlungsgrades von Komponenten im Mischfutter für Schweine. In: Forum angewandte Forschung in der Rinder- und Schweinefütterung, 28. – 29.03.2007 in Fulda, 125-128 KAUFFMANN, F. (1944): Zur Serologie der Coli-Gruppe. Acta Pathol. Microbiol. Scand. 21, 20-45 KENWORTHY, R. u. W. E. CRABB (1963): The intestinal flora of young pigs, with reference to early weaning, Escherichia coli and scours. J. Comp. Pathol. 73, 215-228 KIRCHGESSNER, M. (1997): Tierernährung. VerlagsUnion Agrar, Frankfurt (Main) KIRCHGESSNER, M. u. F. X. ROTH (1988): Ergotrope Effekte durch organische Säuren in der Ferkelaufzucht und Schweinemast. Übers. Tierernährg. 16, 93-108 KNARREBORG, A. S., N. MIQUEL, T. GRANLI u. B. B. JENSEN (2002): Establishment and application of an in vitro methodology to study the effects of organic acids on coliform and lactic acid bacteria in the proximal part of the gastrointestinal tract of piglets. Anim. Feed Sci. Technol. 99, 131-140 KÖNIG, H. E. u. H.-G. LIEBICH (1999): Anatomie der Haussäugetiere. Bd. 2. Schattauer, Stuttgart KÜHN, J., S. JACOBS u. A. MÜLLER (2000): Die positive Beeinflussung der Darmflora beim Schwein durch geeignete Futterzusatzstoffe. In: Fortbildungsveranstaltung Pleuromutiline 29. September 2000 (Fa. Novartis), Bederkesa, KULLA, S. (2001) Untersuchungen zum Einfluss von Kaliumdiformiat als Futterzusatz auf das Keimspektrum und Parameter des mikrobiellen Stoffwechsels im Chymus sowie verschiedene Verdauungsprozesse von Absetzferkeln. Hannover, Tierärztl. Hochsch., Diss. LINDEMANN, M. D., S. G. CORNELIUS, S. M. EL KANDELGY, R. L. MOSER u. J. E. PETTIGREW (1986): Effects of age, weaning and diet on digestive enzyme levels in the piglet. . J. Anim. Sci. 62, 1298-1307 107 Literaturverzeichnis ___________________________________________________________________________ LÖWE, R. (2007): Vermahlungstechniken für Futtermittel. In: Tierernährung für Tierärzte, Im Fokus: Die Fütterung von Schweinen, Hannover, 13.04.2007, Tagungsband, 33-34 MALORNY, G. (1969): Die akute und chronische Toxizität der Ameisensäure und ihrer Formiate. Z. Ernährungswiss. 9, 322-339 MATHEWS, C. J., R. J. MACLEOD, S. X. ZHENG, J. W. HANRAHAN, H. P. BENNETT u. J. R. HAMILTON (1999): Characterization of the inhibitory effect of boiled rice on intestinal chloride secretion in guinea pig crypt cells. Gastroenterology 116, 1342-1347 MAXWELL, C. V., E. M. REIMANN, W. G. HOEKSTRA, T. KOWALCZYK, N. J. BENEVENGA u. R. H. GRUMMER (1970): Effect of dietary particle size on lesion development and on the contents of various regions of swine stomach. J. Anim. Sci. 30, 911-922 MENTSCHEL, J. (2004) Erhöhung der Butyratbildung durch Fütterung von resistenter Stärke beim Schwein: Konsequenzen für die Mitose und Apoptoseregulation der Colonmucosa. Stuttgart, Universität Hohenheim, Diss. MIKKELSEN, L. L. u. B. B. JENSEN (2000): Effect of fermented liquid feed on the activity and composition of the microbiota in the gut of pigs. Pig News and Information 21, 59N-66N MROZ, Z., A. W. JONGBLOED, R. VON DER WEIJ-JONGBLOED u. M. ØVERLAND (2001): Effects of adding potassium diformate and phytase excess for weaned piglet. In: Lindberg, J. E. u. B. Ogle: Digestive physiology of pigs. CABI publishing, S. 305-307 NAUMANN, C. u. R. BASSLER (1993): Die chemische Untersuchung von Futtermitteln. VDLUFA-Verlag, Darmstadt, 3. Auflage NEU, M. (2007) Untersuchungen zu Effekten der Futterstruktur (Pellets aus Komponenten unterschiedlicher Vermahlung) sowie eines Zusatzes freier Säuren bzw. von Kalium-diformiat zum Futter unter den Bedingungen einer experimentellen Infektion von Absetzferkeln mit Salmonella Derby. Hannover, Tierärztl. Hochsch., Diss. 108 Literaturverzeichnis ___________________________________________________________________________ NURMI, E. u. M. RANTALA (1973): New aspects of Salmonella infection in broiler production. Nature 241, 210-211 OFFENBERG, S. (2007) Untersuchungen (Feldstudie) zur Salmonellenprävalenz bei Absetzferkeln unter dem Einfluss einer Kombination von gröberer Futtervermahlung und Futteradditiven (organische Säuren bzw. Kaliumdiformiat). . Hannover, Tierärztl. Hochsch., Diss. ØVERLAND, M., C. C. KJELDSEN u. T. GRANLI (2003): Dietary potassium as feed additive. Feed Magazine 5, 146-152 ØVERSTRAND, M., S. H. STEIN, G. GOTTERBARM u. T. GRANLI (1999): FormiTMLHS - An Alternative to Antibiotic growth Promoters. In: 50th Annual EAAP Meeting, Zurich, Switzerland, PAPENBROCK, S. (2004) Untersuchungen zum Einfluss einer groben Vermahlung des Futters und/oder eines KaliumDiformiat-Zusatzes auf die Chymusqualität sowie die Aktivität und Zusammensetzung der Magen-Darm-Flora unter den Bedingungen einer experimentellen Infektion von Absetzferkeln mit Salmonella Derby. Hannover, Tierärztl. Hochsch., Diss. PARTANEN, K. H., H. SILJANDER-RASI, T. ALAVIUHKOLA, K. SUOMI u. M. FOSSI (2002): Performance of growing-finishing pigs fed medium- or high-fibre diets supplemented with avilamycin, formic acid or formic acid-sorbate blend. Livest. Prod. Sci. 73, 139-152 REGINA, D. C., J. H. EISEMANN, J. A. LANG u. R. A. ARGENZIO (1999): Changes in gastric contents in pigs fed a finely ground and pelleted or coarsely ground meal diet. J. Anim. Sci. 77, 2721-2729 RISLEY, C. R., E. T. KORNEGAY, M. D. LINDEMANN, C. M. WOOD u. W. N. EIGEL (1992): Effect of feeding organic acids on selected intestinal content measurements at varying times postweaning in pigs. J. Anim. Sci. 70, 196-206 ROLLE, M. u. A. MAYR (2002): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. Enke, Stuttgart 109 Literaturverzeichnis ___________________________________________________________________________ ROTH, F. X., B. ECKEL, M. KIRCHGESSNER u. U. EIDELSBURGER (1992a): Zum Einfluß von Ameisensäure auf pH-Wert, Trockenmassegehalt, Konzentrationen an flüchtigen Fettsäuren und Milchsäure im Gastrointestinaltrakt. J. Anim. Physiol. a. Anim. Nutr. 67, 148-156 ROTH, F. X., U. EIDELSBURGER u. M. KIRCHGESSNER (1992b): Zum Einfluss von Fumarsäure, Salzsäure, Natriumformiat, Tylosin und Toyocerin auf pHWert, Trockenmassegehalt, Konzentration an Carbonsäuren und Ammoniak in verschiedenen Segmenten des Gastrointestinaltraktes. J. Anim. Physiol. a. Anim. Nutr. 68, 93-103 SARMIENTO, J. I., T. A. CASEY u. H. W. MOON (1988): Postweaning diarrhea in swine: Experimental model of enterotoxigenic Escherichia coli infection. Am. J. Vet. Res. 49, 1154-1159 SCHUHKNECHT, A. u. H. SCHINKEL (1963): Universalvorschrift für die Bestimmung von Kalium, Natrium und Lithium nebeneinander. Z. Anal. Chem. 194, 176-183 SCHULZE, F. u. W. BATHKE (1977): Zur quantitativen Zusammensetzung der Magen-Darm-Flora beim Läuferschwein. Arch. exp. Veterinärmed. 31, 161-185 SILBERNAGEL, S. u. A. DESPOPOULOS (1991): Taschenatlas der Physiologie. 4. Aufl. Verlag Thieme, Stuttgart, New York, S.166-168 SLAVIN, W. (1968): Atomic absorption spectroscopy. Intrescience Publ., New York, London, Sydney. Chemical Analysis 25, 87-90 STEINBACH, G. u. U. KROELL (1999): Salmonellainfektionen in Schweinebeständen – Zu ihrer Epidemiologie und Bedeutung für Erkrankungen des Menschen. Dtsch. tierärztl. Wschr. 106, 282-288 STELLJES, I. (2000) Untersuchungen zur passiven Immunisierung von Saug- und Absetzferkeln mittels Hühnereiantikörpern gegen enterotoxische Escherichia-coli-Bakterien. Hannover, Tierärztl. Hochsch., Diss. 110 Literaturverzeichnis ___________________________________________________________________________ STOKES, C. R., M. BAILEY, K. HAVERSON, C. HARRIS, P. JONES, C. INMAN, S. PIÉ, I. P. OSWALD, B. A. WILLIAMS, A. D. L. AKKERMANS, E. SOWA, H.-J. ROTHKÖTTER u. B. G. MILLER (2004): Postnatal development of intestinal immune system in piglet: implications for the process of weaning. Anim. Res. 53, 325-334 STUKE, O. (2003) Untersuchungen zu möglichen infektionsprophylaktischen Effekten verschiedener Futterzusätze (Ameisen- und Zitronensäure/ Lactulose/ Pankreasenzyme) unter den Bedingungen einer experimentellen oralen Belastung mit E. coli (Absetzferkel) bzw. mit S. Derby (Mastschweine). Hannover, Tierärztl. Hochsch., Diss. SUTTON, A. L., A. G. MATHEW, A. B. SCHEIDT, J. A. PATTERSON u. D. T. KELLY (1991): Effects of carbohydrate sources and organic acids on intestinal microflora and performance of the weanling pig. In: Digestive Physiology in Pigs Pudoc Wageningen, Netherlands, S. 422-427 ULLRICH, K., J. W. u. E. GLAWISCHNIG (1985): Grundriß der speziellen Pathologie und Therapie der Haustiere. Ferdinand Enke Verlag, Stuttgart VAN WINSEN, R. L., B. A. P. URLINGS, L. J. A. LIPMAN, J. M. A. SNIJDERS, D. KREUZENKAMP, J. H. M. VERHEJDEN u. F. VAN KNAPEN (2001): Effect of fermented feed on the microbial population of the gastrointestinal tracts of pigs. Appl. Environ. Microbiol. 67, 3071-3076 VISSCHER, C. (2006) Untersuchungen (Feldstudie) zur Salmonellen-Prävalenz bei Mastschweinen unter dem Einfluss einer gröberen Futtervermahlung sowie von Futteradditiven (organische Säuren bzw. Kaliumdiformiat). Hannover, Tierärztl. Hochsch., Diss. WALDMANN, K.-H. u. M. WENDT (2001): Lehrbuch der Schweinekrankheiten. Parey, Berlin WARZECHA, A. (2006) Untersuchungen zu Fütterungseinflüssen (Einsatz von Trockenschnitzeln bzw. Lignocellulose sowie unterschiedliche Vermahlungsgrade der Mischfutterkomponenten) auf die Kotbeschaffenheit und -zusammensetzung bei Sauen. Hannover, Tierärztl. Hochsch., Diss. 111 Literaturverzeichnis ___________________________________________________________________________ WENDT, M., G. AMTSBERG, D. HEBELER, M. HOMUTH, J. KAMPHUES, J. POHLENZ, K.-H. WALDMANN u. M. WILHELM (2000): Alternativen in der Bekämpfung der Ödemkrankheit. Dtsch. tierärztl. Wschr. 107, 378 WIESNER, E. u. R. RIBBECK (2000): Lexikon der Veterinärmedizin. Enke, Stuttgart WILLS, R. W. (2000): Diarrhea in growing- finishing swine. In: The veterinary clinics of North America/ Food Animal Practice W. B. Saunders Company, Philadelphia, S. WINKENWERDER, F. (1999) Wirkungen gekapselter Milchsäure bzw. eines gekapselten Säuregemisches als Futteradditiv auf die Dramflora von Absetzferkeln. Hannover, Tierärztl. Hochsch., Diss. WOLF, P. u. J. KAMPHUES (2007): Magenulcera beim Schwein. In: Tierernährung für Tierärzte, Im Fokus: Die Fütterung von Schweinen Hannover, 13.04.2007, Tagungsband, 47-63 112 Anhang ___________________________________________________________________________ 9 Anhang Anhang 1: Phoskana S 80, lysinhaltiges Mineralfutter für Schweine (Deklaration) ............. 113 Anhang 2: Keimgehalt (Escherichia coli) pro ml Infektionsbouillon, Durchgang 1............. 113 Anhang 3: Keimgehalt (Escherichia coli) pro ml Infektionsbouillon, Durchgang 2............. 114 Anhang 4: Botanische Zusammensetzung der Versuchsfutter............................................... 114 Anhang 5: Nährstoff- und Energiegehalte der im Versuch eingesetzten Mischfuttermittel in Versuchsdurchgang 1 und 2, soweit nicht anders angegeben in g/kg TS .............................. 115 Anhang 6: Prozentualer Anteil der Futterpartikel bei einer nassen Siebanalyse des in den zwei Versuchsdurchgängen eingesetzten Mischfutters .................................................................. 121 Anhang 7: Futteraufnahme je Gruppe in kg während der gesamten Versuchsdauer (je n = 5) in beiden Versuchsdurchgängen getrennt nach den Behandlungen ........................................... 122 Anhang 8: Körpermasse (kg) der Ferkel während der verschiedenen Versuchsphasen in Versuchsdurchgang 1 und 2 ................................................................................................... 122 Anhang 9: Qualitative Auswertung der Rektaltupfer hinsichtlich Escherichia coli .............. 123 Anhang 10: Futteraufnahme der einzelnen Tiere vor der Sektion sowie Füllung der MagenDarm-Abschnitte (g uS) in Versuchsdurchgang 1 und 2 ....................................................... 125 Anhang 11: Futteraufnahme der einzelnen Tiere vor der Sektion sowie die Füllung der Magen-Darm-Abschnitte (g TS) in Versuchsdurchgang 1 und 2 .......................................... 126 Anhang 12: pH-Werte im Chymus der einzelnen Magen-Darm-Abschnitte der Versuchstiere in Versuchsdurchgang 1 und 2 ............................................................................................... 128 Anhang 13: TS-Gehalte des Chymus in den einzelnen Magen-Darm-Abschnitten (g/kg uS) der Versuchstiere in Versuchsdurchgang 1 und 2 .................................................................. 129 Anhang 14: Formiat-Gehalte (mg/l uS) im Magen- und Dünndarmchymus der Versuchstiere in Versuchsdurchgang 1 und 2 ............................................................................................... 131 Anhang 15: Laktat-Gehalte (mmol/kg uS) im Magen-, Dünndarm- und Caecumchymus der Versuchstiere in Versuchsdurchgang 1 und 2 ........................................................................ 132 Anhang 16: Flüchtige Fettsäuren (mmol/kg uS) im Magenchymus der Versuchstiere in Versuchdurchgang 1 und 2..................................................................................................... 133 Anhang 17: Flüchtige Fettsäuren (mmol/kg uS) im Dünndarmchymus der Versuchstiere in Versuchsdurchgang 1 und 2 ................................................................................................... 134 Anhang 18: Flüchtige Fettsäuren (mmol/kg uS) im Caecumchymus der Versuchstiere in Versuchsdurchgang 1 und 2 ................................................................................................... 136 Anhang 19: E. coli-Keimzahlen (KBE/g uS) im Magen-, Dünndarm- und Caecumchymus der Versuchstiere in Versuchsdurchgang 1 und 2 ........................................................................ 137 Anhang 20: Qualitative Auswertung der Rektaltupfer hinsichtlich Salmonella Derby in Versuchsdurchgang 1 und 2 ................................................................................................... 138 Anhang 21: Salmonellenbefunde der Organ- und Schleimhautproben der Versuchstiere in Versuchsdurchgang 1und 2 .................................................................................................... 140 Anhang 22: Keimgehalt (Salmonella Derby) pro ml Infektionsbouillon, Durchgang 1 und 2 ................................................................................................................................................ 141 113 Anhang ___________________________________________________________________________ Anhang 1: Phoskana S 80, lysinhaltiges Mineralfutter für Schweine (Deklaration) 21,5 % Calcium 8,0 % Phosphor 5,0 % Natrium 1,0 % Magnesium, 580.000 I.E. Vitamin A Zusatzstoffe je kg Mischfutter 60.000 I.E. Vitamin D3 1.500 I.E. Vitamin E 500 mg Kupfer als Kupfer-(II)-Sulfat, Pentahydrat Zusammensetzung 38 % Dicalciumphosphat (mineralisch) 30 % Calciumcarbonat 13 % Natriumchlorid 5 % Monocalciumphosphat (mineralisch) 5 % Zuckerrohrmelasse 2 % Magnesiumoxid Gehalt an Inhaltsstoffen Anhang 2: Keimgehalt (Escherichia coli) pro ml Infektionsbouillon, Durchgang 1 Erreger E. coli Datum Tiernummer (Gruppe) 02.10.2006 alle Tiere 09.10.2006 139(1),101(2) 140(3),132(4) 10.10.2006 137(2),136(3) 138(4),127(1) 11.10.2006 143(3),123(4) 103(1),114(2) 12.10.2006 107(4),105(1) 144(2),112(3) Indikation Erstinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Menge in KBE/ml ml/Tier 1,5×1011 1,1×1010 1,6×109 2,01×109 1,4×1010 2,8×109 5,7×1010 3,8×1010 7,1×1010 20 10 10 10 10 10 10 10 10 114 Anhang ___________________________________________________________________________ Anhang 3: Keimgehalt (Escherichia coli) pro ml Infektionsbouillon, Durchgang 2 Erreger E. coli Datum Tiernummer (Gruppe) 27.11.2006 alle Tiere 04.12.2006 387(2), 447(3) 385(1), 394(4) 05.12.2006 381(3), 445(2) x00(4), 391(1) 06.12.2006 384(4), 448(1) 393(3), 39x(2) 07.12.2006 431(4), 439(3) Indikation Erstinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Zweitinfektion Menge in KBE/ml ml/Tier 1,9×109 1,8×109 1,6×1010 1,3×109 1,5×109 1,5×109 7,8×108 1,7×109 Anhang 4: Botanische Zusammensetzung der Versuchsfutter Futterkomponenten Weizen Gerste Sojaextraktionsschrot Sojaöl Magermilchpulver Mineralfutter1 L-Lysin DL-Methionin Kalium-Diformiat Ameisen/Propionsäure 1 Kontrollfutter fein gemahlen bzw. Versuchsfutter grob gemahlen (%) Versuchsfutter + KDF (%) Versuchsfutter + freie Säuren (%) 40 34 20 1,1 2 2,2 0,5 0,2 0 38,8 34 20 1,1 2 2,2 0,5 0,2 1,2 39,1 34 20 1,1 2 2,2 0,5 0,2 0 0 0 0,9 Inhaltsstoffe (je kg, laut Hersteller): 215 g Ca, 80 g P, 50 g Na, 5 g Mg, 5000 mg Zn, 4000 mg Fe, 3000 mg Mn, 700 mg Cu, 50 mg J, 10 mg Se, 600000 IE Vit. A, 50000 IE Vit. D3, 1000 IE Vit. E, 50 mg Vit. B1, 200 mg Vit. B2, 100 mg Vit. B6, 1000 µg Vit. B12, 250 mg Pantothensäure, 500 mg Nikotinsäure, 2000 µg Biotin. 20 10 10 10 10 10 10 10 115 Anhang ___________________________________________________________________________ Anhang 5: Nährstoff- und Energiegehalte der im Versuch eingesetzten Mischfuttermittel in Versuchsdurchgang 1 und 2, soweit nicht anders angegeben in g/kg TS Feines Futter ohne Zusätze V1 V2 V3 V4 für die Zusammensetzung unterstellte Werte TS orginal (g) 905,80 961,10 888,50 888,60 911,00 2. TS (g) 910,00 983,90 894,80 892,80 920,38 Rohasche (g) 45,39 42,69 47,28 45,12 Rohprotein (g) 193,20 185,11 187,87 188,73 Rohfaser (g) 46,98 47,20 Rohfett (g) 35,14 35,30 NfE (g) 585,09 583,60 Stärke (g) 391,68 397,08 399,22 395,99 Zucker (g) 45,20 45,20 44,96 45,12 Calcium (g) 8,04 8,30 8,88 8,46 Phosphor (g) 5,21 5,23 Natrium (g) 1,22 1,23 Kalium (g) 7,76 7,76 Magnesium 1,73 1,73 8,60 (g) Schwefel (g) 2,46 Chlorid (g) 3,72 Kupfer (g) 17,93 Energie 2,43 18,54 2,42 17,06 2,44 3,60 3,74 17,22 17,69 (MJ 16,05 16,05 ME) pH – Wert 5,98 6,02 6,10 5,86 5,99 Pufferkapazität 340,56 326,09 490,00 405,00 390,41 (mmol pH 4) HCL, 116 Anhang ___________________________________________________________________________ V1 V2 V3 V4 für die Zusammensetzung unterstellte Werte Pufferkapazität 562,53 551,84 670,00 605,00 597,34 (mmol HCL, pH 3) Ameisensäure 0,11 0,15 0,10 0,15 0,13 (g) Propionsäure 0,53 0,53 (g) Feines Futter plus KDF V1 V2 V3 V4 für die Zusammensetzung unterstellte Werte TS orginal (g) 902,40 897,70 891,50 893,80 896,35 2. TS (g) 905,90 891,90 901,20 897,20 899,05 Rohasche (g) 51,10 49,44 46,00 51,21 Rohprotein (g) 184,29 193,75 192,70 190,25 Rohfaser (g) 41,24 41,40 Rohfett (g) 35,86 36,00 NfE (g) 589,91 588,70 Stärke (g) 401,16 402,10 387,68 396,98 Zucker (g) 42,92 45,04 46,00 44,65 Calcium (g) 8,84 8,14 8,52 8,57 Phosphor (g) 5,41 5,41 Natrium (g) 1,61 1,61 Kalium (g) 12,75 12,75 8,78 117 Anhang ___________________________________________________________________________ V1 V2 V3 V4 für die Zusammensetzung unterstellte Werte Magnesium (g) 1,70 Schwefel (g) 2,87 Chlorid (g) 3,78 Kupfer (g) 17,33 Energie (MJ ME) pH – Wert 1,70 2,57 12,95 2,35 2,60 3,62 3,50 3,63 12,81 14,42 14,38 15,89 5,35 15,89 5,36 5,37 5,29 5,34 Pufferkapazität (mmol HCL, 364,94 364,98 365,00 355,00 362,48 pH 4) Pufferkapazität (mmol HCL, 636,75 638,15 640,00 638,00 638,23 pH 3) Ameisensäure (g) Propionsäure (g) 8,34 0,35 7,95 7,72 8,21 8,06 0,35 118 Anhang ___________________________________________________________________________ Feines Futter plus freie Säuren V1 V2 V3 V4 für die Zusammensetzung unterstellte Werte TS orginal (g) 900,60 897,60 880,30 892,20 892,68 2. TS (g) 906,70 900,80 892,00 895,20 898,68 Rohasche (g) 46,59 45,82 44,34 46,54 Rohprotein (g) 187,63 193,20 184,45 188,43 Rohfaser (g) 41,42 41,70 Rohfett (g) 37,35 37,60 NfE (g) 587,61 585,50 Stärke (g) 403,28 402,35 406,24 403,96 Zucker (g) 44,88 45,07 45,73 45,23 Calcium (g) 8,15 8,48 8,94 8,45 Phosphor (g) 5,16 5,16 Natrium (g) 1,26 1,26 Kalium (g) 7,30 7,30 Magnesium 1,88 1,88 8,21 (g) Schwefel (g) 2,33 Chlorid (g) 3,83 Kupfer (g) 16,47 Energie (MJ 15,98 2,32 18,52 2,29 2,31 3,43 3,49 3,58 14,30 18,46 16,94 15,98 ME) pH – Wert 5,04 4,90 4,80 4,93 Pufferkapazität 261,37 228,26 280,00 283,00 (mmol HCL, pH 4) 4,92 263,16 119 Anhang ___________________________________________________________________________ V1 V2 V3 V4 für die Zusammensetzung unterstellte Werte Pufferkapazität 540,40 514,22 575,00 555,00 546,16 (mmol HCL, pH 3) Ameisensäure (g) 5,46 6,08 7,50 6,60 6,41 Popionsäure (g) 2,91 2,91 Grobes Futter ohne Zusätze V1 V2 V3 V4 für die Zusammensetzung unterstellte Werte TS orginal (g) 902,30 897,50 885,10 889,90 893,70 2. TS (g) 904,20 906,20 895,30 894,90 900,15 Rohasche (g) 43,91 42,95 40,80 44,15 Rohprotein (g) 182,52 163,81 182,00 176,11 Rohfaser (g) 38,72 38,80 Rohfett (g) 26,44 26,50 NfE (g) 610,71 610,10 Stärke (g) 432,04 444,59 402,64 426,42 Zucker (g) 42,05 40,75 43,04 41,95 Calcium (g) 8,45 8,02 8,39 8,17 Phosphor (g) 5,50 5,50 Natrium (g) 1,55 1,55 Kalium (g) 7,80 7,80 Magnesium 1,69 1,69 (g) 7,83 120 Anhang ___________________________________________________________________________ V1 V2 V3 V4 für die Zusammensetzung unterstellte Werte Schwefel (g) 3,16 Chlorid (g) 3,86 Kupfer (g) 13,82 Energie 2,39 14,19 2,20 13,65 2,58 3,71 3,79 16,07 14,43 (MJ 15,82 15,82 ME) pH – Wert 5,84 6,10 6,10 6,03 Pufferkapazität 312,30 366,10 400,00 383,00 (mmol 6,02 365,35 HCL, pH 4) Pufferkapazität 505,44 549,42 610,00 585,00 (mmol 562,47 HCL, pH 3) Ameisensäure 0,14 0,10 0,22 0,08 0,14 (g) Propionsäure (g) 0,45 0,45 121 Anhang ___________________________________________________________________________ Anhang 6: Prozentualer Anteil der Futterpartikel bei einer nassen Siebanalyse des in den zwei Versuchsdurchgängen eingesetzten Mischfutters fein ohne Zusätze fein + KDF fein + freie Säuren grob ohne Zusätze Siebgröße in mm 3,2 2,0 1,4 1,0 0,8 0,6 0,4 0,2 < 0,2 3,2 2,0 1,4 1,0 0,8 0,6 0,4 0,2 V1 Anteil in % 0,02 0,78 6,96 12,84 8,20 9,63 6,42 8,09 47,88 0,00 0,67 4,25 16,04 8,95 10,49 6,53 6,61 V2 Anteil in % 0,07 0,25 3,89 10,48 7,11 12,09 7,07 8,89 50,15 0,19 0,13 1,7 17,17 2,22 14,02 8,03 7,42 < 0,2 3,2 2,0 1,4 1,0 0,8 0,6 0,4 0,2 < 0,2 3,2 2,0 1,4 1,0 0,8 0,6 0,4 0,2 46,46 0,00 0,85 7,43 17,97 10,11 11,87 5,53 5,93 40,31 2,32 11,84 9,72 17,00 3,28 8,93 4,70 4,18 49,12 0,31 0,49 5,05 23,59 9,08 10,89 5,69 9,19 35,71 0,48 5,30 11,01 10,89 6,71 10,48 5,57 8,38 < 0,2 38,03 41,18 122 Anhang ___________________________________________________________________________ Anhang 7: Futteraufnahme je Gruppe in kg während der gesamten Versuchsdauer (je n = 5) in beiden Versuchsdurchgängen getrennt nach den Behandlungen V1 V2 fein ohne Zusätze 287 191 fein + KDF 316 179 fein + freie Säuren 338 252 grob ohne Zusätze 286 236 Anhang 8: Körpermasse (kg) der Ferkel während der verschiedenen Versuchsphasen in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Gewicht in kg Gruppe fein o. Zusätze fein + KDF fein + freie Säuren grob o. Zusätze Tiernr. Gewicht in kg T-8 Gewicht in kg T-3 Sektion = Tag 103 9,50 11,80 39,00 47 105 6,90 9,20 41,40 48 115 8,30 10,20 41,60 42 139 7,30 9,00 37,80 45 127 8,30 11,20 47,80 46 101 8,30 10,40 42,20 45 114 6,90 9,20 51,40 47 137 9,30 11,60 46,80 46 129 7,30 10,80 46,20 42 144 7,90 10,20 46,20 48 102 6,90 9,60 36,80 42 112 7,90 10,20 55,60 48 140/3 7,50 11,20 48,80 45 136 8,30 10,60 46,80 46 143 9,50 11,60 54,40 47 107 6,70 9,20 34,80 48 138 7,90 9,80 42,80 46 123 8,90 12,00 50,60 47 140/4 8,10 10,60 47,00 42 132 6,50 8,60 36,60 45 123 Anhang ___________________________________________________________________________ Versuchsdurchgang 2 Gewicht in kg Gruppe Tiernr. fein o. Zusätze fein + KDF fein + freie Säuren grob o. Zusätze Gewicht in kg T-8 Gewicht in kg T-3 Sektion = Tag 448 11,50 11,60 42,80 46 385 7,50 9,60 40,80 44 396 7,50 9,00 435 8,70 9,80 15,20 Euthanasie T21 17,80 Euthanasie T21 391 10,50 11,60 3xx 6,90 9,00 39x 6,50 8,00 403 9,90 10,60 29,40 41 387 10,90 11,80 40,20 44 445 12,50 12,20 42,80 45 393 7,50 9,40 37,80 46 381 9,90 10,60 36,60 45 447 10,10 10,40 40,40 44 439 10,50 10,40 35,00 47 432 11,90 10,60 35,60 41 394 7,50 9,40 40,20 44 431 7,90 8,80 47,20 47 x00 11,10 12,20 31,00 45 385 11,10 11,60 41,00 46 434 10,30 9,60 36,20 41 38,40 15,40 Euthanasie T21 46 21,80 Anhang 9: Qualitative Auswertung der Rektaltupfer hinsichtlich Escherichia coli Versuchsdurchgang 1 Gruppe fein o. Zusätze fein + KDF 45 nach Primärinfektion mit E. coli Tiernr. 03.10.2006 04.10.2006 05.10.2006 06.10.2006 07.10.2006 08.10.2006 139 1 1 1 1 1 1 105 1 1 1 1 1 1 115 1 1 1 1 127 1 1 1 1 1 1 103 1 1 1 1 1 1 144 1 1 1 1 1 1 114 1 1 1 1 1 1 101 1 1 1 1 1 1 137 1 1 1 1 1 1 129 1 1 1 1 124 Anhang ___________________________________________________________________________ Gruppe fein + freie Säuren grob o. Zusätze Tiernr. 03.10.2006 04.10.2006 05.10.2006 06.10.2006 07.10.2006 08.10.2006 143 1 1 1 1 1 1 112 1 1 1 0 1 0 140 1 1 1 1 1 1 102 1 1 1 1 1 1 1 1 1 1 136 107 1 1 1 1 1 1 132 1 1 1 1 1 1 138 1 1 1 1 1 1 123 1 1 1 0 1 1 140 1 1 1 1 Versuchsdurchgang 2 Gruppe fein o. Zusätze fein + KDF fein + freie Säure grob o. Zusätze 1 = positiv 0 = negativ nach Primärinfektion mit E. coli Tiernr. 28.11.2006 29.11.2006 30.11.2006 01.12.2006 02.12.2006 03.12.2006 448 1 1 1 1 1 1 385 1 1 1 1 1 1 391 1 1 1 0 1 0 490 1 1 1 1 445 1 1 1 1 0 1 39x 1 1 0 0 0 0 387 1 1 1 1 1 0 1 1 0 0 403 393 1 1 0 1 0 1 381 1 1 0 1 1 1 447 1 0 0 0 0 1 439 1 1 0 1 1 1 432 1 1 0 0 431 1 0 1 0 1 0 394 1 1 0 0 0 1 385 1 1 0 1 0 1 434 1 1 1 1 x00 1 1 0 0 1 1 125 Anhang ___________________________________________________________________________ Anhang 10: Futteraufnahme der einzelnen Tiere vor der Sektion sowie Füllung der Magen-DarmAbschnitte (g uS) in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Tiernr. FutterMagen aufnahme 139 105 115 127 103 692,00 437,00 965,00 1505,00 897,00 868,85 140,88 1191,11 1663,86 1301,33 144 114 101 137 129 1117,00 1582,00 565,00 448,00 657,00 1341,58 2187,95 468,27 252,93 891,26 143 112 140/3 102 136 826,00 1143,00 1054,00 472,00 844,00 1270,28 1388,75 1868,33 353,77 1136,33 107 132 138 123 140/4 679,00 661,00 938,00 1361,00 571,00 1065,43 625,41 1018,64 1768,39 692,40 Versuchsdurchgang 2 Tiernr. FutterMagen aufnahme 490 385 391 448 311,00 786,00 732,00 816,00 595,30 1197,21 886,91 897,67 403 387 445 39x 827,00 472,00 586,00 439,00 993,09 506,42 705,47 908,78 Dünndarm Caecum Colonanfang ColonendeRektum fein ohne Zusätze 658,39 118,52 134,87 96,78 805,63 218,23 445,25 151,03 962,36 118,10 302,01 153,11 882,29 242,91 535,97 161,91 613,35 151,02 315,17 80,54 fein + KDF 1052,09 230,46 308,57 124,32 1307,74 96,98 418,15 328,00 954,40 92,31 421,30 208,17 965,67 50,53 407,56 292,69 765,46 114,19 574,41 379,83 fein + freie Säuren 1209,50 34,47 745,50 605,37 1033,74 65,37 661,60 476,22 1018,20 51,77 626,05 272,16 877,89 238,74 685,25 275,43 852,23 85,23 582,63 288,98 grob ohne Zusätze 660,41 106,66 285,40 202,91 824,05 62,17 603,39 271,57 1026,01 150,21 534,83 161,39 911,66 225,55 488,62 518,48 869,54 258,01 563,70 587,83 Dünndarm Caecum Colonanfang ColonendeRektum fein ohne Zusätze 320,03 102,55 218,60 97,57 1367,47 127,15 607,65 331,13 512,96 207,67 393,98 394,19 997,29 100,03 552,15 278,92 fein + KDF 505,45 192,79 519,87 276,95 866,02 202,02 424,98 276,46 564,74 237,75 387,09 382,36 208,55 88,25 383,47 117,63 126 Anhang ___________________________________________________________________________ Tiernr. Futteraufnahme Magen 432 447 381 393 439 438,00 545,00 529,00 597,00 442,00 514,82 392,86 677,47 832,21 479,95 434 394 x00 385 431 779,00 1186,00 380,00 658,00 693,00 1067,73 1584,11 484,42 736,40 852,66 Dünndarm Caecum Colonanfang ColonendeRektum fein + freie Säuren 603,07 98,90 462,19 235,76 537,38 140,82 306,36 183,54 403,44 30,64 755,25 389,70 623,25 93,43 460,55 395,90 649,87 265,06 544,06 157,67 grob ohne Zusätze 591,75 169,28 472,71 259,38 763,80 257,48 678,25 241,81 291,58 120,74 613,74 142,83 748,03 273,39 469,70 215,37 569,72 49,80 565,65 265,02 Anhang 11: Futteraufnahme der einzelnen Tiere vor der Sektion sowie die Füllung der Magen-DarmAbschnitte (g TS) in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Magen Tiernr. Futteraufnahme 139 105 115 127 103 614,84 388,27 857,40 1337,19 796,98 236,88 8,65 208,16 586,74 388,85 144 114 101 137 129 995,81 1410,35 503,70 399,39 585,72 403,90 484,02 101,85 40,69 139,31 143 112 140/3 102 136 727,13 1006,18 927,84 415,50 742,97 153,48 123,27 374,79 46,56 192,88 Dünndarm Caecum Colonanfang ColonendeRektum fein ohne Zusätze 93,99 21,01 23,62 22,85 94,36 26,06 67,69 31,64 152,72 18,07 66,52 41,44 146,51 36,74 91,06 39,17 87,38 26,40 58,54 21,75 fein + KDF 146,79 21,01 59,17 30,52 162,06 26,06 81,02 89,66 117,64 18,07 56,77 43,16 103,07 36,74 64,31 85,23 87,78 26,40 90,15 91,38 fein + freie Säuren 156,64 3,88 119,07 166,15 142,11 7,72 100,99 86,55 151,45 7,53 104,96 79,79 107,86 29,95 110,14 71,18 108,03 10,09 97,40 74,38 127 Anhang ___________________________________________________________________________ Tiernr. Futteraufnahme 107 132 138 123 140/4 600,98 585,05 830,22 1204,62 505,39 Magen 291,87 182,34 290,56 482,12 86,14 Versuchsdurchgang 2 Tiernr. FutterMagen aufnahme 490 385 391 448 276,35 698,44 650,46 725,10 101,29 163,95 214,87 168,03 403 387 445 39x 739,17 421,87 523,77 392,38 177,54 67,04 114,87 159,46 432 447 381 393 439 390,78 486,25 471,97 532,64 394,35 42,50 44,67 193,44 172,22 57,39 434 394 x00 385 431 693,23 1055,42 338,16 585,55 616,70 345,61 465,17 44,45 101,72 176,52 Dünndarm Caecum Colonanfang ColonendeRektum grob ohne Zusätze 88,16 12,22 62,96 59,19 117,24 7,41 75,67 50,25 128,48 20,31 107,20 50,63 131,22 32,63 91,03 134,37 101,30 28,52 84,85 114,30 Dünndarm Caecum Colonanfang ColonendeRektum fein ohne Zusätze 43,22 13,69 42,87 29,43 134,44 13,20 118,01 94,38 63,88 19,13 58,56 103,45 113,99 10,27 88,95 75,61 fein + KDF 65,06 24,05 92,90 78,96 108,85 27,06 76,82 77,71 65,16 24,64 61,59 100,64 20,57 9,97 61,74 26,93 fein + freie Säuren 63,67 9,53 60,53 45,18 59,70 15,32 46,72 41,74 56,38 3,16 106,02 107,36 76,29 8,97 84,47 127,38 71,86 31,03 109,58 44,32 grob ohne Zusätze 83,87 21,23 87,78 68,48 98,61 32,31 120,99 70,85 42,84 12,01 81,54 37,28 90,65 33,45 96,57 58,89 61,32 5,13 72,55 44,94 128 Anhang ___________________________________________________________________________ Anhang 12: pH-Werte im Chymus der einzelnen Magen-Darm-Abschnitte der Versuchstiere in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Tiernr. Magen 139 105 115 127 103 5,36 3,05 5,44 5,67 5,47 144 114 101 137 129 4,94 5,36 5,25 3,68 4,86 143 112 140/3 102 136 3,84 4,36 4,90 3,33 3,27 107 132 138 123 140/4 5,20 5,32 5,54 5,03 2,62 Versuchsdurchgang 2 Tiernr. Magen fein ohne Zusätze 490 5,23 385 4,93 391 5,36 448 5,11 fein + KDF 403 4,59 387 3,68 445 2,75 39x 4,74 Dünndarm Caecum fein ohne Zusätze 6,38 6,35 6,60 5,53 6,63 6,22 6,25 6,07 6,55 6,39 fein + KDF 6,47 5,58 6,49 5,95 6,64 5,93 6,36 6,37 6,19 6,04 fein + freie Säuren 6,10 5,90 6,68 5,54 6,80 6,08 6,06 5,60 6,81 5,65 grob ohne Zusätze 6,16 5,74 5,99 5,68 6,59 6,38 5,75 5,52 5,80 5,43 Dünndarm Caecum Colonanfang ColonendeRektum 5,68 5,76 6,96 6,14 6,28 6,45 6,25 7,07 7,00 7,35 6,13 5,86 5,99 6,37 6,34 7,02 7,27 6,45 6,71 7,04 5,93 5,63 6,13 5,76 5,83 6,63 6,10 7,19 6,53 6,83 6,65 5,71 6,28 5,88 5,82 7,05 6,16 6,82 6,94 6,38 Colonanfang ColonendeRektum 6,84 6,47 6,49 6,23 6,10 6,32 6,41 6,09 6,89 6,80 6,28 6,05 7,33 7,25 6,94 7,12 6,91 6,62 6,92 7,09 5,54 6,08 6,12 6,48 5,74 6,48 5,97 6,02 7,09 6,75 6,92 6,21 129 Anhang ___________________________________________________________________________ Tiernr. Magen 432 447 381 393 439 2,77 2,30 5,33 5,11 2,32 434 394 x00 385 431 5,77 5,17 3,91 5,36 4,21 Dünndarm Caecum fein + freie Säuren 6,40 5,93 6,99 6,06 7,13 6,68 6,92 6,05 6,47 5,61 grob ohne Zusätze 6,78 6,09 6,68 5,79 6,70 6,18 6,92 6,23 5,64 5,55 Colonanfang ColonendeRektum 6,03 6,02 6,50 6,47 6,35 6,64 6,65 6,90 7,07 6,81 6,65 6,00 6,38 6,57 5,48 6,97 7,04 7,27 6,94 5,82 Anhang 13: TS-Gehalte des Chymus in den einzelnen Magen-Darm-Abschnitten (g/kg uS) der Versuchstiere in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Tiernr. Magen 139 105 115 127 103 272,64 61,39 174,76 352,64 298,81 144 114 101 137 129 301,06 221,22 217,50 160,89 156,31 143 112 140/3 102 136 120,82 88,76 200,60 131,62 169,74 Dünndarm Caecum fein ohne Zusätze 142,76 177,27 117,13 119,21 158,69 152,99 166,06 151,27 142,46 174,81 fein + KDF 139,52 116,62 123,92 132,54 123,26 90,27 106,73 101,23 114,67 125,34 fein + freie Säuren 129,51 112,45 137,47 118,07 148,74 145,36 122,86 125,47 126,76 118,38 Colonanfang ColonendeRektum 175,16 152,03 220,25 169,90 185,75 236,06 209,50 270,63 241,95 270,10 191,76 193,75 134,76 157,80 156,94 245,46 273,35 207,35 291,21 240,58 159,72 152,65 167,65 160,73 167,17 274,46 181,74 293,18 258,42 257,38 130 Anhang ___________________________________________________________________________ Tiernr. 107 132 138 123 140/4 Magen 273,95 291,56 285,24 272,63 124,41 Versuchsdurchgang 2 Tiernr. Magen 490 385 391 448 170,15 136,94 242,27 187,18 403 387 445 39x 178,78 132,39 162,83 175,47 432 447 381 393 439 82,56 113,71 285,54 206,94 119,58 434 394 x00 385 431 323,69 293,65 91,75 138,13 207,02 Dünndarm Caecum grob ohne Zusätze 133,50 114,60 142,27 119,21 125,22 135,19 143,93 144,65 116,50 110,54 Dünndarm Caecum fein ohne Zusätze 135,06 133,49 98,31 103,84 124,53 92,14 114,3 102,68 fein + KDF 128,72 124,74 125,69 133,96 115,38 103,65 98,64 112,98 fein + freie Säuren 105,58 96,37 111,09 108,8 139,76 102,98 122,41 95,99 110,57 117,05 grob ohne Zusätze 141,74 125,43 129,11 125,5 146,91 99,44 121,19 122,34 107,63 103,08 Colonanfang ColonendeRektum 220,60 125,41 200,43 186,31 150,52 291,73 185,02 313,73 259,17 194,45 Colonanfang ColonendeRektum 196,09 194,2 148,64 161,1 301,62 285,02 262,43 271,09 178,69 180,77 159,03 161,01 285,09 281,08 263,21 228,97 130,96 152,49 140,38 183,41 201,42 191,62 227,43 275,49 321,75 281,11 185,7 178,39 132,86 205,6 128,26 264,03 293,01 260,98 273,43 169,59 131 Anhang ___________________________________________________________________________ Anhang 14: Formiat-Gehalte (mg/l uS) im Magen- und Dünndarmchymus der Versuchstiere in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Versuchsdurchgang 2 Tiernr. Magen Dünndarm Tiernr. Magen Dünndarm fein ohne Zusätze 139 30,80 799,40 490 39,00 190,50 105 13,75 630,90 385 1068,70 308,70 115 33,45 835,20 391 28,40 303,10 127 27,07 671,70 448 29,30 445,30 103 31,48 903,90 fein + KDF 144 2076,10 583,90 403 963,50 374,70 114 1802,70 895,70 387 574,20 590,60 101 1242,80 764,20 445 294,40 1237,10 137 436,30 705,30 39x 1123,60 72,10 129 977,60 257,60 fein + freie Säuren 143 894,40 378,60 432 173,20 293,70 112 911,60 487,10 447 91,70 660,10 140/3 1176,10 509,90 381 1558,50 787,90 102 12,55 130,60 393 1138,20 482,80 136 692,00 867,60 439 165,60 500,90 grob ohne Zusätze 107 30,50 996,90 434 32,20 195,70 132 30,90 113,80 394 26,13 554,70 138 22,01 948,20 x00 18,50 286,80 123 19,53 327,40 385 22,60 659,70 140/4 12,89 610,30 431 21,10 409,90 132 Anhang ___________________________________________________________________________ Anhang 15: Laktat-Gehalte (mmol/kg uS) im Magen-, Dünndarm- und Caecumchymus der Versuchstiere in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Tiernr. Magen Dünndarm 139 105 115 127 103 1,79 0,53 8,35 4,99 20,30 13,93 17,32 51,46 18,90 144 114 101 137 129 0,75 0,89 0,58 0,75 3,30 13,22 21,61 15,64 11,24 43,68 143 112 140/3 102 136 8,70 0,26 0,40 0,93 0,60 9,08 17,78 15,30 49,00 16,35 107 132 138 123 140/4 2,63 6,18 1,24 51,06 0,86 17,26 48,69 15,70 71,16 18,59 Caecum Versuchsdurchgang 2 Tiernr. Magen Dünndarm Caecum fein ohne Zusätze 490 0,06 385 0,03 391 0,10 448 0,15 fein + KDF 0,06 403 2,83 387 445 0,41 39x 0,08 fein + freie Säuren 3,77 432 8,28 447 1,08 381 35,63 393 6,44 439 grob ohne Zusätze 434 12,83 394 0,05 x00 14,69 385 0,08 431 1,12 0,34 2,58 2,02 17,65 17,90 27,30 18,69 0,97 2,59 2,61 5,00 0,62 0,09 0,27 0,49 12,74 10,71 12,90 7,39 4,36 0,36 0,11 0,46 0,16 0,42 10,22 10,07 9,16 4,80 5,12 0,18 5,62 2,35 1,57 0,48 4,20 29,23 17,96 24,46 5,83 14,51 7,01 4,00 4,34 2,69 0,08 1,31 6,07 133 Anhang ___________________________________________________________________________ Anhang 16: Flüchtige Fettsäuren (mmol/kg uS) im Magenchymus der Versuchstiere in Versuchdurchgang 1 und 2 Versuchsdurchgang 1 Tiernr. Essigs. Propions. 139 105 115 127 103 22,850 20,500 33,150 17,300 24,250 4,550 4,650 8,550 2,400 5,800 144 114 101 137 129 23,200 23,650 13,850 14,950 13,000 5,600 3,050 1,750 3,900 2,200 143 112 140 102 136 30,300 30,000 15,100 5,200 13,800 8,200 8,400 7,350 0,400 5,750 107 132 138 123 140 34,150 25,100 15,450 32,650 11,900 6,400 3,950 3,100 3,350 6,000 i-Butters. n-Butters. fein ohne Zusätze 0,000 1,600 0,000 0,800 0,450 2,750 0,000 0,950 0,000 2,200 fein + KDF 0,000 1,350 0,000 0,900 0,000 4,850 0,000 1,550 0,000 0,750 fein + freie Säuren 0,350 2,400 0,350 2,100 0,000 0,900 0,000 0,000 0,000 4,200 grob ohne Zusätze 0,000 0,250 0,250 1,650 0,000 1,050 0,000 0,900 0,000 0,950 i-Valerians. n-Valerians. 0,000 0,000 0,500 0,000 0,000 0,000 0,000 0,650 0,000 0,550 0,000 0,000 0,000 0,000 0,000 0,000 0,000 0,000 0,000 3,150 0,350 0,000 0,000 0,000 0,000 0,550 0,400 0,000 0,000 0,000 0,000 0,000 0,000 0,000 0,000 0,300 0,000 0,000 0,000 0,000 Versuchsdurchgang 2 Tiernr. Essigs. Propions. i-Butters. n-Butters. i-Valerians. n-Valerians. fein ohne Zusätze 490 15,210 2,050 0,600 3,600 0,000 0,000 385 15,400 3,800 0,000 0,950 0,000 0,000 391 35,400 9,700 0,000 1,600 0,000 0,450 448 18,550 3,600 0,000 0,850 0,000 0,000 fein + KDF 403 7,100 16,700 0,000 2,300 0,350 0,000 387 13,250 4,100 0,000 0,850 0,000 0,000 134 Anhang ___________________________________________________________________________ Tiernr. 445 39x 432 447 381 393 439 434 394 x00 385 431 Essigs. Propions. i-Butters. n-Butters. i-Valerians. n-Valerians. 27,400 5,400 0,350 2,400 0,350 0,550 18,500 5,900 0,000 0,950 0,000 0,000 fein + freie Säuren 17,950 5,250 0,000 2,100 0,000 0,600 15,800 4,250 0,000 1,250 0,000 0,000 21,150 12,900 0,000 1,400 0,000 0,550 12,750 9,900 0,000 0,650 0,000 0,450 16,750 4,150 0,000 0,600 0,000 0,000 grob ohne Zusätze 17,300 3,700 0,000 1,600 0,000 0,000 17,800 2,500 0,000 0,950 0,000 0,000 9,900 0,700 0,000 0,000 0,000 0,000 15,350 3,250 0,000 0,900 0,000 0,000 24,550 4,650 0,000 1,250 0,000 0,000 Anhang 17: Flüchtige Fettsäuren (mmol/kg uS) im Dünndarmchymus der Versuchstiere in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Tiernr. Essigs. 139 105 115 127 103 9,850 18,450 24,600 26,050 31,300 144 114 101 137 129 24,000 29,100 24,800 28,750 14,150 143 112 140 102 136 59,700 25,350 17,800 10,800 33,750 Propions. i-Butters. n-Butters. i-Valerians. n-Valerians. fein ohne Zusätze 0,600 0,000 0,600 0,000 0,000 1,100 0,000 0,400 0,000 0,000 2,600 0,000 0,900 0,000 0,000 1,100 0,000 0,500 0,000 0,000 1,450 0,000 2,200 0,000 0,000 fein + KDF 2,150 0,000 0,600 0,000 0,000 1,700 0,000 1,750 0,000 0,000 0,850 0,000 0,800 0,000 0,000 1,150 0,000 1,700 0,000 0,000 1,500 0,000 1,150 0,000 0,000 fein + freie Säuren 16,950 0,600 7,650 0,550 1,350 2,400 0,000 0,900 0,000 0,000 1,400 0,000 0,000 0,000 0,000 1,250 0,000 0,000 0,000 0,000 1,250 0,000 1,700 0,000 0,000 135 Anhang ___________________________________________________________________________ Tiernr. 107 132 138 123 140 Essigs. 29,850 10,050 36,550 21,400 27,550 Propions. i-Butters. n-Butters. i-Valerians. n-Valerians. grob ohne Zusätze 1,550 0,000 0,650 0,000 0,000 0,450 0,000 0,000 0,000 0,000 1,600 0,000 1,400 0,000 0,000 1,100 0,000 0,000 0,000 0,000 1,450 0,000 2,600 0,000 0,000 Versuchsdurchgang 2 Essigs. Propions. i-Butters. n-Butters. i-Valerians. n-Valerians. Tiernr. fein ohne Zusätze 490 18,250 0,950 0,000 0,850 0,000 0,000 385 13,700 0,000 0,000 0,000 0,000 0,000 391 22,850 2,250 0,000 0,000 0,000 0,000 448 22,150 2,500 0,000 0,850 0,000 0,000 fein + KDF 403 14,900 0,550 0,000 0,000 0,000 0,000 387 21,850 1,950 0,000 0,650 0,000 0,000 445 16,700 1,700 0,000 0,900 0,000 0,000 39x 10,750 2,400 0,000 0,000 0,000 0,000 fein + freie Säuren 432 18,400 3,700 0,000 1,000 0,000 0,000 447 14,150 0,600 0,000 0,450 0,000 0,000 381 39,850 10,300 0,000 3,000 0,000 0,900 393 17,900 1,900 0,000 0,450 0,000 0,000 439 17,700 1,350 0,000 0,450 0,000 0,000 grob ohne Zusätze 434 20,450 2,200 0,000 0,400 0,000 0,000 394 18,400 0,000 0,000 0,000 0,000 0,000 x00 10,650 1,150 0,000 0,000 0,000 0,000 385 17,950 0,700 0,000 0,400 0,000 0,000 431 16,500 1,200 0,000 0,000 0,000 0,000 136 Anhang ___________________________________________________________________________ Anhang 18: Flüchtige Fettsäuren (mmol/kg uS) im Caecumchymus der Versuchstiere in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 Tiernr. Essigs. Propions. i-Butters. n-Butters. i-Valerians. n-Valerians. fein ohne Zusätze 139 82,200 24,600 0,000 5,350 0,800 1,300 105 98,350 43,200 0,000 14,850 0,300 0,900 115 71,000 24,350 1,150 9,750 1,150 1,700 127 106,850 37,950 0,000 12,250 0,850 3,850 103 113,950 28,450 1,600 9,650 1,350 2,700 fein + KDF 144 130,250 34,150 1,150 10,750 0,550 2,500 114 107,550 24,000 0,000 9,200 0,350 0,950 101 93,300 31,850 0,000 11,800 0,450 0,900 137 87,650 24,900 0,000 4,900 0,850 1,850 129 45,400 22,550 0,000 12,000 0,000 3,150 fein + freie Säuren 143 92,800 13,800 0,000 10,600 0,350 1,500 112 78,300 32,250 0,000 7,500 0,000 0,500 140 112,400 39,900 0,000 12,650 1,100 2,150 102 88,600 47,500 0,000 12,750 0,000 0,650 136 109,250 40,500 0,000 12,800 0,000 0,750 grob ohne Zusätze 107 99,300 34,550 1,250 8,000 0,800 2,550 132 89,850 38,050 0,000 18,050 0,000 2,250 138 107,950 34,450 0,000 11,500 1,650 2,500 123 94,300 46,700 0,000 24,300 0,500 6,200 140 119,250 46,400 0,000 21,550 0,650 1,250 Versuchsdurchgang 2 Tiernr. Essigs. Propions. 490 385 391 448 84,100 96,200 65,200 70,800 32,850 27,150 26,750 34,650 403 387 445 66,350 100,250 59,250 36,150 40,250 20,200 i-Butters. n-Butters. fein ohne Zusätze 2,000 13,650 0,000 11,700 0,000 1,350 0,000 7,500 fein + KDF 0,000 9,350 0,000 15,000 0,000 5,250 i-Valerians. n-Valerians. 1,550 0,600 0,400 0,000 2,600 2,000 2,800 1,250 0,000 0,950 0,000 2,150 1,750 0,750 137 Anhang ___________________________________________________________________________ Tiernr. 39x 432 447 381 393 439 434 394 x00 385 431 Essigs. Propions. i-Butters. n-Butters. 45,200 33,250 0,000 7,450 fein + freie Säuren 52,800 22,400 0,000 6,550 93,200 43,900 0,000 12,100 52,800 17,650 0,750 6,250 89,900 31,500 0,800 7,500 99,450 36,350 2,050 14,300 grob ohne Zusätze 80,050 19,300 2,150 16,900 102,150 54,750 1,550 18,400 168,450 124,000 0,000 28,150 94,700 35,000 1,400 10,850 i-Valerians. n-Valerians. 0,350 3,450 0,000 0,000 0,650 0,350 0,950 1,150 1,800 1,400 1,050 2,800 1,450 1,100 0,000 1,050 4,700 6,350 8,300 2,950 Anhang 19: E. coli-Keimzahlen (KBE/g uS) im Magen-, Dünndarm- und Caecumchymus der Versuchstiere in Versuchsdurchgang 1 und 2 Tiernr. 139 105 115 127 103 144 114 101 137 129 143 112 140/3 102 136 107 Versuchsdurchgang 1 Versuchsdurchgang 2 Magen Dünndarm Caecum Tiernr. Magen Dünndarm fein ohne Zusätze 7 8 5,0 x 10 7,8 x 10 9,8 x 108 490 5,0 x 103 ≤102 8 8 9 7 1,6 x 10 1,9 x 10 1,3 x 10 385 2,7 x 10 7,1 x 107 8,25 x 103 5,5 x 103 1,6 x 104 391 2,6 x 107 6,8 x 108 1,8 x 108 2,5 x 109 8,1 x 109 448 2,1 x 107 1,0 x 109 7 7 9 2,5 x 10 8,9 x 10 2,3 x 10 fein + KDF 5 7 8,7 x 10 9,9 x 10 9,6 x 108 403 ≤102 ≤102 5 7 8 4 2,8 x 10 2,2 x 10 4,9 x 10 387 3,5 x 10 8,2 x 107 2,2 x 104 2,6 x 108 1,3 x 108 445 1,3 x 105 3,4 x 107 2,6 x 104 9,9 x 109 9,1 x 108 39x 1,4 x 106 1,1 x 106 3 6 6 1 x 10 1,6 x 10 4,2 x 10 fein + freie Säuren 2 8 ≤10 2,1 x 10 3,6 x 108 432 ≤102 ≤102 5 7 8 5 2,6 x 10 2,6 x 10 1,9 x 10 447 3,1 x 10 5,6 x 109 3,6 x 105 1,1 x 108 2,0 x 108 381 3,0 x 106 1,6 x 108 ≤102 2 x 103 8,3 x 103 393 2,4 x 106 3,8 x 107 4 6 9 3,5 x 10 4,6 x 10 2,8 x 10 439 8,9 x 105 1,4 x 108 grob ohne Zusätze 10 10 4,2 x 10 1,1 x 10 1,2 x 109 434 3,0 x 104 ≤102 Caecum 3,0 x 105 2,9 x 108 6,2 x 108 4,8 x 108 ≤102 1,3 x 108 1,8 x 108 5,5 x 107 ≤102 2,1 x 108 8,8 x 108 3,6 x 107 1,6 x 108 ≤102 138 Anhang ___________________________________________________________________________ Tiernr. Magen Dünndarm Caecum Tiernr. 132 6,2 x 105 3,0 x 107 1,6 x 109 394 7 10 11 138 1,4 x 10 1,8 x 10 1,0 x 10 x00 123 3,7 x 107 1,6 x 1011 1,1 x 109 385 2 5 5 140/4 ≤10 1,1 x 10 2,3 x 10 431 Magen Dünndarm 5,1 x 107 1,8 x 109 1,9 x 106 6,2 x 108 3,5 x 107 4,8 x 108 3,1 x 107 4,8 x 108 Caecum 4,5 x 108 1,8 x 108 2,9 x 108 1,6 x 108 Gelb unterlegte Tiere sind ohne E. coli-Zweitinfektion getötet worden. Anhang 20: Qualitative Auswertung der Rektaltupfer hinsichtlich Salmonella Derby in Versuchsdurchgang 1 und 2 Versuchsdurchgang 1 17 22 26 27 28 29 30 31 1 2 3 4 6 8 10 14 18 22 26 30 5 Tag 8 8 8 8 8 8 8 8 9 9 9 9 9 9 9 9 9 9 9 9 10 Monat Tag -8 -3 1 2 3 4 5 6 7 8 9 10 12 14 16 20 24 28 32 36 41 Versuch fein ohne Zusätze 139 1 1 2 2 2 2 2 1 2 2 1 2 1 2 2 1 1 1 1 1 1 105 1 1 2 2 2 2 2 2 2 2 2 2 2 2 2 1 1 2 2 1 2 115 1 1 0 0 0 1 1 1 1 2 1 1 1 1 1 1 1 1 1 1 1 127 1 1 0 0 0 1 1 1 1 2 1 2 1 1 1 1 1 1 1 1 1 103 1 1 0 0 0 1 1 1 2 2 2 1 1 2 2 1 2 2 1 1 1 fein + KDF 144 1 1 2 1 2 1 2 2 2 2 2 1 1 1 2 1 2 1 1 1 2 114 1 1 2 2 2 2 2 2 2 2 1 1 1 1 1 1 1 1 1 1 1 101 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 137 1 1 0 0 0 2 1 1 1 1 1 2 1 1 1 1 1 1 1 1 1 129 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 fein + freie Säuren 143 1 1 2 2 1 1 1 1 1 1 1 2 1 1 1 1 1 1 1 1 1 112 1 1 2 2 1 1 1 1 2 2 1 1 1 1 1 1 1 1 2 1 1 140 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 102 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 136 1 1 0 0 0 1 1 2 2 2 2 2 1 2 1 1 1 1 1 1 1 grob ohne Zusätze 107 1 1 2 2 1 2 2 1 2 1 1 1 1 1 1 1 1 1 2 1 1 132 1 1 2 2 2 1 2 1 1 1 1 2 2 1 1 1 1 1 2 1 1 138 1 1 0 0 0 1 1 1 1 2 1 1 1 1 1 1 1 1 1 1 1 123 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 140 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 139 Anhang ___________________________________________________________________________ Versuchsdurchgang 2 13 18 22 23 24 25 26 27 28 29 30 31 2 4 6 9 15 19 22 25 30 Tag 10 10 10 10 10 10 10 10 10 10 10 10 11 11 11 11 11 11 11 11 11 Monat Tag -8 -3 1 2 3 4 5 6 7 8 9 10 12 14 16 19 25 29 32 35 40 Versuch fein ohne Zusätze 435 1 1 2 2 2 2 2 2 2 2 2 2 2 2 2 2 Euthanasie 448 1 1 2 2 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 1 2 358 1 1 0 0 0 1 1 1 1 1 1 2 1 1 1 1 1 1 1 1 1 391 1 1 0 0 0 1 1 1 1 1 1 1 2 1 1 1 1 1 1 1 1 396 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 Euthanasie fein + KDF 3xx 1 1 2 2 2 2 2 2 2 2 2 2 2 2 1 1 Euthanasie 39x 1 1 2 2 2 1 2 1 2 1 1 2 2 2 2 1 1 1 1 1 1 387 1 1 0 0 0 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 403 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 445 1 1 0 0 0 1 1 1 1 1 1 1 2 1 1 1 1 1 1 1 1 fein + freie Säuren 393 1 1 2 2 1 1 2 2 1 1 1 2 2 2 2 2 1 1 1 1 1 381 1 1 2 2 2 2 2 1 2 2 2 2 1 2 2 2 1 1 1 1 1 447 1 1 0 0 0 1 1 1 1 1 1 2 1 1 1 2 1 1 1 1 1 439 1 1 0 0 0 1 1 2 1 1 1 1 1 1 1 2 1 2 1 1 1 432 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 grob ohne Zusätze 431 1 1 2 2 1 2 2 2 2 2 2 2 2 2 2 2 1 1 2 1 1 394 1 1 2 2 2 2 2 1 2 2 2 2 2 2 2 1 1 1 1 1 1 385 1 1 0 0 0 2 1 2 1 1 2 1 1 2 1 2 1 1 1 1 1 434 1 1 0 0 0 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 x00 1 1 0 0 0 2 1 1 1 1 1 1 1 2 1 2 1 1 1 1 1 gelb unterlegt: primär infizierte Tiere weiß unterlegt: Kontakttiere 1: Rektaltupfer Salmonellen-negativ 2: Rektaltupfer Salmonellen-positiv 0: es wurde kein Rektaltupfer entnommen 140 Anhang ___________________________________________________________________________ Anhang 21: Salmonellenbefunde der Organ- und Schleimhautproben der Versuchstiere in Versuchsdurchgang 1und 2 Versuchsdurchgang 1 Lnn. Tiernr. Tonsillen ileocaecales Magen1 Dünndarm1 Caecum1 fein ohne Zusätze 139 1 1 1 1 1 105 2 2 1 1 2 115 1 1 1 1 1 127 1 1 1 1 1 103 1 1 2 1 1 fein + KDF 144 2 1 1 1 1 114 2 1 1 1 2 101 1 1 1 1 1 137 1 1 1 1 2 129 1 1 1 1 1 fein + freie Säuren 143 2 1 1 1 2 112 2 2 1 2 2 140 1 1 1 1 1 102 1 1 1 1 1 136 1 1 1 1 1 grob ohne Zusätze 107 2 1 2 1 2 132 1 1 1 1 1 138 1 1 1 1 1 123 1 1 1 1 1 140 1 1 1 1 1 Versuchsdurchgang 2 Lnn. Tiernr. Tonsillen ileocaecales Magen1 Dünndarm1 Caecum1 fein ohne Zusätze 435 1 2 1 1 2 448 2 2 2 2 2 385 1 1 1 1 1 391 1 1 1 1 1 396 1 1 1 1 1 490 1 1 1 1 1 fein + KDF 3xx 1 1 1 1 2 39x 1 1 1 1 2 387 1 1 1 1 1 141 Anhang ___________________________________________________________________________ Tiernr. Tonsillen 403 1 445 1 393 381 447 439 432 1 1 1 1 1 431 394 385 434 x00 2 1 2 1 2 Lnn. ileocaecales Magen1 Dünndarm1 Caecum1 1 1 1 1 1 1 1 1 fein + freie Säuren 1 1 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 grob ohne Zusätze 1 2 2 2 1 1 2 2 1 2 2 2 1 1 1 1 1 1 1 2 1 = Salmonellen-negativ 2 = Salmonellen-positiv 1 = -Schleimhaut Anhang 22: Keimgehalt (Salmonella Derby) pro ml Infektionsbouillon, Durchgang 1 und 2 Erreger S. Derby S. Derby Datum 25.08.2006 = Durchgang 1 21.10.2006 = Durchgang 2 Tiernummer (Gruppe) 139(1),105(1),144(2),114(2), 143(3),112(3),107(4),132(4) 435(1), 448(1), 3xx(2), 39x(2) 393(3), 381(3), 431(4), 394(4) Menge in Indikation KBE/ml ml/Tier Infektion 2,7×107 10 Infektion 8,2×108 10 142 ___________________________________________________________________________ Danksagung Herrn Prof. Dr. J. Kamphues möchte ich herzlich für die Überlassung des interessanten Themas, die wissenschaftliche Betreuung und freundliche Unterstützung sowie das fortwährende Interesse an der Vollendung dieser Arbeit danken. Mein besonderer Dank gilt Marion Neu für die nette Zusammenarbeit und ihre Hilfsbereitschaft- durch sie wurde insbesondere die Versuchsdurchführung zu einer harmonischen und fröhlichen Zeit. Ich danke Frau Dr. V. Taube herzlichst für ihre immerwährende Unterstützung, ihre wertvollen Korrekturen und Anmerkungen und kompetente Hilfsbereitschaft in allen Belangen. Ich danke der Firma BASF-AG Ludwigshafen für die finanzielle Unterstützung dieser Arbeit. Ein ganz herzliches Dankeschön geht an die Mitarbeiter des Instituts für Tierernährung der Stiftung Tierärztliche Hochschule Hannover für das gute Arbeitsklima und die ständige Hilfsbereitschaft. Ganz besonders möchte ich mich bei Mike Patzer und Ulrike Liedtke bedanken für ihren humorvoller Umgang und immerwährende Unterstützung. Weiterhin danke ich Frau Dr. J. Verspohl und allen Mitarbeitern des Instituts für Mikrobiologie und Tierseuchen der Stiftung Tierärztliche Hochschule Hannover für ihre hilfsbereite Unterstützung in mikrobiologischen Anliegen. Ebenso danke ich Herrn Dr. M. Beyerbach und Galina Rechter aus dem Institut für Biometrie, Epidemiologie und Informationsverarbeitung der Stiftung Tierärztliche Hochschule Hannover für ihre Hilfe bei der statistischen Auswertung der Daten. Ich danke meiner Familie und meinen Freunden, die mich immer motiviert und unterstützt haben.