C - FH Dortmund
Werbung

Werkstoffe der Elektrotechnik
im Studiengang Elektrotechnik
- Stoffgemische -
Prof. Dr. Ulrich Hahn
WS 2008/2009
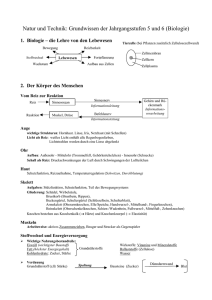
welche Stoffgemische gibt es?
technisch relevante Stoffgemische:
Lösung
Suspension
Legierung
Suspension
{Verbundwerkstoffe}
Mischung der reinen Stoffe (Komponenten)
im molekularen Maßstab
Tröpfchen /feste Teilchen in Flüssigkeiten
Mischung Metallen, Metall – Nichtmetall
(metallischer Charakter)
Mischung fein gemahlener Feststoffe,
gepreßt bei hohen Temperaturen (HIP)
makroskopisch strukturierte Gemische
Eigenschaften stark abhängig von:
Stoffgemische
Zusammensetzung
Druck
Temperatur
Design von Werkstoffen
2
Konzentration
Konzentration:=relativer
relativerAnteil
Anteileiner
einerKomponente
Komponenteam
amGemisch
Gemisch
Konzentration:=
Masseprozent
(Gewichtsprozent)
mA
C :=
(*100);
m A + mB
m
A
Molprozent
C Aν :=
mB
C :=
(*100);
m A + mB
m
B
C Am + C Bm = 1
(Atomprozent)
νA
(*100);
νA + νB
νB
νA + νB
(*100);
VB
C :=
VA + VB
(*100);
C Bν :=
Volumenprozent
VA
C :=
VA + VB
V
A
Stoffgemische
(*100);
V
B
3
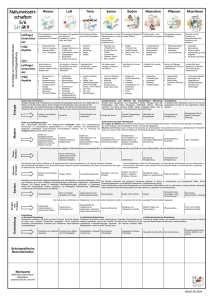
Legierungen
Stoffgemische, mindestens 1 Metall-Komponente
Metall-Eigenschaften
Komponente 1
Komponente 2
Komponente 3
Legierung
Phase(1)
(1)
Phase
Phase(2)
(2)
Phase
{K 1, K 2}
{K 2, K3}
Phase: Stoff/ ~gemisch mit gleichen physikalischen Eigenschaften
Aggregatzustand
Kristallstruktur
Magnetisierung
thermische Eigenschaften
Phasenausbildung abhä
abhängig von T, P, C Zustandsdiagramm
Stoffgemische
thermisches Gleichgewicht
4
Gibbssche Phasenregel
wieviel Phasen können gleichzeitig in einem
Stoffgemisch vorkommen (koexistieren)?
J. W. Gibbs:
p=k–f+2
P fest (Umgebung)
p=k–f+1
p: Zahl der koexistierenden Pasen
k: Zahl der Komponenten im Gemisch
f: Zahl der frei wählbaren physikalischen
Größen, z. B. T, P, C
Beispiel:
Einphasengebiete
Zweiphasengebiete
Dreiphasengebiete
Stoffgemische
5
Zustandsdiagramme: experimentelle Ermittlung
Bei welchem T, C, (P) liegen welche Phasen vor?
Strukturanalyse
Thermoanalyse
Abkühlkurven:
T(t) Verlauf eines Gemisches
Beispiel Wasser (reiner Stoff):
T
T
Dampf
100°C
f = k − p +1 = 0
Kondensation
Wasser
0°C
Stoffgemische
TUmw.= const
Erstarrung
Eis
t
1
C
6
Zustandsdiagramme: experimentelle Ermittlung
Beispiel Eisen (reiner Stoff):
T
Schmelze
1528°C
1401°C
270 J/g
10,5 J/g
δ - Fe (krz)
γ - Fe (kfz)
898°C
768°C
CurieCurie-T
β - Fe (krz)
28,5 J/g
7,5 J/g
α - Fe (krz)
t
Änderung der Kristallstruktur
Stoffgemische
Platzwechsel der Atome
Änderung der Packungsdichte
Volumenänderung d. Kristalls
7
binäre Legierungen (2 Komponenten)
vollständige Löslichkeit im festen Zustand
Bildung von (Substitutions-) Mischkristallen
beliebiger Konzentration
gleiche Kristallstruktur wie die Komponenten
Komponenten chemisch ähnlich
Elektronengase der Komponenten ähnlich
ähnliche Atomgrößen
Verzerrung des Gitters:
Verteilung der Atome:
statistisch
geordnet: meist
intermetallische Verbindungen
Stoffgemische
8
Zustandsdiagramm (vollst. Löslichkeit)
Abkühlkurve einer Cu – Ni Legierung:
T
1381°C
2 Knickpunkte
Beginn der Kristallisation
Schmelztemperatur
1310°C
vollständige Erstarrung
SchmelzSchmelztemperaturtemperaturintervall
t
konzentrationsabhängig
Lage der Knickpunkte: konzentrationsabhä
zwischen den Tschmelz der Komponenten
Stoffgemische
9
Zustandsdiagramm (vollst. Löslichkeit)
T
obere Knickpunkte: Liquiduslinie
oberhalb: Legierung vollständig flüssig
untere Knickpunkte: Soliduslinie
unterhalb: Legierung vollständig erstarrt
dazwischen:
Zweiphasengebiet
Linsenform: unterschiedliche Kohäsion
Stoffgemische
der Komponenten in Kristall & Schmelze
10
binäre Legierung: Zweiphasengebiet
Legierung, Zusammensetzung c0:
T
Zweiphasengebiet
Gibbs:
Gibbs: f = k − p + 1 = 2 − 2 + 1
T1
als freie Größe gewählt: T1
cK
c0
cS
c
⇒ Konzentrationen der Phasen fest
Liquiduslinie: cSchmelze
Soliduslinie: cKristall
Nebenbedingung: Gesamtkonz. c0
⇒ Mengen von Schmelze und Kristall
„Hebelgesetz“
Hebelgesetz“:
Stoffgemische
(c A0 − c AK ) ⋅ mK = (c AS − c 0A ) ⋅ mS
11
Konzentrationsverläufe im 2-Phasengebiet
Legierung mit c0: Abkühlen der Schmelze
T
Abkühlung auf T1
Beginn der Erstarrung
Kristalle: viel A-Komponente
T1
T2
T3
Abkühlung auf T2
2 Phasengebiet
A c c c0 = c c c
c0 = c
K K
1 2
S S
1 2
K
3
S
3
Bc
Abkühlung auf T3
Legierung vollständig erstarrt
Schmelze: viel B-Komponente
Konzentration cK ändert sich während der Abkühlung von T1 T3
Gleichgewichtskonzentration Diffusion
langsames Abkühlen homogene Konzentration
Stoffgemische
12
Konzentrationsverläufe im 2-Phasengebiet
schnelles Abkühlen inhomogene Konzentration im Kristall
Anwendung: Zonenschmelzen
Konzentrationsunterschiede
im 2-Phasengebiet ausnutzen
zur Reinigung
hochschmelzende Komp. Kristall
niedrigschmelzende Komp. Schmelze
Stoffgemische
13
Abweichungen von der Linsenform
größerer Unterschied der Komponenten
Behinderung der Mischkristallbildung
Legierung flüssig auch bei T < TAS, TBS
Liquidus- und Soliduslinie:
Minima
Abkühlkurve:
Plateau bei cMinimum
azeotropes Gemisch
„schmelzen ohne Änderung“
TMinimum < TAS, TBS
Stoffgemische
14
keine Löslichkeit im festen Zustand
Komponenten: stark unterschiedliche Kristallstrukturen
Kristallgemisch der Reinkristalle
Abkühlen der Schmelze:
Ausscheiden von Reinkristallen
höherschmelzende Komponente
Erstarren der Restschmelze
niedrigschmelzende Komponente
einheitliche Erstarrungstemperatur
Soliduslinie:
Stoffgemische
„L“ - Form
15
keine Löslichkeit im festen Zustand
(häufiger) Sonderfall: Reinkristalle gleichartige Nachbarn
Kristallbildung behindert
niedrigere Erstarrungstemp.
Minimum der Liquiduslinie
eutektisches System
eutektische Temperatur
eutektische Konzentration
dort gilt: f = 2 – 3 + 1 = 0
vollst. Erstarrung d. Schmelze
DasEutektikum
Eutektikumverhält
verhältsich
sichwie
wieein
einreiner
reinerStoff
Stoff
Das
Stoffgemische
TEutektikum < TAS, TBS
16
eutektisches System: Abkühlkurven
Überschreiten der Liquiduslinie:
Überschreiten der Soliduslinie:
Knickpunkte
Plateaus / Haltepunkte
Schmelze erstarrt immer bei Teutekt, ceutekt, unabhä
unabhängig von c0
Stoffgemische
17
eutektische Systeme: Kristallgefüge
Eutektikum
feinverteilte Kristalle
der Komponenten
Stoffgemische
untereutektische
Legierung
übereutektische
Legierung
große A-Kristalle,
Eutektikum
große B-Kristalle,
Eutektikum
18
begrenzte Löslichkeit im festen Zustand
Kristalle der Komponenten können begrenzt Fremdatome aufnehmen
Löslichkeitslinie
Mischkristall - Kristallgemisch
hohe Temperatur größere Löslichkeit
Unterschreiten d. Löslichkeit:
Ausscheiden der „überfl
„überflü
ssigen“
berflüssigen“
Fremdatome
sekundärer Mischkristall
Stoffgemische
19
Peritektische Systeme
unterhalb einer Grenztemperatur:
Zerfall einer Phase in 2 andere
Umwandlung einer Phase in eine andere
T
T
S
S+β
TP
β
S+ α
α
α +β
B c
t
c1 cP c2
T > TP: α
Grenztemperatur: peritektische Temperatur
Grenzkonzentration: peritektische Konzentration
A
Stoffgemische
T = TP, c > cP: β und α koexistieren
20
intermetallische Verbindungen
chemische Verbindung der Komponenten
AnBm
geeignete Kristallstruktur
AuSn2
AuSn4 Mg2Pb
stabiler als Legierungen anderer Konzentrationen
Stoffgemische
höherschmelzend
LiquidusLiquidus-, Soliduslinien:
Soliduslinien: Maximum
21
intermetallische Verbindungen
kongruent schmelzende Verbindung:
T
Schmelze Verbindung
1 Phase 1 Phase
Stoffgemische
Abkühlkurve ≙ reiner Stoff
Plateau
22
intermetallische Verbindungen
inkongruent schmelzende Verbindung:
Schmelze und Mischkristall Verbindung
2 Phasen 1 Phase peritektische
Temperatur
Stoffgemische
23
intermetallische Verbindungen
Kristalle der Verbindungen können Fremdatome aufnehmen:
Homogenitä
Homogenitätsbereiche
kongruent schmelzende
Verbindung γ
Stoffgemische
inkongruent schmelzende
Verbindung γ
24
Technisch relevante Legierungen
Fe - C
Stahl, magnetische Werkstoffe
Pb - Sn
Weichlot
Ag - Cu Hartlot
Cu - Zn
Messing
Cu - Sn
Bronze
Al - Cu
Duraluminium
Fe - Ni
weichmagnetische Werkstoffe
Stoffgemische
25
Ternäre Legierungen
Gemisch aus 3 Komponenten
Grundfläche:
Phasendiagramm dreidimensional
Konzentration
gleichseitiges Dreieck
Seiten: bilaterale
Konzentrationen
Beispiel:
50% A, 20% B, 30% C
Beachten: cA + cB + cC = 1
Höhe: Temperatur
Zweidimensionale Schnitte bei bestimmten Temperaturen
Stoffgemische
26
Stoffgemische
27
Ternäre Legierungen
Stoffgemische
28
Ternäre Legierungen
Einfluß auf die mechanischen Eigenschafen
Härten: Behinderung von plastischer Deformation
Behinderung der Bewegung von Versetzungen
Kaltverformung: Fehlstellen, Versetzungen erzeugen
MischkristallDeformation der Kristallstruktur, Anreicherung
härtung:
von Fremdatomen an Versetzungen
Disperionsstatistisches Verteilen kleiner
härtung:
Teilchen im Gefüge
Ausscheidung: sekundäre Mischkristalle
Gase (O2) harte Oxide hochwarmfest
Reaktion:
Umwandlung: Änderung der Kristallstruktur Martensit
Memorymetalle
Homogenisieren, Erweichen:
Stoffgemische
Ausheilen von Kristallfehlern
Glühen
Lösen dispergierter Teilchen Glü
29
Martensitumwandlung
Stahlhärten durch Abschrecken
hohe Temperatur:
Austenit (kfz)
C als Zwischengitteratome in
der Würfelmitte
Abschrecken:
Unterdrücken der Perlitbildung
aber: Entstehung von Ferrit (krz)
C auf den Würfelkanten
Zwischengitteratome dehnen das Gitter
Bildung von Martensitplatten
Martensitumwandlung:diffusionslose
diffusionslosePhasenumwandlung
Phasenumwandlungim
imFesten
Festen
Martensitumwandlung:
Stoffgemische
30
Formgedächtnislegierungen
Reversible Martensitumwandlung bei NENE-Metallen
Verformung in der Martensitphase
Erwärmung in die Austenitphase Zustand vor der
Verformung
Stoffgemische
31
Phasendiagramm Fe - C
Stoffgemische
32
Phasendiagramm Pb - Sn
Stoffgemische
33
Phasendiagramm Al -Cu
Stoffgemische
34
Phasendiagramm Cu - Zn
Stoffgemische
35
Phasendiagramm Cu - Sn
Stoffgemische
36