Prakt_Phasendiagramm - Universität Bayreuth
Werbung

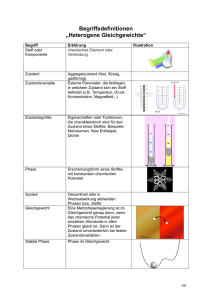
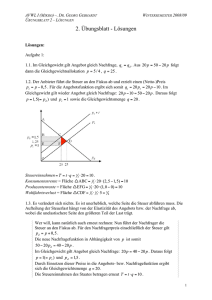
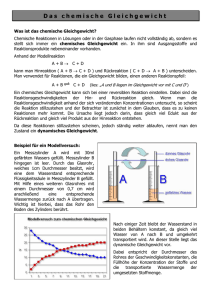
PRAKTIKUM G3 bzw. MW2 Das Phasendiagramm Wismut-Zinn 1 Zielsetzung In diesem Versuch soll mit Hilfe der Thermoanalyse das Zustandsdiagramm eines binären Legierungssystems erarbeitet und bestimmt werden. Hierfür dient im Wesentlichen das Messverfahren DSC (Differential-Scanning-Calorimetry). 2 Grundlagen Im Praktikum werden wir uns mit Schmelz- und Erstarrungsdiagrammen binärer Systeme befassen. Für die grundsätzlichen Betrachtungen ist es belanglos, ob das binäre flüssige System aus geschmolzenen Metallen, Salzen, Lösungen aus Salzen oder einer homogenen Mischung zweier Flüssigkeiten besteht. Analog zum Phasendiagramm eines Reinstoffs zeigt auch das Phasendiagramm einer Mischung an, welche Phase bei vorgegebenen Bedingungen (Temperatur und Konzentration) die thermodynamisch und kinetisch stabilste Phase ist. Bei der Abkühlung eines flüssigen binären metallischen Systems bestehen mehrere Möglichkeiten: Es können sich entweder reine Stoffe, Mischkristalle oder intermetallische Phasen abscheiden. Zum besseren Verständnis sollen aber vorerst grundlegender Begriffe und Regeln behandelt werden. 2.1 System, Phasen, Komponenten und Gleichgewicht Um Verwirrung zu vermeiden, muss man sich über die Bedeutung folgender Begriffe im Klaren sein. SYSTEM Ein System beschreibt einen Bereich, auf den die Aufmerksamkeit begrenzt wird. Es werden dabei offene, geschlossene und abgeschlossene Systeme unterschieden. Bei einem offenen System ist der Austausch von Energie und Materie mit seiner Umgebung möglich. Ein geschlossenes System kann keine Materie, jedoch Energie mit der Umgebung austauschen. Bei einem abgeschlossenen System kann weder Materie noch Energie ausgetauscht werden. PHASE Eine Phase kann als ein Teil eines Systems definiert werden. Der Begriff der Phase wird verwendet um zwei oder mehr Bereiche homogener Zusammensetzung und Eigenschaften voneinander zu unterscheiden. Beispielsweise kann beim Lösen von Salz Materie von der festen Salzphase in die flüssige, wässrige Phase oder ein Stoff beim Schmelzen von einer festen in eine flüssige Phase übergehen. Wechselwirken verschiedene Phasen miteinander, so Das Phasendiagramm Wismut-Zinn sind diese nur unter bestimmten Bedingungen stabil. Diese Bedingungen (meist Druck, Temperatur und Zusammensetzung) können in einem Phasendiagramm aufgetragen werden. KOMPONENTEN Die elementaren chemischen Bestandteile eines Systems aus dem die Phasen zusammengesetzt sind, heißen Komponenten. Die Komponenten eines Systems bestehen aus der Mindestanzahl chemischer Bauteile (Atome und Moleküle), die benötigt werden, um alle anwesenden Phasen vollständig anzugeben. GLEICHGEWICHT Bei einem Gleichgewicht unterscheidet man zwischen dem thermischen und dem chemischen Gleichgewicht. Bei einem thermischen Gleichgewicht heißt dies, dass alle Teile des Systems die gleiche Temperatur besitzen d.h. es gibt keinen Netto-Wärmetransport. Chemisches Gleichgewicht bedeutet, dass die Verteilung der Komponenten unter den Phasen eines Systems konstant sind d.h. es gibt keine Nettoänderung mit der Zeit. Bei Erreichen der Schmelztemperatur eines Stoffes diffundieren Atome durch die Kristallgrenzen, sowohl in den Kristall hinein als auch aus ihm heraus in die Schmelze. Ist die Diffusionsgeschwindigkeit eines Elementes X in den Kristall hinein und aus ihm heraus ungleich, stellt sich eine Änderung der Zusammensetzung jeder Phase mit der Zeit ein, eine Bedingung die als Ungleichgewicht bekannt ist. Stehen verschiedene Phasen miteinander in Wechselwirkung, so sind diese nur unter bestimmten Bedingungen stabil. 2.2 Die Gibbssche Phasenregel Die Gibbssche Phasenregel stellt die Frage, wie viele Phasen zu einem beliebigen Zustand miteinander im Gleichgewicht stehen können. Diese Frage widmete sich in den 70er Jahres des 19. Jahrhunderts J. Willard Gibbs, der Pionier der modernen Thermodynamik. Resultat seiner Arbeiten war die nach ihm benannte Formel, genannt die Gibbssche Phasenregel, die die Anzahl der Phasen (P) die in einem gemeinsamen Gleichgewicht koexistieren, durch die Anzahl der Komponenten (C) und der Anzahl der Freiheitsgrade (F) ausgedrückt wird. PF C2 (1) 3 Phasendiagramme im p-T und T-x Raum Ganz allgemein geben Phasendiagramme an, unter welchen Bedingungen, hinsichtlich des Druckes, der Temperatur oder der Zusammensetzung, eine bestimmte Phase einer Substanz die thermodynamisch und kinetisch stabilste Form hat. Die Gibbssche Phasenregel auf T-x (p = const.) Diagramme angewendet wird auch gekürzte Phasenregel genannt und lautet: P F C 1 -2- (2) Das Phasendiagramm Wismut-Zinn 3.1 Einkomponentensysteme Die Linien zwischen zwei Phasen bezeichnet man auch als Phasengrenzlinien. Bei Einstoffsystemen zeigen sie denjenigen Druck und die Temperatur an, bei denen zwei benachbarte Phasen miteinander im Gleichgewicht stehen. Der Tripelpunkt wird auch als Dreiphasenpunkt bezeichnet und wird die Druck und Temperatur beschrieben an dem 3 Phasen eines Systems im Gleichgewicht sind (F=0). Der kritische Punkt ist der Zustand an dem die Unterschiede zwischen den beiden Aggregatzuständen von flüssiger und Gasphase aufhören zu existieren d.h. die strukturelle Abgrenzung zwischen flüssigen und Gaszustand verwindet und H2O liegt als eine einzelne homogene Phase vor, in der die Eigenschaften eines stark komprimierten Gases und einer überhitzten Flüssigkeit vereint sind. Dieser Zustand wird als überkritische Flüssigkeit bezeichnet. Bild 1: Phasendiagramm eines Einstoffsystems am Beispiel von Wasser 3.2 Binäre Phasendiagramme Die thermische Analyse erlaubt es, aufgrund von Temperatur-Zeit-Kurven Rückschlüsse auf Zustandsänderungen bei der Abkühlung bzw. Erwärmung von Metallen oder Legierungen zu ziehen. In Bild 0 ist das Zustandsdiagramm eines binären Legierungssystems aus den reinen Metallen A und B wiedergegeben, die im schmelzflüssigen Zustand vollständig ineinander löslich sind, im festen Zustand beidseitig eine begrenzte Löslichkeit besitzen (A-reicher Mischkristall und B-reicher Mischkristall ), und bei Abkühlung aus der Schmelze (S) in einem relativ breiten Konzentrationsbereich bei der eutektischen Temperatur TEu vollständig erstarren. TS,A ist der Schmelzpunkt des reinen Metalls A und TS,B der des reinen Metalls B. Anhand eines Zustandsdiagramms lässt sich das bei der thermischen Analyse angewandte -3- Das Phasendiagramm Wismut-Zinn Prinzip relativ einfach beschreiben. In den Zustandsdiagrammen von Zweistoffsystemen sind durch Grenzlinien die Temperatur-Konzentrations-Bereiche als Zustandsfelder voneinander abgegrenzt, in denen bestimmte Phasen (physikalisch und chemisch voneinander unterscheidbare Werkstoffzustände) vorliegen. Oberhalb der sogenannten Liquiduslinien a-e und e-h existiert das Legierungssystem einphasig im schmelzflüssigen Zustand. Die reinen Metalle A und B gehen unmittelbar bei TS,A bzw. TS,B, die Legierung mit der eutektischen Zusammensetzung cEu bei TEu aus der Schmelze in den festen Zustand über. Der Punkt e heißt eutektischer Punkt, die Strecke k-e-m eutektische Gerade (Eutektikale). Die durch a-k-e-a bzw. h-e-m-h begrenzten Bereiche sind Zweiphasengebiete, in denen neben der Schmelze S noch - bzw. -Mischkristalle vorliegen. Im Gebiet A-p-k-a-A existieren nur homogene Mischkristalle, im Gebiet B-q-m-h-B nur homogene -Mischkristalle. Bei den - bzw. Mischkristallen sind B- bzw. A-Atome auf regulären Gitterplätzen der reinen Komponenten A und B statistisch regellos verteilt (Substitutionsmischkristalle). Im Gebiet p-k-m-q-p liegen und -Mischkristalle nebeneinander vor. Die Konzentration der bei gegebener Temperatur in zweiphasigen Gebieten miteinander im Gleichgewicht befindlichen Phasen ergeben sich aus den Schnittpunkten der Geraden T = konst. (Konoden) mit den Begrenzungslinien der Zweiphasengebiete. Die dabei im Gleichgewicht befindlichen Massenanteile der Phasen berechnen sich mit Hilfe des Hebelgesetzes. Betrachtet man beispielsweise die Legierung mit der Konzentration c1 an B-Atomen, so entstehen aus dieser beim Erreichen der Liquiduslinie a-e im Punkte b die ersten -Mischkristalle mit einer dem Punkte b´ entsprechenden Konzentration an B-Atomen. Nach Absenkung der Temperatur auf den Punkt * befinden sich -Mischkristalle mit einer dem Punkte c´ und Schmelze mit einer dem Punkt c entsprechenden Konzentration an B-Atomen miteinander im Gleichgewicht. Ist m der Massenanteil des -Mischkristalls und mS der Massenanteil der Schmelze, so gilt m α c c1 l S . m S c1 c l α (3) lS und l sind (vgl. oberen Teil von Bild 0) die Hebelarme des zweiseitigen Hebels mit dem Auflager * bei der Konzentration c1, an dessen Enden c´ und c man sich die Massenanteile m und mS der Phasen vorzustellen hat. Da für die Gesamtmasse der betrachteten Legierung die Bedingung m m α mS (4) erfüllt sein muss, folgt mit l = l + lS = c – c´ aus Gl. 1 und 2 mα lS m l -4- (5) Das Phasendiagramm Wismut-Zinn bzw. mS lα m l (6) Der bei einer gegebenen Temperatur vorliegende relative Massenanteil einer Phase verhält sich also wie der abgewandte Hebelarm zur Gesamtlänge des zweiseitigen Hebels. Nach Erreichen der Konode d´-d liegt demnach für die betrachtete Legierung die gesamte Legierungsmasse (lS = 1) als -Mischkristall vor. Analoge Überlegungen gelten für die anderen Zweiphasengebiete des Zustandsdiagramms. Bild 2: Binäres Zustandsdiagramm mit vollständiger Löslichkeit im flüssigen und beidseitig begrenzter Löslichkeit im festen Zustand 3.3 Ermittlung von binären Phasendiagrammen Für die Legierung der Konzentration c1 kann mit Hilfe der thermischen Analyse die Lage der Punkte b und d´ leicht ermittelt werden. Bei Abkühlung aus dem schmelzflüssigen Zustand zeigt die Temperatur-Zeit-Kurve (vgl. Bild 0) zunächst einen kontinuierlichen exponentiellen Abfall, der von der spezifischen Wärme und der Masse der Legierung sowie den Umgebungsbedingungen abhängt. Wird die Liquiduslinie bei b erreicht, so bewirkt die -5- Das Phasendiagramm Wismut-Zinn Bildung der -Mischkristalle mit der Konzentration b´ an B-Atomen, dass die zugehörige Schmelze reicher an B-Atomen wird und deshalb ihre Erstarrungstemperatur absenkt. Aufgrund der bei der Kristallisation frei werdenden Erstarrungsenthalpie verläuft die Temperatur-Zeit-Kurve der Legierung somit nach Unterschreiten der Liquiduslinie flacher als im einphasigen Schmelzbereich, und es tritt ein Knickpunkt im Kurvenverlauf auf. Mit weiter abnehmender Temperatur nimmt sowohl die Konzentration der Restschmelze als auch die der -Mischkristalle an B-Atomen zu. Der noch flüssige Massenanteil der Legierung wird kleiner, der kristallisierte entsprechend größer. Da die Erstarrung der Schmelze beim Erreichen der Konode d´-d abgeschlossen ist (d´ liegt auf der sogenannten Soliduslinie), wird bei dieser Temperatur ein weiterer Knickpunkt beobachtet. Danach erfolgt die Abkühlung auf Raumtemperatur kontinuierlich. Für den eben beschriebenen Sachverhalt sind in Bild 0 Temperatur-Zeit-Kurven für die reinen Metalle A und B sowie für die in Bild 0 vermerkten Legierungen mit den Konzentrationen c2, cEu, c3 und c4 aufgezeichnet. Bild 3: Abkühlungskurven für die reinen Metalle und fünf Legierungen des Zustandsdiagramms Die reinen Metalle A bzw. B ergeben als Folge der bei den Schmelztemperaturen TS,A bzw. TS,B beim Erstarren frei werdenden Kristallisationswärme (Erstarrungsenthalpie) Kurven mit sog. Haltepunkten. Für Legierungskonzentrationen, die zwischen den Begrenzungspunkten der eutektischen Geraden k-e-m liegen, gelten – mit Ausnahme der eutektischen Zusammensetzung cEu – nach Unterschreiten der Grenzlinie a-e und e-h zunächst die gleichen Überlegungen wie für die Legierung mit der Konzentration c1. Kurz vor Erreichen der eutektischen Temperatur TEu liegen aber in allen Fällen neben - bzw. -Mischkristallen unterschiedlich große Mengenanteile an Schmelze mit der Konzentration cEu vor, die sich nach weiterer Temperatursenkung bei T = TEu gemäß -6- Das Phasendiagramm Wismut-Zinn S αβ (7) eutektisch umwandeln. Das Erreichen der Eutektikalen macht sich also bei diesen Legierungen als Haltepunkt in den T-t-Kurven bemerkbar. Aus der Schmelze der Legierung mit der Konzentration c2 bilden sich z.B. zunächst -Mischkristalle. Bei Erreichen einer wenig über TEu liegenden Temperatur besteht Gleichgewicht zwischen -Mischkristallen mit einer dem Punkt k entsprechenden Konzentration an B-Atomen und Restschmelze, die praktisch die eutektische Konzentration an B-Atomen besitzt. Absenken der Temperatur auf T = TEu führt zur eutektischen Reaktion der Restschmelze gemäß Gl. 1. Eine eutektische Legierung der Konzentration cEu erstarrt dagegen direkt als heterogenes Gemenge aus - und -Mischkristallen bei der Temperatur TEu. Die entsprechende Abkühlungskurve (cEu in Bild 0) zeigt daher, wie bei reinen Metallen, nur einen Haltepunkt. Bei der Legierung der Konzentration c3 sind die Vorgänge bei der Abkühlung zwischen f und l ähnlich der Legierung mit der Konzentration c2 zwischen d und r. Zunächst bilden sich bei Überschreiten der Linie e-h B-reiche Mischkristalle, so dass die Schmelze B-ärmer wird. Die Restschmelze reichert sich bei weiterer Absenkung der Temperatur solange an A an, bis sie die eutektische Zusammensetzung erreicht. Dementsprechend enthält die zugehörige Abkühlungskurve (c3 in Bild 0) neben einem Knick bei der Temperatur f noch einen Haltepunkt bei der eutektischen Temperatur TEu. Bei der Konzentration c4 schließlich finden zwischen g-n ähnliche Erstarrungsvorgänge statt wie für c1 auf der A-reichen Legierungsseite zwischen b-d´. Nach unterschreiten der Grenzlinie m-h liegen nur noch homogene -Mischkristalle vor. Wird die Gleichgewichtslinie m-q unterschritten, so bilden sich -Mischkristalle aus den B-reichen Mischkristallen. Die Legierung geht wieder in einen zweiphasigen Zustand mit heterogenem Gefüge über. Die Abkühlkurve c4 spiegelt diese Prozesse wider. 3.4 Bestimmung von Phasenübergängen mittels DSC Bei der Differential Scanning Calorimetry (DSC) wird eine Probesubstanz und eine Inertsubstanz mit einer bestimmten Heizrate (Abkühlrate) aufgeheizt (abgekühlt). Dabei werden Probe- und Inertsubstanz (bzw. ein leerer Tiegel) durch die Steuerung der Heizleistung stets auf gleicher Temperatur gehalten. Detektiert wird die Energie, die der Probesubstanz dabei mehr oder weniger zugeführt werden muss. Damit ist es möglich Umwandlungswärmen zu messen und den Schmelzpunkt bzw. Schmelzbereich festzulegen. -7- Das Phasendiagramm Wismut-Zinn Temperaturfühler Probesubstanz H1 H2 Hx: Heizelemente Inertsubstanz/ leerer Tiegel Registriereinheit Versorgungs-, Regelungs- und Verstärkungseinheit Bild 4: Schematischer Aufbau einer DSC. 3.5 Gefügebilder bei Systemen ohne Mischkristallbildung Als Gefüge beschreibt die Anordnung der Bestandteile aus Schmelzen entstandenen Stoffen wie Metallen, Legierungen oder Mineralien. Dabei wird zwischen dem Primärgefüge und dem Sekundärgefüge unterschieden. Der Begriff Gefüge wird auch als Mikrostruktur bezeichnet und umfasst das Gemenge der Kristallite (mikroskopisch kleine Kristalle), die auftretenden Phasen oder Defekte. Durch Beschreibung von Größe, Form und Anordnung der Kristallite sowie Verunreinigungen lassen sich umfangreiche Aussagen über den Temperaturzustand sowie über die chemische Zusammensetzung treffen. So sind die Kristalle eines Reinstoffes ungefähr gleich groß. Bei einer eutektikumsnahen Zusammensetzung bilden sich große Kristalle der Zusammensetzung A oder B mit dazwischenliegenden kleinen Kristallen der Zusammensetzung A und B. Das Gefüge eines Eutektikums zeigt gleichgroße Kristalle der Zusammensetzung A und B. Bild 5a: Reinstoff, Legierung mit Mischkristallbildung -8- Das Phasendiagramm Wismut-Zinn Bild 5b: eutektikumsnahe Zusammensetzung mit Primär-A-Kristallen (links) und Primär-BKristallen (rechts) Bild 5c: die eutektikale Zusammensetzung zeigt die A- und B-Kristalle in homogener Verteilung 4 Verwendete Materialien Wismut Wismut (oder Bismut, chem.: Bi) ist ein rötlich glänzendes, relativ sprödes Metall aus der 5. Hauptgruppe des Periodensystems. Bei Wismut handelt es sich um das Metall mit dem am stärksten ausgeprägten Diamagnetismus (äußere Magnetfelder stoßen Material ab) und mit der geringsten Wärmeleitfähigkeit. Flüssiges Wismut dehnt sich als einer der wenigen Stoffe beim Erstarren aus (Dichteanomalie). Zinn Zinn (chem.: Sn) ist ein niedrigschmelzendes Schwermetall aus der 4. Hauptgruppe. Bei Erwärmung verändert sich graues Zinn (α-Zinn), welches eine kubische Kristallstruktur hat, bei 13,2°C zu weißem Zinn (β-Zinn), welches in einer kubischen Kristallstruktur vorliegt. Die Phasenumwandlung von β-Zinn zu α-Zinn bei niedrigen Temperaturen wird auch Zinnpest genannt. -9- Das Phasendiagramm Wismut-Zinn 5 Aufgabenstellung In diesem Versuch werden verschiedene Wismut-Zinn-Legierungen untersucht. Zum einen werden die Schmelzkurven einzelner Reinelemente, sowie die verschiedener Legierungen aufgenommen. Des Weiteren wird die Mikrostruktur der Legierungen unter dem Lichtmikroskop bestimmt. 1. Untersuchen Sie das Schmelzverhalten von reinem Wismut und Zinn mit Hilfe eines Thermoelements 2. Führen Sie DSC-Messungen an verschiedenen Wismut-Zinn Legierungen durch und werten Sie diese bezüglich des Schmelzverhaltens aus. 3. Untersuchen Sie die Mikrostruktur der verschiedenen Wismut-Zinn-Legierungen am Lichtmikroskop. 4. Stellen Sie mit Hilfe der gewonnenen Daten das binäre Phasendiagramm von WismutZinn auf. Verwenden Sie hierfür die Thermoelementmessungen, DSC-Messungen und die Informationen die Sie für die Legierungen am Lichtmikroskop erhalten haben. 6 Fragen zur Vorbereitung Erklären Sie die Funktionsweise der Differential-Scanning-Calorimetry (DSC) Erklären Sie folgende Begriffe: Stoff, Komponente, Phase, Legierung, Gefüge Rekristallisation Was ist die Gibbssche Phasenregel und was beschreibt sie? Was ist ein invariantes oder univariantes Gleichgewicht? Was ist ein Tripelpunkt? Zeichnen Sie Phasendiagramme mit und ohne Mischkristallbildung Was ist ein Eutektikum? Was versteht man unter partielles Schmelzen? - 10 -