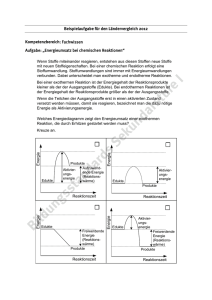
Übung 5. Rechnen mit mittleren Bindungsenthalpien (Tabelle in
Werbung

Übung 5. Rechnen mit mittleren Bindungsenthalpien (Tabelle in Kapitel 5, Seite 10) 1) Überlegen Sie sich, ob bei der industriellen Herstellung von elementarem Chlor (Cl2) das "Verbrennen" von Chlorwasserstoff unter energetischen Gesichtspunkten ein geeigneter Weg sein könnte. Ausgangsstoffe: HCl, O2; Produkte: Cl2, H2O. 2) Biogas. Bei der Erzeugung von "Biogas" wird organisches Material unter Sauerstoffausschluss durch Mikroorganismen in Kohlendioxid und Methan aufgespalten. Das Methan kann als Energieträger verwendet werden. Wie sieht bei diesem Prozess die Energiebilanz aus? Betrachten Sie als Modellreaktion die Umsetzung von Glukose in Kohlendioxid und Methan. 3) Verbrennung von Dioxin. "Dioxin" ist eine ökotoxikologisch äußerst bedenkliche Verbindung ("Seveso-Gift"). Dioxinhaltige Abfälle müssen in speziellen Öfen entsorgt (verbrannt) werden. Wie sieht die Energiebilanz aus? Annahme: Bei der Verbrennung entsteht Kohlendioxid und Chlorwasserstoff. Hinweis zum Lösen der Aufgaben; gehen Sie wie folgt vor: 1) Formulieren Sie für die drei Prozesse korrekte stöchiometrische Gleichungen (Erhaltungssätze beachten!) 2) Schätzen Sie die Reaktionswärme ab, indem Sie die Edukte vollständig in einzelne Atome zerlegen und dann aus den Atomen die Produkte bilden. Verwenden Sie für diese beiden Teilschritte mittlere Bindungsenthalpien, und verrechnen Sie anschließend die beiden Energiebeträge. H Cl Cl H C O HO C Cl C C C C C C C C C O H C H Dioxin CH2 O HC CH HC Cl HO OH CH CH OH Glukose OH Lösungen 1) 4 HCl + O2 2 Cl2 + 2 H2O. Energiebilanz. Zerlegung der Edukte in Atome 4 × 429 kJ = 495 kJ = 4 H-Cl 1 O=O 1716 kJ 495 kJ 2211 kJ Bildung der Produkte aus den isolierten Atomen 2 × -224 kJ = -448 kJ 4 × -463 kJ = -1852 kJ 2 Cl-Cl 4 O-H -2300 kJ Fazit: Die Reaktion ist exotherm. Pro mol Cl2 wird eine Reaktionswärme (-ΔH) von 44.5 kJ frei. 2) C6H12O6 3 CO2 + 3 CH4. Energiebilanz. Zerlegung der Edukte in Atome 5 C-C 5 O-H 7 C-O 7 C-H 5× 5× 7× 7× 345 kJ 463 kJ 358 kJ 416 kJ = = = = 1725 kJ 2315 kJ 2506 kJ 2912 kJ 9458 kJ Bildung der Produkte aus den isolierten Atomen 6 C=O 12 C-H 6 × -803 kJ = 12 × -416 kJ = -4818 kJ -4992 kJ -9810 kJ Fazit: Die Reaktion ist exotherm. Pro mol Methan wird eine Reaktionswärme (-ΔH) von 117 kJ frei. 3) C12H4Cl4O2 + 11 O2 12 CO2 + 4 HCl. Energiebilanz. Zerlegung der Edukte in Atome 12 C-C (a) 4 C-Cl 4 C-H 4 C-O 11 O=O 12 × 4× 4× 4× 12 × 518 kJ 327 kJ 416 kJ 358 kJ 495 kJ = 6216 kJ = 1308 kJ = 1664 kJ = 1432 kJ = 5445 kJ 16'065 kJ Bildung der Produkte aus den isolierten Atomen 24 C=O 4 Cl-H 24 × -803 kJ = -19272 kJ 4 × -429 kJ = -1716 kJ -20'988 kJ Fazit: Die Reaktion ist exotherm. Pro mol Dioxin wird eine Reaktionswärme (-ΔH) von 4923 kJ frei.