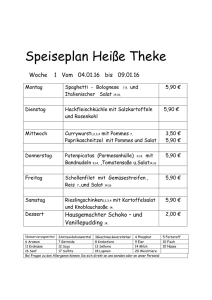
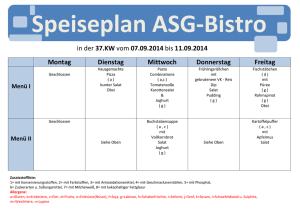
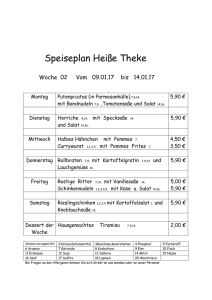
Aus dem Institut für Pflanzenernährung Fachgebiet
Werbung

Aus dem Institut für Pflanzenernährung Fachgebiet Pflanzenernährung (Düngung) Prof. Dr. Volker Römheld und dem Institut für Botanik Fachgebiet Biodiversität und pflanzliche Interaktion Prof. Dr. Otmar Spring Das Potenzial von Falschem Mehltau als Quelle von Omega-3-Fettsäuren für die menschliche Ernährung Dissertation zur Erlangung des Grades eines Doktors der Agrarwissenschaften (Dr. sc. agr.) vorgelegt der Fakultät Agrarwissenschaften Universität Hohenheim von Ann-Marie Anderle aus Mutlangen 2009 Die vorliegende Arbeit wurde am 10. Juli 2009 von der Fakultät Agrarwissenschaften der Universität Stuttgart-Hohenheim als „Dissertation zur Erlangung des Grades eines Doktors der Agrarwissenschaften“ angenommen. Tag der mündlichen Prüfung: 30. Juli 2009 1. Prodekan: Prof. Dr. W. Bessei 1. Prüfer (Betreuer): Prof. Dr. O. Spring 2. Prüfer (Mitberichter): Prof. Dr. V. Römheld 3. Prüfer: Prof. Dr. K. Haas Eingereicht am 28.01.2009 Mündliche Prüfung am 30. Juli 2009 Für meine Familie Danksagung Ich bedanke mich ganz herzlich bei meinen 3 hervorragenden Betreuern, die sich gegenseitig optimal ergänzten. Zuallererst danke ich Herrn Professor Spring für die Annahme als Doktorandin und die Vergabe des höchst interessanten Themas. Er stand mir äußerst zuverlässig mit wissenschaftlichem und menschlichem Rat zur Seite. Er war der Hauptbetreuer und Förderer dieser Arbeit und führte alle notwendigen Korrekturen durch. Ganz herzlich bedanke ich mich auch bei Herrn Professor Haas für das stets entgegengebrachte Vertrauen, das freundschaftliche Arbeitsklima, seine praktischen Tipps sowie für die zur Verfügung gestellten Sachmittel und Freiräume für meine Arbeiten am GC. Herrn Professor Römheld danke ich ganz herzlich für seine Tätigkeit als Gutachter, die wissenschaftlichen Anregungen, seine stets motivierende Art und für die zur Verfügung gestellte Klimakammer während meiner Versuche am Institut für Pflanzenernährung. Mein Dank gilt auch besonders meinen Projektpartnern im „Nahrungskettenversuch“. Bei Herrn Professor Grashorn bedanke ich mich sehr herzlich für die Kooperation bei der Umsetzung der Idee. Ebenso danke ich seinen Mitarbeiterinnen und Mitarbeitern vom Unteren Lindenhof. Herrn Bässler von der Versuchsstation für Gartenbau danke ich für die Überlassung der Versuchsfläche für die Salatanzucht, Frau Tina Schuster und dem gesamten Gärtnerteam danke ich herzlich für ihre Arbeit und die sehr gute Zusammenarbeit während der gesamten Zeit bis zur Ernte. Herrn Blauhorn von der Staatsschule für Gartenbau danke ich für die vielen Fachgespräche über Salat und die Überlassung des infizierten Roten Eichblatt Salats für Futterzwecke. Ich bedanke mich herzlich bei Herrn Professor Müller und Herrn Dr. Heindl für die Benutzung des Hordentrockners am Institut für Agrartechnik. Ganz besonders bedanke ich mich bei Frau Amberg für die Trocknungsprozessführung und ihre engagierte Hilfe. Ich bedanke mich recht herzlich bei allen Kolleginnen und Kollegen der Institute für Botanik und für Pflanzenernährung, ganz besonders danke ich Herrn Reinhard Zipper, der mir stets zuverlässig mit praktischen Ratschlägen zur Seite stand und Frau Dr. Kania danke ich für die vielen Fachgespräche. Vor allem danke ich aber meinem Mann Marc Anderle, der psychologisch und materiell stets hinter mir stand und mich stets in Allem förderte. Ich danke meiner ganzen Familie, die mich immer bei meinen Vorhaben unterstützte. Inhaltsverzeichnis 1. Einleitung ........................................................................................................... 1 1.1. Omega-3-Fettsäuren in der menschlichen Ernährung und Nahrungsmittelproduktion ................................................................................................... 1 1.1.1. Chemische Definition der n-3-Fettsäuren ............................................. 2 1.1.2. Die medizinische Wirkung der n-3-Fettsäuren...................................... 3 1.2. Natürliche Quellen von n-3-Fettsäuren ......................................................... 5 1.2.1. Öle Höherer Pflanzen ........................................................................... 6 1.2.2. Tierische Quellen ................................................................................. 7 1.3. Problematik natürlicher Quellen.................................................................... 8 1.4. Alternative Quellen für EPA und DHA........................................................... 8 1.4.1. Öle Niederer Pflanzen als alternative Quellen für EPA und DHA ......... 8 1.4.2.Transgene Pflanzen ............................................................................10 1.5. Problematik alternativer Quellen.................................................................10 1.6. Aktueller Stand der Forschung und Zielsetzung der Arbeit.........................11 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe ............................................................13 2.1. Materialien und Methoden ..........................................................................13 2.1.1 Infektionstechniken und Ernte .............................................................13 2.1.1.1. Keimlingsinfektion bei P. halstedii............................................14 2.1.1.2. Blattinfektion bei B. lactucae.......................................................... 15 2.1.1.3. Ernte und Lagerung von Sporangien und Pflanzenmaterial.....16 2.1.2. Aufbereitung der Fettsäuren für die GC-Analyse................................16 2.1.2.1. Extraktion der Fettsäuren ........................................................17 2.1.2.2. Säure-katalysierte Veresterung der Fettsäuren für die GCAnalyse ...................................................................................18 2.1.3. GC-FID Messtechnik ..........................................................................19 2.1.3.1. Kalibrieren des Messbereiches ...............................................19 2.1.3.2. Einspritztechnik/Probenaufgabe..............................................20 2.1.3.3. Säulen .....................................................................................20 2.1.3.4. Temperaturprogramme und Gassystem..................................22 2.1.4. Quantifizieren der FAMEs am GC-FID ...............................................23 2.1.5. DC-Technik.........................................................................................25 I 2.2. Ergebnisse..................................................................................................28 2.2.1. Qualitative Analyse der FS-Muster von P. halstedii und B. lactucae ..28 2.2.2. Lipidklassentrennung und FS-Zusammensetzung der einzelnen Lipidklassen.......................................................................................29 2.2.3. EPA-Konzentrationen von Sporangien und Wirtsgewebe ..................32 2.3. Diskussion ..................................................................................................35 2.3.1. Qualitative FS-Zusammensetzung von P. halstedii und B. lactucae ..35 2.3.2. Lipidklassenzusammensetzung..........................................................35 2.3.3. EPA-Konzentrationen in Sporangien u. infiziertem Pflanzengewebe .37 2.4. Schlussfolgerungen ....................................................................................39 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii .....40 3.1. Einleitung ....................................................................................................40 3.2. Materialien und Methoden ..........................................................................40 3.2.1. Artinternes Screening auf EPA-Gehalte in Sporangien ......................40 3.2.2. Erfassen besonders EPA-reicher Sonnenblumensorten/-linien..........42 3.2.3. Variation des Infektionsdrucks............................................................42 3.2.4. Variation des Stickstoffangebotes ......................................................43 3.2.4.1. Etablieren der Nährlösungskultur ............................................43 3.2.4.2. Wachstum und Gewichte.........................................................45 3.2.4.3. Infektion und Befallsgrad .........................................................46 3.2.4.4. Gesamt-N Bestimmung im Sonnenblumengewebe.................46 3.2.4.5. Analyse der FS-Gehalte im Stickstoff-Steigerungsversuch .....48 3.2.5. Statistische Auswertung .....................................................................49 3.3. Ergebnisse..................................................................................................51 3.3.1. EPA-Gehalte verschiedener Sporangienstämme von P. halstedii......51 3.3.2. Besonders anfällige Sonnenblumensorten und –linien.......................51 3.3.3. Variation des Infektionsdrucks............................................................53 3.3.4. Variation des Stickstoffangebots ........................................................55 3.3.4.1. Wachstum und Gewichte.........................................................55 3.3.4.2. Infektion und Befallsgrad .........................................................57 3.3.4.3. Gesamt-N-Gehaltsbestimmung in Sonnenblumenpflanze.......58 3.3.4.4. EPA-Konzentrationen bei 3 N-Stufen ......................................59 3.4. Diskussion ..................................................................................................62 3.4.1. Optimierungspotenzial durch die Selektion von Pathogenstämmen...62 II 3.4.2. Optimierungspotenzial durch die Selektion von Wirtspflanzen ...........62 3.4.3. Optimierungspotenzial durch variierten Infektionsdruck .....................63 3.4.4. Optimierungspotenzial durch variierte N-Düngung.............................63 3.5. Schlussfolgerungen ....................................................................................66 4. Fütterungsexperiment zur Anreicherung von n-3 FS aus B. lactucae in Hühnereiern......................................................................................................68 4.1. Hintergrund und Zielsetzung des Fütterungsexperiments ...........................68 4.2. Materialien und Methoden...........................................................................68 4.2.1. Versuchsaufbau und Aufgabenverteilung..........................................68 4.2.2. FS-Konzentrationen der Salatextrakte, der Futterrationen und der Dotterlipide ........................................................................................70 4.2.3. Salatproduktion..................................................................................72 4.2.4. Trocknung..........................................................................................74 4.2.5. Fütterungsversuch .............................................................................76 4.2.5.1. Leistungsdaten der Tiere ...........................................................78 4.2.6. Statistische Auswertung der Lipidgehalte in den Dotterproben .........80 4.3. Ergebnisse ..................................................................................................81 4.3.1. Befallsergebnis des Feldversuches zur Ernte....................................81 4.3.2. Temperaturstabilität und Trocknung ..................................................81 4.3.3. Fettsäureanalyse in der Nahrungskette.............................................82 4.3.4. Lipidoxidation und Sensorik...............................................................88 4.3.5. Leistungsdaten der Tiere ...................................................................89 4.4. Diskussion...................................................................................................94 4.4.1. Befallsergebnis vom Feldversuch......................................................94 4.4.2. Temperaturstabilität und Trocknung ..................................................95 4.4.3. FS-Analyse in der Nahrungskette......................................................96 4.4.4. Lipidoxidation und Sensorik...............................................................97 4.5. Zusammenfassung......................................................................................98 5. Bewertung des Potenzials von infizierten Nutzpflanzen als n-3-FS Quellen für die menschliche Ernährung ......................................................................99 5.1. Das Potenzial von Sporangien ....................................................................99 5.2. Das Potenzial von infiziertem, essbarem Pflanzengewebe .........................99 5.3. Das Potenzial von Bremia lactucae in der Nahrungskette.........................101 III 6. Zusammenfassung ........................................................................................103 7. Summary ........................................................................................................105 8. Literatur ..........................................................................................................107 9. Anhang ...........................................................................................................118 IV Abkürzungsverzeichnis A Signalfläche ALA Alpha-Linolensäure (18:3 n-3) ANOVA Varianzanalyse AOCS American Oils Chemists Society ARA Arachidonsäure (20:4 n-6) B. lactucae Bremia lactucae Regel (1843) (Falscher Mehltau auf Salat) DC Dünnschichtchromatographie DG Dottergewicht DGE Deutsche Gesellschaft für Ernährung DHA Docosahexaensäure (22.6 n-3) DP Depositionsrate EPA Eicosapentaensäure (20:5 n-3) F-Wert Statistisches Maß zur Bestimmung der Signifikanz FA Futteraufnahme FAME(s) Fettsäuremethylester FE Flächeneinheiten FG Frischgewicht(e) FID Flammenionisationsdetektor FS Fettsäure(n) GC Gaschromatograph(ie) GC-MS Gaschromatograph(ie)-Massenspektrometrie GLA Gamma-Linolensäure (18:3 n-6) ID Innendurchmesser IS Interner Standard LA Linolsäure (18:2 n-6) LC-PUFAs Langkettige, mehrfach ungesättigte Fettsäuren LL Legeleistung m Einwaage MW Mittelwert N Stickstoff n.s. nicht signifikant N1 Stickstoffkonzentration 0,1 mmol/l Ca(NO3)2 N2 Stickstoffkonzentration 1,0 mmol/l Ca(NO3)2 N3 Stickstoffkonzentration 5,0 mmol/l Ca(NO3)2 V n-3-FS Omega-3-Fettsäure(n) n-6-FS Omega-6-Fettsäure(n) p p-Wert, statistische Teststärke P. halstedii Plasmopara halstedii (Farl.) Berl. & DeToni (1888) p.a. pro analysi (chem. Reinheit) PUFAs Mehrfach ungesättigte Fettsäuren Rf Retentionsfaktor bei der Dünnschichtchromatographie rQ relative Quantität RT Raumtemperatur TBARS Thiobarbitursäure-reaktive Substanzen TBME Tertiärer Butylmethylether TG Trockengewicht(e) U Umdrehungen v/v Volumenanteil WHO Weltgesundheitsorganisation VI 1. Einleitung 1. Einleitung 1.1. Omega-3-Fettsäuren in der menschlichen Ernährung und Nahrungsmittelproduktion Derzeit stößt man in den Regalen von Supermärkten auf Margarinen, Fette und Pflanzenöle, die dafür werben, besonders reich an Omega-3-Fettsäuren (n-3-FS) zu sein. Es gibt einige Lebensmittel auf dem Markt, die mit n-3-FS angereichert werden (TRAUTWEIN 2001), unter anderem n-3-FS-Eier und n-3-FS-Brot (KOLANOWSKI & LAUFENBERG 2006) und als „Funktionelle Lebensmittel“ bzw. „Functional Food“ (HASLER 2002) bezeichnet werden. In Margarinen kommen n-3-FS-reiche Öle von Höheren Pflanzen zum Einsatz, wie Rapsöl oder Leinöl. Mit einer jährlichen Produktion von etwa 100 Mio Tonnen haben n-3-FS-reiche Pflanzenöle den größten Marktanteil als funktionelle Lebensmittel für die menschliche Ernährung (DREXLER et al. 2003). Als Nahrungsergänzungsmittel in Form von Fischölkapseln, Algenölkapseln oder Pflanzenölkapseln sind n-3-FS in Drogeriemärkten und Apotheken erhältlich. Doch die Marktbedeutung der n-3-FS geht weit darüber hinaus. Spezielle n-3-FS aus Algen, Pilzen, Oomyceten, Fischen oder Hühnereiern werden in manchen Ländern der Kinder- und Säuglingsnahrung zugesetzt (W ARD & SINGH 2005). Da der Markt noch Expansionspotenzial besitzt, forschen namhafte Firmen wie die BASF AG, Abott S.A., Aventis S.A., Nestle S.A. oder Novartis S.A. derzeit intensiv an neuartigen Organismen, die n-3-FS produzieren und Produkten, denen n3-FS zugesetzt werden (W ARD & SINGH 2005). Einen weiteren Markt für n-3-FS aus Algen und Oomyceten stellen Meeres-Aquakulturen dar. Normalerweise nehmen Larven und Fische im Meer Plankton und Algen auf, welche reich an n-3-FS sind. Die n-3-FS reichern sich über die Nahrungskette im Fisch stark an, was diesen für den menschlichen Verzehr so wertvoll macht. In heute üblichen Aquakulturen zur Anzucht von Lachsen erfolgt die Fütterung meist über Kraftfutter, dem n-3-FS aus der Nahrungskette fehlt. Daher werden neuerdings zusätzlich n-3-FS-haltige Algen und Oomyceten für die Aufzucht der Fischlarven eingesetzt (BARCLAY & ZELLER 1996; W ARD & SINGH 2005). Auch für den Tierfuttermarkt sind n-3-FS ein aktuelles Thema. n-3-FS-haltige Öle Höherer Pflanzen, Oomyceten-Präparate sowie Fischöl und Algenöl werden beispielsweise zu Hühner- und Putenfutter gemischt, um den n3-FS-Anteil in Fleisch und Eiern zu erhöhen (SIMOPOULOS & SALEM 1992; W ARD & SINGH 2005). 1 1. Einleitung 1.1.1. Chemische Definition der n-3-Fettsäuren n-3-Fettsäuren sind Bestandteile der sehr umfangreichen Stoffgruppe der Lipide, innerhalb derer FS ein zentrales, Struktur gebendes Element darstellen. Als FS werden Kohlenwasserstoffe bezeichnet, die aus mindestens 4 C-Atomen bestehen und mit einer Carboxylgruppe enden. Dabei werden in der Natur Kettenlängen von bis zu 28 C-Atomen gebildet, inzwischen sind über 1000 verschiedene Strukturen beschrieben (BELITZ et al. 2001; THURNHOFER 2007). Die hohe Variabilität entsteht nicht nur durch die Anzahl der C-Atome, sondern auch durch die die Bildung von CC-Doppelbindungen, Verzweigungen und H-Substitutionen mit anderen funktionellen Gruppen. Oft sind solche Veränderungen charakteristisch für bestimmte Organismengruppen, da sie besondere Enzyme erfordern. 17Z bzw. n-3 Position COOH H3 C Methylende, nNomenklatur Carboxylende, C-1-Position 14Z bzw. n-6- Position Abb. 1.1.: Schematische Darstellung der Eicosapentaensäure (20:5 n-3). Die Methylgruppe stellt die n-Position in n-Schreibweise dar, die Carboxylgruppe enthält das C-1-Atom der Delta-Schreibweise. Nomenklatorisch wird die strukturelle Vielfalt der FS durch die Angabe der Kettenlänge (Zahl der C-Atome) und die Anzahl der Doppelbindungen ausgedrückt. Eine Fettsäure mit 20 C-Atomen und 5 Doppelbindungen wird daher als 20:5 bezeichnet. Nach den Regeln der „International Union of Pure and Applied Chemistry“ (IUPAC-IUB 1978) wird das C-Atom der Carboxylgruppe als C1 gezählt. Damit ist die Position von Doppelbindungen im Molekül eindeutig definiert. Für das Beispiel der erwähnten FS 20:5 (Eicosapentaensäure) sind das die Positionen 5, 8, 11, 14, 17. Dies wird bei ausführlicher Benennung dem Namen der FS vorangestellt und durch die Isomerie der Doppelbindungen in cis-(Z)- oder trans-(E)-Form ergänzt, hier also (5Z, 8Z, 11Z, 14Z, 17Z)-Eicosapentaensäure (vgl. Abb.1.1.). Verwirrung stiftet mitunter die Verwendung der unterschiedlichen Schreibweisen, die sich vor allem auf die funktionell wichtige Position der letzten Doppelbindung 2 1. Einleitung beziehen. Liegt diese, wie bei Eicosapentaensäure, zwischen dem viert- und drittletzten C-Atom der Kette, so wird die FS als n-3-FS oder ω-3-FS bezeichnet. Diese Schreibweise ist besonders im medizinischen und pharmakologischen Bereich gebräuchlich, da FS mit Doppelbindung in der n-3-Position besondere physiologische Funktionen zugeordnet werden. Ähnliches gilt für die n-6- (ω-6)-Position der letzten Doppelbindung im Molekül. Die ω-Symbolik ist zwar populär, jedoch veraltet. Im wissenschaftlichen Bereich wird sie schon länger durch die n-Symbolik ersetzt. 1.1.2. Die medizinische Wirkung der n-3-Fettsäuren n-3-FS und n-6-FS sind für den Menschen essenziell, d.h. sie können nicht selbst produziert werden und müssen über die Nahrung aufgenommen werden. Die Deutsche Gesellschaft für Ernährung (DGE) empfiehlt aktuell eine tägliche Aufnahme von n-6- und n-3-FS im Verhältnis von 5:1 (DGE 2007) Da in unserer Nahrung n-6-FS im Anteil sehr stark überwiegen, liegt das Verhältnis von n-6:n-3-FS oft bei 10:1, 20:1 und schlechter. Tab. 1.1.: Einige wichtige n-6- und n-3-FS und ihr Haupt-Vorkommen in unterschiedlichen Organismen. *=essenzielle Fettsäuren für Menschen. Die n-6-und n-3-FS Höherer Pflanzen sind blau dargestellt. n-3 Fettsäuren Haupt-Vorkommen n-6 Fettsäuren Haupt-Vorkommen 18:3 n-3 (ALA)* Leinöl, Walnussöl, Rapsöl Fisch, Algen, Eumyceten, Moose, Oomyceten Fisch, Algen, Eumyceten Oomyceten, Eidotter 18:2 n-6 (LA)* Sonnenblumenöl, Distelöl Borretsch, Nachtkerze, Eumyceten, Oomyceten, Tierische Fette, Eumyceten, Muskelfleisch , Algen, 20:5 n-3 (EPA)* 22:6 n-3 (DHA)* 18:3 n-6 (GLA) 20:4 n-6 (ARA) Dies kann unsere Gesundheit auf Dauer negativ beeinträchtigen, da n-6-FS und n-3FS auf molekularer Ebene in einem komplizierten Zusammenspiel immunologische Vorgänge im Körper regulieren (STULNIG 2003). Das n-6/n-3-FS-Verhältnis ist für die meisten Körperfunktionen wichtiger als der absolute Gehalt dieser Fettsäuren (STULNIG 2003; W ILLIAMS 2000). n-6-FS fördern entzündliche und gefäßschädigende Prozesse, n-3-FS steuern solchen Prozessen entgegen (SANDERS et al. 2006; SIMOPOULOS 1999; SIRTORI 1994). Daher wird von Gesundheitsbehörden vieler Staaten empfohlen, mehr n-3-FS über 3 1. Einleitung die Nahrung aufzunehmen, um das n-6/n-3-Verhältnis zu verbessern und Gesundheitsrisiken vorzubeugen (KRIS-ETHERTON et al. 2000). Einige wichtige n-6- und n-3-FS und ihr Vorkommen werden in Tab. 1.1. aufgeführt. Für die menschliche Ernährung sind besonders die 3 Fettsäuren der n-3-Reihe Alpha-Linolensäure (ALA, 18:3 n-3), Eicosapentaensäure (EPA, 20:5 n-3) und Docosahexaensäure (DHA, 22:6 n-3) von Bedeutung. Zur Reihe der n-6-FS gehören Linolsäure (LA, 18:2 n-6), die seltene Gamma-Linolensäure (GLA, 18:3 n-6) und Arachidonsäure (ARA, 20:4 n-6). Da sie mehr als eine Doppelbindung enthalten, werden sie auch als „mehrfach ungesättigte FS“ („polyunsaturated fatty acids“ bzw. „PUFAs“) bezeichnet. Beträgt die Kettenlänge der Fettsäuren dabei mehr als 18 C-Atome, so spricht man von „langkettigen, mehrfach ungesättigten FS“ („long-chain poly unsaturated fatty acids“, bzw. „LC-PUFAs“) (SIMOPOULOS & SALEM 1992). Alpha-Linolensäure muss als essenzielle FS vom Menschen über die Nahrung aufgenommen werden. Aus ALA als Vorstufe können vom Menschen EPA und DHA gebildet werden (Tab. 1.1.). Diese n-3-FS sind daher im engeren Sinne nicht essenziell. Die Fettsäuren der n-6- und n-3-Reihe konkurrieren bei der Biosynthese jedoch um dieselben Enzymsysteme (CLARKE 2001). Wir nehmen im Verhältnis zu viele n-6-FS zu uns, so dass LA gegenüber ALA stark im Vorteil ist und dadurch weder EPA noch DHA in ausreichender Menge gebildet werden können. Da dies zu Mangelerscheinungen führt, werden EPA und DHA ebenfalls als essenziell eingestuft (BROWNING 2003). Die wichtigen medizinischen Funktionen der n-3-FS werden nicht ALA selbst sondern den längerkettigen FS EPA und DHA zugeordnet (FINNEGAN et al. 2003; SANDERSON et al. 2002). Weil unter Grönland Eskimos, trotz fettreicher Ernährung, Herzkrankheiten sehr selten waren, wurden in den 70er Jahren Studien zu den Gründen dieses Phänomens durchgeführt. Die Herzgesundheit dieser ethnischen Gruppe wurde auf die hohe Aufnahme von EPA und DHA aus Robben- und Fischöl zurückgeführt (BANG et al. 1971). EPA und DHA steuern Stoffwechselprozesse, welche die Blutfettwerte senken, was in der Infarktprophylaxe eine wesentliche Rolle spielt (KRIS-ETHERTON et al. 2002; SANDERS et al. 2006; W OLFRUM & SPENER 2000). LCPUFAs werden daher in der Schlaganfall- und Herzinfarktprophylaxe sowie für die 4 1. Einleitung Folgetherapie nach einem Infarkt eingesetzt (CALDER 2004). Da Fettsäuren in Phospholipiden wichtige Membran-Bestandteile von Zellen sind, beeinflussen sie die Elastizität von Gefäßen (W ILLIAMS 2000). Je höher der Anteil an hoch ungesättigten Fettsäuren ist, desto beweglicher und belastbarer werden die Membranen von Blutkörperchen und Gefäßen (MEAD 1984). Herzinfarkt und Schlaganfall sind Konsequenzen von Ablagerungsprozessen, bei denen ein Thrombus die Gefäße verstopft und die Blutzirkulation verhindert (MARTIN et al. 2005). Sind nur gesättigte Fettsäuren in die Gefäßmembranen eingebaut, so entstehen aufgrund der starren Strukturen und in Kombination mit LDL-Cholesterin („low denstiy lipoprotein“) Ablagerungen an den Gefäßwänden (ERKKILÄ et al. 2008). EPA und DHA sorgen für eine elastische Struktur der Blutzellen und Gefäßmembranen und verhindern dadurch Ablagerungen (LICHTENSTEIN et al. 2006). Sie haben zusätzlich vasodilatatorische (gefäßerweiternde), sowie Cholesterin senkende (HARRIS 1989; SIMOPOULOS 1989) und Blutdruck senkende Eigenschaften (MORRIS et al. 1993). EPA ist außerdem die Vorstufe von Gewebshormonen, den sogenannten Eicosanoiden. Zu ihnen gehören Prostaglandine, Leukotriene, Prostacycline und Thromboxane (FUNK 2001). Diese Gewebshormone steuern Prozesse der Immunabwehr. Eicosanoide wirken Entzündungsprozessen im Körper entgegen (CALDER 2001), weshalb EPA in der Therapie gegen Psoriasis, Asthma, Allergien und andere Autoimmunkrankheiten eingesetzt wird (BROWNING 2003; SIMOPOULOS 2002; STULNIG 2003). DHA ist wesentlich an der Entwicklung von Augen und Neuronalsystem bei Embryonen beteiligt und wird schwangeren Frauen von Ärzten zur Ergänzung der Nahrung empfohlen (UAUY & CASTILLO 2003). 1.2. Natürliche Quellen von n-3-Fettsäuren Als natürliche Quellen von n-3-FS werden in dieser Arbeit Nahrungsmittel bezeichnet, die vom Menschen in ihrer ursprünglichen Form verzehrt werden können und nicht genetisch oder technisch in ihrer Zusammensetzung verändert wurden. Dazu zählen pflanzliche und tierische Öle, Meeresfisch und Hühnereier. 5 1. Einleitung 1.2.1. Öle Höherer Pflanzen Die wichtigsten Lieferanten der essenziellen n-3-FS sind Öle Höherer Pflanzen. Höhere Pflanzen produzieren n-3-FS allein in Form von ALA sowie n-6-FS in Form von LA und GLA, da Enzyme zur weiteren Desaturierung (Einfügen von Doppelbindungen) und Elongation (Kettenverlängerung) der n-3-FS fehlen (SAYANOVA & NAPIER 2004). Die seltene FS GLA wird als taxonspezifisches Merkmal nur von wenigen Gattungen wie z.B. Oenothera (Nachtkerze) und Borago (Borretsch) produziert (FROHNE & JENSEN 1992; VELASCO & GOFFMAN 1999). Da Höhere Pflanzen n-3-FS ab der Kettenlänge von 20 C-Atomen nicht synthetisieren können (BROOKS & STUMPF 1966), wird im Zusammenhang mit natürlichen Pflanzenölen und n-3-FS ausschließlich von ALA gesprochen. Zu den Ölen, die besonders reich an n-3-FS sind gehören Leinöl, welches in seinem Fettsäuremuster bis zu 60% ALA enthält, Rapsöl mit Gehalten von 6 bis 14% und Walnussöl mit 9-15 % ALA (BUNDESMINISTERIUM FÜR VERBRAUCHERSCHUTZ 2006; FUSSENEGGER & W INDHALM 2003). Zu den Ölen, die von Natur aus sehr reich an n-6-FS sind, gehören Distelöl mit 68-83% LA, Sonnenblumenöl mit 48-74% LA, Maiskeimöl mit 39-66% LA und Walnussöl mit 54-65% LA. Wiederum spielt das n-6:n-3 Verhältnis eine Rolle. Bei Rapsöl und Walnussöl ist das Verhältnis recht ausgewogen und liegt etwa bei 5:1. Distelöl und Sonnenblumenöl enthalten dagegen kaum n-3-FS und haben daher Verhältniswerte sehr zu Gunsten der n-6-FS. Es gibt allerdings sogenannte „high oleic“ Sonnenblumensorten auf dem Markt, die so gezüchtet wurden, dass anstatt hohen Mengen an LA sehr hohe Mengen an Ölsäure (18:1 n-9, engl.: oleic acid) produziert werden (COLE et al. 1998), was das Verhältnis zu Gunsten von n-3-FS verbessert. Ölsäure ist mit 60% auch Hauptbestandteil in Olivenöl, einer Hauptkomponente der „Mittelmeerdiät“, welches mit einem n-6:n-3Verhältnis von 5:1 ebenfalls als physiologisch wertvoll gilt (SIMOPOULOS 2001). Nicht nur Öle sondern auch grüne Pflanzengewebe enthalten hohe Konzentrationen an ALA. So gilt z.B. Portulak (Portulaca oleracea L.) mit 3-4 mg ALA pro g Frischgewicht als guter ALA Lieferant (EZEKWE et al. 1999; SIMOPOULOS 1995), auf Verpackungen von französischem Feldsalat wird aktuell mit der n-3-FS Konzentration von 2,5 mg pro g Frischgewicht geworben. 6 1. Einleitung 1.2.2. Tierische Quellen Der Begriff n-3-FS wird selten mit tierischen Produkten in Verbindung gebracht, da damit meist gesättigte, feste Fette (ERKKILÄ et al. 2008) wie Schweineschmalz, Butter oder Rinderfett assoziiert werden. Es gibt jedoch auch Tiere wie Meeresfische und Hühner, die n-3-FS in Form von LC-PUFAs (EPA und DHA) anreichern können. Meeresfische Über die natürliche Nahrung nehmen Meeresfische Phytoplankton auf, welches zu einem erheblichen Anteil von Mikroalgen aus der Gruppe der Heterokontophyta gebildet wird. Diese Mikroalgen produzieren nennenswerte Mengen an EPA und DHA (TONON et al. 2002), die sich über die Nahrungskette in Fleisch und Fettgewebe von Fischen anreichern. Bereits 1-2 Portionen Meeresfisch pro Woche können so den menschlichen Bedarf an PUFAs decken (KRIS-ETHERTON et al. 2002). Wo Fisch in unzureichender Menge auf dem Speiseplan steht, werden Nahrungsergänzungsmittel wie Fischölkapseln empfohlen (KRIS-ETHERTON et al. 2000). Diese enthalten EPA und DHA in angereicherter Form, je nach Hersteller in Konzentrationen von 100-300 mg EPA/g ÖL und 100-300 mg DHA/g ÖL (ACKMAN et al. 1989). Hühnereier Hühnereier genießen den Ruf, den Cholesterinspiegel im Blut in die Höhe zu treiben und daher ungesund zu sein. Hühnervögel produzieren jedoch im Eidotter, welches zu 33% aus Lipiden besteht, etwa 4% DHA (SIMOPOULOS & SALEM 1989). Mit dem Verzehr eines Eies mit einem Eigewicht von 40 g kann damit fast der komplette Tagesbedarf an DHA gedeckt werden. Das n-6/n-3-Verhältnis bei Eiern liegt bei konventionellen Eiern etwa bei 8-10:1, bei „Omega-3-Eiern“ liegt es bei oder unter 5:1, was den Empfehlungen der DGE entspricht. Der mäßige Verzehr von Eiern wird daher als gesund und empfehlenswert eingestuft (NOBLE et al. 1990; SIMOPOULOS & SALEM 1992). Der DHA- und Cholesteringehalt von Eiern kann durch die Fütterung der Hühner, und damit über die Nahrungskette, stark beeinflusst werden (CHUNG et al. 1965; GRASHORN 1994; OH et al. 1991; SCHOLTYSSEK 1991). Für die Herstellung von „Omega-3-Eiern“ bekommen Hühner ALA-reiche Pflanzenöle wie z.B. Leinöl zugefüttert (RICHTER & KÖHLER 1998). Diese werden bei genügend hoher Dosis im Organismus des Huhnes in DHA umgewandelt und reichern sich als ALA und DHA im Eidotter an (STEINHILBER 2003). Auch Fischöl, Fischmehl und Robbenöl haben 7 1. Einleitung einen positiven Effekt auf den EPA und DHA Gehalt im Eidotter und werden dem Hühnerfutter zugemischt, um „Omega-3-Eier“ zu erhalten (SCHREINER et al. 2004). Diese Produkte können allerdings den negativen Nebeneffekt haben, dass die Eier nach Fisch schmecken (MARSHALL et al. 1994). 1.3. Problematik natürlicher Quellen Die Fischbestände im Meer sinken rapide, da global Überfischung betrieben wird (NAYLOR et al. 2000). Hinzu kommt die Verschmutzung der Gewässer mit Industrieabfällen und Schwermetallen, welche sich im Fisch anreichern, was diesen ungenießbar machen kann. Die beiden Alternativen Hühnereier und Öle Höherer Pflanzen haben ebenfalls entscheidende Schwachpunkte. So enthalten Hühnereier von Natur aus viel DHA, sie enthalten jedoch äußerst wenig EPA und auch viele gesättigte FS, die als nicht so gesund gelten. Die Öle Höherer Pflanzen sind dagegen reich an ungesättigten Fettsäuren. Mit Hilfe von Ölen Höherer Pflanzen können Menschen zwar ihren Bedarf an ALA decken, nicht jedoch den Bedarf an LCPUFAs der n-3-Reihe, also EPA und DHA. Diese gelten jedoch wegen ihrer pharmakologischen Eigenschaften als besonders wertvoll und sollten deshalb zusätzlich über die Nahrung aufgenommen werden. 1.4. Alternative Quellen für EPA und DHA In Anlehnung an die Definition der geltenden Fassung der „Novel Food Verordnung“ der EU von 1997 (EU 1997) werden in dieser Arbeit solche Organismen als alternative n-3-FS-Quellen bezeichnet, die in dieser Form in Europa noch nicht verzehrt werden. Dazu gehören technisch gewonnene Produkte Niederer Pflanzen und gentechnisch veränderte Pflanzen. 1.4.1. Öle Niederer Pflanzen als alternative Quellen für EPA und DHA Niedere Pflanzen sind im Gegensatz zu Höheren Pflanzen dazu in der Lage, EPA und DHA zu produzieren und können uns als alternative Quellen für diese FS dienen. Zu ihnen zählen marine Mikroalgen der Heterokontophyta, Oomyceten, Eumyceten und Moose. Oomyceten sind mit den heterokontophyten Algen phylogenetisch eng verwandt und sind als Saprophyten oder als Krankheitserreger von Tieren und Pflanzen bekannt. Zur den Oomyceten gehören z.B. die Gattungen Thraustochytrium und Schizochytrium, die saprophytisch von abgestorbenen Pflanzenteilen im 8 1. Einleitung Brackwasser leben. Die auf lebende Wirte angewiesenen Falschen Mehltaupilze (Peronosporaceae), sind dagegen hoch spezialisiert und auf künstlichen Nährmedien bisher nicht kultivierbar. Thraustochytrium und Schizochytrium sind bereits wirtschaftlich relevant für die Produktion von DHA und ARA und werden großtechnisch in Bioreaktoren mit Nährmedium gezüchtet, wobei sie, je nach Nährmedium, Stamm und Biomasse, bis zu 10 g DHA pro L und Tag produzieren (WARD & SINGH 2005). Schizochytrium-Arten werden als Futter für Aquakulturen verwendet und aktuell als Ersatz für Fischmehl im Futter für Meerbrassen in Aquakultur diskutiert (BARCLAY & ZELLER 1996; GANUZA et al. 2008). Mikroalgen mehrerer Gattungen werden bereits wirtschaftlich zur EPA und DHA Gewinnung in Bioreaktoren gezüchtet und für die Gewinnung von sogenanntem „Algenöl“ herangezogen. Dabei handelt es sich um einen Lipidextrakt aus Algenbiomasse, der in lipophilem Lösungsmittel angereichert und aufgereinigt (nur die gewünschten FS bleiben enthalten) wurde. Es sind sowohl heterotrophe als auch phototrophe Algen im Einsatz. Die heterotrophe Mikroalge Ulkenia wird z.B. für die Produktion von Algenöl der Firma Lichtwer (Berlin) verwendet, welches in der Apotheke in Form von Algenölkapseln (Ameu® Alge) erhältlich ist. DHA ist darin in aufgereinigter Form enthalten und erreicht Konzentrationen von ca. 300 mg/g ÖL. Dies entspricht der Menge in konzentrierten Fischölkapseln. Die phototrophe Alge Phaeodactylum tricornutum wird in Photobioreaktoren gezüchtet und zur EPA Gewinnung herangezogen, wobei bis zu 40 mg pro L und Tag produziert werden können (MEISER et al. 2004). Die phototrophe, marine Mikroalge Monodus subterraneus (HSIAO & BLANCH 2006) wird neben vielen anderen Gattungen ebenfalls zur EPA Produktion eingesetzt und kommt unter optimalen Bedingungen auf ähnliche Gehalte wie Phaeodactylum tricornutum (W ARD & SINGH 2005). DHA aus Oomyceten- und Mikroalgenkulturen wird als „Einzelleröl“ bzw. „single cell oil“ in den USA bereits großtechnisch produziert und Babynahrung zugesetzt (W ARD & SINGH 2005), da DHA an der Entwicklung des Nervensystems und des Immunsystems vom Menschen beteiligt ist. Es wird momentan intensiv nach neuen Organismen gesucht und es werden laufend neue Gattungen gefunden, die DHA und EPA produzieren und als Genbank oder auch als Produzenten für LC-PUFAs genutzt werden können (QI et al. 2002; SANINA et al. 2008). Eumyceten der Gattung Mortierella und 9 1. Einleitung Oomyceten der Gattung Pythium sind ebenfalls als EPA und DHA Lieferanten beschrieben, manche Stämme produzieren 25 mg EPA pro g Trockenmasse (O´BRIEN et al. 1993; SINGH & W ARD 1998). Kulturen von Mortierella- und Pythium werden Rapsöl und Rapsschrot zugesetzt, so dass die Organismen, aus LA und ALA als Vorstufen, die FS ARA und EPA produzieren (DONG & W ALKER 2008). Auch Moose der Gattung Physcomitrella sind in der Lage EPA und ARA zu produzieren (SENGER et al. 2005). Sie spielen daher momentan für die Erforschung der Fettsäurebiosynthese für EPA und ARA eine Rolle (KAEWSUWAN et al. 2006) 1.4.2. Transgene Pflanzen Für Zwecke der industriellen Nutzung und Ernährung werden derzeit jährlich ca. 100 Mio Tonnen Pflanzenöl produziert (DREXLER et al. 2003). Höhere Pflanzen sind natürliche „Ölfabriken“, die effizient mit reinem Sonnenlicht arbeiten. In den letzten Jahren wurde intensiv an den Biosynthesewegen von LC-PUFAs geforscht (GALANINA & KONOVA 1998; MICHAELSON et al. 1998; SPERLING & HEINZ 2001) und die DNA- Sequenzen der verantwortlichen Enzyme für die Synthese von DHA und EPA aus Niederen Pflanzen wurden aufgeklärt (BEAUDOIN et al. 2000a; BEAUDOIN et al. 2000b; DOMERGUE et al. 2002; NAPIER & MICHAELSON 2001; SAYANOVA & NAPIER 2004). Es gibt aktuell mehrere Forschergruppen, die versuchen, über den Gentransfer von Enzymen aus Niederen Pflanzen (Pilzen, Algen oder Moosen) in Raps und Soja EPA und DHA zu produzieren (NAPIER et al. 2004; QI 2004; ROBERT 2006; TONON et al. 2005). Ins Genom eingebaute Elongasen und Desaturasen sollen aus ALA die FS EPA und DHA produzieren (URSIN 2003; W U et al. 2005). Auf diese Weise wird es bald Landpflanzen geben, die LC-PUFAs synthetisieren können (GRAHAM et al. 2007; URSIN 2003). 1.5. Problematik alternativer Quellen Niedere Pflanzen sind, was die Quantitäten von DHA angeht, zwar sehr gute Alternativen zu Meeresfisch. Die Produktion in Bioreaktoren sowie die Aufreinigung des Öls kosten jedoch sehr viel Energie und setzen ein Höchstmaß an Technik voraus. Mikroalgen und Oomyceten produzieren vorwiegend nur eine LC-PUFA, d.h. es wird entweder viel EPA oder viel DHA produziert. Ölkapseln sind zudem keine Form natürlicher Ernährungsweise und nicht jeder kann sich Ölkapseln aus der Apotheke leisten, da eine teure Produktion auch teure Produkte hervorbringt. 10 1. Einleitung Die Biosynthese von EPA oder DHA in Ölen Höherer Pflanzen ist bisher noch im Forschungsstadium. Das gezielte Einbringen der Gene an die Orte, wo später die Fettsäurebiosynthese und Speicherung stattfindet, stellt immer noch eine große Herausforderung dar (CSIRO 2005; DREXLER et al. 2003). In der Bevölkerung gibt es zudem für gentechnisch modifizierte Nahrungsmittel wenig Akzeptanz, da die Folgen für Mensch und Umwelt nicht abschätzbar sind. 1.6. Aktueller Stand der Forschung und Zielsetzung der Arbeit Der Falsche Mehltau der Sonnenblume Plasmopara halstedii (Farl.) Berl. & DeToni (1888) und der Falsche Mehltau auf Salat Bremia lactucae Regel (1843) gehören, wie die bereits erwähnten Taxa Schizochytrium oder Thraustochytrium, ebenfalls zu den Oomycota. Sie sind jedoch nicht heterotroph im Reaktor kultivierbar sondern wirtsspezifisch und von der lebenden Wirtspflanze abhängig (obligat biotroph). Sie schädigen die Pflanze nur begrenzt und bilden keine Toxine. Die Fettsäurezusammensetzungen dieser Gattungen sind taxonspezifisch und können zu systematischen Zwecken benutzt werden (SPRING & HAAS 2002; SPRING & THINES 2004; SPRING et al. 2005). Sowohl B. lactucae als auch P. halstedii produzieren die Fettsäure EPA zu einem erheblichen Anteil ihres Fettsäuremusters, lassen sich jedoch wegen ihrer biotrophen Lebensweise nicht direkt zur Gewinnung von EPA nutzen. Bei der bisherigen Suche nach alternativen Quellen zur Produktion von LC-PUFAs wurden die Organismen isoliert betrachtet. Es wurde nicht berücksichtigt, dass obligat-biotrophe Oomyceten zusammen mit ihrem Wirt ein mögliches Potenzial für die menschliche Ernährung mit LC-PUFAs besitzen könnten. Das Ziel dieser Arbeit war es, die Nutzungsmöglichkeit der Falschen Mehltaupilze von Sonnenblume und Salat in Kombination mit ihren Wirten als n-3-FS-Lieferanten zu erforschen. Hintergrund dafür war der Gedanke, eine alternative und gentechnikfreie Quelle für LC-PUFAs zu finden, deren Produktion durch ein natürliches, energetisch günstiges, System geschieht. Dabei war der Blick besonders auf die FS EPA gerichtet. Eventuell konnte mit Hilfe spezieller, optimierter Kultivierungstechniken genügend EPA produziert werden, um in der menschlichen Ernährung genutzt zu werden. 11 1. Einleitung Als Basis für die Bewertung des Nutzungspotenzials infizierter Nutzpflanzen dienten die Anwendung und die Weiterentwicklung von Infektions- und Anzuchtmethoden für genetisch homogenes Sporangienmaterial von P. halstedii und B. lactucae sowie vergleichende Fettsäureanalysen. Um zusätzlich zum bisherigen Forschungsstand die Fettsäurezusammensetzung verschiedener Lipidklassen zu untersuchen, wurden für diese Arbeit für die Aufbereitung von Oomycetenlipiden kombinierte Methoden der Dünnschichtchromatographie (DC) und Gaschromatographie (GC) angewandt. Die Fettsäuremuster und -konzentrationen der Modellsysteme Sonnenblume/ P. halstedii und Salat/B. lactucae wurden mit Hilfe der Gaschromatographie (GC) qualitativ erfasst und quantifiziert (Kapitel 2), mit dem Ziel, diese für die menschliche Ernährung qualitativ und quantitativ zu bewerten. Es wurde angenommen, dass die produzierten EPA-Gehalte von Sporangien und infiziertem Pflanzengewebe beeinflusst und erhöht werden konnten. Um dies zu zeigen, wurden verschiedene Versuche zur Erhöhung des EPA-Gehaltes von Sporangien und infiziertem Blattmaterial in Kapitel 3 durchgeführt. Das Wirt/Pathogen-System Sonnenblume/P. halstedii diente als Modellbeispiel, da die Kultivierungstechnik bekannt und mit vielen Isolaten und Stämmen am Institut für Botanik etabliert war (ROZYNEK 2000; SPRING et al. 1997). Zunächst wurden über artinternes Screening zwischen Sporangienstämmen genotypische Unterschiede in der EPA-Konzentration erforscht. Dann wurde nach besonders anfälligen Wirtspflanzen gesucht und über die Variation des Infektionsdrucks versucht, den EPA-Gehalt im infizierten Blattmaterial zu optimieren. Ebenso galt es, die Auswirkungen von Stickstoff auf Wachstum und EPA-Konzentration infizierter Pflanzen zu untersuchen. Um die praktische Relevanz des Systems Wirt/Falscher Mehltaupilz für die Nahrungskette zu erforschen (Kapitel 4), wurde mit Salat/B. lactucae und Hühnern ein Versuch zur Anreicherung von EPA über die Nahrungskette durchgeführt. Es wurde getestet, ob eine 10%ige Futterbeimischung von infiziertem Salat dazu geeignet ist, über den Stoffwechsel des Huhnes den n-3-FS Gehalt im Eidotter zu verbessern. Die spezielle Frage war, ob sich EPA aus B. lactucae infiziertem Salat als Zusatz in Hühnerfutter im Eidotter als EPA oder DHA anreichern würde. Abschließend wurde das Potenzial von infizierten Nutzpflanzen als n-3-FS-Quellen für die menschliche Ernährung bewertet (Kapitel 5). 12 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Mit Hilfe spezieller Anzucht- und Infektionstechniken sollten infiziertes Pflanzengewebe sowie genetisch homogenes Sporangienmaterial produziert werden, um die enthaltenen EPA-Konzentrationen erfassen zu können. Die Fettsäuremuster der Gesamtlipidextrakte von Sporangien von B. lactucae und P. halstedii wurden für taxonomische Zwecke am Institut für Botanik bereits qualitativ und prozentual aufgeklärt und beschrieben (SCHÄUFFELE 2005). Um genaue Angaben zu den EPAKonzentrationen in Sporangien und infiziertem Pflanzengewebe machen zu können, musste für diese Arbeit zusätzlich ein GC-Verfahren erarbeitet werden, mit dem eine verlässliche Quantifizierung möglich war. Ergänzend zum bisherigen Forschungsstand wurden Untersuchungen darüber durchgeführt, wie die Fettsäuren in den einzelnen Lipidklassen von P. halstedii und B. lactucae verteilt sind. Für Mikroalgen werden solche Analysen auf Grund chemotaxonomischer und ökonomischer Interessen aktuell durchgeführt (CHEN et al. 2008; SANINA et al. 2008). Am Ende des Kapitels konnte so ein Vergleich der qualitativen Beschaffenheiten der FS-Muster sowie der FS-Zusammensetzungen der einzelnen Lipidklassen stattfinden. Zudem wurden die EPA-Produktivitäten verschiedener Systeme miteinander verglichen. 2.1. Materialien und Methoden 2.1.1. Infektionstechniken und Ernte Feldisolate genetisch homogener Einzelsporenisolate von P. halstedii standen am Institut für Botanik zur Verfügung. Die Stämme BL-11.06-02-A4z, GG-16.10.07-A25, He-10.01.06-A8, LS-13.12.05-C6 wurden für taxonomische Zwecke mit Einzelsporangien oder Einzelsporen aus Feldisolaten generiert und vermehrt (SPRING et al. 1998). Die Inokulation der Pflanzen erfolgte im Keimlingsstadium nach der WSI (whole seedling infection)- Methode (COHEN & SACKSTON 1973; ROZYNEK 2000). Zur Anzucht und Vermehrung von P. halstedii wurde die Sonnenblumensorte Giganteus verwendet, die als besonders anfällig gilt. 13 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Ein Feldisolat von B. lactucae konnte im Rahmen dieser Arbeit von Salatpflanzen der Versuchsstation für Gartenbau (Hohenheim) isoliert werden. Die Salatsorte Cobham Green diente der Anzucht und Vermehrung von B. lactucae (DATNOFF et al. 1994). 2.1.1.1. Keimlingsinfektion bei P. halstedii Für die Infektion wurden 20 Sonnenblumensamen verschiedener Sorten bzw. Linien mit dest. Wasser gewaschen und in Petrischalen auf feuchtem Filterpapier bei 25 °C im dunklen Wärmeschrank für 24 h angekeimt. Gleichzeitig standen ca. 14 Tage alte, stark infizierte Sonnenblumen zur Verfügung, deren Keimblätter voll entwickelt waren. 10 µm Abb. 2.1.: P. halstedii. Links: Sporangien mit schlüpfenden Zoosporen. Rechts: Infizierte Sonnenblume nach induzierter Sporulation. Der Erreger, der sich 14 Tage lang latent im Sonnenblumengewebe vermehrt hatte, wurde über Nacht in einer nassen, geschlossenen Styroporbox zur Sporulation gebracht, so dass am nächsten Tag ein weißer Rasen frischer, infektionsfähiger Sporangien auf den Keimblättern zu sehen war (Abb. 2.1.). Die angekeimten Sonnenblumensamen wurden mit einer Pinzette von ihren Schalen befreit, unter dest. Wasser in einem Sieb abgespült und in ein Becherglas mit 20 ml dest Wasser überführt. Zwei bis vier infizierte Keimblätter der sporulierenden Sonnenblumen wurden in das Becherglas gegeben und die Sporangien gründlich mit Wasser vom Blatt gespült. Die Konzentration der Sporangien/ml Inokulum wurde lichtmikroskopisch mit Hilfe einer Fuchs-Rosenthal-Zählkammer bestimmt und durch entsprechende Verdünnung auf den gewünschten Wert eingestellt. Die Keimlinge wurden ca. 4 h abgedunkelt bei 16°C im Infektionsinoku lum belassen, damit die Zoosporen schlüpfen konnten (Abb. 2.1.). Die Schlüpfrate der Zoosporen wurde mikroskopisch kontrolliert und lag meist zwischen 70 und 100 %. Die Zoosporen 14 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe bildeten Keimschläuche, die in das Wirtsgewebe eindrangen. Nach 4 h Inkubation wurden die Keimlinge in eine Pflanzschale mit Einheitserde gepflanzt und mit dest. Wasser und dem restlichen Inokulum gleichmäßig bewässert. Die Pflanzschalen wurden eine Nacht abgedunkelt und 14 Tage offen in den Klimaschrank gestellt (16/8 h Tag/Nacht, 16°C, 80% relative Luftfeuchte, Lichtint ensität (Photonenfluss) 30 µmol/m²•s). Nach 14 Tagen waren die Keimlinge bereits voll infiziert und reif für das nächste Sporulationsereignis. 2.1.1.2. Blattinfektion bei B. lactucae Für die Infektion mit B. lactucae wurde gesunder Salat im Klimaschrank angezogen, bis er im 4-6 Blattstadium war (ca. 8 Wochen). B. lactucae wurde dann auf diesen Salatblättern vermehrt, indem die Methode der Blattscheibeninfektion für Sonnenblumen (ROZYNEK & SPRING 2001; SPRING et al. 1997) etwas abgewandelt wurde. Im Abstand von 3 Wochen wurde Salat der Sorte Cobham Green in 2 Schalen mit Einheitserde gepflanzt und 8 bis 10 Wochen angezogen, so dass immer frische und infektionsfähige Blätter zur Verfügung standen. Aus stark befallenen und sporulierenden Salatblättern vom Feld bzw. aus neusporulierendem, genetisch homogenem Material aus dem Klimaschrank wurde analog zu den Versuchen mit P. halstedii ein Inokulum hergestellt. Die Sporangienmenge wurde mit Hilfe einer Fuchs-Rosenthal-Zählkammer auf die optimale Menge von 5000 Sporangien/ml eingestellt. Im Unterschied zu P. halstedii bildeten die Sporangien von B. lactucae unter genannten Bedingungen direkt Keimschläuche und entließen keine Zoosporen (Abb. 2.2.). 5 µm Abb. 2.2.: B. lactucae. Links: Keimendes Sporangium von B. lactucae mit Keimschlauch und Plasma. Rechts: Sporulierender Erreger mit weißem Sporangienrasen auf der Blattunterseite von jungem Salat. 15 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Die Infektion selbst erfolgte in großen, flachen, lichtdurchlässigen und verschließbaren Plastikschalen. Diese wurden mit feuchtem Papier ausgelegt, worauf 8 Wochen alte, gesunde Salatblätter platziert wurden. Das Inokulum wurde mit einer 1ml Pipette aufgezogen und tropfenweise, gleichmäßig auf die Salatblätter verteilt. Die lichtdurchlässigen Plastikschalen wurden geschlossen und in den Klimaschrank (16/8 h Tag/Nacht, 20°C, 80% relative Luftfeuchte, Li chtintensität (Photonenfluss) 30 µmol/m²•s) gestellt. Nach ca. 7-10 Tagen fand auf der Oberfläche (meist zu 80-100 %) der Salatblätter spontan die Neusporulation statt (Abb. 2.2.). 2.1.1.3. Ernte und Lagerung von Sporangien und Pflanzenmaterial Die Sporangien von P. halstedii und B. lactucae mussten, um den Fettsäuregehalt untersuchen zu können, von den Pflanzenoberflächen möglichst schonend, komplett und verlustfrei geerntet werden. Dies geschah mit einer Mikroabsaugvorrichtung (ROZYNEK 2000), die als Deckel auf ein 2 ml Reaktionsgefäß passte. Sie funktionierte nach dem Unterdruckprinzip mit einem Teflonschlauch, der an eine Wasserstrahlpumpe angeschlossen war. Durch den entstehenden Sog wurden die Sporangien der Pflanzenoberflächen in das Reaktionsgefäß eingesaugt. Die Gefäße mit dem eingesaugten Sporangien- und Hyphenmaterial wurden in Kryoboxen bei -20°C gelagert, wo die Erreger haltbar und infektionsfähig blieben. Um den EPA-Gehalt der infizierten Keimlinge und Salatblätter zu bestimmen, wurden diese bei voller Infektion aber vor Sporulation geerntet, um keine Verluste während der Ernte zu haben und gute Vergleichbarkeit zu garantieren. Die infizierten Pflanzengewebe wurden für die FS-Analyse in einem geöffneten Reaktionsgefäß bei Raumtemperatur (RT) im Exsikkator 4 Tage getrocknet. Das getrocknete Pflanzengewebe wurde, ebenfalls wie die Sporangien, auf die EPA-Konzentration hin untersucht. 2.1.2. Aufbereitung der Fettsäuren für die GC-Analyse Um die verschiedenen Gehalte an EPA und anderen FS verschiedener Proben miteinander vergleichen zu können, war eine verlässliche Standard-Analytik notwendig. Für die Erfassung der FS-Profile von Oomyceten wurde die Gas-Chromatographie (GC) mit Kapillarsäulen zur Flüssigaufgabe und Flammenionisationsdetektor (FID) verwendet (SPRING & HAAS 2002). Diese Technik gilt auch in der Lebensmittel16 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe industrie als Standardmethode zur Quantifizierung und Analyse von Fettsäuremethylestern (FAMEs) und wird ausdrücklich von der „American Oil Chemists Society“ (AOCS) empfohlen (SHANTHA & NAPOLITANO 1992). Die Bestimmung und Identifikation der FAMEs in den Proben basierte auf identischen Retentionszeiten von Probenpeak und externem Standard. Die Probenaufbereitung selbst bestand aus zwei Schritten: 1. Extraktion der Gesamtlipide mit Lösungsmittel, 2. Abspalten der FS von ihren Lipidklassen und Derivatisierung in leicht verdampfbare Methylester. 2.1.2.1. Extraktion der Fettsäuren Materialien: Sporangien, infiziertes Pflanzenmaterial, Stahlkugeln, Vakuumkonzentrator (Bachofer, Reutlingen), Waage (sartorius research, Sartorius, Göttingen), Zentrifuge (Biofuge 13, Heraeus, Hanau), Schüttelmühle (Retsch, Haan), n-Hexan (p.a., Merck, Darmstadt), 2 ml Glasgefäße für chromatographische Zwecke, 2 ml Plastikreaktionsgefäße. Sporangien Für die GC-Analyse der FS reichten Sporangien in kleinsten Mengen, daher wurde mit Lösungsmittelmengen im µl Bereich gearbeitet. Da Sporangien in lipophilem Lösungsmittel sehr schnell aufplatzten und ihren Inhalt freigaben, war eine einmalige Zugabe von n-Hexan ausreichend, Extraktion und Methylierung erfolgten daher in einem Schritt (LEPAGE & ROY 1984; MEIER et al. 2006). Zu ca. 0,5 mg Sporangien wurden 150 µl n-Hexan gegeben. Die Methylierungsreagenzien wurden dem Proben/n-Hexan-Gemisch direkt zugesetzt, wonach die Säurekatalysierte Veresterung der FS für die GC-Analyse durchgeführt wurde. Jeder Probe wurde vor Extraktion/Methylierung ein 17:0 oder ein 23:0 Standard (vgl. Kap. 2.1.4.) in definierter Konzentration zugesetzt. Pflanzenmaterial Das Pflanzenmaterial wurde dagegen in 2 Schritten extrahiert und methyliert. Die Proben (0,05-0,5 g) wurden auf einer Analysenwaage eingewogen und in einem 2 ml Plastikreaktionsgefäß mit einer Schüttelmühle 5 min bei 70 Schwingungen/min mit 2 Stahlkugeln fein zermahlen. Jeder Probe wurden die Fettsäuren 17:0 bzw. 23:0 in einer definierten Konzentration als interner Standard zugesetzt. So konnte man 17 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe spätere Verluste an Fettsäuren während der Verarbeitung korrigieren. Die Lipide der Proben wurden 3x30 min mit 150 µl n-Hexan extrahiert. Die Lösungsmittelphasen mit Lipiden wurden bei 13000 Upm für 2 min abzentrifugiert und in 2 ml Reaktionsgefäßen vereint. Das Lösungsmittel wurde bei RT für 30 min im Vakuumkonzentrator abgedampft. Die Lipide wurden in 150 µl n-Hexan aufgenommen und in 2 ml Glasgefäße für die GC überführt. Sie wurden anschließend für die GC-Messungen derivatisiert. 2.1.2.2. Säure-katalysierte Veresterung der Fettsäuren für die GC-Analyse Die FS mussten aus ihren Lipidgerüsten abgespalten und in leicht verdampfbare Fettsäuremethylester (FAMEs) überführt werden. Bortrifluorid in Methanol ist eine Lewis-Säure und katalysiert die Abspaltung der FS von den Lipidgerüsten sowie die Neuveresterung der Säuregruppen der FS mit einer Methylgruppe. Im Gegensatz zur Basen-katalysierten Veresterung werden bei der Säure-katalysierten Veresterung die FS aller Lipidklassen, auch Freie FS, in ihre Methylester überführt (SHANTHA & NAPOLITANO 1992). Die Derivatisierung der FS zu FAMEs erfolgte säurekatalysiert mit Bortrifluorid– Methanolkomplex (SPRING et al. 2005). Da die Veresterung mit Bortrifluorid–Methanolkomplex auch in der Lebensmittelchemie als Standardmethode der AOCS empfohlen wird (ACKMAN 1998; SHANTHA & NAPOLITANO 1992), konnte diese etablierte Methode unter geringer Abwandlung beibehalten werden. Materialien: Spritze (10 µl ml, SGE, Griesheim) zur Flüssigprobenaufgabe am GC, Thermoblock (Pierce reacti-therm, Thermo Fisher Scientific, Illinois, USA), Bortrifluorid-Methanolkomplex (p.a.,20%, Merck, Darmstadt), Petrolether (Riedel-de Haën, Taufkirchen), tertiärer Butylmethylether (TBME) (p.a., Merck, Darmstadt), H20 dest, Isooctan (p.a., Merck, Darmstadt), Stickstoff gasförmig (Reinheit 4.6, 5.0), Pasteurpipetten, Eppendorfpipetten, Supelco 37 Komponenten-Standard (Sigma-Aldrich, Taufkirchen), EPA-Methylester (Sigma-Aldrich, Taufkirchen), Heptadecansäure (17:0) (Fluka, Taufkirchen). 18 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Den Proben wurden 50 µl TBME als Lösungsvermittler und 250 µl BortrifluoridMethanolkomplex zugesetzt. Bei 90°C im Thermoblock wurd en die FS von ihren Esterbindungen abgespalten (Verseifung) und neu verestert. Die Proben mussten ca. 10 min bei RT abkühlen. Für die anschließende Phasentrennung wurden 500 µl Petrolether sowie 500µl dest. Wasser zugesetzt und die Proben wurden gründlich ausgeschüttelt. Die Petroletherphase wurde abpipettiert und im Stickstoffstrom abgedampft. Die FAMEs wurden in 30-50 µl Isooctan aufgenommen und in 2 ml Glasgefäßen bei -20°C bis zur Messung am GC gelagert. 2.1.3. GC-FID Messtechnik Da es für die Quantifizierung der FS entscheidend ist, wie die Proben aufgegeben werden (SCHREINER 2005), welche Säulen verwendet werden, wie die Temperaturprogramme geregelt sind und welcher Messbereich gewählt wird, soll kurz darauf eingegangen werden. 2.1.3.1. Kalibrieren des Messbereiches FID-Detektoren sind massenabhängig (SCHOMBURG 1987). Das elektrische Signal, das am FID gemessen wird ist proportional zur Probenmenge. Um den linearen Bereich des FID zu verifizieren und eine verlässliche Quantifizierung zu ermöglichen, wurde eine bekannte Konzentration EPA-Methylester in unterschiedlicher Menge eingespritzt (ACKMAN et al. 1963). Die Linearität der Messbereiche war stets mit einem Bestimmtheitsmaß von über 99% gegeben. Es wurde je nach Probenkonzentration mit „Range 0“ und „Range 1“ gearbeitet, wobei „Range 0“ das empfindlichste Detektionsfenster darstellte, mit dem noch pg-Mengen an Substanzen in Proben nachgewiesen werden konnten. „Range 1“ war um den Faktor 10 weniger empfindlich und für höher konzentrierte Proben mit Fettsäuremengen im ng-Bereich und µg-Bereich geeignet. Proben höherer Konzentration belasteten jedoch die empfindlichen Säulen, was zu deaktivierten Stellen und Säulenbluten führte. Daher wurde auf niedrigere Empfindlichkeitsstufen (Range 2 etc.) verzichtet, indem die Proben so verdünnt wurden, dass bei Range 0 oder Range 1 gemessen werden konnte. 19 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe 2.1.3.2. Einspritztechnik/Probenaufgabe Die Proben wurden in einer flüssigen Isooctan-Matrix mit einer 10 µl Spritze mit Stahlkolben aufgegeben. Da jede Probe manuell eingespritzt wurde, war es für eine reproduzierbare und verlässliche Quantifizierung nötig, eine präzise Einspritztechnik anzuwenden (ACKMAN et al. 1963). Daher wurde die Probenaufgabe stets von derselben Person durchgeführt. Es wurde die Kaltnadel-Technik („solvent flush cold needle“) angewendet (SCHOMBURG 1987). Dazu wurden zwischen 0,5 und 2 µl Flüssig-Probe aufgezogen. Zur Probe wurde zusätzlich 0,5 µl Luft aufgezogen und sie wurde ohne Wartezeit in den Injektor gespritzt. 2.1.3.3. Säulen Für die Fettsäure-Analytik am GC-FID wurden in dieser Arbeit gebundene SilikaKapillarsäulen („fused silica“) als stationäre Phasen verwendet. Dieser Säulentypus gilt aktuell für die Trennung von FS als der Beste (ACKMAN 2002). Die Säulen werden meist nach dem Polaritätsindex eingeteilt der von 0 (unpolar, Innenbeschichtung mit Squalan) bis 100 (polar, Innenbeschichtung mit Cyanopropylpolysiloxan oder Polyethylenglykol) reicht. Für diese Studie wurden polare Säulen verwendet, da unpolare Säulen die ungesättigten FS der Kohlenstofflänge 18 schlecht bis gar nicht trennen, ebenso wenig die ungesättigten FS der Kohlenstofflänge 20 und 22 (SHANTHA & NAPOLITANO 1992). Diese ungesättigten FS werden auf polaren Säulen dagegen gut getrennt. Die Auftrennung auf der Säule erfolgte nach Polarität (Anzahl der Doppelbindungen) und Kettenlänge der enthaltenen FAMEs. Je länger die Kohlenstoffkette und je mehr Doppelbindungen, desto länger die Retentionszeit der FAMEs. Isomere eluieren schneller, je näher die Doppelbindung an der COOHGruppe liegt, also 18:1 n-9<18:1 n-7<18:2 n-6 <18:3 n-3. Die polaren stationären Phasen ermöglichen sogar die Trennung von cis- und trans-Isomeren, was sie für die moderne Fettsäureanalytik besonders attraktiv macht (Abb. 2.3., 2.4.). Jedoch können auch auf den besten polaren Säulen nicht alle FS voneinander getrennt werden. Dieses Problem kann jedoch dadurch gelöst werden, dass nacheinander mit 2 verschiedenen Säulen gearbeitet wird. In dieser Arbeit wurde mit den polaren Säulen CP7419 (Varian, Middelburg, Niederlande) und DB-23 (J&W Scientific, Folsom, USA) analysiert, die folgende Spezifikationen aufweisen: DB-23: 30 m, 20 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Filmdicke 0,25 µm, Innendurchmesser (ID) 0,25 mm. CP7419: 50 m, Filmdicke 0,25 µm, ID 0,25 mm. 9 1 27 15 3 5 2 4 8 10 12 6 7 32 20 13 24 - 25 22 211- - 26 29 - 28 30 17 16 18 11 23 - 19 14 31 Abb. 2.3.: Standardlauf der FAMEs mit 37 Komponenten-Standard, Säule DB-23 1: 8:0+10:0, 2: 11:0, 3: 12:0, 4: 13:0, 5: 14:0, 6: 14:1, 7: 15:0, 8: 15:1, 9: 16:0, 10: 16:1, 11: 17:0, 12: 17:1, 13: 18:0, 14: 18:1 n-9 trans, 15: 18:1 n-9 cis, 16: 18:2 n-6 trans, 17: 18:2 n-6 cis,: 18: 18:3 n-6, 19: 18:3 n-3, 20: 20:0, 21: 20:1, 22: 21:0, 23: 20:2, 24: 20:3 n-6, 25: 20:3 n-3, 26: 20:4 n-6, 27: 20:5 n3 + 22:0, 28: 22:1, 29: 23:0. 30: 22:2, 31: 24:0 + 24:1, 32: 22:6 n-3 2 3 26 5 1 7 4 6 11 8 9 10 15 17 19 21 12 14 24 18 20 22 13 16 28 25 27 29 30 32 31 23 Abb. 2.4.: Standardlauf der FAMEs mit 37 Komponenten-Standard, Säule CP7419 1: 6:0, 2: 8:0, 3: 10:0, 4: 11:0, 5: 12:0, 6: 13:0, 7: 14:0, 8: 14:1, 9: 15:0, 10: 15:1, 11: 16:0, 12: 16:1, 13: 17:0, 14: 17:1, 15: 18:0, 16: 18:1 n-9 trans, 17: 18:1 n-9 cis, 18: 18:2 n-6 trans, 19: 18:2 n-6 cis, 20: 18:3 n-6, 21: 18:3 n-3 + 20:0, 22: 20:1, 23: 21:0, 24: 20:2, 25: 20:3 n-6, 26: 20:3 n-3 + 20:4 n-6 + 22:0, 27: 22:1, 28: 20:5 n-3 + 23:0, 29: 22:2, 30: 24:0, 31: 24:1, 32: 22:6 n-3 21 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Beide Säulen-Innenbeschichtungen bestehen zu mindestens 80% aus Cyanopropylpolysiloxan. Herstellerangaben zur genauen Beschaffenheit existieren nicht. Über die Kombination dieser Standardläufe waren alle FAMEs ihren Retentionszeiten zuordenbar. Der qualitative und quantitative Vergleich der Fettsäuremuster erfolgte an beiden Säulen über den Supelco 37 Komponenten-Standard (Sigma-Aldrich, Taufkirchen). Auf der Säule DB-23 (Abb. 2.3.) waren die FS EPA (20:5 n-3) und 22:0 an Position 27 des Chromatogramms sehr dicht aufeinander. Eine Trennung der Peaks war nur schwer möglich. Die anderen versuchsrelevanten FS wurden gut getrennt. ALA (18:3 n-3) lief an Position 19. Auf der Säule CP7419 gab es ebenfalls Koelutionen von FS. EPA koeluierte mit 23:0 an Stelle 28 (Abb. 2.4.). Da 23:0 in biologischem Material aber sehr selten oder gar nicht vorkommt, spielte das keine Rolle. Als interner Standard konnte 23:0 auf dieser Säule nur dann nicht verwendet werden, wenn EPA quantifiziert werden sollte. An Position 26 im Chromatogramm koeluierten die FS 20:3 n-3, ARA (20:4 n-6) und 22:0. Durch wechselseitiges Einspritzen der Proben an beiden Säulen und die Quantifizierung über einen mitgeführten Internen Standard konnte die Koelutions-Problematik beseitigt werden. 2.1.3.4. Temperaturprogramme und Gassystem Gassystem: Trägergas: Helium 4.6, Schönungsgas: Wasserstoff 5.0, Brenngase: Wasserstoff 5.0 und Luft (KW frei). Software: Class-VP (Shimadzu, Japan). DB-23: Säulen-Temperaturprogramm: Vorsäulen- und Säulentemperatur 140°C (1 min), Aufheizrate 5°C/min auf 240°C (9 min). Injekt ortemperaturprogramm: 150°C (1 min), Aufheizrate 6°C/min auf 240°C (14 min). CP7419: Säulen-Temperaturprogramm: Vorsäulen- und Säulentemperatur 120°C, Aufheizrate 4°C/min auf 240°C. Injektortemperaturpro gramm: 150°C, Aufheizrate 4°C/min auf 240°C (7,5 min). 22 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe 2.1.4. Quantifizieren der FAMEs am GC-FID Die qualitative und quantitative Bestimmung der FS erfolgte unter Verwendung Interner Standards und Externer Standards. Materialien: Supelco 37 Komponenten-Standard (Sigma-Aldrich, Taufkirchen), EPAMethylester (Sigma-Aldrich, Taufkirchen), Heptadecansäure/Margarinsäure (17:0, Fluka, Taufkirchen), Tricosansäure (23:0, Fluka, Taufkirchen). Interne Standards Als interne Standards (IS) wurden den Proben in definierten Konzentrationen die FS 17:0 oder 23:0 zugesetzt. Dies sind gängige IS in der Fettsäureanalytik, da sie als FS mit ungerader Anzahl an Kohlenstoffatomen von Organismen selten produziert werden. Damit konnte die Extraktionseffizienz ermittelt werden und die FAMEs konnten ohne Überschneidungen quantifiziert werden. FS-IS wurden als Korrekturstandards (Wiederfindung) während der Extraktion und der Methylierung zugesetzt und gewährleisteten eine Kontrolle über die korrekte Probenverarbeitung, ein korrektes Einspritzvolumen sowie eine exakte Quantifizierung (JOSEPH 1992; SCHREINER 2005). Mit Hilfe der IS 17:0 und 23:0 konnte auf die absolute Konzentration der Fettsäuren bezüglich der Probengewichte zurückgerechnet werden. FS unterschiedlicher Länge und Anzahl an Doppelbindungen zeigen bei selber Konzentration verschiedene Signalstärken bzw. Signalflächen („Response“) am FID (SCHREINER 2005). Die Signalflächen der FS 22:6 sind z.B. bei selber Ausgangskonzentration höher, als die der Fettsäure 20:5 und viel höher als die von 17:0. Über Korrekturfaktoren („Responsefaktoren“) können diese Flächenabweichungen korrigiert werden. Der Faktor für jede einzelne FS errechnet sich aus dem Konzentrations- und Signalflächenabgleich mit einem Mehrkomponentenstandard. Das Signalfläche zu Konzentrationsverhältnis einer FS mit dem Faktor 1 (meist 20:0) dient als Basis für die Abweichungen der anderen FS. Da die Korrekturfaktoren für viele FID-Systeme übereinstimmen, die Gehalte der FS also in selber Weise über- oder unterbewertet werden, kann man auch nach entsprechender Geräte-Kalibrierung einen Korrekturfaktor („Theoretischer Responsefaktor“) aus der Literatur verwenden (ULBERTH et al. 1999). 23 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe In Kap. 3 dieser Arbeit wurden lediglich Wiederfindungskorrekturen mit dem IS 17:0 durchgeführt, denn ging es um vergleichende Studien unterschiedlicher Behandlungen, wobei nicht die absoluten Mengen entscheidend waren, sondern die Unterschiede der Mittelwerte. In Kapitel 4 erfolgte dagegen, erfolgte die Bestimmung der absoluten Konzentrationen der Fettsäuren und EPA in Sporangien, Eidotter und infiziertem Pflanzenmaterial empirisch mit dem 37 Komponenten-Standard (CRASKE & BANNON 1987; ULBERTH et al. 1999). Externe Standards Die Verwendung externer Standards erfolgte zur Identifizierung der FS über die Retentionszeiten (KOLB 2003). Es wurden absichtlich Substanzen gewählt, die in der Probe enthalten waren und deren Retentionszeiten übereinstimmten. Der 37 Komponenten Standard wurde verwendet, da aufgrund der verschiedenen Prozentanteile der Einzelfettsäuren eine genaue Zuordnung durch die Retentionszeiten auf der Säule möglich war. Es war außerdem sehr bequem, nicht jede Fettsäure die man später identifizieren wollte, als Einzelstandard einspritzen zu müssen. Um eine eindeutige Identifizierung von EPA oder einzelnen FS zu gewährleisten, wurden zusätzlich einzelne FAMEs zur Absicherung der Retentionszeiten verwendet. Mit Hilfe des externen Standards EPA-Methylester wurden die EPA-Gehalte der Proben in Kapitel 2 über Eichkurven bestimmt und mit Eichkurven wurde auch der FID kalibriert. Die absoluten EPA-Konzentrationen von Proben konnten durch die Kombination einer externen Eichkurve mit EPA-Methylester und einem 17:0 oder 23:0 Wiederfindungsstandard ermittelt werden, was vom Prinzip her der Methode des empirischen Korrekturfaktors entsprach (siehe Interne Standards). Absicherung der FS-Identitäten Die Identitäten der FS von Oomyceten der Gattungen Bremia und Plasmopara wurden im Rahmen von taxonomischen Arbeiten mittels GC-MS (GaschromatographieMassenspektrometrie) über die molekularen Massenspektren und Retentionszeiten bereits abgesichert (SPRING et al. 2005). Da mit demselben Säulen- und GC-System gearbeitet wurde, konnten die GC-MS-Analyse-Ergebnisse auf diese Arbeit übertragen werden und es waren keine zusätzlichen Absicherungen nötig. 24 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe 2.1.5. DC-Technik Vom ernährungsphysiologischen Standpunkt sind die verschiedenen Lipidklassen von Interesse, da nicht nur FS selbst, sondern auch die Lipidklassen Einfluss auf Prozesse im menschlichen Körper nehmen (SCHNEIDER 2001). Die Charakterisierung der Lipidklassen von potenziellen Lebensmitteln nimmt daher, neben der Fettsäurezusammensetzung oder –konzentration, eine zentrale Stellung in aktuellen Forschungsarbeiten ein (CARVALHO et al. 2005; CHEN et al. 2008; PACETTI et al. 2005). So werden Phospholipide als besonders günstig für die Gesundheit eingeschätzt und als Zutat für „functional food“ postuliert (SCHNEIDER 2001), Acylglyceride gelten ebenfalls als positiv, Freie FS sind dagegen aufgrund ihrer starken Oxidationsanfälligkeit nicht gerne in Lebensmitteln gesehen (MARSHALL et al. 1994). Daher werden Lebensmittel und potenzielle Lebensmittel, wofür auch die Oomyceten in dieser Arbeit betrachtet wurden, auf die Zusammensetzung ihrer Lipide untersucht. Da eine diesbezügliche Untersuchung für obligat-biotrophe Oomyceten aufgrund der schwierigen Kultivierbarkeit noch nicht durchgeführt wurde, bot sich die Analyse der Lipidzusammensetzung für diese Arbeit an. Um die Lipidklassen von P. halstedii und B. lactucae voneinander zu trennen und ihre Fettsäurezusammensetzungen zu ermitteln, wurde kombiniert mit DC und GC gearbeitet. Es werden 2 Lipidgruppen unterschiedlicher chemischer und biologischer Eigenschaften beschrieben. Hierzu gehören die Fettsäurederivate und die Steroidderivate (LOTTSPEICH & ENGELS 2006). Zur Lipidgruppe der Fettsäurederivate zählen die Lipidklassen der Freien FS, der Acylglyceride (Mono-, Di-, Tri-, Glyko-), der Phospholipide (PL) und Wachse, da sich von diesen Lipidgruppen, im Gegensatz zu Steroiden, Sphingolipiden und Alkanen, Fettsäuregruppen chemisch abspalten lassen. Die Lipidklassen wurden über DC nach einem Standardverfahren (BELITZ et al. 2001; PACETTI et al. 2005; SCHREINER et al. 2005) aufgetrennt und die Banden aus dem Kieselgel herauspräpariert. Die enthaltenen FS wurden danach in einem Schritt extrahiert, methyliert und am GC als FAMEs detektiert. Stationäre Phase: Kieselgelplatten Alugram Sil G 60, Schicht 0,2 mm (Nr. 818162, Macherey-Nagel, Düren), DC-Standards: Cholesterin (Nr. 3670, Merck, Darmstadt), Triolein (Nr. T7140, Sigma-Aldrich Taufkirchen,), Sphingomyelin (Nr. 85615, Fluka, 25 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Taufkirchen), L-α-Phosphatidinositol (Nr. P6636, Sigma-Aldrich, Taufkirchen), Heptadecaensäure (Nr. 51633, Fluka, Taufkirchen), L-α-Lecithin (Nr. 42556, Fluka, Taufkirchen). Mobile Phase: Petrolether/Diethylether/Essigsäure (90+10+1 v/v/v). Detektionsreagenz: 2’,7’-Dichlorfluorescein (Nr. 410217, Sigma-Aldrich, Taufkirchen) 0,05% in Methanol (99,8%, Fluka, Taufkirchen,). Herstellung der Probenextrakte von P. halstedii und B. lactucae 50 mg Sporangienpulver ohne Hyphenanteil von P. halstedii (Stamm GG-16.10.97A25) und 40 mg von B. lactucae (Feldisolat der Versuchsstation für Gartenbau, Hohenheim) wurde mit 100 µl n-Hexan/TBME/Methanol 80+15+5 v/v/v 3mal für je 30 min extrahiert. Die Proben wurden 2 min bei 30000 rpm abzentrifugiert, die Überstände wurden vereinigt. Um alle Lipidklassen quantitativ zu extrahieren, wurde ein Gemisch aus polarem (Methanol), mittelpolarem (TBME) und unpolarem (n-Hexan) Lösungsmittel verwendet, da die Lipide selbst verschiedene Polaritäten besitzen und sich danach die Lösungseigenschaften richten. Phospholipide sind polarer als Freie FS, Freie FS sind etwas polarer als Acylglyceride. Herstellung der Standard Lösungen Für jede Lipidklasse wurden repräsentative Standards gewählt und in der Konzentration 5 mg/ml in Lösungsmittel n-Hexan/TBME/Methanol (80+15+5 v/v/v) gelöst (PACETTI et al. 2005; SCHREINER et al. 2004): Cholesterin (Sterine), Triolein (Triacylglyceride), L-α -Phosphatidylcholin (Phospholipide), Sphingomyelin (Sphingophospholipide), L-α-Phosphatidinositol (Glycerophospholipide), C17:0 (Freie FS). Je 500 µl aus den Standardlösungen wurden entnommen und in einer Standardmischung vereint. 26 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Durchführung der DC Die Kieselgelplatten wurden mit Aceton vorgewaschen. Mit Glaskapillaren wurden die Lipidproben der Oomyceten komplett (je 300 µl) und die Standards in 5 cm langen Banden im Abstand von 1 cm vom Unterrand der DC-Platte aufgetragen. Die Detektion erfolgte durch Besprühen mit 2’,7’-Dichlorfluorescein (0,05% in Methanol) und Betrachten unter UV-Licht (254 nm). Um herauszufinden in welcher Lipidklasse welche FS vorhanden waren, wurden die Einzelbanden der Lipide, von denen Fettsäuren abgespalten werden konnten, nämlich Phospholipide, Freie FS und Triacylglyceride aus dem Kieselgel präpariert und in 2 ml Glasgefäße für die GC überführt. Da auf den Ebenen der Di- und Monoacylglyceride kaum Banden sichtbar waren, wurde auf deren weitere Fettsäure-Charakterisierung verzichtet. Dem lipidhaltigen Kieselgelpulver wurden 100 µl n-Hexan und 50 µl TBME zugesetzt. Die Lipide wurden unter Schütteln über Nacht bei RT extrahiert. Am nächsten Tag wurden 250 µl Bortrifluorid-Methanolkomplex zu den Proben gegeben. Die Methylierung und die Messung der FS am GC erfolgten wie unter Kapitel 2.1.2. bis 2.1.4. beschrieben. 27 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe 2.2. Ergebnisse 2.2.1. Qualitative Analyse der FS-Muster von P. halstedii und B. lactucae Das FS-Muster aus dem Gesamtlipidextrakt der Sporangien von P. halstedii des Stammes GG-16.10.97-A25 ist in Abb. 2.5. dargestellt. Die FS 16:0, 18:2 n-6 und 20:5 waren die 3 typischen Hauptfettsäuren der Sporangien von P. halstedii. EPA (20:5 n-3) hatte mit ca. 37% Gesamtanteil den größten Anteil im FS-Muster. % am Gesamtanteil 40 35 30 25 20 15 10 5 0 14:0 16:0 16:1 18:0 Area% 2,60 16,88 0,53 0,49 18:3 n-6 18:3 n-3 20:1 20:2 20:3 20:4 n-6 5,04 24,13 0,55 3,04 1,32 0,97 1,55 4,41 36,76 0,22 0,44 18:1 18:2 n-6 20:5 n-3 22:1 22:2 22:6 FAME n-3 0,45 Abb. 2.5.: FAMEs des Gesamtlipidextraktes aus P. halstedii (Stamm GG-16.10.97-A25). % am Gesamtanteil 35 30 25 20 15 10 5 0 14:0 16:0 16:1 Area% 5,43 17,67 6,27 18:3 n-6 18:3 n-3 20:1 20:2 20:3 20:4 n-6 22:1 22:2 22:6 FAME n-3 0,78 11,70 15,43 0,48 4,55 1,70 0,50 1,04 1,88 29,52 1,71 0,00 1,83 18:0 18:1 18:2 n-6 20:5 n-3 Abb. 2.6.: FAMEs des Gesamtlipidextraktes aus B. lactucae (Feldisolat von der Versuchsstation für Gartenbau, Stuttgart-Hohenheim). 28 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Die FS 18:2 n-6 war mit 24% Anteil am FS-Muster ebenfalls sehr stark vertreten, gefolgt von 16:0 mit ca. 17% Anteil. ALA (18:3 n-3) war mit 3% am FS-Muster vertreten. Weitere typische FS für P. halstedii mit ebenfalls hohen Anteilen am FSMuster waren 14:0, 20:4 n-6 und 18:1 n-9. Die LC-PUFA 22:6 n-3 war mit 0,4% Anteil nur sehr schwach vertreten. Sporangien von B. lactucae enthielten etwa 30% EPA im Gesamtlipidextrakt (Abb. 2.6.). Die FS 18:2 n-6 und 16:0 waren mit je 15-18% Anteil ebenfalls stark am Gesamtfettsäuremuster vertreten. Die n-3-FS 18:3 n-3 und 22:6 n-3 waren mit ca. 5% und 2% stärker vertreten, als bei P. halstedii. Die FS 20:4 n-6 war im Extrakt von P. halstedii mit durchschnittlich 4-6 % Anteil am Gesamtfettsäuremuster deutlich stärker vertreten als bei B. lactucae mit nur ca. 1-2%. Die Verschiedenheit der Fettsäuremuster ist artspezifisch und da es dazu bereits einschlägige Arbeiten gibt (SCHÄUFFELE 2005), soll an dieser Stelle nicht näher darauf eingegangen werden. 2.2.2. Lipidklassentrennung und FS-Zusammensetzung der einzelnen Lipidklassen Um die einzelnen Lipidklassen zu trennen und deren FS-Zusammensetzung zu untersuchen, wurde die DC mit anschließender GC durchgeführt. Die Gesamtlipidextrakte aus 50 mg Sporangien von P. halstedii und B. lactucae wurden mittels DC in ihre Lipidklassen getrennt. Sowohl P. halstedii als auch B. lactucae zeigten Banden auf Höhe aller 4 Lipidklassen, die von Standards repräsentiert wurden (Abb. 2.7.). Die Phospholipide blieben als stark fluoreszierende Banden am Start sitzen, Sterine (Rf 0,07), Freie FS (Rf 0,14) und Triacylglyceride (Rf 0,25) wurden im gewählten Laufmittel aufgetrennt. Zusätzlich fluoreszierten Banden der Monoacylglyceride kurz oberhalb der Phospholipide und der Diacylglyceride kurz oberhalb der Sterine sehr schwach. Diese wurden auf Grund der geringen Substanzmenge jedoch nicht weiter untersucht. Die Breite der Triacylglyceridbanden in den Proben der Oomyceten ließ auf ein Gemisch aus mehreren Komponenten schließen. Da Sterine keine Fettsäurereste enthalten, wurde diese Fraktion für den GC-FID nicht weiterverarbeitet. Von der Leuchtkraft der Lipidbanden her zu schließen, waren 29 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe bei beiden Arten die Triacylglyceride am stärksten vertreten, gefolgt von den Phospholipiden und Freien FS. Standard P. halstedii B. lactucae Abb. 2.7.: DC-Banden der Lipide aus Sporangien unter UV 265 nm. Von links nach rechts: Standardmischung mit Lipiden in aufsteigender Reihenfolge (L-α-Phosphatidylcholin (Rf 0), Cholesterin Rf 0,07, 17:0 (Rf 0,14), Triolein (Rf 0,25)), Lipide aus P. halstedii und B. lactucae. Schwache Banden auf Höhe der Mono- und Diacylglyceride zeigten, dass auch diese Lipidklassen in beiden Arten vertreten waren. Die am GC-FID gemessenen Signale der FAMEs aus den DC-Lipidbanden von P. halstedii und B. lactucae wurden als Bestandteile ihrer Lipidklassen in Prozent am Gesamtlipidmuster dargestellt (Abb. 2.8., 2.9.). So entstand, zusätzlich zur groben Bestimmung der Lipidklassen von P. halstedii und B. lactucae, ein genaues Bild über die Lokalisation der einzelnen Fettsäuren aus dem Gesamtlipidextrakt. Beim Vergleich der FS-Muster der Lipidklassen von P. halstedii und B. lactucae (Abb. 2.8. u. 2.9.) ergibt sich, aus der Senkrechtaddition der Werte jeder einzelnen FS für Triacylglyceride, Phospholipide und Freien Fettsäuren, der Gesamtanteil der FS im Gesamtextrakt. Aus der Waagrechtaddition aller FS-Anteile innerhalb der Triacylglyceride bzw. Freien FS oder Phospholipide ergibt sich der Gesamtanteil der Lipidklassen am Gesamtmuster. Die Gesamtgehalte aus der Senkrecht bzw. Waagrechtaddition sind in den Abb. 2.8. und 2.9. nicht zusätzlich aufgeführt. Addiert man die FS aus Sporangien von P. halstedii waagrecht (Abb. 2.8.), so lagen diese insgesamt zu ca. 60,8% als Triacylglyceride, zu 32,4% als Phospholipide und zu 6,8% als Freie FS vor. Bei Senkrechtaddition lag die FS 20:5 n-3 insgesamt zu 30 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe 18,89% am Gesamtmuster vor: Mit 12,18% in Triacylglyceriden, mit 6,44% in Phospholipiden und mit 0,27% in Spuren als Freie FS. Das Balkendiagramm für die einzelnen FS entstand folgendermaßen: Wurde der Wert 18,89% von z.B. 20:5 n-3 auf 100% gesetzt, so zeigte sich, dass die FS 20:5 n-3 zu einem Anteil von 67,67 in Triacylglyceriden, zu 34,1 % in Phospholipiden und zu 1,4% in Freien FS vorkam. Prozent im Lipidextrakt 100% 80% 60% 40% 20% 0% 14:0 16:0 16:1 18:0 18:1 n-9 18:3 n-3 20:1 20:2 20:3 n-6 20:3 n-3 20:4 n-6 TAG 4,54 12,00 1,21 0,68 6,41 18:2 n-6 18:3 n-6 13,12 0,43 2,09 1,22 0,22 0,96 1,62 0,25 20:5 n-3 22:6 n-3 12,18 0,52 Freie FS 0,18 1,19 0,00 0,47 0,95 0,21 0,33 0,00 0,16 0,00 0,00 0,00 2,85 0,27 0,00 PL 0,72 11,21 0,33 0,49 1,97 7,35 0,15 0,95 0,57 0,00 0,51 0,89 0,00 6,44 0,28 FAME Abb. 2.8.: Zusammensetzung des FS-Musters der Lipidklassen von P. halstedii (Stamm GG16.10.97-A25). Von links nach rechts ist für jeden FAME im Gesamtlipidextrakt der Anteil (%) in den Lipid-klassen der Phospholipide (PL, gestreifte Balken), Freien FS (weiße Balken) und der Triacylglyceride (TAG, schwarze Balken) aufgeführt. Prozent im Lipidextrakt 100% 80% 60% 40% 20% 0% 14:0 16:0 16:1 18:0 18:1 n-9 18:2 n-6 18:3 n-6 18:3 n-3 20:1 20:2 20:3 n-6 20:3 n-3 20:4 n-6 20:5 n-3 22:6 n-3 TAG 5,20 8,87 0,77 1,23 7,48 6,27 0,36 2,60 1,35 0,00 0,45 0,62 0,16 8,22 0,31 Freie FS 5,37 4,80 0,23 1,87 2,14 1,96 0,00 0,94 0,48 0,00 0,08 0,17 0,00 5,38 0,55 PL 2,20 8,15 0,75 0,88 2,30 5,58 0,20 1,81 0,50 0,20 0,00 0,40 0,00 6,36 0,83 FAME Abb. 2.9.: Zusammensetzung des FS-Musters der Lipidklassen von B. lactucae (Feldisolat der Versuchsstation für Gartenbau, Hohenheim). Von links nach rechts ist für jeden FAME im Gesamtlipidextrakt der Anteil (%) in den Lipidklassen der Phospholipide (PL, gestreifte Balken), Freien FS (weiße Balken) und der Triacylglyceride (TAG, schwarze Balken) aufgeführt. In ähnlichen Größenverhältnissen (Triacylglyceride > Phospholipiden > Freie FS) wie 20:5 n-3, lagen auch die FS 16:1, 18:2 n-6, 18:3 n-3, 20:3n-6, 20:3 n-3 und 22:6 n-3 als Triacylglyceride, Phospholipide oder Freie FS vor. Die FS 16:0, 18:0, 18:1 n-9, 18:3 n-6 sowie 20:1 kamen in allen 3 Lipidklassen in nennenswerten Anteilen vor. 31 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Besonders auffällig war die FS 20:2, die beinahe ausschließlich als Triacylglycerid vorlag, sowie die FS 20:4 n-4, die fast nur als Freie FS vorlag. Addiert man die FS aus Sporangien von B. lactucae waagrecht (Abb. 2.9.), so lagen diese insgesamt zu ca. 45% als Triacylglyceride, zu 31% als Phospholipide und zu ca. 24% als Freie FS vor. Bei Senkrechtaddition lag die FS 20:5 n-3 insgesamt zu 19,95% am Gesamtmuster vor: Mit 8,22% in Triacylglyceriden, mit 6,36% in Phospholipiden und mit 5,38% in Freien FS. Wurde der Wert von 19,95% für das Balkendiagramm auf 100% gesetzt, so zeigte sich, dass die FS 20:5 n-3 von B. lactucae zu 41,2% aus Triacylglyceriden, zu 31,9% aus Phospholipiden und zu 26,9% aus Freien FS stammte. Die Sporangien von B. lactucae enthielten insgesamt deutlich mehr Freie FS als die Sporangien von P. halstedii. Die Freien FS dominierten besonders bei 14:0 und 18:0. Als Phospholipide lagen vor allem 16:1 und 22:6 n-3 vor. Bei 16:0, 16:1, 18:1 n-9, 18:2 n-6, 18:3 n-3, 20:1 und 20:3 n-3, waren, wie bei 20:5 n-3, Triacylglyceride und Phospholipide etwa gleich stark vertreten, wobei beachtliche Anteile an Freien FS zu finden waren. Deutlich mehr Triacylglyceride als Phospholipide bei einem sehr geringen Anteil an Freien FS enthielt nur die FS 18:3 n-6. Besonders auffällig waren die FS 20:3 n-6 und 20:4 n-6, die beinahe nur als Triacylglyceride vorlagen, sowie die FS 20:2, die hauptsächlich in der Phospholipidfraktion gefunden wurde. 2.2.3. EPA-Konzentrationen von Sporangien und Wirtsgewebe Die absoluten Konzentrationen an EPA, die mit Hilfe einer EPA-Eichkurve und dem 17:0 IS bestimmt wurden (vgl. Kap. 2.1.4.), betrugen in den Sporangien von P. halstedii 25-30 mg EPA/g FG. Die absoluten Konzentrationen an EPA in infiziertem Sonnenblumengewebe lagen bei maximal 1,1 mg pro g TG (Tab. 2.1.). Die absoluten Konzentrationen an EPA in den Sporangien von B. lactucae betrugen durchschnittlich 8-13 mg EPA/g FG, in infiziertem Salatgewebe lagen die EPAKonzentration jedoch, ähnlich wie bei infiziertem Sonnenblumengewebe, bei maximal 1,0 mg EPA/ g TG. 32 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Tab. 2.1.: EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe: P. halstedii (Stamm BL-11.06.02-A4z), B. lactucae (Feldisolat der Versuchsstation für Gartenbau, Hohenheim) und Peronospora swinglei (Supermarktware (Isolat 867)). ___________________________________________________________________ Kultursystem Wirtsgewebe Infektionsdauer (Tage) P. halstedii Sonnenblumenkeimlinge 14 B. lactucae adulte Salatblätter 7-10 P. swinglei adulte Blätter nicht getestet EPA-Konzentration (mg/g TG) Sporangien Inf. Gewebe 25-30 1,1 8-13 1,0 30-38 1,4 ___________________________________________________________________ Die Analyse der EPA-Gehalte einer weiteren Wirt-Parasit-Kombination, Ocimum basilicum L. (Basilikum) und Peronospora swinglei, ergab EPA-Konzentrationen in Sporangien von durchschnittlich 30-38 mg EPA/g FG und EPA-Konzentrationen von infiziertem Gewebe von maximal 1,4 mg EPA/g TG. Da diese Werte im selben Produktivitätsbereich wie für P. halstedii und B. lactucae lagen, wurde in dieser Kombination kein Vorteil im Hinblick auf die Zielsetzung der Arbeit gesehen. Die im Labormaßstab erzielten EPA-Gehalte wurden für B. lactucae im Großmaßstab hochgerechnet, um einen Vergleich mit der EPA-Produktivität derzeit verwendeter Systeme aus dem Bioreaktor zu ermöglichen. Es wurden die Produktivitäten in g EPA pro Tag im Volumen (Bioreaktormedium) bzw. der Fläche (benötigte Fläche für Pflanzen) verglichen. In Tabelle 2.2. erfolgt ein Vergleich der theoretisch erzielbaren EPA-Produktivität von Sporangien von B. lactucae sowie der theoretisch (unter Laborbedingungen) erzielbaren EPA-Produktivität von infiziertem Salat (auf einer theoretischen Anbaufläche) mit den derzeit leistungsfähigsten EPA-Produktivitäten anderer Organismen, die jedoch in Bioreaktoren gezüchtet werden (W ARD & SINGH 2005). Die höchste EPA-Produktivität von Oomyceten aus optimierten Systemen erreicht die Gattung Thraustochytrium mit maximal 47 mg EPA/L•Tag. In optimierten BioreaktorSystemen können derzeit von Schizochytrium Stämmen DHA-Konzentrationen von bis zu 10 g/L•Tag produziert werden, Schizochytrium Stämme sind jedoch bezüglich 33 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe EPA wenig produktiv. Im Vergleich dazu produziert die Mikroalge Nitzschia alba 100300 mg EPA/L•Tag und Phaeodactylum tricornutum produziert im Photobioreaktor 40 mg EPA/L•Tag. Tab. 2.2.: Vergleich der erzielbaren EPA-Produktivität. Systeme im Bioreaktor (g/L•d) nach WARD & SINGH 2005 und die theoretisch erzielbare EPA-Produktivität von B. lactucae auf Salat (g/(m²•d). Hochgerechnete EPA-Mengen sind blau dargestellt. Kultursystem Erzielbare EPA-Produktivität B. lactucae Sporangien (FG) 0,047 g/(m²•d) Inf. Salat (TG) 0,280 g/(m²•d) Phaeodactylum tricornutum (TG) 0,040 g/(L•d) Thraustochytrium sp. (TG) 0,047 g/(L•d) N. alba (TG) 0,1-0,3 g/(L•d) Für die EPA-Produktivitätsprognosen von B. lactucae wurden folgende Hochrechnungen angestellt: Um 1 g Sporangien zu produzieren waren für infizierten Salat unter genannten Laborbedingungen (vgl. Kap. 2.1.1.) Infektionszeiten von 7-10 Tagen, für infizierte Sonnenblumen von 14-16 Tagen nötig. Für die Produktivität von 47 mg EPA/ m² •Tag aus Sporangien von infiziertem Salat wäre eine absaugbare Pflanzenoberfläche der Blätter von ca. 26 ausgewachsenen Salatköpfen nötig, wofür ca. 3 m² Anbaufläche benötigt würden. In infiziertem, getrocknetem Pflanzengewebe konnte mit Salat etwa 1 mg EPA/g produziert werden. Daher könnten rein rechnerisch in 7 Tagen (nach vorangegangener 8-wöchiger Salatanzucht) nach optimierter Infektion und optimierten Sporulationsbedingungen auf 60 m² Fläche ca. 120 kg infizierter Salat gezüchtet werden. Dies entspräche einer Produktivität von 280 mg EPA/ m² •Tag aus B. lactucae infiziertem Salat. 34 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe 2.3. Diskussion 2.3.1. Qualitative FS-Zusammensetzung von P. halstedii und B. lactucae P. halstedii und B. lactucae wiesen mit 30-40% ähnlich hohe Anteile an EPA wie andere Systeme auf, die bereits großtechnisch für die menschliche Ernährung verwendet werden (WARD & SINGH 2005). So produziert Phaeodactylum tricornutum unter optimalen Bedingungen im Bioreaktor ca. 35 % EPA an seinem FS-Muster, der Eumycet Mortierella alpina produziert EPA zu 20% seines FS-Musters, Thraustochytrium-Stämme produzieren 30-40% EPA in ihrem FS-Muster. Vergleicht man die relativen FS-Anteile von P. halstedii und B. lactucae, so hat EPA in P. halstedii mit durchschnittlich 37 % EPA einen etwas höheren Anteil am FSMuster als in B. lactucae mit 29% (Abb. 2.5. u. 2.6.). Trotz etwas geringerer EPAAnteile am Gesamtmuster hat B. lactucae gegenüber P. halstedii jedoch den Vorteil, als Pathogen auf einem Nahrungsmittel zu wachsen, das in großen Mengen roh verzehrt wird, während die befallenen Teile der Sonnenblumen nicht nahrungsrelevant für den Menschen sind. 2.3.2. Lipidklassenzusammensetzung Die FS-Muster sowie die Fettsäuren der einzelnen Lipidklassen wurden für manche Oomyceten (HUANG et al. 2001; KENDRICK & RATLEGE 1992), Mikroalgen (GALANINA & KONOVA 1998; SANINA et al. 2008), Pilze (KOCK & VAN DER W ALT 1986) und Höhere Pflanzen (MONGRAND et al. 2001) für taxonomische und industrielle Zwecke intensiv erforscht. Für die meisten Gattungen und Arten der Oomyceten sind bisher jedoch weder die Fettsäurezusammensetzungen der einzelnen Lipidklassen noch die Gesamtlipidmuster bekannt. Vergleicht man die Gesamtlipidmengen der Abb. 2.5. u. 2.6. mit denen der Abb. 2.8. u. 2.9., so wurden im Gegensatz zum Gesamtlipidextrakt ohne DC-Auftrennung für P. halstedii und B. lactucae nicht 37 bzw. 29% EPA im Extrakt sondern lediglich 18,89 % bzw. 19,95% EPA wiedergefunden. Dies lässt sich jedoch dadurch erklären, dass bei der Auftrennung per DC natürliche Verluste auftraten, die durch oxidative Prozesse und Verschleppung auf dem Kieselgel verursacht wurden. Diese Verluste traten bei P. halstedii und B. lactucae in selber Weise auf. Bei den ungesättigten FS 35 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe verstärkte sich dieser Verschleppungseffekt mit zunehmender Anzahl an Doppelbindungen gegenüber den gesättigten FS zusätzlich, was auf wesentlich niedrigere Siedepunkte und damit verbundener stark erhöhter Flüchtigkeit zurückzuführen war. Die prozentualen Zusammensetzungen der FS in den einzelnen Lipidklassen unterschieden sich zwischen P. halstedii und B. lactucae. Vergleicht man die Zusammensetzung dominierender FS wie 20:5 n-3, 18:2 n-6 oder 16:0 von P. halstedii und B. lactucae, so fällt auf, dass B. lactucae wesentlich mehr Freie FS als P. halstedii enthält. Die Anteile von Triacylglyceriden und Phospholipiden überwogen jedoch bei beiden Organismen gegenüber den Freien FS. Lediglich im Gesamtextrakt schwach vertretene FS (Abb. 2.8. u. 2.9.) wie 20:4 n-6, 20:2, 20:3 n-6 21:0, 22.1 oder 22:6 n-3 unterschieden sich extrem in ihrer Lipidklassenzusammensetzung, was jedoch sehr wahrscheinlich ein methodisches Problem der verlässlichen Quantifizierung im Bereich der Nachweisgrenze ist. Das sehr unterschiedliche Vorhandensein von Einzelfettsäuren in den unterschiedlichen Lipidklassen könnte zudem an verschiedenen Entwicklungsstadien der Sporangien und auch Umwelteffekten liegen, da bei B. lactucae ein Feldisolat verwendet wurde, bei P. halstedii dagegen ein regenerierter Laborstamm. Die Unterschiede in der Zusammensetzung der Freien FS zwischen B. lactucae und P. halstedii, besonders im Hinblick auf 20:5 n-3 und 20:4 n-6, sollten daher nochmals näher untersucht und in einem anderen Zusammenhang diskutiert werden. Eventuell ließe sich durch weitere Messungen bestätigen, dass die Zusammensetzung der einzelnen Lipidklassen taxonspezifisch ist, dann wäre es mit genügend zur Verfügung stehendem Sporangienmaterial eventuell auch möglich über einen „FS-Strichcode“ eine Art zu identifizieren. Da Fettsäuremuster taxonspezifisch sind (SPRING & THINES 2004; SPRING et al. 2006), würde ihre weitere Erforschung, neben dem Potenzial zur industriellen Nutzbarkeit, eine reizvolle Ergänzung zu molekularbiologischen Untersuchungen bieten. Die Hauptfettsäuren von P. halstedii und B. lactucae (16:0, 18:1 n-9, 18:2 n-6, 20:5 n-3) lagen zu sehr hohen Anteilen als Neutrallipide (Triacylglyceride) vor, es existierten jedoch auch nennenswerte Anteile an polaren Lipiden wie Phospholipiden gefolgt von Freien FS. Ferner wurden per DC geringe Mengen an Mono- und 36 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Diacylglyceriden detektiert. Im Vergleich dazu zeigte eine Studie zur Lipidklassenverteilung von Thraustochytrium, dass dort Triacylglyceride mit 44-68% am Gesamtlipidanteil überwogen, gefolgt von Phospholipiden mit ca. 29% Anteil (KENDRICK & RATLEGE 1992), was einer sehr ähnlichen Lipidklassenzusammensetzung wie für P. halstedii und B. lactucae entspricht. Freie FS wurden genannter Studie nicht behandelt. Die Anwesenheit von Phospholipiden und Triacylglyceriden konnte für P. halstedii und B. lactucae als positive potenzielle Lebensmitteleigenschaft bewertet werden, von den Freien FS musste jedoch befürchtet werden, dass sie sich aufgrund ihrer hohen Oxidationsanfälligkeit negativ in einem potenziellen Lebensmittel auswirkten. In ernährungsphysiologisch wertvollen Pflanzenölen sind die ungesättigten FS nur als Triacylglyceride gespeichert und werden, besonders in Sonnenblumen und Walnussöl, zusätzlich durch die Produktion des Lipidvitamins Tocopherol (Vitamin E) vor Oxidation geschützt (BÄSSLER 1991). Tierische Lipide enthalten im Vergleich zu Ölen Höherer Pflanzen neben Triacylglyceriden auch Phospholipide. Eidotterlipide bestehen z.B. zu ca. 67% aus Triacylglyceriden und zu 25 % aus Phospholipiden. Die übrigen Lipide sind Sterole, die zu 98% aus Cholesterin bestehen (SCHREINER et al. 2005). Freie FS finden sich dagegen in ranzigem Öl und in verdorbenem Eidotter. Sind Freie FS in einem Lebensmittel vorhanden, so tragen zu dessen ernährungsphysiologischer Wertminderung bei (BELITZ et al. 2001). 2.3.3. EPA-Konzentrationen in Sporangien u. infiziertem Pflanzengewebe Die beinahe selben EPA-Konzentrationen in infiziertem Pflanzengewebe bei jedoch recht unterschiedlichen EPA-Konzentrationen in Sporangienlipiden könnten dadurch erklärt werden, dass die 3 Arten P. halstedii, B. lactucae und P. swinglei ihre Sporangien zwar in unterschiedlichem Maße mit FS ausstatten, der Mycelanteil im Pflanzengewebe jedoch verschieden ist. Eine weitere Erklärung wäre, dass die Lipidgehalte der Erreger aus entsprechendem Pflanzengewebe in Mycel und Sporangien stark variieren. Da eine gesonderte Analyse des Mycels auf Grund der Untrennbarkeit vom Wirtsgewebe nicht möglich ist, konnte dem Phänomen nicht weiter nachgegangen werden. 37 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe Sporangienpulver von P. halstedii bzw. B. lactucae enthielt 25-30 bzw. 8-13 mg EPA/ g FG. Um 1 g Sporangien von B. lactucae zu produzieren wären bei einem Durchschnittswert von 10 mg EPA/g TG gemäß Hochrechnung (Tab. 2.2.) die Blätter von ca. 26 optimal infizierten Salatköpfen auf 3 m² Fläche nötig. Die Realisierung dieser Mengen scheitert derzeit jedoch an geeigneten Anzucht- und Produktionssystemen, die auf sehr großer Fläche (mehrere hundert m²) mit optimaler Technik steuerbare Umweltverhältnisse bieten sollten und gleichmäßige Sporulation sowie eine ökonomische Ernte der Sporangien gewährleisten müssten. In Anbetracht der Nutzung von infiziertem Salatgewebe sind die EPA-Produktivitätsvergleiche von B. lactucae mit bisher verwendeten Bioreaktor-Systemen recht vielversprechend. Vergleicht man die im Reaktor erzielbaren EPA-Mengen von 40300 mg EPA/ L • Tag mit 280 mg EPA/ m² • Tag aus infiziertem Salat, so läge man in mengenmäßig konkurrenzfähigen Dimensionen. Das System B. lactucae/ Salat wäre gegenüber der derzeitigen EPA-Produktion im Bioreaktor konkurrenzfähig, wenn es betriebswirtschaftlich günstiger wäre, optimiert billiger in der Fläche zu produzieren als im Bioreaktor. Es bestehen jedoch derzeit keine optimierten Infektions- und Anzuchtsysteme für infizierten Salat auf Großflächen, die erst entwickelt werden müssten, um diese Rechnung zu verifizieren, so dass die Diskussion damit hinfällig wird. Für den direkten menschlichen Verzehr sind die Gehalte an EPA in infiziertem Pflanzengewebe mit 1 mg/g TG etwa um den Faktor 10 zu niedrig dosiert, da pro Tag 150-300 mg EPA aufgenommen werden sollen. Um diese Menge EPA aufzunehmen müsste man nach bisherigen Rechnungen am Tag z.B. 1,5-3-kg frischen, infizierten Salat essen. Könnte man den EPA-Gehalt jedoch um Faktor 10 steigern, so wäre die tägliche Aufnahmemenge mit 150 g Salat (eine große Portion) durchaus realistisch. 38 2. Qualitative FS-Zusammensetzung und EPA-Konzentrationen in Sporangien und infiziertem Pflanzengewebe 2.4. Schlussfolgerungen Sowohl die qualitativen FS-Muster von P. halstedii und B. lactucae als auch die Fettsäurezusammensetzungen der Lipidklassen von Sporangien wurden für die menschliche Ernährung wegen der hohen EPA-Gehalte in Form von Triacylglyceriden und Phospholipiden als geeignet erachtet. Die EPA-Konzentrationen in Sporangien (10-30 mg EPA/g FG) und infiziertem Gewebe (ca. 1 mg EPA/g TG) erreichten ebenfalls nennenswerte Größen. Die theoretisch erzielbare EPA-Produktivität mit infiziertem Salat pro Flächeneinheit lag mit 0,28 g/(m²•d) im Wertebereich der derzeit erzielbaren Mengen im Bioreaktor pro Volumeneinheit durch andere Systeme. Es wurden jedoch keine weitere Studien durchgeführt um diese Rechnung zu verifizieren, da dies bereits großtechnische Dimensionen annehmen würde und in dieser Arbeit, im Rahmen der Mittel (Arbeitsaufwand, Zeit, begrenzter Raum, Kosten), der Fokus auf der natürlichen Produktion lag. Da EPA-Mengen von 1 mg/g TG in infiziertem Sonnenblumen- bzw. Salatgewebe nicht genügen, um den täglichen menschlichen Bedarf an EPA zu decken, sollte nun, im Rahmen der Möglichkeiten und im Labormaßstab, mit Optimierungsversuchen getestet werden, ob eine relevante Steigerung (Faktor 10) der EPA-Produktion auf natürlichem Wege möglich war. 39 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.1. Einleitung Nach den Schlussfolgerungen in Kap. 2 galt es die Fragen zu klären, auf welche Weise und in wieweit man die EPA-Gehalte von P. halstedii bzw. B. lactucae durch Selektion des Ausgangsmaterials oder Modifikation der Kulturbedingungen steigern konnte. Da die Biologie von P. halstedii bereits untersucht war (ROZYNEK 2000) und Infektionstechniken und genetisch homogene Stämme zur Verfügung standen, wurde P. halstedii als Modellbeispiel für Optimierungsversuche herangezogen. Zunächst wurde erforscht, ob eine natürliche genetische Variabilität zwischen verschiedenen Pathogenstämmen existierte, die eine Selektion besonders leistungsfähiger Stämme ermöglichte. Für Arten der Gattung Thraustochytrium wurden schon mehrere leistungsfähige Stämme für die Produktion von DHA entdeckt (HUANG et al. 2001). Analog dazu wurde auf Seite der Wirtspflanze getestet, ob Sorten oder Linien existieren, die besonders anfällig sind und dadurch eine erhöhte Besiedelung zulassen, was mehr EPA im Gewebe zur Folge haben könnte. Zusätzlich wurde versucht, den EPA-Gehalt über den Infektionsdruck zu beeinflussen. Abschließend sollte die Frage geklärt werden, ob und wie sich die FS-Konzentrationen von infizierten und gesunden Pflanzen im Hinblick auf extreme und optimale Stickstoffgaben (N) in Form von Calciumnitrat Ca(NO3)2 änderten. Um Bodeneffekte zu vermeiden, wurde eine Nährlösungskultur etabliert. So konnten alle Nährstoffe gezielt verabreicht und bis auf den variierten Makronährstoff N gleichgehalten werden. Aus Ernährungsstudien von Algen aus de Bioreaktoren war bereits bekannt, dass über den Faktor Ernährung der EPA-Gehalt positiv beeinflusst werden kann (KHOZIN-GOLDBERG & COHEN 2006). Aus einer aktuellen Studie ging zudem hervor, dass der Feldbefall von Wegerich mit dem Oomyceten Peronospora plantaginis durch hohe N-Düngergaben stark gefördert wurde (MANDAL et al. 2008). 3.2. Materialien und Methoden 3.2.1. Artinternes Screening auf EPA-Gehalte in Sporangien Der erste Schritt bestand darin, nach leistungsfähigen, geeigneten Stämmen von P. halstedii zu suchen, die möglichst hohe Mengen an EPA produzierten. Es sollte geklärt werden, ob grundsätzlich zwischen den Isolaten signifikante Unterschiede im 40 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii absoluten EPA Gehalt bestanden und ob sich eine Selektion in diese Richtung lohnen würde. Die Anzucht von 4 verschiedenen Stämmen von P. halstedii für die Fettsäureanalyse erfolgte auf der Sorte Giganteus und 8 weiteren Sonnenblumenlinien. Ziel war es, Sporangien, die von derselben Wirtssorte/-linie geerntet wurden, auf ihre absoluten EPA-Gehalte hin zu testen um eventuelle Unterschiede zwischen verschiedenen Stämmen zu entdecken. Da die Erreger auf derselben Wirtssorte/-linie unter selben Bedingungen angezogen wurden, konnten Umwelteffekte ausgeschlossen werden. Materialien: Je 20 Sonnenblumenkeimlinge: Sorte Giganteus, Linien HA821, HA304, RHA 265, RHA 274, DM2, PM13, 799-2, 803-1; Einheitserde; Saatschalen; genetisch homogene Isolate von P. halstedii: Stämme LS-13.12.05-C6, BL-11.06.02-A4z, GG16.10.97-A25, HE-10.01.06-A8. 20 Sonnenblumensamen der jeweiligen Sorte/Linie wurden 24h im Wärmeschrank bei 20°C angekeimt und mit der WSI Methode (vgl. Ka p. 2.1.1.1.) infiziert. Für die Fettsäureanalysen wurden für ein Isolat je 7 Keimlinge geerntet. Da jedes Isolat auf 9 Wirten angezogen wurde, standen pro Isolat 63 Messwerte zur Verfügung. Die statistische Analyse erfolgte wie in. Kap. 3.2.5. beschrieben. Mikroskopische Kontrolle und Aufbereitung der Sporangien für die GC-Analyse Die Sporangien wurden mit einer Mikroabsaugvorrichtung in 2 ml Plastikreaktionsgefäße überführt. Um eine möglichst gute Vergleichbarkeit der Proben zu gewährleisten und homogenes Probenmaterial zu schaffen, wurden die Sporangien einer mikroskopischen Kontrolle unterzogen. Die Hyphenanteile der Proben lagen unter 5%. Dies wurde dadurch erreicht, dass die Hyphen, die sich nach dem Absaugvorgang als wolliges Knäuel oberhalb des Sporangienpulvers sammelten, mit Hilfe einer Pinzette entfernt wurden. Das Sporangienpulver wurde bis zur Extraktion bei -20°C tiefgefroren. Die Aufbereitung der Lipide der Sporangien für die qualitative und quantitative GCAnalyse erfolgte wie in Kapitel 2.1.2.-2.1.4. beschrieben. 41 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.2.2. Erfassen besonders EPA-reicher Sonnenblumensorten/-linien Bei einem obligat-biotrophen System liegt es auch am Wirt, wie gut sich der Parasit entwickelt. Daher lag der Schritt nahe, innerhalb der Wirtsart Sonnenblume nach Genotypen zu suchen, die besonders anfällig für P. halstedii waren und dementsprechend viel Mycel und EPA im Gewebe enthielten. Von Arbeiten aus dem Pflanzenschutz war bekannt, dass es nicht nur besonders virulente Stämme (GULYA et al. 1991) sondern auch besonders anfällige Sonnenblumensorten bzw -linien für P. halstedii gab. Die Materialien und Methoden für Anzucht und Infektion entsprachen im Wesentlichen denen von Kapitel 2.1.1.1. bis auf die Infektion, die mit einem Isolat, BL11.06.02-A4z von P. halstedii, für 10 Wirtssorten/-linien (zusätzliche Linie PM-17) durchgeführt wurde. Nach 12 Tagen waren die Sonnenblumenkeimlinge bereits sehr stark befallen und mussten geerntet werden. Die Biomasse jedes Keimlings mit Keimblättern und 2 cm Stängel wurde an der Analysenwaage bestimmt. Ernte und Lagerung von getrocknetem Pflanzenmaterial erfolgten wie unter 2.1.1.3. beschrieben. Die Extraktion, Methylierung und Quantifizierung der FS aus dem Pflanzengewebe erfolgten wie in Kapitel 2.1.2.-2.1.4 beschrieben. 3.2.3. Variation des Infektionsdrucks Der Infektionsdruck wurde über das Sporangieninokulum definiert. Anhand der Biomasse und der EPA-Konzentrationen des Pflanzengewebes wurde die Auswirkung des Infektionsdrucks gemessen. Je 25 Sonnenblumenkeimlinge der Sorte Giganteus wurden mit 3 verschiedenen Inokuli des genetisch homogenen Erregerstammes BL-11.06.02-A4z (vgl. Kap. 2.1.1.) infiziert. 2000 Sporangien/ml sollten schwach infizieren, 5000 Sporangien/ml eine mittelschwere Infektion auslösen und 10000 Sporangien/ml sollten zu einer schweren Infektion, bis hin zum Absterben von Pflanzen, führen. Die entsprechend infizierten Keimlinge wurden nach 16 Tagen Infektion gleichmäßig oberirdisch abgeerntet und gewogen. Die Frischgewichte (FG) und die Letalität der Pflanzen nach Behandlung mit 2000, 5000 und 10000 Sporangien/ml wurden verglichen. 42 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.2.4. Variation des Stickstoffangebotes 3.2.4.1. Etablieren der Nährlösungskultur Die Pathogenanzucht erfolgte wie unter 2.1.1.1. beschrieben. Im Unterschied dazu fand die Infektion jedoch nicht in Erd- sondern in Hydrokultur statt, wofür die Sonnenblumen daher speziell angezogen wurden. Materialien: Sonnenblumensaatgut der Sorte Giganteus, Bechergläser (100 ml), stumpfe Pinzette, Sieb, destilliertes Wasser, frische Sporangien von P. halstedii Erregerisolat BL-11.06.02-A4z, Wärmeschrank, Klimakammer (16°C, 80% Luftfeuchte), Filterpapier DIN A 2, verschließbare, transparente Anzuchtboxen. Gesunde (Kontrollpflanzen) und mit P. halstedii infizierte Sonnenblumenpflanzen wurden räumlich getrennt, jedoch zeitgleich, angezogen. Aussaat und Keimung: Sonnenblumensaatgut der Sorte Giganteus wurde sorgfältig in einem Sieb mit destilliertem Wasser abgespült. Die Keimlinge wurden in flachen Plastikschalen auf feuchtem Papier verschlossen und dunkel im Wärmeschrank für 12 h bei 23°C angekeimt. Am nächsten Tag wurden alle Sonnenblumenkerne von Hand mit einer stumpfen Pinzette von ihren Schalen befreit. Die angekeimten Samen kamen am 1. Tag nach Aussaat ohne Schale in Bechergläser mit destilliertem Wasser. Das Saatgut wurde in 2 x 120 Keimlinge in 100 ml Bechergläser mit dest. Wasser aufgeteilt. Eine Hälfte wurde infiziert, die andere Hälfte blieb ohne Infektion. Am 2. Tag nach Aussaat bzw. nach einem Tag im Becherglas wurden das infizierte und gesunde Saatgut nicht in Erde gepflanzt, sondern auf Filterpapier ausgelegt. Das Filterpapier war mit destilliertem Wasser getränkt und wurde so gefaltet, dass die Keimlinge darin ein Hypokotyl ausbilden konnten, das lang genug war, um die Pflanzen später mit Schaumstoff in Hydrokultur zu pflanzen. Infiziertes und gesundes Saatgut wurden je mit sterilen Gerätschaften und zeitlich um eine Stunde getrennt behandelt, um einer eventuellen Infektion des gesunden Kontrollsaatgutes vorzubeugen. Das Filterpapier mit den Sonnenblumenkeimlingen wurde mit Bodenkontakt 43 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii in eine transparente Plastikwanne mit Deckel gestellt, die zu 2 cm mit destilliertem Wasser gefüllt war. Gesundes und infiziertes Pflanzenmaterial wurden in getrennte Wannen gestellt und an verschiedenen Orten über Nacht mit geschlossenen Deckeln bei 15°C gelagert. Am 3.Tag nach Aussaat wurden die transparenten Gefäße in geschlossenem Zustand (Schutz vor Läusen und anderen Schädlingen) ins Gewächshaus überführt, damit die Pflanzen ergrünen konnten. Am 4. Tag nach der Aussaat wurden die Pflanzen in eine belüftete Nährlösungskultur in die Klimakammer überführt (Abb. 3.1.). Materialien: Klimakammer, 24 Nährlösungstöpfe a 2,5 l, 240 Schaumstoffstreifen, 24 Silikonschläuche mit Glasausgang für die Töpfe, Nadeln für den Pumpenanschluss, Luftpumpe, Nährlösungen. Abb. 3.1.: Nährlösungskultur mit Sonnenblumen. Links: Belüftete Nährlösungskultur in der Klimakammer. Mitte: Mit BL-11.06.02-A4z infizierte Keimlinge der Sorte Giganteus nach 14 Tagen Infektionszeit. Rechts: Giganteus-Kontrolle ohne Infektion nach 14 Tagen. Die Pflanzen wurden bis zum 15. Tag nach Aussaat unter kontrollierten Bedingungen in einer Klimakammer (16/8 h Tag/Nacht, 20°C, 70% re lative Luftfeuchte, Lichtintensität (Photonenfluss) 250 µmol/m²•s) kultiviert. In jedes Gefäß (Fassungsvermögen 2,5 l), welches bis 2 cm unter den Rand mit Nährlösung befüllt war, wurden 10 Keimlinge gesetzt. Jeder Gefäßdeckel hatte 10 runde Löcher, in welche die Keimlinge, in Schaumstoffstreifen gewickelt, in das Gefäß gepfropft werden konnten. Die Zusammensetzung der Nährlösung (mmol/L) für Sonnenblumen folgte den Angaben von Dannel bzw. Pfeffer (DANNEL et al. 1995; PFEFFER 1999): 0,7 K2SO4, 0,1 KCl, 0,5 MgSO4, 0,1 KH2PO4, 0,5 x 10-3 MnSO4, 0,5 x 10-3 ZnSO4, 0,2 x 10-3 CuSO4, 0,01 x 10-3 (NH4)6Mo7O24, 0,02 NaFe(III)-EDTA, 0,01 H3BO3. 44 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii Stickstoff wurde in Form von Ca(NO3)2 zugegeben und variiert. Um Effekte zu sehen, wurden die Stickstoffstufen (N-Stufen) im Minimum, Optimum und Maximum gewählt. Die erste Stufe (N1) mit 0,1 mmol/L Ca(NO3)2 sollte deutlichen N-Mangel hervorrufen, die zweite N-Stufe (N2) mit 1,0 mmol/L Ca(NO3)2 sollte im optimalen Versorgungsbereich liegen, die dritte N-Stufe (N3) mit 5,0 mmol/L Ca(NO3)2 sollte eine Überversorgung der Pflanzen gewährleisten. Die prozentualen N-Grenzwerte (%TG), die von Jungpflanzen aufgenommen werden können und die daraus berechneten Mengen an Ca(NO3)2 wurden aus der Literatur entnommen (REUTER et al. 1997). Ein Wechsel der Nährlösungen erfolgte am 8. Tag, und am 11. Tag nach Aussaat, um eine dauerhaft gute Nährstoffversorgung zu garantieren. Die Ernte erfolgte am 15. Tag nach Aussaat. Es existierten insgesamt 6 Behandlungen: 3 N-Stufen mit 2 Varianten (infizierte und gesunde Pflanzen). Von jeder Behandlung (N- Stufe) gab es 4 Töpfe mit je 10 Pflanzen, sodass 40 Pflanzen pro Ansatz zur Auswertung zur Verfügung standen. Zur Ernte wurden alle 40 Pflanzen fotografiert und gewogen um das FG zu ermitteln. Die Pflanzen wurden anschließend mit einer Schere in die Einzelteile Wurzel, Spross, Keimblätter und Primärblätter zerlegt und erneut gewogen. Von 28 willkürlich ausgewählten Pflanzen pro Behandlung wurden die Keimblätter für Sporulationsversuche geerntet, die restlichen Pflanzenteile wurden, nachdem sie gewogen waren, als Rückstellmuster eingefroren. Die restlichen 12 Pflanzen pro Behandlung wurden komplett, jedoch in ihre Einzelteile zerlegt, in Trockentütchen gepackt und 3 Tage bei 60°C im Wärmeschrank getrocknet. D ie getrockneten Keimblätter von 8 Pflanzen wurden für die Fettsäureanalysen verwendet, 4 Gesamtpflanzen wurden zur Elementaranalyse verwendet, wobei der N-Gehalt in % Trockengewicht ermittelt wurde. 3.2.4.2. Wachstum und Gewichte Wachstum und FG von je 40 Pflanzen pro Behandlung wurden mit einer zweistelligen Analysenwaage ermittelt. Das Wachstum wurde zudem mit Fotos dokumentiert. 45 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.2.4.3. Infektion und Befallsgrad Die Sporulation wird im Pflanzenschutz als gängiger Infektionsbeweis und als Maß zur Bestimmung von Pathotyp und Infektionsgrad bei obligat-biotrophen Oomyceten benutzt (GARIBALDI et al. 2007; GULYA et al. 1991; ILOTT et al. 1987; MANDAL et al. 2008). Dabei wird der Prozentsatz an Pflanzen mit Befallssymptomen (Sporulation) gegenüber den Pflanzen ohne Befallssymptome ausgewertet. Befallsgrad und Infektion sollten mit Hilfe der Sporulation von 28 Keimblattpaaren pro Behandlung ermittelt werden. Material: Sporulationsgitter, Styroporbox, destilliertes Wasser, Pinzette, FuchsRosenthal-Zählkammer, Lichtmikroskop. Um den Befallsgrad zu ermitteln und den Befall zu bestätigen, wurden Sporulationsversuche mit Keimblattpaaren von 28 Pflanzen pro Behandlung durchgeführt. Um Verluste an Sporangien zu vermeiden, wurden die Keimblätter der befallenen Pflanzen in unsporuliertem Zustand geerntet und auf umgedrehte Spitzenhalter von Reaktionsgefäßboxen gelegt, sodass sie nur an wenigen Punkten auflagen und beidseitig sporulieren konnten. Die Keimblätter wurden über Nacht in einer Styroporbox zur Sporulation gebracht. Am nächsten Morgen wurden die Keimblätter fotografiert. Jedes Keimblattpaar wurde vorsichtig mit einer spitzen Pinzette in ein 10 ml Gefäß mit 3 ml destilliertem Wasser überführt. So konnten die Sporangien verlustfrei mit einer Fuchs-Rosenthal-Zählkammer ausgezählt werden. Die ermittelte Zahl der Sporangien für die Keimblattpaare der Pflanzen aus einem Behandlungsansatz diente so als Beweis für eine Infektion und als Maß für den Befallsgrad der jeweiligen Probe. Anschließend erfolgte für jedes Keimblattpaar zusätzlich eine Blattflächenmessung am Tageslichtprojektor mit der Computersoftware „WinDias“ (UP GmbH, Osnabrück), um eventuell bestehende Korrelationen zwischen Sporangienanzahl und Blattfläche zu ermitteln. 3.2.4.4. Gesamt-N Bestimmung im Sonnenblumengewebe Die Elementaranalyse diente zur Abschätzung des Ernährungszustandes der Pflanzen mit Hilfe von Grenzwerttabellen (Gesamt-N%) und zusätzlich zur Berechnung der tatsächlichen N-Bilanz. Die Prozentanteile an Stickstoff von der 46 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii Pflanzeneinwaage (TG) wurden am Elementaranalysator nach der Dumas-Methode gemessen. Die Proben wurden dafür im Gasstrom verbrannt und die Elementarzusammensetzung wurde mit einem Wärmeleitfähigkeitsdetektor über einen Referenzgasstrom gemessen. Material: Waage, Wärmeschrank, Trockentüten, Pflanzenproben von 4 Pflanzen pro Behand-lung, Schüttelmühle (Retsch GmbH, Haan), 2 ml Reaktionsgefäße, Stahlkugeln, Feinwaage, Zinnkartuschen (5x9 mm, Hekatech GmbH, Wegberg) für den Elementaranalysator, Elementaranalysator (NCS 2500, CE Instruments, Mailand, Italien), Pinzetten, Feinspatel. Vier Proben ganzer Pflanzen pro Behandlung (N-Stufe), bestehend aus getrocknetem Keimblattpaar, Hypokotyl, Wurzel und Primärblattpaar, wurden mit der Schüttelmühle in 2 ml Gefäßen mit 2 Stahlkugeln fein zermahlen. Pro Probe wurden zwischen 1 und 5 mg in die Zinnkartuschen an der Feinwaage eingewogen. Die Gehalte an Stickstoff wurden am Analysator ermittelt und in Prozent am Gesamtprobenanteil angegeben. Auf Basis der Trockengewichte sowie der N-Gehalte (% TG) der untersuchten Pflanzen wurde nach folgender Beispiel-Rechnung eine N-Bilanz (Angebot/Aufnahme-Verhalten) erstellt: In einer 1 molaren Ca(NO3)2- Lösung befanden sich 28 g/l reines N. In 2,5 l Nährlösung (c= 1 mM) befanden sich folglich 0,07 g N. In 0,1 mM Nährlösung waren 0,007 g N vorhanden, in 5 mM Nährlösung befanden sich 0,35 g N. Da pro Topf 10 Pflanzen wuchsen, standen pro Pflanze in 0,1 mM Lösung 0,0007 g N zur Verfügung, in 1,0 mM Lösung 0,007 g und in 5,0 mM Lösung 0,035 g N. Enthielt die Pflanze beispielsweise 6,3% N im TG von 3,3 g (=0,006 g N) und wurde in einer 1,0 mM Lösung mit 10 anderen Pflanzen aufgezogen, so entsprach das einer Aufnahme von 0,006 g N bei einem Angebot von 0,007 g N und damit einer ausgeglichenen N-Bilanz bzw. optimalen Düngung. 47 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.2.4.5. Analyse der FS-Gehalte im Stickstoff-Steigerungsversuch Die Fettsäureanalysen wurden zur Analyse der EPA-Konzentrationen nach unterschiedlichen N-Behandlungen sowie zum genaueren Nachweis des Infektionsstadiums durchgeführt. Die infizierten Keimblätter der Sonnenblumen sowie Keimblätter der 3 N-Stufen der Kontrollpflanzen wurden, wie in Kap. 2.1.1.3. beschrieben, geerntet und getrocknet. Die Proben für die Fettsäureanalyse verblieben bis zur Verarbeitung bei RT im Exsikkator. Die Fettsäurekonzentrationen wurden qualitativ und quantitativ wie in Kap. 2.1.2.-2.1.4. beschrieben ausgewertet. Korrektur mit dem IS für die Wiederfindung und Vergleichbarkeit Allen Proben wurde eine definierte Konzentration der FS 17:0 zugesetzt, womit Aufar-beitungs- bzw. Einspritzverluste über die Peakflächen des 17:0 Peaks korrigiert werden konnten. Der Mittelwert des elektrischen Signals von 17:0 aller Proben (selbe Konzentration) wurde bestimmt und einer Konzentration zugeordnet. Die Signal-flächen jeder Probe wurden in Relation zur Abweichung an diesem 17:0 Mittelwert angepasst: Die Konzentrationen der FS in der Probe wurden daher wie folgt berechnet: Es galt: C FS = A FS C17:0 IS A 17:0 (MW) Daraus folgte: C FS = C 17:0 IS • A FS A 17:0 (MW) Wobei: C FS = Konzentration der FS in der Probe, C 17:0 = bekannte Konzentration des IS, A FS = Signalfläche der FS in der Probe, A 17:0 (MW) = auf Mittelwert korrigierte Signalfläche des IS. 48 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.2.5. Statistische Auswertung Die statistische Auswertung erfolgte mit dem Statistikpaket SAS (SACHS & HEDDERICH 2006). Die Daten wurden in Excel aufgenommen und in SAS Datenblätter transformiert (DUFNER et al. 1992). Die Auswertung erfolgte mit der SAS Methode „Mixed“, da mit dieser Prozedur alle Rechenoperationen wie für das GLM (general linerar model) durchgeführt werden konnten. Mit SAS standen graphische Verfahren zur Überprüfung von Varianzhomogenität und Normalverteilung (WEBSTER 2001) der Proben zur Verfügung. Design zum Vergleich der Sporangienstämme und Wirtspflanzen Die Mittelwertsvergleiche bei der einfaktoriellen Varianzanalyse (ANOVA) erfolgten über einen multiplen t-Test. Die Schätzung der Mittelwerte und Varianzen erfolgte nach der REML-Methode (restricted maximum likelyhood), die derzeit als beste Schätzmethode gilt (PIEPHO et al. 2003). Bestanden innerhalb des Faktors „Fettsäurekonzentration“ Unterschiede, so wurde ein multipler t-Test nachgeschaltet, der signifikante Unterschiede zwischen den einzelnen Faktorstufen (Sporangienstämme bzw. Wirtspflanzen) aufdeckte. Statistisches Design zum Stickstoffversuch Es sollte überprüft werden, ob sich Wachstum und Fettsäuregehalt infizierter und gesunder Sonnenblumen, die in hydroponischer Kultur aufsteigend viel Stickstoff erhielten, positiv änderten. Für alle 3 Stickstoff-Stufen (N1, N2, N3) und beide Varianten (infiziert/gesund) wurden je 4 Wiederholungen angelegt. Pro Topf wuchsen 10 Pflanzen, pro N-Stufe und Variante standen somit 40 Pflanzen zur Verfügung, die als eine Parallele gewertet wurden. Damit stellte eine Parallele grundsätzlich eine Mischprobe mehrerer Individuen dar. Alle Töpfe wurden bei Nährlösungswechsel örtlich randomisiert, so dass keine Standorteffekte auftreten konnten. Tabellen und Grafiken wurden mit Software Excel 2003 (Microsoft) erstellt. Es wurden immer Mittelwerte und Standardfehlerbalken angegeben. In den Standardfehler (SF=√(s²)/√n) geht, verglichen mit der Standardabweichung, neben der Varianz (s²) noch die Anzahl der Proben (n) mit ein, was ab einem Stichprobenumfang von 4 Proben empfohlen wird (SACHS & HEDDERICH 2006). Es wurde eine zweifaktorielle Varianzanalyse (Einfluss der N-Stufe und der Variante infiziert/gesund 49 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii auf die Faktoren EPA-Konzentration bzw. Wachstum) durchgeführt. Bei der zweifaktoriellen ANOVA zeigte ein F-Test, ob überhaupt signifikante Unterschiede zwischen Faktoren bestanden. Bestanden Unterschiede zwischen Faktoren, wurde ein multipler t-Test nachgeschaltet, der signifikante Unterschiede zwischen den einzelnen Faktorstufen aufdeckte. Unterschiede zwischen den Faktorstufen innerhalb des Faktors wurden auf dem 5%igen Signifikanzniveau (p<0,05%) mit Hilfe eines multiplen t-Tests festgestellt. 50 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.3. Ergebnisse 3.3.1. EPA-Gehalte verschiedener Sporangienstämme von P. halstedii Es galt die Frage zu klären, ob Stämme existieren, die besonders leistungsstark in der n-3-FS-Produktion sind. Der Stamm BL-11.06.02-A4z enthielt mit durchschnittlich fast 25 mg EPA/g Sporangien signifikant mehr EPA als die Stämme GG-16.10.97A25, LS-13.12.05-C6 und HE-10.01.06-A8, die durchschnittlich 20 und 18 mg EPA/g Sporangien enthielten (Abb. 3.2.). mg EPA/g Sporangien 30 a 25 b b b 20 15 10 5 0 BLA4 GGA25 HEA8 LSC6 P. halstedii Stämme Abb. 3.2.: EPA-Gehalte der untersuchten P. halstedii Stämme: BL-11.06.02-A4z (BL-A4), GG16.10.97-A25 (GGA25), HE-10.01.06-A8 (HE-A8), LS-13.12.05-C6 (LS-C6). Dargestellt sind die Mittelwerte aus n=63 Messungen und die Standardfehler. Verschiedene Buchstaben stellen signifikante Unterschiede dar. Da BL-11.06.02-A4z die höchste EPA-Konzentration aufwies, wurde dieser Stamm für die Untersuchung von weiteren Optimierungsschritten verwendet. 3.3.2. Besonders anfällige Sonnenblumensorten und -linien In infiziertem Zustand zeigten die Sorte Giganteus und die Linie DM-2 die höchsten Biomassen (Abb. 3.3.), wogegen die Linien 799-2 und 803-1 sehr wachstumsschwach waren. Die Produktion von EPA korrelierte sehr stark mit der Biomasse der Wirtspflanze (vgl. Abb. 3.3. u. 3.4.). Es gab bei einer Infektion im selben Zeitraum stark anfällige Wirte wie Giganteus und DM-2, die bei viel Biomasse viel EPA enthielten, es gab jedoch auch wenig anfällige Linien wie PM17, die bei viel 51 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii Biomasse wenig EPA enthielten. Als dritte Variante gab es noch Linien, die nicht viel Biomasse bilden konnten und dementsprechend wenig EPA enthielten wie 803-1 und TG [g] 799-2. 0,06 0,05 a a b 0,04 0,03 b c b c c 0,02 d d 0,01 0,00 Mittleres TG [g] Gigan teus HA 821 HA 304 RHA 265 RHA 274 0,05 0,02 0,04 0,04 0,02 PM 13 799-2 PM 17 803-1 DM-2 Sorte/Linie 0,02 0,01 0,04 0,01 0,04 Abb. 3.3.: Mittlere Trockengewichte TG (g) mit Standardfehler von 20 P. halstedii-infizierten Keimlingen einer Sonnenblumensorte bzw. -Linie. Unterschiedliche Buchstaben stehen für statistisch EPA [mg/g TG) signifikante Unterschiede in der Biomasse. 1,40 a 1,20 a 1,00 b a b b c 0,80 c 0,60 0,40 d d 0,20 0,00 EPA [mg/g TG] Gigan teus HA 821 HA 304 RHA 265 RHA 274 0,98 0,88 1,07 0,87 0,72 PM 13 799-2 PM 17 803-1 DM-2 Sorte/Linie 0,86 0,68 0,28 0,31 1,10 Abb. 3.4.: Mittlere EPA-Gehalte mit Standardfehler (mg/g TG) von je 20 P. halstedii-infizierten Keimlingen einer Sorte bzw. Linie. Unterschiedliche Buchstaben stehen für statistisch signifikante Unterschiede in der EPA-Produktion. Die Sorte Giganteus und die Linien HA304 und DM-2 konnten vom Stamm BL11.06.02-A4z bei den höchsten EPA-Durchschnittsgehalten pro g Biomasse am besten infiziert werden. Die höchst erzielbaren Konzentrationen an EPA im Wirt 52 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii betrugen bei voller Infektion und vor Sporulation bei Giganteus im Mittel 0,98 mg EPA/g TG, bei HA 304 1,07 und bei DM-2 sogar 1,10 mg/g TG, wobei jedoch keine statistischen Unterschiede zwischen den 3 Wirten festgestellt werden konnten (Abb. 3.4.). 3.3.3. Variation des Infektionsdrucks Ziel war es, das Optimierungspotenzial von Biomasse und EPA-Gehalt durch den Infektionsdruck über die Variation des Erregerinokulums zu untersuchen. Eine Infektionszeit von etwa 2 Wochen war erwünscht, da ab diesem Zeitraum unter gegebenen Bedingungen (vgl. Kap. 2.1.1.1.) die Biomassen der Keimblätter der Sonnenblumen maximal ausgebildet waren. Bei einem Inokulum von 10000 Sporangien/ml wurde ein Durchschnittsgewicht von 2,7 g/Keimling erreicht (Abb. 3.5.), alle Pflanzen der Infektionsstufe zeigten nach 16 Tagen und Inkubation über Nacht Sporulation. Die Keimlinge bei einer Inokulation von 5000 Sporangien/ml erreichten mittlere Gewichte von 3,02 g, 3 Pflanzen zeigten keine Sporulation. FG [g] 4,50 4,00 a a 3,50 b 3,00 b 2,50 2,00 1,50 1,00 0,50 0,00 FG (g) gesund (0) 2000,00 5000,00 10000,00 3,68 3,34 3,03 2,77 c(Sp.)/ml Abb. 3.5.: Mittlere Frischgewichte von 25 infizierten (Stamm BL-11.06.02-A4z) Sonnenblumen (Sorte Giganteus) mit Standardfehler bei versch. Sporangieninokuli (16 Tage Infektionszeit): c=2000 Sporangien/ml, 5000 Sporangien/ml, 10000 Sporangien/ml. Verschiedene Buchstaben stellen statistisch signifikante Unterschiede dar. Mit einem mittleren Gewicht von 3,34 g waren die Biomassen der Keimlinge bei 2000 Sporangien/ml am besten ausgeprägt, jedoch gab es bei dieser Behandlung 10 von 25 Pflanzen, die nach Inkubation keine Sporulation zeigten und damit nicht sichtbar 53 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii infiziert waren. Nach 16 Tagen Infektionszeit, bei einem Sporangieninokulum von 10000 Sporangien/ml starben 7 von 25 Keimlingen vor der Ernte (Abb.3.6.). Bei einem Inokulum von 5000 Sporangien/ml starben nur 3 Pflanzen, bei 2000 Sporangien/ml starben nur 2 von 25 Pflanzen frühzeitig ab. Die höchsten Biomassen bei geringer Letalität und guter allgemeiner Infektion (wenig gesunde Pflanzen) erreichten die Keimlinge bei einer Infektion mit 5000 Sporangien/ml. Bei steigender Sporangienanzahl nahmen die FG von infizierten Sonnenblumen deutlich ab und die Letalität stieg, bei niedrigerer Sporangienzahl gab es zu Stück viele Pflanzen ohne Befallssymptome. 30 25 20 15 10 5 0 gesund (0) 2000 5000 10000 Letale Pfl. 0 2 3 7 gesunde Pfl. 25 10 3 0 c(Sp.)/ml Abb. 3.6.: Letalität bei versch. Sporangieninokuli (16 Tage Infektionszeit): c=2000 Sporangien/ml, 5000 Sporangien/ml, 10000 Sporangien/ml. Sonnenblumen der Sorte Giganteus, gesund und nach Infektion mit dem Stamm BL-11.06.02-A4z. Eine Infektionsdauer über 20 Tage hinaus führte unter gegebenen Bedingungen im Klimaschrank meist zu Totalausfall, da die Pflanzen durch fortschreitende Infektion umkippten und faulten. Die besten Infektionsergebnisse bezüglich Biomasse der Keimblätter und Infektionsgrad (= Ausbreitungsfläche für den Erreger bei gleichzeitigem Anstieg des EPAGehaltes) zeigten sich daher nach etwa 2 Wochen Infektionszeit bei dem Inokulum von 5000 Sporangien/ml. 54 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.3.4. Variation des Stickstoffangebotes 3.3.4.1. Wachstum und Gewichte In diesem Kapitel sollte geklärt werden, ob mit Hilfe der N-Düngung die Wirtsbiomasse oder die EPA-Konzentrationen in infiziertem Gewebe gesteigert werden konnten. Das Wachstum der infizierten Pflanzen in Hydrokultur zeigte die Erreger-typischen Symptome (ROZYNEK 2000): P. halstedii verursachte Wuchshemmung, Blattchlorosen und verdickten Wurzelhals bei infizierten Sonnenblumen. Befallene Pflanzen waren somit bereits visuell von den Kontrollpflanzen ohne Infektion deutlich zu unterscheiden. Verglich man die N-Stufen 1, 2 und 3 der infizierten Pflanzen miteinander, so fiel auf, dass die oberirdischen Teile aller N-Stufen ähnlich klein blieben und wenige optische Unterschiede zwischen den Behandlungen feststellbar waren (Abb. 3.7. oben). 0,1 mM 1,0 mM 0,1 mM 1,0 mM 5,0 mM 5,0 mM Abb. 3.7.: Vergleich des Wachstums 15 Tage alter Sonnenblumen bei 3 N-Stufen. Oben: Infizierte Sonnenblumen, unten: Gesunde Sonnenblumen. Von links nach rechts sieht man das Wachstum bei 0,1 mM, 1 mM und 5 mM Ca(NO3)2 pro Topf. Die Wurzelfarbe der infizierten Pflanzen war bei der niedrigsten N-Stufe 0,1 mM Ca(NO3)2/Topf weiß, bei der mittleren N-Stufe 1,0 mM Ca(NO3)2 gelblich und bei der höchsten N-Stufe mit 5,0 mM Ca(NO3)2/Topf braun. Dies war ein Indiz dafür, dass sich hohe Ca(NO3)2-Gaben toxisch auf das Wurzelwachstum der infizierten Pflanzen auswirkten. Im Vergleich zu den gesunden Kontrollpflanzen waren alle infizierten Pflanzen deutlich kleiner und schwächer entwickelt. 55 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii Verglich man die N-Stufen der gesunden Variante untereinander, dann wiesen die Kontrollpflanzen zwischen allen 3 N-Stufen deutliche Unterschiede im Wachstum der oberirdischen und der unterirdischen Pflanzenteile auf (Abb. 3.7. unten). Mit 0,1 mM Ca(NO3)2 waren die Keimblätter ausgewachsen, die Primärblätter waren jedoch, im Vergleich mit den beiden höheren N-Stufen unterentwickelt. Das Wurzelwachstum der Mangelvariante stand ebenfalls sichtbar hinter dem Wurzelwachstum bei höheren N-Gaben zurück. Von der optimalen N-Stufe mit 1,0 mM Ca(NO3)2 pro Topf zur überdüngten Variante mit 5,0 mM Ca(NO3)2/Topf war eine leichte Abnahme der Wurzelmasse und der oberirdischen Pflanzenmasse zu sehen. Die Frischgewichte von 40 gesunden und infizierten Pflanzen derselben Düngungsstufe wurden miteinander verglichen und statistisch mit einem multiplen Mittelwertsvergleich überprüft (Abb.3.8.). Die mittleren Frischpflanzengewichte der Stickstoffstufen N1 und N3 innerhalb der gesunden Variante (Kontrolle) lagen mit 2,2 bzw. 2,17 g signifikant (p<0,01) unter den Frischgewichten der optimal gedüngten FG [g] Stufe N2 mit 3,3 g. 4,00 b c 3,50 3,00 a 2,50 2,00 1,50 d e e 1,00 0,50 0,00 0,1 mM 1 mM 5 mM K [g] 2,21 3,32 2,71 I [g] 0,66 0,77 0,68 Ca(NO3)2/Topf Abb. 3.8.: Mittlere FG (mit Standardfehler) von je 40 gesunden (K) und infizierten (I), 15 Tage alten Sonnenblumen. Von links nach rechts sieht man nebeneinander die Gewichte der N-Stufen 1 bis 3 mit 0,1m 1 und 5 mM Ca(NO3)2 pro Topf. Unterschiedliche Buchstaben stellen statistisch signifikante Unterschiede dar. Die mittleren FG der infizierten Pflanzen lagen mit etwa 0,7 g insgesamt signifikant unter denen der gesunden, gleichaltrigen Kontrollpflanzen, die Gewichte bis zu 3,3 g 56 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii pro Pflanze erreichten. Innerhalb der infizierten Pflanzen ließ sich zusätzlich beweisen, dass die Pflanzen der mittleren Düngungsstufe mit durchschnittlich 0,77 g signifikant mehr Biomasse aufwiesen, als die Pflanzen der anderen beiden Düngungsstufen. 3.3.4.2. Infektion und Befallsgrad Es wurden Sporulationsversuche ausgeführt, um Infektion und Befallsgrad der 3 NStufen zu testen. Hierzu wurden von 28 Pflanzen die Keimblattpaare abgenommen und zur Sporulation gebracht (vgl. Kap. 2.1.1.1.). Es gab statistisch signifikante Unterschiede zwischen den Sporangienzahlen der Keimblattpaare der verschiedenen Düngerstufen (Abb. 3.9.). Die mittlere Stufe N2 wies mit 72708 Sporangien pro Keimblattpaar einen statistisch signifikant höheren Mittelwert auf, als die nicht optimal gedüngten Stufen N1 und N3 mit mittleren Sporangienzahlen von 33088 und 36428 Sporangien pro Keimblattpaar. Sporangien pro Keimblattpaar 100000 b 80000 60000 40000 a a 20000 0 Sp/KB-Paar 0,1 mM 1 mM 5 mM 33088 72708 36428 N-Stufe Abb. 3.9.: Mittlere Sporangienzahlen von 28 Keimblattpaaren infizierter Pflanzen bei 3 N-Stufen mit Standardfehlerbalken. Unterschiedliche Buchstaben kennzeichnen statistisch signifikante Unterschiede zwischen den Behandlungen. Zusätzlich durchgeführte Messungen der Blattflächen der Keimblattpaare zeigten, dass die Sporangienzahlen eine positive Korrelation zur durchschnittlichen Blattfläche der Keimblattpaare aufwiesen. Je größer die durchschnittliche Blattfläche war, umso mehr Sporangien wurden gefunden. So wiesen Keimblattpaare der Mangel57 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii Stufe N1 die kleinsten durchschnittlichen Oberflächen mit 2,0 cm²/Keimblattpaar auf, Keimblattpaare der Stufe N2 hatten mit 2,6 cm²/Keimblattpaar die größten Blattflächen und die Stufe N3 zeigte einen mittlere Blattfläche von 2,2,cm²/Keimblattpaar. 3.3.4.3. Gesamt-N-Gehaltsbestimmung in Sonnenblumenpflanzen Grenzwerte für die optimale N-Düngung wurden aus der Literatur entnommen (REUTER et al. 1997) und mit vorliegenden Werten der N-Analyse verglichen. Für Sonnenblumenkeimlinge wird der Literatur-Grenzwert für ausreichende N-Versorgung bei 5,21 N(%) angesetzt. In diesem Versuch wurden Gesamt-N Gehalte von 4 bis 7,5 N(%) erreicht. Mit der Elementaranalyse konnte für die Kontrolle gezeigt werden, dass die Pflanzen der Töpfe der Stufe N1 mit durchschnittlich 4 % N unter der Grenze von 5% lagen und damit als unterversorgt eingestuft werden konnten (Abb. 3.10.). Die Pflanzen der Stufe N2 lagen mit 6,3% N im Trockengewicht daher im optimal versorgten Bereich (Abb. 3.10). Die Pflanzen der Stufe N3 waren mit Gesamt N in Gewichts-% 7,41% Gesamt-N im Stickstoffüberschuss. 8,00 7,00 6,00 5,00 4,00 3,00 2,00 1,00 0,00 0,1 mM (N1) 1 mM (N2) 5 mM (N3) Kontrolle 3,94 6,31 7,41 Befallen 6,84 6,16 5,88 N-Stufe Abb. 3.10.: Gesamt-N Gehalte (% TG) von gesunden (Kontrolle, gestreifte Balken) und P. halstediibefallenen Sonnenblumen (weiße Balken) bei 3 N-Stufen. Bei den infizierten Pflanzen der Stufe N1 waren die Prozentanteile von N am TG sehr viel höher als bei der Kontrolle, wobei sich ein deutlicher N-Verdünnungseffekt von N-Stufe 1 nach N-Stufe 3 zeigte. Es wurde zwar N angeboten, die ansteigenden Mengen konnten jedoch nicht assimiliert werden. 58 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii Die N-Bilanz (vgl. Kap. 3.2.4.4.) bestätigte die Aussage der Literatur-Grenzwerte. So nahmen die gesunden Pflanzen bei optimaler N-Versorgung (N2) etwa soviel Stickstoff auf (0,006 g pro Pflanze), wie in der Nährlösung angeboten wurde (0,007 g). Bei einem Überangebot von 0,035 g N/Pflanze in den Nährlösungen konnte von den Pflanzen ebenfalls nur 0,006 g N/Pflanze aufgenommen werden. Im N-Mangel Nährmedium stand mit 0,0007-0,0014 g N/Pflanze weniger N zur Verfügung als pro Pflanze/Topf durchschnittlich assimiliert wurde (0,0015 g N/Pflanze). Die N-Bilanz für die infizierten Pflanzen ergab, dass mit steigendem N-Angebot zwar mehr N assimiliert wurde (N-Aufnahme: Stufe N1 0,00041 g N/Pflanze, Stufe N2 0,00049 g N/Pflanze, Stufe N3 0,00058 g N/Pflanze), die Gesamtaufnahme jedoch stark unter dem Niveau der gesunden Sonnenblumenpflanzen lag und das Angebot an N in der Nährlösung bei allen 3 N-Stufen nicht ausgeschöpft werden konnte. 3.3.4.4. EPA-Konzentrationen bei 3 N-Stufen Für die infizierten und gesunden Pflanzen der 3 N-Stufen wurden qualitative und quantitative Vergleiche der FS mit den höchsten Anteilen am FS-Muster durchgeführt Diese wurden zunächst exemplarisch als Signalflächenmuster dargestellt (Abb. 3.11. u. 3.12.). Es folgten die Analyse und der Vergleich der FS-Konzentrationen der Behandlungen in mg pro g TG für die N-Stufen 1 bis 3 (Abb. 3.13.). Bei gesunden Pflanzen bestand das Fettsäuremuster hauptsächlich aus den Fettsäuren 18:3 n-3 mit über 50% Anteil am Gesamtmuster, 18:2 n-6 mit etwa 30%, 18:1 n-9 mit etwa 5% und 16:0 mit etwa 10 % am Gesamtanteil des Fettsäuremusters (Abb. 3.11.). Die FS 14:0, 16:0, 16:1, 18:1 n-9, 18:2 n-6, 18:3 n-3 und 20:5 n-3 waren die dominierenden FS der P. halstedii-infizierten Pflanzen (Abb. 3.12.), wobei von gesunden Sonnenblumen weder 16:1 noch 20:5 n-3 produziert wurden. Die Flächensignale der FSME aus infizierten Pflanzen waren, trotz ähnlicher Pflanzeneinwaagen, deutlich stärker als die aus gesunden Pflanzen. 59 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 18:3 n-3 18:2 n-6 16:0 17:0 IS 18:1 n-9 Abb. 3.11.: Fettsäuremuster von gesundem Sonnenblumenkeimblatt. Sorte Giganteus mit den FS 16:0, 18:1 n-9, 18:2 n-6 und 18:3 n-3 auf der Säule CP7419. 16:0 14:0 18:2 n-6 20:5 n-3 17:0 IS 18:1 n-9 18:3 n-3 Abb. 3.12.: FS-Muster von den Keimblättern einer P. halstedii-infizierten Sonnenblume. Sorte Giganteus mit dem kombinierten Muster von P. halstedii und Sonnenblume auf der Säule CP7419. Die Fettsäurekonzentrationen stiegen innerhalb der gesunden Variante bei den ungesättigten FS 18:2 n-6 und 18:3 n-3 von Stufe N1 (0,1 mM) nach Stufe N3 (5 mM) signifikant an (vgl. Abb. 3.13.). Die Stufen N1 und N2 zeigten keine signifikanten Unterschiede. Auch bei den infizierten Sonnenblumen lagen die Konzentrationen der FS bei NStufe 1 insgesamt deutlich niedriger, als bei der höchsten Stufe N3 (Abb. 3.14.). Bei den FS 16:0, 18:2 n-6 und 20:5 n-3, die für P. halstedii typisch sind, waren diese Unterschiede zwischen den Stickstoffstufen N1 und N3 ebenfalls signifikant (p<0,01). Die höchsten Fettsäuregehalte für 20:5 n-3 und 18:2 n-6 mit 1,8 und 2,2 mg/g TG wurden von infizierten Pflanzen der höchsten Stufe N3 mit 5,0 mM Ca(NO3)2/Topf erzielt (vgl. Tab. 3.14.). 60 mg FS/g TG 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3 2,5 2 1,5 1 0,5 0 16:0 18:1 18:2 n-6 18:3 n-3 0,1 mM 0,25 0,19 0,58 0,94 1 mM 0,23 0,09 0,47 0,84 5 mM 0,28 0,09 0,85 1,42 FAME Abb. 3.13.: FS-Gehalte von gesunden Sonnenblumen (15 Tage) bei 3 N-Stufen: 0,1 mM, 1,0 mM und mg FS/g TG 5,0 mM Ca(NO3)2 pro Topf. Dargestellt sind Mittelwerte mit Standardfehler. 3 2,5 2 1,5 1 0,5 0 14:0 16:0 16:1 18:1 18:2 n-6 18:3 n-3 20:5 n-3 0,1 mM 0,18 0,98 0,02 0,75 1,74 0,22 0,69 1 mM 0,39 1,79 0,26 1,05 1,94 0,58 1,23 5 mM 0,30 1,53 0,07 0,96 2,26 0,43 1,80 FAME Abb. 3.14.: FS-Gehalte von P. halstedii-infizierten Sonnenblumen (15 Tage) bei 3 N-Stufen: 0,1 mM, 1,0 mM und 5,0 mM Ca(NO3)2 pro Topf. Dargestellt sind Mittelwerte mit Standardfehler. Verglich man die FS-Konzentrationen zwischen den Behandlungen gesund/infiziert, (Abb. 3.13. u. 3.14.) so produzierten die gesunden Keimblätter im Gesamtmittel 2,6 mg FS/g TG bei Stufe N3, bei der infizierten Variante war es auf derselben N-Stufe mit 7,0 mg FS/g TG mehr als das Doppelte. Dabei fiel jedoch die FS 18:3 n-3 etwas aus dem Rahmen, da die Gehalte in gesunden Pflanzen von Stufe N1 nach Stufe N3 signifikant stiegen, wogegen sie in infizierten Keimblättern bei der höchsten N-Stufe absanken. 61 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.4. Diskussion 3.4.1. Optimierungspotenzial durch die Selektion von Pathogenstämmen Das artinterne Sporangienscreening zeigte, dass Stämme von P. halstedii existierten, die im Durchschnitt statistisch signifikant mehr EPA produzieren konnten als andere Stämme. Mit BL-11.06.02-A4z stand ein Stamm zur Verfügung, der 25-30 mg EPA/g Sporangien produzieren konnte. Es war eine Steigerung von 25% zwischen den untersuchten Stämmen möglich. Diese geringe Steigerungsmöglichkeit des EPA-Gehaltes innerhalb der Art P. halstedii genügte jedoch nicht, um den EPAGehalt in geforderter Weise so zu steigern, dass der Verzehr von infizierten Sonnenblumenkeimlingen einen erheblichen EPA-Gewinn durch das potenzielle Nahrungsmittel darstellen würde. Es muss allerdings bemerkt werden, dass lediglich 4 unterschiedliche Stämme verschiedener Feldisolate auf ihre EPA-Gehalte untersucht wurden. Es kann zu diesem Zeitpunkt daher nicht ausgeschlossen werden, dass leistungsfähigere Stämme oder Isolate von P. halstedii oder auch anderer Arten wie z.B. B. lactucae existieren, bei denen deutlichere Leistungsunterschiede vorhanden sind. 3.4.2. Optimierungspotenzial durch die Selektion von Wirtspflanzen Erwünscht war ein möglichst geringes Biomasse/EPA-Verhältnis, da möglichst viel EPA pro Biomasse im Pflanzengewebe enthalten sein sollte. Mit der Sorte Giganteus konnte man aufgrund der großen Samen besonders gut arbeiten. Sie gehörte mit der Linie DM-2 zu den Wirten, mit der besten Biomasseentwicklung und dem besten Biomasse/EPA-Verhältnis, wenn mit dem besonders EPA-haltigen Sporangienisolat BL-11.06.02-A4z infiziert wurde (Abb. 3.3. u. 3.4.), jedoch auch andere Isolate erzielten gute EPA-Gehalte auf der Sorte Giganteus. Die Wirt/Pathogen-Kombination Giganteus/BL-11.06.02-A4z schien für weitere Optimierungsversuche besonders geeignet. Da jedoch, aufgrund genannter Vorzüge, bereits im Vorfeld der Optimierungsversuche (Kap. 2.2.) mit der Sorte Giganteus gearbeitet wurde, war der Optimierungsspielraum durch einen besonders anfälligen Wirt bereits ausgereizt, und infiziertes Gewebe erreichte lediglich die bisher gemessenen EPA-Gehalte von durchschnittlich 1 mg/g TG. 62 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii 3.4.3. Optimierungspotenzial durch variierten Infektionsdruck Über den Infektionsdruck konnte der Infektionsverlauf gesteuert werden. Mit Hilfe der Inokulation definierter Sporangienkonzentrationen wurde in einem definierten Zeitraum eine relativ homogene, gleichmäßige Infektion von Sonnenblumenkeimlingen derselben Sorte erreicht. Dies war Voraussetzung für vergleichbare Ergebnisse und optimale Erntemöglichkeiten von Sporangien und infiziertem Pflanzengewebe. Der Spielraum für eine Optimierung des Infektionsdrucks war jedoch sehr begrenzt, da im selben Zeitraum bei zu hohem Inokulum die Infektion schneller verlief und zu statistisch vermehrtem Pflanzenausfall führte, wogegen ein zu niedrig gewähltes Inokulum für eine Infektion innerhalb des gewähltes Zeitraumes nicht genügte. Infizierte Pflanzen bei zu hohem Sporangieninokulum zeigten daher verfrühte Letalität, Pflanzen bei zu niedrigem Sporangieninokulum wurden entweder nicht infiziert oder konnten, trotz Infektion (Nachweis über EPA-Gehalt), nach dem definierten Infektionszeitraum nicht mehr zur Sporulation gebracht werden. Zur Optimierung des EPA-Gehaltes war der Infektionsdruck daher zwar indirekt wichtig, um einen gleichmäßigen Infektionsverlauf und gute Ernteergebnisse zu erzielen, direkte EPA-Steigerungsmöglichkeiten waren damit jedoch nicht möglich. 3.4.4. Optimierungspotenzial durch variierte N-Düngung Das Wachstum verlief für gesunde und infizierte Pflanzen bei den 3 N-Stufen sehr unterschiedlich. Die gesunde Variante verhielt sich bezüglich der gebildeten Biomasse gemäß den Düngeregeln. Je mehr N den gesunden Pflanzen angeboten wurde, umso mehr N wurde in das Pflanzengewebe eingelagert (MARSCHNER 1995). Die infizierte Variante blieb im Wachstum bei allen N-Stufen stark hinter der Kontrolle zurück und konnte den zusätzlichen Stickstoff nicht umsetzten. Dieses Wachstumsverhalten stimmte sowohl mit der Elementaranalyse des Anteils an N im Pflanzengewebe, als auch mit der N-Bilanz überein. Für Sonnenblumenkeimlinge wird dort der Literatur-Grenzwert für ausreichende N-Versorgung bei 5,21 N(%) angesetzt. In diesem Versuch wurden Gesamt-N Gehalte von 4 bis 7,5 N(%) erreicht. Bei infizierten Sonnenblumen zeigte sich dabei ein negativer Verdünnungseffekt (Abb. 3.10.), trotz steigendem N-Angebot konnte kein zusätzlicher Stickstoff assimiliert werden. Auffällig waren zudem die deutlich höheren N-Gehalte der infizierten Variante der Stufe N1 im Vergleich zur Kontrolle (Abb. 3.10.). So lagerten 63 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii infizierte Pflanzen der Stufe N1 ca.7 % N ins Gewebe ein, die gesunden Kontrollen jedoch nur ca. 4 % N. Bei der optimal gedüngten Stufe N2 gab es mit ca. 6 % N im Pflanzengewebe keine Unterschiede zwischen infizierter und gesunder Variante. Bei der hoch gedüngten Stufe N3 enthielt die Kontrolle mit ca. 7 % N signifikant mehr N als die infizierte Variante mit nur 6 % N. Eventuell löste die Infektion als „Stressfaktor“ eine gesteigerte N-Assimilation aus. Solche Reaktionen sind aus der Literatur bekannt, bei moderatem Salzstress wurden z.B. für Gossypyrum hirsutum L. (PESSARAKLI & TUCKER 1985) und für Solanum melongena L. (PESSARAKLI & TUCKER 1988), trotz Wachstumsdepression der Pflanzen, signifikante Anstiege in der N-Assimilation ins Gewebe registriert, wobei dieser Effekt bei sehr hohem Salzstress nicht mehr nachgewiesen wurde und die Kontrollpflanzen mehr N pro Trockenmasse zeigten. Dieses Ergebnis deckt sich auch mit den Beobachtungen dieser Arbeit. Von den infizierten Pflanzen der höheren N-Stufen wurde gegenüber der Kontrolle weniger N ins Gewebe assimiliert. Dies stand wohl mit dem zusätzlichen Stressfaktor der zunehmenden Wurzelschädigung bei steigender N-Düngung in Zusammenhang. Bei den Sporulationsversuchen zu Infektion und Befallsgrad zeigte sich, dass optimal gedüngte Pflanzen deutlich mehr Sporulation aufwiesen als die Pflanzen der niedrig und hoch gedüngten N-Variante. Es zeigte sich jedoch, dass sowohl die mittlere Biomasse, als auch die mittlere Blattfläche der infizierten Pflanzen bei optimaler NStufe signifikant höher waren, als die der beiden anderen N-Stufen. Da mit vermehrter Biomasse mehr Keimblattfläche und damit mehr Sporulationsfläche zur Verfügung stand, konnten aufgrund dieser positiven Korrelation bei der mittleren NStufe am meisten Sporangien geerntet werden. Die Fettsäuremessungen zeigten, dass hohe Gaben an Ca(NO3)2 hohe Konzentrationen an n-3-FS in Pflanzengewebe förderten. Der ALA (18:3 n-3) Gehalt stieg mit zunehmender N-Stufe bei gesunden Pflanzen signifikant an. Diese Ergebnisse stimmten mit den Ergebnissen anderer Arbeitsgruppen überein, die versuchten Fettsäuregehalte von Pflanzen über den Weg der N-Düngung zu beeinflussen. Bei hohen Stickstoffgaben in hydroponischer Kultur ließen sich z.B. auch die n-3-FSGehalte von Portulak signifikant steigern (FONTANA et al. 2006; RANI PALANISWAMY et al. 2000). 64 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii In infizierten Pflanzen stiegen die EPA Gehalte mit steigenden N-Konzentrationen in der Nährlösung ebenfalls deutlich an. Untersuchte Keimblätter der höchsten N-Stufe mit 5,0 mM (CaNO3)2 zeigten dabei die höchsten EPA-Gehalte. Eventuell förderten hohe Stickstoffgaben den Befall mit Falschem Mehltau. Dass hohe Stickstoffgaben den Befall mit Falschem Mehltau fördern, wurde aktuell für Wegerich gezeigt (MANDAL et al. 2008). Gegenüber vorherigen Optimierungsversuchen bei denen höchstens 1 mg EPA/g TG erzielt werden konnte, war es mit Hilfe von N immerhin möglich, die EPA-Konzentration in infiziertem Gewebe um Faktor 2 auf ca. 2 mg/g TG zu steigern. Auffällig war dabei, dass die FS-Gehalte in infizierten Pflanzen, außer für 18:3 n-3, insgesamt deutlich höher waren als in gesunden Pflanzen. Die zusätzlichen FS wurden wohl von P. halstedii gebildet, denn es waren hauptsächlich die Hauptfettsäuren von P. halstedii, wie 16:0, 18:2 n-6 und 20:5 n-3, die in infizierten Pflanzen vermehrt vorkamen. Dass allein die FS 18:3 n-3 bei infizierten Pflanzen in deutlich geringerem Maße vorkam, als bei Kontrollpflanzen, war interessant. Ein Grund dafür könnte die Verwendung von 18:3 n-3 als Substrat für die Synthese von EPA sein (SAYANOVA & NAPIER 2004; TRIPODI et al. 2006), von der, vor allem von der infizierten der Stufe N3, erhebliche Mengen (1,8 mg/g TG) produziert wurden. Für manche Mikroalgen wurde bereits bewiesen, dass 18:3 n-3 als Substrat für die Biosynthese von EPA oder DHA dient (TONON et al. 2005). Im Rahmen von Optimierungsstudien bezüglich der Produktion von EPA bei Mikroalgen und heterotrophen Oomyceten führten andere Forschergruppen bereits Ernährungsstudien mit Stickstoff durch, für obligat-biotrophe Oomyceten ist die vorliegende Studie diesbezüglich die erste. Zählt man die Ergebnisse anderer Studien auf, so produzieren die heterotrophen Oomyceten Schizochytrium und Thraustochytrium in N-Mangel-Medium mehr EPA und DHA als in N-reichem Medium (HUANG et al. 2001; W ARD & SINGH 2005). Die Mikroalge Pavlova lutheri hat unter N-Mangel ebenfalls eine verbesserte EPAProduktion (CARVALHO et al. 2005) und auch Eismeerdiatomeen erhöhen die EPAProduktion in Phospholipiden bei N-Mangel (MOCK & KROON 2002). Bei N-Mangel ist zudem die EPA-Produktion von Nitzschia laevis erhöht. 65 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii Es existieren jedoch auch Studien zu Mikroalgen mit gegenteiligen Ergebnissen. Diese Arten erhöhen ihre EPA-Produktion, wenn viel Stickstoff im Nährmedium ist. Phaeodactylum tricornutum produziert bei viel N im Medium mehr EPA (YONGMANITCHAI & W ARD 1991), ebenso verhalten sich Nannochloropsis oculata und Thalassiosira pseudonana (TONON et al. 2002). Im Widerspruch zu dem phylogenetisch näher verwandten Oomyceten Schizochytrium und Thraustochytrium produzierte P. halstedii bei höheren N-Gaben an den Wirt mehr EPA und verhielt sich daher ähnlich wie die phototrophen Algen Phaeodactylum tricornutum, Nannochloropsis oculata und Thalassiosira pseudonana, die ebenfalls mehr EPA produzieren, je mehr N im Nährmedium vorhanden war (TONON et al. 2002). Beim Wirt/Pathogen System Sonnenblume/P. halstedii konnte das Pathogen nicht direkt in einem Nährmedium gezogen werden, da es sich vom lebenden Wirt ernährt. Daher mussten die Zusammenhänge komplexer betrachtet werden. Wurde dem Wirt mehr N zur Verfügung gestellt, so konnte auch im infizierten Gewebe deutlich mehr EPA nachgewiesen werden. Da EPA allein von P. halstedii stammt, kann festgestellt werden, dass hohe N-Gaben den Erreger wohl fördern. Dies konnte zum Einen mit der dichteren Ausbreitung des Erregers in Pflanzengewebe in Verbindung stehen, dem zu Gunsten von Proteinen und Aminosäureverbindungen die stabilisierenden Strukturelemente verloren gingen. Eine weitere Erklärung wäre eine verbesserte EPA-Synthese im Mycel von P. halstedii wegen des Vorhandenseins von mehr FSSubstrat für die EPA-Synthese im Pflanzensaft, denn auch gesunde Pflanzen erhöhten bei vermehrter N-Gabe ihren ALA-Anteil im Gewebe. 3.5. Schlussfolgerungen Die Grenzen der Optimierbarkeit innerhalb geeigneter Parasitenstämme und Wirtspflanzen waren mit 30 mg EPA/FG für Sporangien und 1 mg EPA/g TG für Pflanzengewebe erreicht. Mithilfe des Faktors Stickstoffernährung und gesteigerten N-Gaben an die Wirtspflanzen konnten die EPA-Gehalte des genetisch homogenen Stammes BL-11.06.02-A4z immerhin um Faktor 2 von 1 mg EPA/g TG auf 2 mg EPA/g TG gesteigert werden. Um in realistische Dimensionen für die direkte menschliche Ernährung zu kommen, wäre eine Steigerung der EPA-Konzentrationen in Sporangien oder infiziertem Wirtsgewebe um Faktor 10 nötig gewesen (vgl. Kap. 2.). 66 3. Optimierung der EPA-Konzentrationen am Modellbeispiel P. halstedii In der Studie einer anderen Arbeitsgruppe, wobei es im die Erhöhung der Produktion von Docosapentaensäure (DPA, 22:5 n-3) in einer Pilzkultur von Pythium acanthicum im Bioreaktor ging, blieb die erreichbare Menge an n-3-FS nach Optimierungsversuchen ebenfalls auf 1-5 mg DPA/g Biomasse beschränkt (SINGH & W ARD 1998). Die Möglichkeit der direkten Nutzung von EPA aus infizierten Pflanzen für die menschliche Ernährung bleibt somit weiterhin fraglich. Da aus Kap. 2 jedoch hervorging, dass eventuell erzielbare Mengen auf großer Fläche mit den gewonnenen Mengen aus Bioreaktoren konkurrenzfähig waren und in infiziertem Gewebe immerhin 1-2 mg EPA/g TG erreicht wurde, schien es denkbar und realistisch die FS EPA aus B. lactucae zwar nicht durch technische Anreicherung in Kapseln, jedoch durch natürliche Anreicherung über die Nahrungskette nutzbar zu machen. 67 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereiern 4.1. Hintergrund und Zielsetzung des Fütterungsexperiments Als Futterzusätze zur Steigerung der Gehalte von DHA und EPA im Eidotter werden derzeit n-3-FS-haltige Pflanzenöle wie Leinöl (CASTON & LEESON 1990; STEINHILBER 2003) aber auch Robbenöl und Fischöl (SCHREINER et al. 2004) verwendet. Analog zur Nahrungskette im Meer sollte versucht werden, über die Nahrungskette mit infiziertem Salat, der an Hühner verfüttert wurde, den EPA- oder DHA-Gehalt im Eidotter zu erhöhen. Da Salat in großen Mengen von Hühnervögeln verzehrt werden kann und B. lactucae unter beschriebenen Bedingungen in infiziertem, getrocknetem Pflanzengewebe bis zu 1mg EPA/g produzierte (vgl. Kap. 2.2.3.), stand ein Wirt/Parasit-System mit geeignetem FS-Muster für einen Nahrungskettenversuch zur Verfügung. Hierzu waren mehrere, bisher ungeklärte Voraussetzungen zu überprüfen: 1.) Lässt sich für eine Fütterung genügend infiziertes Pflanzenmaterial gewinnen? 2.) Wie hoch sind die erzielbaren EPA-Gehalte in infiziertem Salat vom Freiland? 3.) Sind Trocknung und Lagerung von großen Salatmengen ohne Verlust an EPA realisierbar? 4.) Wie wirkt Bremia-infizierter Salat als Futterbeimischung auf die Tiere und die Eiqualität? 4.2. Materialien und Methoden: 4.2.1. Versuchsaufbau und Aufgabenverteilung Für die Bearbeitung der komplexen Fragestellung war die Kooperation mit mehreren Instituten Hohenheims notwendig. Die Umsetzung des Versuches wurde in 5 generelle Schritte untergliedert (Abb. 4.1.), die mit Hilfe der Kooperationspartner ausgeführt wurden. 68 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Feldanzucht von Bremia lactucae-infiziertem Salat und gesundem Kontrollsalat Versuchsstation für Gartenbau, Institut für Botanik Bestimmung der Trocknungsparameter im Labor, Trocknung der Fütterungsversuche im Hordentrockner Institut für Botanik Institut für Agrartechnik Qualitätskontrolle der Futterproben Bestimmung der Omega-3-Fettsäuren Institut für Botanik Institut für Tierhaltung und Tierzüchtung Herstellung von Futtermischungen Fütterungsversuche mit Legehennen Produktion von Hühnereiern Versuchsstation für Tierzüchtung „Unterer Lindenhof“ Analyse der Eidotter Überprüfung der Hühnergesundheit Institut für Tierhaltung und Tierzüchtung Abb. 4.1.: Flussdiagramm der Projekteinheiten und die dafür zuständigen Kooperationspartner. Die Feldanzucht von genügend gesundem und infiziertem Salat mit starkem B. lactucae-Befall erfolgte auf der Versuchsstation für Gartenbau des Landes BadenWürttemberg (Stuttgart-Hohenheim). Der langfristige Anbau- und Pflegeplan wurde, nach Abstimmung mit den Futterberechnungen von Herrn Grashorn, von Frau Anderle erstellt und von Gärtnern der Versuchstation durchgeführt. Die Trocknung von infiziertem und gesundem Salat im Großmaßstab erfolgte am Institut für Agrartechnik, wo mit freundlicher Unterstützung von Herrn Professor Müller ein Hordentrockner zur Verfügung stand, mit dem die großen Salat-mengen für die Hühnerfütterung fachgerecht und definiert getrocknet werden konnten. Die Trocknung musste sofort nach der Ernte erfolgen, um Qualitätsverluste (Oxidationsund Abbauprozesse) zu verhindern. Kurze Wege waren erforderlich, da infizierter Salat schnell welkte und die Oxidationsanfälligkeit auf Grund des hohen Gehaltes an n-3-FS von B. lactucae (BELITZ et al. 2001) stark erhöht war. An den Instituten für Botanik und Agrartechnik wurden Vorversuche mit infiziertem Salat gefahren, um eine optimale Trocknungsprozessführung zu gewährleisten. 69 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Die Herstellung der Futterrationen für die einzelnen Tier-Versuchsgruppen erfolgte unter Leitung von Herrn Professor Grashorn auf der Versuchsstation für Tierhaltung, Tierzüchtung und Kleintierzucht „Unterer Lindenhof“. Die Aufzucht und die Haltung von Hühnern als Multiplikatoren der n-3-FS aus dem Futter ins Ei erfolgten ebenfalls unter Leitung von Herrn Prof. Grashorn auf der Versuchsstation für Tierzüchtung „Unterer Lindenhof“. Alle Gesundheits- und Leistungsdaten der Tiere sowie alle weiteren Qualitätsmerkmale der Legeabschnitte wurden am Unteren Lindenhof vom Institut für Tierhaltung und Tierzüchtung erhoben. Es wurden 5 Fütterungsgruppen gebildet, die jeweils 8 Tiere umfassten. Die Versuchsdauer betrug 21 Tage. Um eine verlässliche Quantifizierung der n-3-FS in Salat, Futter und Eidotter zu garantieren, wurden die Fettsäureanalysen am Institut für Botanik und am Institut für Tierhaltung und Tierzüchtung (Zentrallabor „Unterer Lindenhof“) durchgeführt. So konnten die Ergebnisse verglichen und abgesichert werden. 4.2.2. FS-Konzentrationen der Salatextrakte, der Futterrationen und der Dotterlipide Materialien: Infizierte und gesunde Salatblätter von Grünem Kopfsalat (Sorte Nadine Fa. Rijkzwaan, Niederlande), Roter Eichblattsalat (Mischung der Sorten Murai, Fa. Rijkzwaan, Niederlande, Ribai (Fa. Rijkzwaan, Niederlande), Nun7816 (Fa. Nunhems Zaden BV, Niederlande), Stromboli (Fa. Seminis, USA)). Futtermischungen der 5 Varianten: Kraftfutter+ 10% Grüner Kopfsalat infiziert; Kraftfutter+ 10% Grüner Kopfsalat gesund; Kraftfutter+ 10% Roter Eichblattsalat infiziert; Kraftfutter + 10% Roter Eichblattsalat gesund; Kraftfutter ohne Salat als Kontrolle; Eidotter von Hühnern, die mit den 5 Futtervarianten versorgt wurden. Die qualitativen und quantitativen Analysen der Fettsäuremuster am Institut für Botanik erfolgten mit geringen Abwandlungen wie in den Kapiteln 2.1.2.-2.1.4. beschrieben. Für Wiederfindung und Vergleichbarkeit erfolgte die Korrektur mit dem IS 17:0 (vgl. Kap. 3.2.4.5.). Am „Unteren Lindenhof“ erfolgte die Extraktion der Proben unter Verwendung des 20:0 IS nach der Standardmethode von Folch (FOLCH et al. 1957). 70 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Die Korrektur der absoluten FS-Konzentrationen erfolgte mit Hilfe des externen Supelco 37 Komponenten-Standards, dessen Signalfläche/Konzentration-Verhältnis von 20:0 (Faktor 1) bezüglich der anderen FS ins Verhältnis gesetzt wurde (vgl. Kap. 2.1.4.). Dazu wurde der 37-Komponenten-Standard siebenmal injiziert. Da sich die FS im 37 Komponentenstandard bezüglich ihrer Signalfläche/Konzentrationsverhältnisse (bekannte relat. Konzentration, bekannte Signalfläche) ebenso verhalten wie der FS-Standard in der Probe, galt für die Korrekturfaktoren der FS folgende Formel (HAASMANN 1998): Korrekturfaktor = (rQIS/rQS)/(AIS/AS), wobei galt: rQIS = Flächenprozentanteil der FS im internen Standard, rQS = Flächenprozentanteil der FS im externen Standard, AIS = FS-Signalfläche der FS im internen Standard, AS = FS-Signalfläche der FS im externen Standard. Bsp.: Bei gegebener Konzentration bekommt der interne Standard 20:0 den Faktor 1 zugeordnet, FS mit selber Konzentration jedoch abweichender Signalfläche im externen Standard, bekommen Faktoren < oder > 1 zugeordnet, die FS 20:5 z.B. 0,89, 22:6 z.B. 1,06 (Anhang I). Für die Quantifizierung der Lipidgehalte der Dotterproben erfolgte ein Flächenvergleich des 20:0 IS mit jeder einzelnen Fettsäure unter Verwendung dieser berechneten Korrekturfaktoren. Die hierfür verwendete Formel lautete (HAASMANN 1998): CFS = Korrekturfaktor•(mIS/mPR)•(AFS/AIS), wobei galt: CFS =korrigierte Konzentration FS, mIS= Einwaage interner Standard, mPR = Einwaage Probe, AIS = Peakfläche interner Standard, AFS = Peakfläche FS Probe. Bsp. C20:5 = 0,89•(1g/4g)•(18000 PFE 20:5)/14000 PFE 20:0), EPA ist in einer Konzentration von 0,17 mg pro g Probe enthalten. Da dies dem derzeitigen Standard in der Wissenschaft zur absoluten Konzentrationsberechnung von FS in Lebensmitteln am GC-FID entspricht, wurden für die statis- 71 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier tische Auswertung (Kap. 4.2.6.) die empirisch über den 37-Komponenten-Standard korrigierten FS-Konzentrationswerte vom Institut für Tierzüchtung verwendet. 4.2.3. Salatproduktion Aus Forschungsarbeiten (STEINHILBER 2003) war bekannt, dass Leinölzusatz zum Futter (einer Menge von 17,6 mg ALA/g entsprechend) die Produktion von ALA und DHA im Eidotter erheblich steigerte. Auf 1 kg Futter wurden 40 g Leinöl (4%) zugemischt. Ein kg Futter enthielt 17,6 g n-3-FS in Form von ALA. Infizierter Kopfsalat produzierte im Labor bei optimaler Infektion (Sporulation von 100% der Fläche) 1 mg EPA/g TG. Für den besten Infektionsfall galt daher die Annahme, dass ein kg getrockneter Salat mit B. lactucae-Infektion 1 g EPA enthielt. Da Salat dem Hühnerfutter nur in eingeschränkter Konzentration zugemischt werden sollte, um die Legeleistung der Hennen nicht zu beeinträchtigen, wurde eine Zumischung von 10 % infiziertem Salat zum Kraftfutter festgelegt. Damit konnten EPA Mengen von höchstens 0,1 g EPA/kg TG erreicht werden. Da aber Salat selbst erhebliche Mengen an ALA produzierte (ca. 5-7 mg/g TG), konnte die ALA-Menge aus Salat den Gesamtgehalt an n-3-FS im Futter wesentlich erhöhen. Somit war von einer n-3-FS Menge von 7,1 g n-3-FS/kg TG (7 g ALA/kg + 0,1 g EPA/kg Futter) auszugehen, was nur noch etwas weniger als der Hälfte der Menge der ALA Beimischung aus Leinöl (17,6 g/kg) entsprach. Eventuell würde ALA aus Salat zu einer Sättigung an ALA im Eidotter beitragen, was wiederum zum Anstieg von DHA führen könnte, das aus dem überschüssigen ALA und EPA synthetisiert werden konnte. Dann würden die EPA-Mengen aus B. lactucae schon in kleinen Mengen ins Gewicht fallen. Ein Huhn benötigte etwa 100 g Trockenfutter/Tag, 8 Hühner bildeten eine Gruppe. Der Versuch wurde auf 21 Tage angelegt. Gruppe 1 bekam Kontrollfutter, die Gruppen 2, 3, 4 und 5 erhielten Kontrollfutter mit 10 % getrockneten Salat mit oder ohne B. lactucae. Um diese Mischung zu erhalten, mussten für diesen Zeitraum pro Gruppe 30 kg Frischsalat bzw. 3 kg Trockensalat eingeplant werden. Um diese Menge an getrocknetem Salat auf jeden Fall zu erhalten, wurden etwa 2000 Köpfe für die infizierte Variante und ca. 1000 Köpfe für die Kontrolle gepflanzt. Dafür standen 2x2 Beete (räumlich getrennt) mit je 150 m² zur Verfügung. 72 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Anbau, Infektion und Ernte des Futtersalates Da das Feldisolat in dem Laborversuch identisch mit dem bodenbürtigen Pathogen auf der Versuchsstation für Gartenbau war und dies zusätzlichen Genehmigungsaufwand verhinderte, wurde auf eine Zusatzinfektion verzichtet und mit dem natürlichen Befall gearbeitet. Alle Jungpflanzen wurden vor der Pflanzung einmal mit dem Pflanzenschutzmittel Polyram (Wirkstoff: Ethylen(bis)-dithiocarbamat) behandelt, um eine Frühinfektion mit B. lactucae und einen dadurch bedingten Pflanzenverlust zu vermeiden. Die Beete mit B. lactucae-infiziertem und die Beete mit „gesundem“ Salat waren räumlich durch ein Kohlfeld getrennt (Abb. 4.2.), Beete auf denen Falscher Mehltau erwünscht war, wurden abends zusätzlich bewässert, da dies die Verbreitung förderte. Abb. 4.2.: Feldanbau von infiziertem Salat. Links: Früher und später Satz von Grünem Kopfsalat, Rechts: Sortenversuch der Staatsschule für Gartenbau mit infiziertem und gesundem Roten Eichblattsalat. Die Beete, die infektionsfrei bleiben sollten, wurden nach der Pflanzung zusätzlich mit Ortiva (Wirkstoff: Azoxystrobin) und Aliette (Wirkstoff: Fosetyl) behandelt, um eine Infektion auszuschließen. Der Anbau von Rotem Eichblattsalat erfolgte im Rahmen eines Sortenversuches von Herrn Blauhorn von der Staatsschule für Gartenbau (Abb. 4.2.) und durfte mit freundlicher Genehmigung für den Bremia-Versuch zusätzlich geerntet werden. Da von einer Sorte des Roten Eichblatt Salats nicht genügend infiziertes bzw. gesundes Material zur Verfügung stand, wurde je eine Mischung mehrerer Sorten vorgenommen (vgl. Kap. 4.2.2.). 73 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Die Ernte erfolgte in Etappen über 3 Wochen, wobei gleichzeitig die Trocknung stattfand. Zunächst wurde im Zeitraum von einer Woche gesunder Salat geerntet und getrocknet. Zeitlich versetzt, um Kontaminationen vorzubeugen, erfolgten Ernte und Trocknung des infizierten Salates. Der Salat wurde, um eine kurze Ernte- und Verarbeitungsdauer zu gewährleisten, stets mit mehreren Personen geerntet. Die Kisten mit Salat wurden mit dem Auto direkt zur Trocknungshalle gefahren und dort weiterverarbeitet. 4.2.4. Trocknung Trocknung im Kleinmaßstab Die wichtigste Voraussetzung war eine gewisse Temperaturstabilität der FS im infizierten Salatgewebe während der Trocknung. Um allgemein zu testen, wie temperaturstabil die Lipide von B. lactucae waren, wurde zunächst am Institut für Botanik ein Trocknungsversuch im Kleinmaßstab durchgeführt. Material: Ein vollständig infiziertes, frisch sporulierendes Salatblatt von Grünem Kopfsalat, 3 Trockenschränke mit Thermometer, Exsikkator bei RT 20°C, 2 ml Reaktionsgefäße. Methode: Von einem gleichmäßig sporulierenden Salatblatt wurden mit einer Rasierklinge acht 0,5 cm² große Stücke ausgeschnitten. Die beiden der Hauptblattader gegenüberliegenden Stücke vom Blattgrund zur Blattspitze wurden bei 20°C (RT) für je 24 und 48 h im Exsikkator und bei 40°C, 60°C bzw. 80°C für j e 24 und 48 h im Wärmeschrank einzeln getrocknet. Anschließend wurden die EPA-Gehalte der 8 Proben nach der Methode von Kapitel 2.1.2.-2.1.4. bestimmt. Trocknung der Salatmenge für Futterzwecke im Großmaßstab Der Salat für das Fütterungsexperiment wurde im Großmaßstab, anhand der Erfahrungswerte aus dem Kleinversuch, in einem Hordentrockner, nach dem Umluftprinzip getrocknet (Abb. 4.3.). 74 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Zuerst wurde 2 h bei 60°C getrocknet, wobei die Oberfl ächentemperatur des Salates ca. 40°C betrug. Danach folgte eine Trocknungszeit von 15 h bei 40°C. Abb. 4.3. : Trocknung des Salats auf Blechen im Hordentrockner. Links: Entfernen des Strunks. Mitte: Befülltes Blech für den Hordentrockner. Rechts: Abfüllen des getrockneten Salates in ein geeignetes Behältnis bis zur Fütterung. Damit der Trocknungszeitraum nicht unnötig verlängert wurde und der Salat keine Stellen mit erhöhter Restfeuchte aufwies, sollten keine ungleichmäßig getrockneten Stellen entstehen. Daher entfernte man den Strunk mit dem Handmesser und legte die Blätter einschichtig auf die Trockenbleche (Abb. 4.3.). Um 120 kg Frischsalat zu trocknen wurden 8 Trockner-Ladungen mit jeweils ca. 17 h Trockenzeit benötigt. Der getrocknete Salat wurde an zwei Terminen gewogen und die Restfeuchte, die unter 10% liegen sollte, wurde bestimmt. 75 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4.2.5. Fütterungsversuch Versuchstiere und Haltungsbedingungen Für den Versuch standen 40 Legehennen der Rasse „Lohmann Selected Leghorn“ (LSL, Rhein-Main, Groß-Umstadt) im Alter von 38 Wochen zu Verfügung, die in Einzelkäfighaltung (Grundfläche 40 x 50 cm) untergebracht waren. Die Eier wurden von Hand gesammelt. Die Belüftung des Stalles erfolgte über eine Unterdrucklüftung, wobei eine RT von 18-20°C und eine rel. Luftfeuchte von 60 % angestrebt wurde. Der Stall war ohne Tageslichteinfall, die Beleuchtungsdauer betrug 14 h bei 10 Stunden Dunkelheit. Die Beleuchtungsintensität lag bei 20 Lux. Futter Die Herstellung der Versuchsrationen erfolgte auf der amtlich zugelassenen Mischfutteranlage (DE BW 4 000 01) der Versuchsstation „Unterer Lindenhof“. Für die Versuchsrationen wurde eine gemeinsame Grundration erstellt, bei der die Nährstoffverdünnung durch die 10%ige Salatzugabe berücksichtigt wurde (Tab. 4.1.). Für die Kontrollgruppe wurde eine eigene Ration ohne Salat hergestellt. Die Nährstoffgehalte der Rationen wurden auf der Basis der Empfehlungen des Legehennenzüchters (Lohmann Tierzucht, Cuxhaven) eingestellt. 76 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Tab. 4.1.: Futterzusammensetzung und wichtigste kalkulierte Nährstoffgehalte (g/kg) Komponenten Kontrollgruppe Versuchsgruppe Sojaextraktionsschrot 210 200 Weizen 528 430 Mais 120 100 Salat - 100 Sojaöl 24 55 Futterkalk grob 52 50 Futterkalk fein 44 43 Mono-Calciumphosphat 8,0 10 Natrium-Bikarbonat 2,4 2,4 Kochsalz 2,4 2,4 Cholinchlorid 1,0 1,0 Methionin 1,6 1,6 Kalzium-Propionat 4,0 4,0 Antioxidans Loxidan 0,2 0,2 Farbstoff Avizant Y 20S 0,6 0,6 Farbstoff Avizant R 20S 0,8 0,8 Spurenelement-VM* 0,8 0,8 Vitamin-VM** 2,0 2,0 Rohprotein 171 171 Methionin 3,9 3,9 L-Lysin 7,8 7,8 Umsetzbare Energie (MJ/kg)* 11,4 11,3 Ca 39 4,0 Pges 5,8 5,9 Kalkulierte Nährstoffe * Spurenelement-Vormischung (mg/kg): 120.000 Mn, 80.000 Zn, 90.000 Fe, 15.000 Cu, 1.600 J, 500 mg Se, 600 mg Cu. ** Vitamin-Vormischung (/kg): 6.000.000 I.E. A, 1.500.000 I.E. D3, 15.000 mg E, 1.500 mg B1, 3.000 mg B2, 3.000 mg B6, 15.000 µg B12, 1.200 mg K2, 25.000 mg Nikotinsäure, 7.000 mg Ca-Panthotenat, 500 mg Folsäure, 50.000 µg Biotin 77 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4.2.5.1. Leistungsdaten der Tiere Die Legeleistung wurde täglich erfasst, der Futterverbrauch wöchentlich. Die Eigewichte wurden am Versuchsende im Rahmen der Bestimmungen zu Eiqualität (Dotterfarbe, Dotter- und Schalenanteil, n-3-FS Depositionsrate) und FS-Muster ermittelt. Zur Bestimmung der Fettsäuremuster im Dotter wurden zwei Eier pro Henne gesammelt. Die Dotter wurden einzeln bis zum Analysentermin tiefgefroren. Der Dotteranteil wurde berechnet. Je ein Dotter wurde für die Analysen am Institut für Botanik und eines für die Analysen am Institut für Tierhaltung und Tierzüchtung verwendet. Vom Institut für Tierhaltung und Tierzüchtung wurden zusätzlich die Oxidationsprodukte (TBARS) im Dotter bestimmt. Eigewichte, Dotter- und Schalenanteil, Dotterfarbe Es wurde untersucht, wie sich die Fütterung auf die Eigewichte, den Dotter- und Schalenanteil sowie die Dotterfarbe auswirkte. Es wurden die Farben von frischen und gekochten Eidottern bestimmt. Zusätzlich wurde ein Sensoriktest zur visuellen und geschmacklichen Konsistenz gekochter Eier durchgeführt. Depositionsraten der n-3-FS im Dotter Die Berechnung der Depositionsraten der n-3-FS erfolgte am Institut für Tierhaltung und Tierzüchtung nach der Beschreibung von Steinhilber (STEINHILBER 2003). Die Depositionsrate beschreibt die prozentuale Einlagerung an n-3-FS aus dem Futter in die Dotterlipide. Sie ist ein Maß für die Verwertung der Hühner von n-3-FS aus dem Futter. Zur Berechnung der Depositionsraten (%) wurde folgende Formel eingesetzt: DP = ((DG•FSD)•LL)/(FA•FSF), wobei: DP=Depositionsrate (%), DG=Dottergewicht (g), FSD=Fettsäuregehalt Dotter (mg/g), FA=Futteraufnahme (g), FSF=Fettsäuregehalt Futter (mg/g), LL=Legeleistung (%). Lipidoxidation - TBARS-Bestimmung in Eidotter EPA und DHA neigen wegen ihrer hohen Anzahl an Doppelbindungen sehr leicht zur Oxidation, wobei kurzkettige, aromatische Verbindungen entstehen. Diese Verbindungen sind für Fehlaromen im Ei verantwortlich und unerwünscht (MARSHALL et al. 78 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 1994). Ein Maß für die Oxidation und die damit verbundene Qualität stellte der TBARS-Test dar (vgl. Kap. 4.2.5). Beim TBARS-Test reagieren 2 Moleküle Thiobarbitursäure mit einem Molekül Malondialdehyd. Dies führt zur Bildung eines roten Farbkomplexes, der photometrisch zwischen 532-538 nm nachgewiesen werden kann (SINNHUBER & YU 1958). Die Intensität der gemessenen Farbe hängt vom PUFA-Gehalt der Probe ab. Eine Probe mit hohen Gehalten an mehrfach-ungesättigten FS weist deutlich höhere TBARS-Werte auf, als eine Probe mit nur gesättigten Fettsäuren (DAHLE 1962). Die TBARSBestimmung erfolgte unter Leitung von Herrn Grashorn am Unteren Lindenhof nach einer modifizierten Methode von Kornbrust und Mavis (KORNBRUST & MAVIS 1980). Die Berechnung der TBARS erfolgte photometrisch als Malondialdehyd unter Zuhilfenahme des molaren Extinktionskoeffizienten nach folgender Formel: Malondialdehyd (nmol/mg Dotter) = (6,410•1000•3•Extinktion)/100. Für die Analyse der TBARS wurde 1g Dotter in ein Reagenzgefäß eingewogen. Der Probe wurden 9 ml KCl (1,15 %ig) hinzugefügt. Um eine homogene Lösung zu erhalten, wurde die Probe bei 9000 Umdrehungen ca. 15 sec. gründlich homogenisiert. Anschließend wurde in 10 ml Schraubgefäße 0,5 ml 80 mM Tris-Malat-Puffer (pH 7,4), 0,2 ml 5 mM Eisensulfatlösung, 0,2 ml 2mM Ascorbinsäure und 0,1 ml Probenhomogenat vorgelegt. Als Blindwert für die spätere photometrische Bestimmung wurde in 2 Röhrchen, anstelle des Probenhomogenats, 1,15% KCl pipettiert. Den Proben wurde nun 2 ml des Probenreagenz (150 g Trichloressigsäure und 3,75 g Thiobarbitursäure, die in 1Liter 0,25 n HCl gelöst wurden) gegeben. Nach dieser Zugabe wurden die Röhrchen fest verschlossen und 30 s kräftig geschüttelt. Es folgte ein 30minütiges Kochen und ein anschließendes Abkühlen der Proben auf Eis, um die Reaktion zu stoppen. Bei 2200 U/min und 4°C wurden die Proben 20 min zentrifugiert und danach in 1 cm Glasküvetten bei einer Wellenlänge von 535 nm in einem Photometer (PM 2 DL, Zeiss, Jena) vermessen. 79 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4.2.6. Statistische Auswertung der Lipidgehalte in den Dotterproben Der Test des Einflusses der Faktoren Salatsorte und Futtervariante auf den Gehalt an n-3-FS im Dotter, in Abhängigkeit vom Faktor Futterbehandlung, erforderte über die klassische Varianzanalyse hinaus, die Formulierung eines statistischen Modells. Das Modell wurde in Zusammenarbeit mit Jens Möhring vom Institut für Biometrie (Prof. Dr. Piepho) an der Universität Hohenheim entwickelt und mit Hilfe der Prozedur für Gemischte Modelle mit SAS ausgewertet. Modell mit fixen Effekten: Y(ijkl) = µ + αi + βj (αi) + γk (αi) + βγjk (αi) + eijkl Wobei: Y= Fettsäure (z.B. 22:6 n-3 bzw. 18:3 n-3) µ= geschätzter wahrer Gruppen-Mittelwert αi= Faktor Futterbehandlung (Salat ja/nein) βj (αi)= Faktorstufe Futterbehandlung (Salatsorte) innerhalb des Faktors αi γk (αi)= Faktorstufe Bremia-Befall ja/nein innerhalb des Faktors αi βγjk (αi)= Wechselwirkungen der Faktorstufen innerhalb des Faktors αi eijkl= Restfehler Die Signifikanzgrenze wurde mit Hilfe des p-Wertes (Teststärke) ausgedrückt. Sie lag bei p<0,05%, was der Vertrauenswahrscheinlichkeit von α=5% entspricht. Bei p>0,05 (α>5%) wurde die Nullhypothese (es existieren keine Unterschiede) angenommen, bei p<0,05 (α<5%) wurde die Nullhypothese abgelehnt und die Alternativhypothese (es existieren Unterschiede) trat in Kraft. Bei p<0,01 waren die Unterschiede als hochsignifikant einzustufen. 80 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4.3. Ergebnisse 4.3.1. Befallsergebnis des Feldversuches zur Ernte Die Ernte von Rotem Eichblatt- und Grünem Kopfsalat erfolgte vom 25.09.15.10.2007. Der Befall mit B. lactucae erfolgte bei Rotem Eichblattsalat massiv schon ab Mitte September 2007. Zuerst wurden einzelne ältere Blätter befallen, die Kontakt mit dem Boden hatten. B. lactucae verbreitete sich von einem Intercostalfeld zum nächsten, so dass innerhalb von 2 Wochen Die Salatköpfe komplett infiziert waren, was sich an einem weißen Sporulationsbelag von B. lactucae auf den Blattunterseiten zeigte. Ein infizierter Salatkopf wog durchschnittlich 350 g, gesunde Köpfe wogen etwa 500 g. Ab Anfang Oktober zeigte auch der 3 Wochen jüngere Grüne Kopfsalat ersten Befall mit B. lactucae. Ab Anfang Oktober konnte der Grüne Kopfsalat geerntet werden, der jedoch deutlich weniger Biomasse aufwies und schlechter befallen war, als der Rote Eichblattsalat. Infizierte Köpfe wogen im Durchschnitt 150 g, gesunde Köpfe wogen ca. 200 g. Der frühere Satz des Grünen Kopfslates (Aussaat am 07.08.) war zu 20% besser mit Falschem Mehltau befallen als der spätere Satz (Aussaat am 22.08.) und wies fast doppelt soviel Biomasse auf. Insgesamt war der Grüne Kopfsalat nur zur Hälfte sichtbar infiziert, wobei nur die ältesten Blätter Sporulation zeigten. Der Rote Eichblattsalat dagegen wies Sporulation bis in die jüngsten Blätter hinein auf, wobei ältere infizierte Blätter teilweise schon faulten. Von beiden Salattypen konnten infizierte und gesunde Köpfe in ausreichender Menge geerntet werden. Grüner Kopfsalat vom Feld enthielt 150200 mg EPA/kg TG, Roter Eichblattsalat vom Feld enthielt 300-400 mg EPA/kg TG. 4.3.2. Temperaturstabilität und Trocknung Die Voruntersuchungen zur Trocknung (Abb. 4.4.) von infiziertem Salat zeigten, dass die EPA-Konzentrationen bei RT nach 24 h bei 0,7 mg EPA/g TG lagen, wobei nach 48 h nur noch 0,35 mg EPA/g TG nachgewiesen werden konnten. Bei 40°C waren die EPA-Gehalte mit ca. 1 mg EPA/g TG am höchsten und blieben über den Zeitraum von 48 h stabil. Bei 60°C lagen die EPA Gehalte sowohl nach 24 h als a uch nach 48 h nur noch bei etwa 0,7 mg/g TG, bei 80°C lagen die EPA-Gehalte fü r beide Trocknungszeiträume nur noch bei ca. 0,5 mg/g TG. 81 EPA-Gehalt [mg/g TG] 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 1,20 1,00 0,80 0,60 0,40 0,20 0,00 20°C 40°C 60°C 80°C 24 h 0,71 1,06 0,62 0,53 48 h 0,36 1,01 0,70 0,60 [°C] Abb. 4.4.: Vergleich der EPA-Gehalte innerhalb eines gleichmäßig sporulierenden Salatblattes bei 4 Temperaturen (20°C, 40°C, 60°C, 80°C) und 2 Zeiträu men (24 h und 48 h). An diese Werte angepasst wurde der Salat im Hordentrockner auf Blechen für 2 h bei einer Ofentemperatur von 60°C getrocknet, wobei die Oberflächentemperatur vom Salat ca. 40°C betrug. Danach folgte eine Trocknung szeit von 15 h bei 40°C. Der Restfeuchtegehalt des getrockneten Salates lag durchschnittlich und stabil zwischen 5 und 9 %. Nach etwa 17 h konnte der getrocknete Salat von den Blechen genommen und gewogen werden. Danach wurde der Salat in doppelwandige Papiersäcke überführt, die in verschließbaren, blauen 60 l Plastiktonnen gelagert wurden. Das Fassungsvolumen einer Tonne wurde von ca. 1,5 kg Trockensalat ausgefüllt. Stichproben nach 1 und 2 Wochen Lagerung zeigten, dass es weder Veränderungen gegenüber der Anfangsfeuchte gab und keine nachträgliche Durchfeuchtung stattfand, noch dass sich FS-Gehalte verschlechterten. 4.3.3. Fettsäureanalyse in der Nahrungskette Zunächst wurden die qualitativen Muster der FS von infiziertem und gesundem Salat, den Futtermischungen und den Eidottern mit ihren relativen Anteilen an FAME am Gesamtmuster miteinander verglichen. In Abb. 4.5. sind die relativen Anteile der relevanten FS der verschiedenen Nahrungsmittel einander gegenübergestellt. Der Übersichtlichkeit wegen wurde die Darstellung auf das Beispiel des Roten Eichblattsalates beschränkt. Grüner Kopfsalat wies dasselbe Fettsäuremuster mit nicht signifikant unterscheidbaren relativen Anteilen auf. Die Qualität der Fettsäuremuster der Eidotter änderte sich nach unterschiedlicher Fütterung nicht. Das Muster blieb konstant, es wurden keine zusätzlichen oder fehlenden FS detektiert. 82 Signalflächenanteile der FAME [% ] 70 60 50 40 30 20 10 0 14:0 16:0 16:1 18:0 18:1 18:2 n-6 18:3 n-3 20:4 n-6 20:5 n-3 22:6 n-3 Fläche % RE- 0,11 11,27 0,11 2,20 1,95 28,73 55,63 0,00 0,00 0,00 Fläche % RE+ 3,83 25,66 2,03 3,28 2,91 17,27 43,28 0,00 1,73 0,00 Fläche % FK 0,09 9,97 0,11 2,37 23,71 57,81 5,94 0,00 0,00 0,00 Fläche % FRE- 0,16 11,22 0,16 2,99 22,45 54,96 8,05 0,00 0,00 0,00 Fläche % FRE+ 0,14 11,38 0,20 3,04 22,69 54,54 7,97 0,00 0,04 0,00 Fläche % Dok 0,18 28,11 1,71 13,18 31,07 17,36 0,49 4,81 0,00 3,08 Fläche % DoRE- 0,20 24,06 1,45 14,66 28,53 21,61 1,04 5,67 0,00 2,78 Fläche % DoRE+ 0,16 23,92 1,27 14,63 28,06 22,71 0,93 4,93 0,00 3,40 Abb. 4.5.: Vergleich der relativen Signalflächenanteile der FAME in der Nahrungskette. Infizierter Salat (RE+), gesunder Salat (RE-), Futter (Kontrolle (FK), mit inf. Salat (FRE+), mit gesundem Salat (FRE-)) und Dotter (nach Fütterung mit Kontrollfutter (DoK), mit Beimischung von inf. (DoRE+) und gesundem (DoRE-) Salat). 83 FAME 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Im Fettsäuremuster von gesundem Salat dominierte die Fettsäure ALA (18:3 n-3) mit über 50% Anteil, gefolgte von LA (18:2 n-6) und Palmitinsäure (16:0) mit je ca. 25% Gesamtanteil. Infizierter Salat enthielt sowohl FS von B. lactucae als auch von Salat und war von gesundem Salat dadurch eindeutig unterscheidbar, dass EPA zu einem Anteil von 1-2 % am Fettsäuremuster beteiligt war. Eine Infektion mit B. lactucae konnte bei einem EPA-Anteil von 0,01 % noch nachgewiesen werden. Das Fettsäuremuster von Kontrollfutter ohne Salatzusatz wurde deutlich vom enthaltenen Sojaöl geprägt (Abb. 4.5.). Sojaöl enthält zu 60% und mehr die n-6-FS LA (vgl. Kap. 1), was sich im Fettsäuremuster vom Kontrollfutter (Abb. 4.5.) widerspiegelte. Die n-3-FS ALA war nur zu einem Anteil von ca. 5-6 % im FS-Muster enthalten. Im Kontrollfutter waren zudem hohen Mengen an Ölsäure (18:1 n-9) mit ca. 23% und Palmitinsäure (16:0) mit ca. 10% Anteil nachweisbar. Kontrollfutter mit Beimischung von 10% Salat (infiziert bzw. gesund) enthielt als Hauptfettsäure ebenfalls LA (18:2 n-6), durch die Beimischung sank der LA-Anteil im Futter jedoch von 57 auf 54%. Der ALA-Anteil in Futter mit Salatzusatz war mit durchschnittlich 8 % gegenüber dem ALA-Gehalt im Kontrollfutter mit nur 5,9 % statistisch signifikant erhöht. EPA konnte in Futter mit 10% infiziertem Salat nachgewiesen werden, jedoch mit nur noch sehr geringen Anteilen von 0,02-0,04%, die aus Abb. 4.5. grafisch nicht mehr ersichtlich sind. Der Anteil von ALA im Dotter war nach Fütterung mit Kontrollfutter mit 0,5% sehr gering und konnte mit Salatbeimischung auf 1% gesteigert werden. EPA konnte in Dotter nicht bzw. nur in Spuren nachgewiesen werden. Von der n-6-FS-Reihe waren LA (18:2 n-6) mit 17% und ARA (20:4 n-6) in Dotter aus Kontrollfütterung weniger stark vertreten wie in Dotter aus Salatfütterung mit 21 und 22%. Ölsäure (18:1 n-9) hatte ca. 30% den höchsten Anteil am FS-Muster im Eidotter, gefolgt von Palmitinsäure (16:0), Linolsäure (18:2 n-6) und Stearinsäure (18:0). DHA und ARA waren, im Gegensatz zu Futter oder Salat, nur in Dotter vorhanden. DHA war die dominante n-3-FS im Eidotter. Sie hatte einen durchschnittlichen Gesamtanteil von etwa 4-5% am Fettsäuremuster. Die gesättigten FS 16:0 und 18:0 hatten im Dotter einen gemeinsamen Anteil von etwa 40%. 84 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Die absoluten n-3-FS-Konzentrationen in Form von ALA, EPA und DHA aus Sporangien von B. lactucae, Salat, Futter und Dotter sowie die n-6/n-3-Verhältnisse wurden in Tab. 4.2. zusammengefasst, um einen vergleichenden Überblick zu ermöglichen. Je kleiner der n-6/n-3-Wert der Tabelle, umso besser war das n-6/n-3Verhältnis. Tab. 4.2.: Die Konzentrationen der n-3-FS in der Nahrungskette EPA mg/g ALA mg/g DHA mg/g n-3 Gesamt n-6/n-3- (20:5 n-3) (18:3 n-3) (22:6 n-3) (mg/g) Verhältnis Bremia lactucae Sporangien FG 10 1,5 0,5 12 0,72 Infizierter Grüner Kopfsalat TG 0,14 5,02 - 5,16 0,75 Gesunder Grüner Kopfsalat TG - 7,15 - 7,15 0,52 Infizierter Roter Eichblattsalat TG 0,27 5,00 - 5,27 0,59 Gesunder Roter Eichblattsalat TG - 7,26 - 7,26 0,52 Futter mit 10% inf. Grünem 0,019 5,43 5,45 6,5 - 4,93 - 4,93 5,3 0,026 5,43 - 5,46 6,8 - 4,49 4,49 6,8 Kontrollfutter ohne Salat TG - 2,42 - 2,42 9,7 Dotter mit inf. Grünem Kopfsalat - 4,62 3,39 8,01 8,71 - 4,34 3,63 7,98 8,48 - 4,05 3,71 7,76 8,69 - 4,26 3,54 7,80 8,42 - 2,12 2,92 5,04 9,82 Kopfsalat TG Futter mit 10% ges. Grünem Kopfsalat TG Futter mit 10% inf. Rotem Eichblattsalat TG Futter mit 10% ges. Rotem Eichblattsalat TG FG Dotter mit ges. Grünem Kopfsalat FG Dotter mit inf. Rotem Eichblattsalat FG Dotter mit ges. Rotem Eichblattsalat FG Dotter mit Kontrollfutter FG ALA Sporangien enthielten nur 1,5 mg ALA/g FG. Da auch hier durch den 10%igen Futterzusatz die Konzentrationen bis in den µg Bereich hinein verdünnt wurden, 85 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier spielte ALA aus B. lactucae wohl keine Rolle für den ALA Gehalt im Dotter. Salat dagegen zeigte Mengen an ALA im einstelligen mg-Bereich. Gesunder Grüner Kopfsalat produzierte durchschnittlich 7,15 mg ALA/g TG, gesunder Roter Eichblattsalat produzierte durchschnittlich 7,26 mg ALA/g TG. Futter ohne Salatzusatz enthielt nur 2,42-3 mg ALA/g TG. In Futter mit 10%iger Beimischung von infiziertem und gesundem Salat wurden zwischen 4,5 und 5,5 mg ALA/g TG gemessen. Diese Mengen wirkten sich bereits signifikant auf die ALA-Gehalte im Eidotter aus, denn Hühner, denen Futter mit Salatbeimischung gegeben wurde, produzierten mit bis zu 4,6 mg/g FG im Dotter signifikant höhere ALA-Gehalte, als Hühner, denen nur Kontrollfutter gegeben wurde (2,12 mg ALA/g FG). Dabei war es nicht entscheidend, ob der Salat infiziert war oder nicht. Bezüglich der n-3-FS ALA aus Salat zeigten sich somit signifikante Anreicherungseffekte über die Nahrungskette. EPA Enthielten Sporangien noch EPA Gehalte von ca. 10 mg/g FG, so enthielt infizierter Grüner Salat im Trockengewicht nur noch 0,14 mg EPA/g TG. Der etwas besser befallene Rote Eichblatt Salat wies durchschnittlich 0,27 mg EPA/g TG auf. Futter mit 10% Grünem Kopfsalat enthielt daher durchschnittlich 0,019 mg EPA/g TG, Roter Eichblattsalat enthielt im Schnitt 0,026 mg EPA/g TG. Im Dotter war EPA nur in Spuren nachweisbar. Bezüglich EPA aus B. lactucae zeigten sich daher keine Anreicherungseffekte über die Nahrungskette. DHA DHA war mit 0,5 mg/g in Sporangien von B. lactucae nachweisbar und stellte die n-3FS mit dem höchsten Anteil im Eidotter dar. Eidotter aus Fütterung mit Kontrollfutter enthielt mit nur 2,92 mg DHA/g FG statistisch signifikant weniger DHA als die Eidotter aus Fütterung mit Salatbeimischung mit bis zu 3,71 mg DHA/g FG. Es gab keinen Beweis dafür, dass eine Infektion mit B. lactucae den Gehalt an DHA beeinflusste. Bezüglich der FS DHA zeigten sich durch Zufütterung von Salat zwar nicht ebenso starke, jedoch gleichfalls statistisch signifikante Anreicherungseffekte wie für ALA. 86 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier n-6/n-3-Verhältnisse Sporangien und Mycel von B. lactucae zeigten ein n-6/n-3-FS-Verhältnis von 0,72 (Tab. 4.2.). Die n-6/n-3-FS Gehalte von Salat lagen zwischen 0,5 und 0,75. Infizierter Salat wies tendenziell höhere n-6/n-3-Verhältnisse auf als gesunder Salat. Im Kontrollfutter ohne Salatbeimischung zeigte sich ein n-6/n-3-Verhältnis von 9,710. Die n-6/n-3-Verhältnisse von Futter mit 10% Salatbeimischung lagen mit einem durchschnittlichen Verhältnis von 6 in einem signifikant besseren Bereich, als die des Kontrollfutters. Es spielte keine Rolle, ob der Salat infiziert war oder nicht. Die FS-Muster von Eidotter nach Fütterung mit 10%iger Salatbeimischung enthielten signifikant mehr ALA und DHA als Kontrollfutter. Das n-6/n-3-Verhältnis im Dotter änderte sich nach unterschiedlicher Fütterung signifikant positiv (Tab. 4.2.) von 9,82 bei Fütterung ohne Salatzusatz nach durchschnittlich 8,5 bei Fütterung mit Salatzusatz. Gesamt-n-3-FS-Gehalte Sporangien von B. lactucae enthielten einen Gesamtgehalt an n-3-FS von 12 mg/g. Gesunder Salat enthielt je nach Typus 7,15 (Grüner Kopfsalat) bzw. 7,26 (Roter Eichblattsalat) mg n-3-FS/g TG (Tab. 4.2.). infizierter Salat wies mit 5,16 bzw. 5,27 n3-FS/g TG statistisch signifikant weniger n-3-FS im Gewebe auf als gesunder Salat. Kontrollfutter enthielt nur 2,42, mg n-3-FS/g TG. Futter mit 10% Beimischung von gesundem Salat enthielt mit 4,49 bzw. 4,93 mg n-3 FS/g TG etwas niedrigere n-3FS-Gehalte als Futter mit Beimischung von infiziertem Salat mit 5,46 bzw. 5,45 mg n3-FS/g TG. Eine 10%ige Salatbeimischung zum Kontrollfutter brachte einen signifikanten Gewinn an n-3-FS im Eidotter. Enthielten die Dotter der Kontrollgruppe in Schnitt 5,04 mg n-3/g FG, so waren es bei den Salatgruppen bis zu 8,01 mg n-3/g FG. Dies bedeutete eine statistisch signifikante Verbesserung des Gesamt-n-3 Fettsäuregehaltes des Dotters um ca. 60%. Es gab keine statistisch signifikanten Unterschiede zwischen Fütterung mit gesundem oder infiziertem Salat. 87 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4.3.4. Lipidoxidation und Sensorik Die Oxidation startete erst nach etwa 60 min Inkubation (Abb. 4.6., Zeitstufe 4). Die Oxidationsstufen in den Behandlungen mit infiziertem Salat waren von Anfang an niedriger und bewegten sich danach auf einem insgesamt geringeren Niveau, parallel zu den anderen Behandlungsgruppen. MDA [nmol/mg] 2,00 1,50 1,00 0,50 0,00 1 2 3 4 5 6 7 8 9 10 Kontrolle 0,21 0,30 0,31 0,33 0,39 0,76 1,11 1,55 1,62 1,83 RE- 0,30 0,32 0,39 0,45 0,48 0,85 1,25 1,47 1,68 1,82 RE+ 0,28 0,37 0,41 0,36 0,38 0,67 0,90 1,18 1,39 1,60 SN- 0,26 0,31 0,33 0,37 0,56 0,96 1,24 1,41 1,60 1,77 SN+ 0,25 0,32 0,36 0,33 0,34 0,44 0,72 0,95 1,15 1,47 Zeitstufen Abb. 4.6.: Verlauf der Oxidation bis zur Inkubationszeit von 135 min in den Dottern der 5 Fütterungsgruppen: 10%Roter Eichblattsalat gesund (RE-) bzw. infiziert (RE+), 10%Grüner Kopfsalat gesund (SN-) bzw. infiziert (SN+) und 100% Kontrolle. Die Zeitstufen sind in 15 min-Schritten von 1 bis 10 aufgeteilt. So ergab die Bestimmung der Oxidationsprodukte (TBARS) in den Eiern tendenziell höhere Inkubations-Endwerte für die Kontrollgruppe und die Futtergruppen mit gesundem Salat (Abb. 4.6., Zeitstufe 10). Eidotter aus Fütterung mit infiziertem Salat neigten daher weniger zur Oxidation, als Eidotter aus Fütterung mit konventionellem Futter oder gesundem Salat. Die Unterschiede zwischen den Futterbehandlungen waren wegen hoher Standardabweichungen der Mittelwerte jedoch nicht signifikant. 10 Eier jeder Versuchsgruppe wurden gleichmäßig abgekocht und in einem Blindtest verkostet. Alle Teilnehmer des Sensoriktests bewerteten die Eier, die von Hühnern aus Fütterung mit infiziertem Salat stammten, als geschmacklich am besten. 88 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4.3.5. Leistungsdaten der Tiere Die Hühner wurden durch keine Fütterungsvariante in ihrer Gesundheit oder Leistungsfähigkeit beeinträchtigt. Nährstoffgehalte von Salat und Futter Die Analyse der Salatproben offenbarte deutliche Unterschiede. Bei infiziertem Salat waren Asche- und Kalziumgehalte deutlich erhöht, während bei infiziertem Grünem Kopfsalat geringe Stärke- und keine Zuckergehalte ermittelt wurden. Die erhöhten Asche- und Kalziumgehalte bei infiziertem Salat (Grüner Kopfsalat und Roter Eichblattsalat) konnten auf starke Verunreinigungen mit Erdreich zurückgeführt werden. Die Abweichungen des infizierten Grünen Kopfsalates bezüglich der Zuckerund Stärkewerte entstanden eventuell durch Fehler bei Probenahme des Salates, der sehr inhomogen strukturiert und unterschiedlich befallen war. Die umsetzbare Energie von Rotem Eichblattsalat lag mit 5,05 und 6,73 MJ/kg deutlich über Grünem Kopfsalat mit nur 3,47 und 3,51, MJ/kg. Salatvariante/ Nährstoffe Wasser Eiweiß Fett Asche Rohfaser Zucker Stärke Calcium Phosphor Umsetzbare Energie (MJ/kg) Tab. 4.3.: Analyse der Nährstoffgehalte der getrockneten Salate (%). RE inf. (TG) 7,63 20,2 3,27 20,2 10,3 6,05 0,00 1,12 0,53 5,05 RE ges. (TG) 9,48 18,5 2,77 13,7 8,87 22,5 0,00 0,99 0,44 6,73 GK inf. (TG) 8,10 13,4 2,51 34,4 7,10 4,39 0,00 2,16 0,41 3,51 GK ges. (TG) 10,2 17,6 1,43 12,2 8,48 0,00 1,49 0,66 0,50 3,47 RE = Roter Eichblattsalat, GK = Grüner Kopfsalat, inf. = infiziert, ges. = gesund; MJ = Megajoule 89 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Die Nährstoffanalyse der eingesetzten Futterrationen stimmte weitgehend mit den geplanten Gehalten (vgl. Kap. 4.2.5.) überein. So lag die umsetzbare Energie der Futterrationen zwischen 11,5 und 11,8 MJ/kg, der Richtwert war bei 11,3 MJ/kg angesetzt (Tab. 4.4.). Die Eiweißgehalte lagen mit 13,4 bis 20,2 % ebenfalls im geforderten Bereich von 17,1%. Die Kalziumgehalte lagen etwas unterhalb der geforderten Menge von 3,9%, die Phosphorgehalte lagen dagegen wieder im geforderten Bereich von 0,58%. Futtervariante / Nährstoffe Wasser Eiweiß Fett Asche Rohfaser Zucker Stärke Calcium Phosphor Umsetzbare Energie (MJ/kg) Tab. 4.4.: Analyse der Nährstoffgehalte (%) der Versuchsrationen (* Erklärung siehe Tab. 4.1. in Abschnitt 4.2.5.) Futter + RE inf. (TG) 9,87 17,5 7,46 14,5 3,69 4,55 33,6 4,28 0,60 11,5 Futter + RE ges. (TG) 9,78 17,3 7,58 13,6 3,76 5,41 33,8 4,09 0,57 11,6 Futter + GK inf. (TG) 9,43 16,7 7,45 17,2 13,8 4,29 35,0 4,70 0,61 11,5 Futter + GK ges. (TG) 9,86 17,5 7,81 14,4 3,78 6,15 33,6 4,29 0,62 11,8 Kontrollfutter ohne Salat TG 10,9 17,1 4,73 13,6 2,72 4,07 40,5 4,39 0,53 11,6 90 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Legeleistung Die Fütterung mit dem gesunden Salat führte zu einem geringeren Futterverzehr bei höherer Legeleistung gegenüber der Kontrollfütterung. Tab. 4.5.: Mittelwerte und Standardabweichungen für Legeleistung und täglichen Futterverzehr Futtervariante Legeleistung (%) Täglicher Futterverzehr (g) Futter + RE inf. (TG) 92,5±8,18 111±15,8 Futter + RE ges. (TG) 95,2±6,23 111±12,5 Futter +GK inf. (TG) 91,7±7,53 117±9,38 Futter + GK ges. (TG) 96,4±2,20 108±8,37 Kontrollfutter ohne Salat (T)G 94,1±6,10 118±7,08 F-Werte (Sign.) 0,73 (n.s.) 1,13 (n.s.) Futter mit infiziertem Salat führte zu einem tendenziellen Rückgang der Legeleistung der Hennen, während die Futteraufnahme bei infiziertem Grünem Kopfsalat etwa so hoch war wie beim Kontrollfutter (Tab. 4.5.). Die Unterschiede zwischen den Behandlungen waren jedoch nicht signifikant. Eigewichte, Dotter- und Schalenanteil, Dotterfarbe Für keines der untersuchten Qualitätskriterien wie Eigewichte, Dotter- und Schalenanteil oder Dotterfarbe (ungekocht), konnten signifikante Effekte der Fütterung beobachtet werden (Tab. 4.6.). Mit durchschnittlich 68,2 und 67,6 g waren die Eigewichte bei Fütterung mit infiziertem Salat etwas höher als die Eigewichte bei Fütterung mit gesundem Salat mit 66,7 und 66 g. Bei den Dotteranteilen verhielt es sich umgekehrt, diese waren bei Fütterung mit gesundem Salat mit 25,7 und 26,8 % höher als die von infiziertem Salat mit 25,0 und 25,5%. Alle durchschnittlichen Schalenanteile waren bei Zufütterung von Salat niedriger als bei Fütterung mit Kontrollfutter. Die Fütterung wirkte sich nicht auf die Dotterfarbe von frischem Eidotter aus. Ein Sensoriktest zeigte jedoch, dass die Eier nachdem sie gekocht und verzehrt wurden, deutliche Unterschiede zeigten. Die Dotter von Eiern aus Salatfütterung wurden von allen Testpersonen als „sattgelb“, geschmacklich sehr gut und von 91 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier angenehmerer Konsistenz bewertet. Eier aus konventioneller Fütterung sowie aus einer Vergleichsgruppe aus dem kommerziellen Handel wurden im Vergleich dazu als „blass“, „künstlich orange“ und „schmierig“ eingestuft. Tab. 4.6.: Mittelwerte und Standardabweichungen für Eigewichte (g), Dotteranteil (%), Schalenanteil (%), Dotterfarbe (Fächerwert). Futtervariante Eigewicht Dotteranteil Schalenanteil Dotterfarbe Futter + RE inf. (TG) 68,2±4,03 25,0±1,03 9,71±0,69 12,0±0,00 Futter + RE ges. (TG) 66,7±5,55 25,7±1,12 9,65±0,50 12,0±0,00 Futter + GK inf. (T) 67,6±4,82 25,5±1,11 9,64±0,59 12,3±0,46 Futter + GK ges. (TG) 66,0±2,53 26,8±1,22 9,60±0,79 12,0±0,00 Kontrollfutter ohne Salat 66,9±4,00 25,7±1,35 9,94±0,55 12,0±0,00 0,33 n.s. 2,42 n.s. 0,37 n.s. 2,33 n.s. (TG) F-Werte Depositionsraten und Gesamtgehalte an n-3-FS im Gesamtei Die n-3-Aufnahme war bei Fütterung mit infiziertem Salat deutlich höher als für gesunden Salat oder Kontrollfutter, was mit dem höheren Futterverbrauch korrelierte. Die Aufnahme an Gesamt-n-3-FS mit 1020 mg/Ei war bei Fütterung mit infiziertem Grünem Salat am höchsten (Tab. 4.7.). Sie war höher, als bei Fütterung mit infiziertem Roten Eichblatt Salat (934 mg/Ei), mit gesundem Roten Eichblatt Salat (858 mg/Ei) und bei Fütterung mit gesundem Grünem Kopfsalat (896 mg/Ei). Die geringste n-3-Aufnahme mit nur 553 mg/Ei lag bei der Kontrollgruppe vor. Die n-3-FS-Gehalte pro Ei waren mit 122,6 und 118 mg/Ei bei Zufütterung von Rotem Eichblattsalat deutlich geringer als bei Zufütterung von Grünem Kopfsalat mit 130 und 135,7 mg/Ei. Bei den Hühnern, die mit Salat gefüttert wurden, wiesen die Eidotter mit bis zu 135,7 mg/Ei beinahe um das Doppelte höhere n-3-FS-Gehalte auf, als die Eidotter der Kontrollgruppe mit nur 81,8 mg n-3-FS/Ei (Tab. 4.7.). Die Aufnahme an n-3-FS sowie die n-3-FS-Gehalte der Eier korrelierten mit den vergleichsweise hohen n-3-FSGehalten von Futter mit Salatbeimischung gegenüber Kontrollfutter. 92 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Die Depositionsrate für n-3-FS variierte zwischen 13,1 und 15,1 % und lag im Durchschnitt bei 13,9 %. Im Vergleich dazu lag die durchschnittliche Depositionsrate von n-3-FS verschiedener Hühnerrassen bei einer Studie mit Leinöl als Futterzusatz in derselben Größenordnung bei 17,4% (STEINHILBER 2003). Die n-3-FS aus Salat konnten folglich genau so gut „verwertet“ werden wie die FS aus Leinöl mit ähnlich guter „Einlagerungsbilanz“. Die Depositionsraten waren bei Fütterung mit infiziertem Salat nicht signifikant von denen bei Fütterung mit gesundem Salat oder Kontrollfutter verschieden. Tab. 4.7.: Berechneter durchschnittlicher Futterverbrauch (FV, g/Ei), Dottergewicht (DG, g/Ei), n-3-FSAufnahme (mg/Ei), n-3-FS-Gehalt (mg/Ei), und n-3-Deposition (%) Futtervariante FV DG n-3-FS-Aufnahme n-3-FS-Gehalt n-3-Deposition Futter + RE inf. (TG) 120,4 15,8 934 122,6 13,1 Futter + RE ges. (TG) 117,0 16,1 858 118,0 13,8 Futter + GK inf. (TG) 127,4 16,2 1020 130,0 12,7 Futter + GK ges. (TG) 112,3 17,0 896 135,7 15,1 Kontrollfutter ohne Salat (TG) 125,6 16,2 553 81,6 14,8 Futterverbrauch, Dottergewichte, n-3-Aufnahme und Depositionsraten unterschieden sich nicht signifikant, wohingegen die Unterschiede im n-3-FS-Gehalt bei der Salatfütterung gegenüber der Kontrollfütterung statistisch signifikant erhöht waren. 93 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4.4. Diskussion 4.4.1. Befallsergebnis vom Feldversuch Verglichen mit dem im Labor 100%ig infizierten Salat und erzielten EPA-Gehalten von 1 mg/g, wies der zur Hälfte infizierte Grüne Kopfsalat vom Feld mit 0,2 mg EPA/g FG nur etwa 1/5 des erzielbaren EPA-Gehaltes auf. Der Rote Eichblattsalat war, trotz Sporulation auf der kompletten Blattfläche, mit 0,4 mg EPA/g TG um 60% schlechter als Laborsalat und doch doppelt so gut befallen wie der Grüne Kopfsalat. Die anfänglich abgeschätzte Menge an EPA für das Fütterungsexperiment entsprach somit nicht dem aus Laborversuchen erwarteten Wert von 1 g EPA/kg TG Salat. In einem Kilogramm Trockensalat war mit Konzentrationen von nur 200-400 mg lediglich genauso viel EPA enthalten, wie in einer handelsüblichen Fischölkapsel. Dieser geringe EPA-Gehalt des Salates vom Feldversuch lag wohl an mehreren Faktoren. Zuallererst war wohl das Pflanzdatum für den schlechten Befall des Grünen Kopfsalates mit B. lactucae verantwortlich, im Labor wurden sowohl der Rote Eichblatt- als auch der Grüne Kopfsalat etwa gleich gut und gleich schnell infiziert. Sorteneffekte wurden ausgeschlossen, da bei verschiedenen Sorten und beiden Salattypen unter Laborbedingungen dieselben EPA-Durchschnittsgehalte gemessen wurden. Der Rote Eichblattsalat konnte wohl aufgrund des früheren Pflanzdatums eine bessere Biomasse und einen stärkeren Bremia-Befall ausbilden. Dafür spricht auch das Ergebnis, dass die Biomasse und der Befall des früheren Satzes des Grünen Kopfsalates ebenfall besser ausgeprägt waren, als beim späteren Satz. Die Faktoren Licht, Feuchtigkeit und Temperatur, welche die Infektion mit B. lactucae steuern (DATNOFF et al. 1990; SCHERM et al. 1993; SU et al. 2000; SU et al. 2004) konnten auf dem Feld nicht beeinflusst werden. Die durchschnittlich schlechteren EPA-Gehalte des Salates vom Freiland wurden wohl auch vom zeitlich verzögerten Befall von älteren zu jüngeren Blättern mit verursacht. Da die Zellstruktur des Salates bei Infektion mit Falschem Mehltau durch die Besiedelung verändert wurde, waren die älteren Blätter teilweise schon braun und faulig, während die jüngeren Blättern noch in der Anfangsphase einer Infektion waren oder frisch sporulierten. Daher schwankten die Fettsäuregehalte innerhalb eines Salatkopfes sehr stark. Ein Freilandfeld war, aufgrund der schlechten Optimierbarkeit des Befalls, wegen kaum regulierbarer Umweltbedingungen, nicht für den Erhalt optimaler EPA-Gehalte in 94 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier infiziertem Salat geeignet. Infiziertes Pflanzenmaterial für einen Fütterungsversuch ließ sich zwar in genügender Menge, jedoch nicht in genügender Qualität gewinnen. 4.4.2. Temperaturstabilität und Trocknung Die EPA-Gehalte bei den Messungen der Temperaturstabilität in den Vorversuchen unterschieden sich etwas bei unterschiedlichen Trocknungstemperaturen und Trocknungszeiten. Dabei konnte ein nicht sichtbarer Befallsgradient vom Mycel im Salatblatt jedoch nicht ausgeschlossen werden, da nur ein (äußerlich homogen sporulierendes) Salatblatt beprobt wurde und für jede Temperatur mit zugehörigem Trocknungszeitraum immer Blattstücke links und rechts der Hauptblattader verwendet wurden. Es konnte jedoch auch nicht ausgeschlossen werden, dass die mittleren Blattteile besonders gut infiziert waren und folglich bei 40°C die höchsten EPAKonzentrationen aufwiesen. Die blattinterne Befallsdichte konnte jedoch nicht weiter untersucht werden, da Mycel vom Blattgewebe nicht trennbar war. So konnte nicht gesagt werden, ob die niedrigen FS-Gehalte bei 20°C auf eine sehr niedrige Befallsdichte am Blattgrund zurückzuführen waren oder ob enzymatische Abbauprozesse bei vergleichsweise erhöhtem Wassergehalt dafür verantwortlich waren, denn bei RT enthielten die Blattstücke nach 48 h mehr Restfeuchte als bei 40°C. Die niedrigeren FS-Gehalte bei 60°C bzw. 80°C Trocknung ko nnten ebenfalls sowohl am niedrigen Befall der Blattspitze liegen, als auch am Verlust der flüchtigen FS durch zu hohe Trocknungstemperatur wegen hitzebedingtem Aufplatzen von Zellen. Auf jeden Fall galt: 1. Je Kürzer der Trocknungszeitraum und je geringer die Temperatur, umso geringer die Energie- und Sachkosten. 2. Für stabil getrocknetes Gewebe war eine Restfeuchte höher als 10% unerwünscht, da enzymatischer FS-Abbau in engem Zusammenhang mit dem Wassergehalt steht (BELITZ et al. 2001). Eine Restfeuchte kleiner als 10% konnte mit 20°C Trocknungstemperatur na ch 48 h Trocknung nicht erreicht werden. Als Fazit aus dem Vorversuch ging daher hervor, dass eine Trocknungstemperatur bei 40°C über einen möglichst kurzen Zeitraum optimale EPA-Gehalte bei vertretbarem Energieaufwand ermöglichte. Diese Parameter wurden bei der Trocknung im Hordentrockner umgesetzt und eine Lagerung ohne Verluste an FS konnte gewährleistet werden. 95 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier 4.4.3. FS-Analyse in der Nahrungskette Die FS-Messungen zeigten, dass in infiziertem Salat weniger ALA und damit insgesamt weniger n-3-FS enthalten waren als in gesundem Salat. Dies war wohl auf Oxidationsprozesse während des Feldbefalls zurückzuführen, da ältere infizierte Blätter meist schon faulig waren. Auch die geringen zusätzlichen Mengen an EPA und ALA aus B. lactucae konnten dieses ALA-Defizit im infizierten Salat nicht wettmachen. In den Futterproben konnte dieser Trend nicht nachgewiesen werden. Futter mit infiziertem Salat unterschied sich im n-3-FS-Gehalt nicht signifikant vom Futter mit gesundem Salat, was an einer sehr großen Varianz zwischen den einzelnen Futterproben lag. Dass das Futter eher grobkörnig strukturiert war und schon beim Salat große Unterschiede von Infektionsgrad und Beschaffenheit (älteres oder jüngeres Blatt) vorhanden waren, wirkte sich auf die Beprobung aus. Futter mit Salatbeimischung enthielt jedoch insgesamt doppelt soviel n-3-FS wie Kontrollfutter, was sich statistisch signifikant auswirkte. So zeigten auch die Dotter der Hühner aus Fütterung mit infiziertem und gesundem Salat um ein Drittel höhere n-3-FS-Gehalte als Dotter von Hühnern aus Kontrollfütterung, was sich als statistisch signifikant belegen ließ. Eine Beimischung von 10% Salat wirkte sich folglich positiv auf den n3-FS-Gehalt im Eidotter aus, wobei es keine Rolle spielte, ob dieser infiziert oder gesund war. Es konnte nicht bewiesen werden, dass sich EPA über die Nahrungskette auswirkte, da die Gehalte in infiziertem Salat bei einer Beimischung von 10% zum Futter für einen Effekt nicht genügten. Dies lag wohl auch mit an den geringeren EPA-Gehalten des Freilandsalates. Die FS, die einen nachweisbaren Einfluss auf den n-3-FS-Gehalt in der Nahrungskette „Salat-Futter-Dotter“ hatte, war ALA aus Salat, da diese FS mengenmäßig genügend ins Gewicht fiel. ALA aus Salat erhöhte den ALA-Anteil im Dotter um das Doppelte und den DHA-Anteil um etwa 20%. Infizierter Salat wies trotz niedrigerer ALA-Konzentrationen ein besseres n-6/n-3Verhältnis auf als gesunder Salat. Dies war dadurch zu erklären, dass gesunder Salat mehr von der n-6-FS LA produzierte. Im Futter war dieser Effekt nicht nachweisbar. Das verbesserte FS-Verhältnis im Futter mit Salatbeimischung war, wie der höhere n-3-FS-Gehalt, auf ALA aus Salat zurückzuführen. Das verbesserte n6/n-3 Verhältnis im Eidotter, nach Salatbeimischung zum Futter, war durch signifikant erhöhte ALA und DHA Gehalte im Eidotter gegenüber der Kontrollgruppe begründet. 96 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier Eine Infektion mit B. lactucae wirkte sich auf das n-6/n-3-Verhältnis im Dotter statistisch gegenüber Fütterung mit gesundem Salat nicht aus. Als exzellente Quelle von ALA, die positiv zum FS-Muster von Eidotter beitragen kann, wurde Portulak beschrieben. Portulak enthält in 1 g Frischgewicht 3-4 mg ALA (SIMOPOULOS & SALEM 1986; SIMOPOULOS 1995). Die Zufütterung von Portulak kann den n-3-FS Gehalt von Hühnereiern daher deutlich verbessern (SIMOPOULOS & SALEM 1992; SIMOPOULOS 1995). In Salat wurden im Vergleich zu Portulak nur 5-7 mg ALA/g TG bzw. 0,5-0,7 mg ALA auf 1 g Frischgewicht gemessen. An dieser Stelle sollte zusätzlich bemerkt werden, dass bei der Herstellung von „Omega-3Eiern“ ALA- und DHA-Steigerungen um Faktor 5-10 gefordert werden (Professor Grashorn mündlich), die bisher nur durch massive Zufütterung von n-3-FS-haltigen Ölen erreicht werden können. 4.4.4. Lipidoxidation und Sensorik Für die Dotter der Hühner der Salatgruppen wurden höhere Oxidationswerte erwartet, da aus Fütterungsversuchen mit Leinöl bekannt ist, dass die Dotterlipide wegen des höheren n-3-FS-Gehaltes schneller zu Oxidation neigen, als Dotterlipide aus Kontrollfütterung (LEESON et al. 1998). Zudem sind in Sporangien Freie FS enthalten, die Oxidationsprozesse theoretisch ebenfalls beschleunigen sollten (vgl. Kap. 2). Insgesamt waren die Dotter jedoch wohl alle gut gegen Oxidation geschützt, so dass erst nach 60 Minuten Oxidationsprozesse messbar waren. Interessant war, dass die Eidotter aus Fütterung mit infiziertem Salat die starke Tendenz aufwiesen, weniger gegen Oxidation anfällig zu sein, als Dotter aus Kontrollfütterung oder Fütterung mit gesundem Salat. Diese Unterschiede waren jedoch wegen zu hoher Standardabweichungen knapp unter der Signifikanzgrenze von 5 % und daher nicht mehr signifikant. Eventuell produziert infizierter Salat jedoch vermehrt Stoffe, die Oxidationsprozesse verhindern. Dem Tierfutter wurden insgesamt wohl genügend Antioxidantien beigemischt, sodass Oxidationsvorgänge allgemein verhindert werden konnten. Dieses Ergebnis belegte deutlich, dass sich EPA aus B. lactucae, trotz massiver Zufütterung, nicht negativ auf die Eiqualität auswirkte. Der Sensoriktest war eine zusätzliche Bestätigung für die Richtigkeit der OxidationsMessungen, da die massive Verfütterung von infiziertem Salat keineswegs zu Fehl- 97 4. Fütterungsexperiment zur Anreicherung von n-3-FS aus B. lactucae in Hühnereier aromen im Eidotter beitrug, der Geschmack der Eier aus Fütterung mit infiziertem Salat sogar als sehr gut bewertet wurde. 4.5. Zusammenfassung Die Studie zur Anreicherung von EPA aus B. lactucae über die Nahrungskette in Hühnerdotter zeigte, dass die eingesetzten EPA-Mengen aus B. lactucae bei Zusatz von 10% infiziertem Salat zum Futter offensichtlich zu gering waren, um sich über Nahrungskette die im ALA oder DHA-Gehalt des Dotters niederzuschlagen. Hierbei muss allerdings bemerkt werden, dass mit dem Freilandversuch nicht die optimalen EPA-Gehalte in infiziertem Salat erreicht werden konnten. Gegenüber der Fütterung mit gesundem Salat brachte infizierter Salat keine Vorteile, jedoch auch keine Nachteile für den n-3-FS-Gehalt von Eiern. In einem Sensoriktest wurden Eier aus Fütterung mit infiziertem Salat sogar mit am besten bewertet. Auf Grund der hohen ALA-Gehalte von Salat und den damit verbundenen erhöhten n-3-FS-Gehalte des Futters, war nach Fütterung mit salatversetztem Futter eine deutliche Anreicherung der n-3-FS im Eidotter zu beobachten. Die Salat-Menge im Futter bewirkte im Hühnerdotter gegenüber der Kontrollfütterung, dass doppelt soviel ALA und 20% mehr DHA synthetisiert wurden. Verglichen mit etwa 17 mg ALA/kg TG in Futter mit Leinöl, lag Futter mit 10% Salat (7 mg ALA/kg TG) daher schon in dem Bereich, der für eine Anreicherung der DHA-Gehalte im Dotter relevant war. Durch die Verbesserung des n-3-FS- Anteils im Futter mit Salatbeimischung wurden auch die n-6/n-3-Verhältnisse im Eidotter signifikant positiv beeinflusst. Negative Auswirkungen von infiziertem Salat auf Qualität oder Tierleistung konnten für keines der untersuchten Merkmale festgestellt werden. Das Experiment belegte erstmalig, dass die Zufütterung von Pflanzenmaterial mit Infektion durch einen obligat-biotrophen Oomyceten keine toxischen oder leistungsmindernden Einflüsse auf die Versuchstiergruppe hatte. 98 5. Bewertung des Potenzials von infizierten Nutzpflanzen als n-3-FS-Quellen für die menschliche Ernährung 5. Bewertung des Potenzials von infizierten Nutzpflanzen als n-3-FSQuellen für die menschliche Ernährung 5.1. Das Potenzial von Sporangien In Sporangien von B. lactucae und P. halstedii konnten EPA-Konzentrationen von 10 bis 30 mg/g FG gemessen werden. Neben den Empfehlungen für Aufnahmeraten von n-6 und n-3-FS existieren Empfehlungen für die täglichen Aufnahmekonzentrationen für EPA und DHA, die in den USA bei 650 mg/Tag und in Großbritannien bei 200 mg/Tag liegen. Die NATO empfiehlt sogar 800 mg EPA + DHA täglich. Die DGE empfiehlt eine EPA- und DHA-Aufnahme von 300 mg pro Person und Tag. Fischölkapseln und Algenölkapseln, in denen hoch ungesättigte FS stark aufkonzentriert werden, enthalten zwischen 100 und 300 mg EPA und zusätzlich 100 bis 300 mg DHA pro Kapsel. Um eine tägliche Aufnahme von 100-300 mg EPA zu gewährleisten, müssten statt einer Fischölkapsel täglich 10 g Sporangien von B. lactucae oder P. halstedii verzehrt werden. Ein Produktivitätsvergleich in Kap. 2 (Tab. 2.2.) zeigte zwar, dass die theoretisch erzielbaren EPA-Gehalte pro Fläche von sporu-lierenden Pflanzen durchaus mit den EPA-Gehalten pro Volumen aus Bioreaktorsystemen konkurrenzfähig wären. Dafür wären jedoch sehr große Anbauflächen (mehrere hundert m²) notwendig, deren Umwelt steuerbar sein sollte und Fach-personal mit guten Kenntnissen im Umgang mit Erreger und Wirt wäre unabdingbar. Da B. lactucae und P. halstedii obligat-biotroph sind und noch kein Nährmedium für Kultivierung existiert, ist eine direkte Gewinnung der FS auf diese Art bisher ausgeschlossen. Zudem gibt es schon Oomyceten-Gattungen wie Ulkenia oder Thraustochytrium, die in Nährmedium alleine ohne Wirt wachsen und sehr hohe Anteile an EPA oder DHA produzieren können. Das Potenzial von Sporangien als direkte Quelle für die menschliche Ernährung wird daher derzeit als gering eingestuft. 5.2. Das Potenzial von infiziertem, essbarem Pflanzengewebe In infiziertem Pflanzengewebe fand man nach Optimierungsversuchen EPA-Höchstgehalte von etwa 2 mg EPA/g TG. Um den Tagesbedarf von 200-300 mg EPA zu decken, müssten daher 100 g getrocknetes, infiziertes Pflanzengewebe gegessen werden, was etwa einer Menge von 1 kg Frischgewicht entspricht. Bezieht man diese 99 5. Bewertung des Potenzials von infizierten Nutzpflanzen als n-3-FS-Quellen für die menschliche Ernährung Menge auf z.B. Salat, so müssten vier komplett infizierte Salatköpfe mit je 250 g FG von einer Person am Tag verzehrt werden. Dies sind Mengen, die nicht der natürlichen Nahrungsaufnahme entsprechen. Es kann nun natürlich bemerkt werden, dass die empfohlenen Tagesmengen an EPA sehr hoch angesetzt sind, da sie an klinische Studien zur Wirksamkeit angelehnt sind. Würde pro Person nur ein infizierter Salatkopf pro Tag verzehrt, käme man schon auf eine nennenswerte Dosis von etwa 50 mg EPA. Fraglich bliebe allerdings die Akzeptanz der Verbraucher für infizierten Salat. Die Tatsache, dass sich B. lactucae in Salat latent ausbreitet und bis zum Zeitpunkt der Sporulation nicht sichtbar ist, könnte die Akzeptanz der Verbraucher steigern, zumal die gesundheitsfördernde Wirkung der n-3-FS hervorgehoben werden könnte. Das Potenzial von großtechnisch produzierten Nutzpflanzen als Quelle für die menschliche Ernährung wurde in dieser Arbeit relativ hoch eingeschätzt. Die theoretische Produktivität von infizierten Pflanzen pro Fläche war im Vergleich zu Bioreaktorsystemen hoch (vgl. Kap. 2). Allerdings sollte die Infektion nicht im Freiland sondern in Gewächshäusern stattfinden. Dort könnten Luftfeuchtigkeit und Temperatur geregelt werden, um die Infektion ohne Nachteile für EPA-Gehalt, Aussehen oder Geschmack des Salates optimal zu steuern. Die Infektion müsste standardisiert mit ausgewählten, besonders EPA-haltigen Stämmen von B. lactucae geschehen. Zudem müssten Gefahren für die menschliche Gesundheit über zusätzliche Biotests ausgeschlossen werden. Das Potenzial von mit Oomyceten infizierten Pflanzen als n-3-FS-Quellen für die menschliche Ernährung wird unter den genannten Vorbehalten, als bedingt möglich eingestuft. 100 5. Bewertung des Potenzials von infizierten Nutzpflanzen als n-3-FS-Quellen für die menschliche Ernährung 5.3. Das Potenzial von Bremia lactucae in der Nahrungskette Zunächst müsste das Potenzial von B. lactucae als EPA-Lieferant für die Nahrungskette besser ausgeschöpft werden, indem die Anbau- und Infektionstechniken auf Großflächen mit steuerbarer Umwelt optimiert würden, so dass die EPA-Mengen im Futter von bisher nur 0,2 mg EPA/g TG um Faktor 5 auf mindestens 1 mg EPA/g TG (Laborwerte) gesteigert werden könnten. Zudem könnte versucht werden, analog zum Optimierungsversuch für P. halstedii bei Sonnenblumen (vgl. Kap. 3), den EPAGehalt in infiziertem Salat über gesteigerte Stickstoffgaben zusätzlich um den Faktor 2 zu erhöhen. Um deutliche Effekte von B. lactucae im Dotter zu sehen, müssten die EPA-Mengen von Futter mit Beimischung von infiziertem Salat wohl mindestens um den Faktor 10 erhöht werden, was mit optimierten Infektions- und Anbaumethoden eventuell möglich wäre. Hier besteht noch pflanzenbaulicher Forschungsbedarf. Der Versuch zur Anreicherung von EPA aus B. lactucae in Hühnereier brachte zwar den gewünschten Effekt erhöhter ALA- bzw. DHA-Konzentration, dieser war jedoch nicht auf B. lactucae sondern auf Salat zurückzuführen. Ein Zusatz von nur 10% stark infiziertem Salat zum Futter zog einen Verdünnungseffekt des EPA-Gehaltes im Futter nach sich, so dass sich EPA selbst nicht im Dotter anreicherte und es auch keine Hinweise dafür gab, dass EPA vom Huhn für die DHA-Synthese verwendet wurde. Das Potenzial von absichtlich produziertem, infiziertem Salat für die Produktion von n-3-FS-Eiern oder für die direkte menschliche Ernährung kann derzeit noch nicht abgeschätzt werden. Angesichts existierender, leistungsfähiger und bewährter Alternativen (Algen, heterotrophe Oomyceten, Grünfutter, gut dosierbare n-3-FShaltige Öle), erscheint eine Weiterentwicklung des hier getesteten Versuchsansatzes als wirtschaftlich wenig sinnvoll. Infizierter Salat fällt großflächig jedoch öfters an und stellt einen enormen Ernteverlust für Landwirte dar, die Arbeit, Geld und Zeit in die Anzucht und Pflege verwendeten. Da es sich bei B. lactucae um einen landwirtschaftlichen Erreger handelt, dessen Einfluss auf die menschliche Ernährung bisher nicht erforscht wurde, ist der Salat nicht marktfähig und muss vernichtet werden. 101 5. Bewertung des Potenzials von infizierten Nutzpflanzen als n-3-FS-Quellen für die menschliche Ernährung Wenn Salat großflächig von B. lactucae befallen wird, könnte er aufgrund der Ergebnisse der vorliegenden Arbeit jedoch an Tiere verfüttert werden. Um B. lactucae-infizierten Salat als Futtermittel zulassen zu können, bedürfte es eindeutiger, ernährungsmedizinischer Studien bezüglich der Nahrungskette, die zweifelsfrei belegen, dass der Verzehr von großen Mengen an B. lactucae für Tiere und Menschen ungefährlich ist. Das Potenzial von infiziertem Salat in dieser Hinsicht wird als relativ vielversprechend eingestuft, zumal DHA-reiche, getrocknete Schizochytrium-Präparate bereits als Tierfutterzusatz zugelassen sind und als sicher und unbedenklich gelten (W ARD & SINGH 2005). 102 6. Zusammenfassung 6. Zusammenfassung Obligat-biotrophe Systeme wurden bisher nicht auf ihre Eignung als Omega-3Fettsäure-Quellen (n-3-FS-Quellen) untersucht. Das Ziel dieser Arbeit war es, das Potenzial der Nutzpflanzen-Pathogene Plasmopara halstedii (Farl.) Berl. & DeToni (1888) und Bremia lactucae Regel (1843) auf ihre Eignung als alternative Quellen von n-3-FS für die menschliche Ernährung zu erforschen, da die Lipide dieser Oomyceten zu über 30% aus diesem Fettsäuretyp bestehen. Die Methodik der quantitativen Fettsäureanalytik wurde im Rahmen der vorliegenden Arbeit angewandt und für die Testsysteme adaptiert. Die Fettsäure Eicosapentaensäure (EPA) wurde für beide Erreger mittels Gaschromatographie quantifiziert. EPA war nicht nur in Triacylglyceriden gespeichert, sondern stammte zu großen Teilen auch aus anderen Lipidklassen wie z.B. Phospholipiden und Freien FS (vgl. Kap. 2). Die Ergebnisse wurden mit der Produktivität von EPA aus anderen Systemen verglichen. Bei optimierter EPAProduktion pro Fläche könnte B. lactucae nach Hochrechnungen mit 0,28 g/(m²•d) durchaus mit der EPA-Produktion derzeit bestehender Bioreaktorsysteme (z.B. Nitzschia alba) konkurrieren. Infizierte Pflanzen produzierten durchschnittlich 1 mg EPA/g Trockengewicht (TG). Dies ist jedoch für den direkten Einsatz in der menschlichen Ernährung um etwa den Faktor 10 zu wenig. Daher wurden die Grenzen der natürlichen Optimierbarkeit von EPA in Kap. 3 am bereits gut erforschten Modellorganismus P. halstedii in Sonnenblumen getestet. In Sporangien waren maximale EPA-Konzentrationen von 25-30 mg/g FG erreichbar, es gab Stämme, die unwesentlich mehr EPA produzierten als andere. Bezüglich des Wirtes gab es spezielle Sonnenblumensorten und –linien, die bei guter Biomasseentwicklung besonders gut infiziert werden konnten, was sich in vergleichsweise höheren EPA-Gehalten pro Biomasse zeigte. In infiziertem Gewebe fand man im Optimalfall weiterhin lediglich etwa 1 mg EPA/g TG. Über die Variation des Infektionsdruckes (verschiedene Sporangieninokuli) konnten die EPA-Konzentrationen in infiziertem Sonnenblumengewebe nicht gesteigert werden. Hohe Gaben von Stickstoff an die Wirtspflanzen trugen dagegen statistisch signifikant zur Steigerung der EPA-Gehalte im Pflanzengewebe bei, sodass bis zu 2 mg 103 6. Zusammenfassung EPA/g TG erreicht werden konnten. Da die erreichten EPA-Konzentrationen bei normalen Ernährungsgewohnheiten immer noch nicht ausreichten, um den in Deutschland empfohlenen Tagesbedarf von 150-300 mg EPA zu decken, wurde versucht, EPA über die Nahrungskette aus infiziertem Salat in Hühnerdotter anzureichern (vgl. Kap. 4). Ein Kooperationsprojekt mit dem Institut für Tierhaltung und Tierzüchtung, der Versuchsstation für Gartenbau und dem Institut für Agrartechnik ermöglichte die Durchführung eines komplexen Versuches zur Anreicherung von EPA aus B. lactucae-infiziertem Salat in Dotterlipiden von Hühnereiern. Die Studie ergab, dass bei einem Zusatz von 10% Salat (stark infiziert bzw. gesund) zum Hühnerfutter, im Dotter die Gehalte der n-3-FS Alpha-Linolensäure (ALA) und Docosahexaensäure (DHA) um das Doppelte bzw. um 20% gesteigert werden konnten. Gleichzeitig verschob sich das n-6/n-3-Verhältnis zu günstigeren Werten für die menschliche Ernährung. Für diese Effekte war es nicht relevant, ob der Salat infiziert oder gesund war. Der Geschmack der Eier wurde durch Fütterung mit infiziertem Salat positiv beeinflusst. Bezüglich der Eiqualität und der Leistungsdaten der Tiere konnten im untersuchten Zeitraum keine negativen Einflüsse durch B. lactucae festgestellt werden. 104 7. Summary 7. Summary The potential of downy mildew as source of omega-3-fatty acids for human nutrition Obligate-biotrophic systems have yet not been tested for their suitability as sources for omega-3-fatty acids (n-3-FA). The aim of this work was, to explore the potential of the crop-plant pathogens Plasmopara halstedii (Farl.) Berl. & DeToni (1888) and Bremia lactucae Regel (1843) to serve as alternative sources of n-3-FA for human nutrition, as the lipids of these oomycetes consist of 30% or more n-3-FA. Methods of quantitative fatty acid analysis were applied in this work and adapted for the test systems. The fatty acid eicosapentaenoic acid (EPA) of both pathogens was quantified by means of gas chromatography. The study showed that EPA was not only stored in triacylgycerides but was also part of other lipid classes, e.g. phospholipids and free fatty acids (see chapter 2). The results were compared with the productivity of EPA from other systems. The estimated EPA-production of B. lactucae per area (0,28 g/(m²•d)) could compete with the EPA-production of existing bioreactor systems (e.g. Nitzschia alba). Infected plants produced an average of 1 mg EPA/g dry weight (DW). This, however, is only about 10% of the amount which would be required for direct use in human nutrition. In consequence, the possibility of enhancing EPA production through genotype selection and growth conditions was tested with the already well explored model organism P. halstedii in sunflowers (chapter 3). Sporangia of different pathogen strains slightly varied in their EPA content, reaching maximum concentrations of 2530 mg/g DW. With respect to the host, several sunflower cultivars and –lines were tested for susceptibility and biomass development in infected plant tissue. A maximum of 1 mg EPA/g DW was found. Variation of infection pressure (different doses of sporangia) could not influence the EPA-production. In contrast, high amounts of nitrogen during host plant cultivation raised the EPAcontents in infected plant tissue up to 2 mg EPA/g DW. This was still insufficient to 105 7. Summary meet the recommended daily uptake of 150-300 mg EPA within normal dietary habits. Hence an enrichment of EPA or n-3-FA in hens´ egg yolk was attempted, using infected lettuce in hens´ food (chapter 4). This experiment was carried out in colaboration with the “Institut für Tierhaltung und Tierzüchtung (Universität Hohenheim)”, the “Versuchsstation für Gartenbau (Hohenheim)” and the “Institut für Agrartechnik (Universität Hohenheim)”. B. lactucae infected lettuce was produced in a field trial, dried and added to commercial hens´ food with a ratio of 10%. Uninfected lettuce served as control. The study showed, that a supplementation of 10 % lettuce (strongly infected or healthy) to hens´ food doubled the content of the n-3-FA alpha-linolenic acid (ALA, 18:3 n-3) and raised docosahexaenoic acid (DHA) by 20 % in egg yolk. Simultaneously the n-6/n-3-ratio with respect to the physiological requirement of human nutrition improved. The plants cultivated in the field contained only about 20% of the maximum EPA-contents of plants in the laboratory. It was not relevant for the n-3-FA content of egg yolk, if the lettuce was infected or healthy. The flavour of the eggs was influenced positively by feeding hens with infected lettuce. With respect to the egg quality and the performance data of the hens, there could not be seen any negative influences. 106 8. Literatur 8. Literatur ACKMAN, R.G., BURGHER, R.D., SIPOS, J.C. (1963). Quantitative gas-liquid chromatography of the higher fatty acids. Nature 4908: 777-778. ACKMAN, R.G., RATNAYAKE, W.M.N., MACPHERSON, E.J. (1989). EPA and DHA contents of encapsulated fish oil products. Journal of the American Oil Chemists Society 66: 1162-1164. ACKMAN, R.G. (1998). Remarks on official methods employing boron trifluoride in the preparation of methyl esters of the fatty acids of fish oils. Journal of the American Oil Chemists Society 75: 541-545. ACKMAN, R.G. (2002). The gas chromatograph in practical analyses of common and uncommon fatty acids for the 21 st century. Analytica Chimica Acta 465: 175192. BANG, H.O., DYERBERG, J., NIELSEN, A.B. (1971). Plasma lipid and lipoprotein pattern in Greenlandic West-coast Eskimos. Lancet 1: 1143-1145. BARCLAY, W.R., ZELLER, S. (1996). Nutritional enhancement of n-3 and n-6 fatty acids in rotifers and Artemia napuli by feeding spray-dried Schizochytrium sp. Journal of the World Aquacultural Society 27: 314-322. BÄSSLER, K.H. (1991). On the problematic nature of vitamin E requirements: net vitamin E. Zeitschrift für Ernährungswissenschaft 30: 174-180. BEAUDOIN, F., MICHAELSON, L.V., HEY, S.J., LEWIS, M.J., SHEWRY, P.R., SAYANOVA, O.V., NAPIER, J.A. (2000a). Heterologous reconstitution in yeast of the polyunsaturated fatty acid biosynthetic pathway. Proceedings in the National Academic Sciences 97: 6421-6426. BEAUDOIN, F., MICHAELSON, L.V., LEWIS, M.J., SHEWRY, P.R., SAYANOVA, O.V., NAPIER, J.A. (2000b). Production of C20 polyunsaturated fatty acids (PUFAs) by pathway engineering: identification of a PUFA elongase component from Caenorhabditis elogans. Biochemical society transactions 28: 661-663. BELITZ, H.-D., GROSCH, W., SCHIEBERLE, P., Eds. (2001). Lehrbuch der Lebensmittelchemie. Berlin, Heidelberg, New York, Springer Verlag. BROOKS, J.L., STUMPF, P.K. (1966). Fat metabolism in higher plants. Biochemistry and Biophysics 116: 108-116. BROWNING, L.M. (2003). n-3 Polyunsaturated fatty acids, inflammation and obesityrelated disease. Proceedings in the Nutrition Society 62: 447-453. BUNDESMINISTERIUM FÜR VERBRAUCHERSCHUTZ, E.U.L., Ed. (2006). Speisefette, aid. CALDER, P.C. (2001). Polyunsaturated fatty acids, inflammation and immunity. Lipids 36: 1007-1024. CALDER, P.C. (2004). n-3 fatty acids and cardiovascular disease: evidence explained and mechanisms explored. Clinical Science 107: 1-11. 107 8. Literatur CARVALHO, A.P., PONTES, I., GASPAR, H., MALCATA, X. (2005). Metabolic relationships between macro- and micronutrients, and the eicosapentaenoic acid and docosahexaenoic acid contents of Pavlova lutheri. Enzyme and Microbial Technology 38: 358-366. CASTON, L., LEESON, S. (1990). Research note: Dietary flax and egg composition. Poultry Science 69: 1617-1620. CHEN, G., JIANG, Y., CHEN, F. (2008). Variation of lipid class composition in Nitzschia laevis as a response to growth temperature change. Food Chemistry 109: 8894. CHUNG, R.A., ROGLER, J.C., STADELMAN, W.J. (1965). The effect of dietary cholesterol and different dietary fats on cholesterol content and lipid composition of egg yolk and various body tissues. Poultry Science 44: 221-228. CLARKE, S.D. (2001). Polyunsaturated fatty acid regulation of gene transcription: a molecular mechanism to improve the metabolic syndrome. Journal of Nutrition 131: 1129-1132. COHEN, Y., SACKSTON, W.E. (1973). Factors affecting infection of sunflowers by Plasmopara halstedii. Canadian Journal of Botany 51: 15-22. COLE, G., COUGHLAN, S., FREY, N., HAZEBROEK, J., JENNINGS, C. (1998). New sunflower and soybean cultivars for novel vegetable oil types. Fett/Lipid 100: 177181. CRASKE, J.D., BANNON, C.D. (1987). Gas liquid chromatography analysis of the fatty acid composition of fats and oils: a total system for high accuracy. Journal of the American Oil Chemists Society 64: 1413-1417. CSIRO (2005). Healthy new future for omega-3 grains. CSIRO, http://www.csiro.au/files/mediaRelease/mr2005/Omega3.htm. DAHLE, L.K. (1962). The thiobarbituric acid reaction and the autoxidations of polyunsaturated fatty acid methyl esters. Archives of Biochemistry and Biophysics 98: 253-261. DANNEL, F., PFEFFER, H., MARSCHNER, H. (1995). Isolation of apoplasmatic fluid from sunflower leaves and its use for studies on influence of nitrogen supply on apoplasmic pH. Journal of Plant Physiology 146: 273-278. DATNOFF, L.E., NAGATA, R.T., RAID, R.N., SCHETTINI, T.M., MICHELMORE, R.W. (1990). Field evaluation of crisphead and butterhead lettuce for downy mildew resistance and characterization of virulence phenotype. Proceedings in the Florida State Horticulture Society 103: 140-142. DATNOFF, L.E., NAGATA, R.T., RAID, R.N. (1994). Pathotyping of Bremia lactucae in Florida. Plant Disease 78: 854-857. DGE (2007). Fett. 14. Ernährungsfachtagung der Deutschen Gesellschaft für Ernährung. Universität Hohenheim, DGE Baden-Württemberg. 108 8. Literatur DOMERGUE, F., LECHL, J., ZÄHRINGER, U., HEINZ, E. (2002). Cloning and functional characterization of Phaeodactylum tricornutum front-end desaturases involved in eicosapentaenoic acid biosynthesis. European Journal of Biochemistry 269: 4105-4113. DONG, M., W ALKER, T.H. (2008). Addition of polyunsaturated fatty acids to canola oil by fungal conversion Enzyme and Microbial Technology 42: 514-520. DREXLER, H., SPIEKERMANN, P., MEYER, A., DOMERGUE, F., ZANK, T., SPERLING, P., ABBADI, A. (2003). Metabolic engineering of fatty acids for breeding of new oilseed crops. Journal of Plant Physiology 160: 779-802. DUFNER, J., JENSEN, U., SCHUMACHER, E., Eds. (1992). Statistik mit SAS, Teubner Verlag. ERKKILÄ, A., DEMELLO, V.D.F., RISERUS, U., LAAKSONEN, D.E. (2008). Dietary fatty acids and cardiovascular disease: an epidemiological approach. Progress in Lipid Research 3: 172-187. EU (1997). Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates über neuartige Lebensmittel und neuartige Lebensmittelzutaten, Amt für amtliche Veröffentlichungen der Europäischen Gemeinschaften. CONSLEG: 1997R0258 - 18/04/2004: 9. EZEKWE, M.O., OMARA-ALWALA, T.R., MEMBRAHTU, T. (1999). Nutritive characterization of purslane accessions as influenced by planting date. Plant Foods for Human Nutrition 54: 183-191. FINNEGAN, Y.E., MINIHANE, A.M., LEIGH-FIRBANK, E.C., KEW , S., MEIJER, G.W., MUGGLI, R., CALDER, P.C., W ILLIAMS, C.M. (2003). Plant- and marine-derived n-3 polyunsaturated fatty acids have differential effects on fasting and postprandial blood lipid concentrations and on the susceptibility of LDL to oxidative modification in moderately hyperlipidemic subjects. American Journal of Clinical Nutrition 77: 783-95. FOLCH, J., LEES, M., STANLEY, S. (1957). A simple method for the isolation and purification of total lipids from animal tissues. Journal of Biological Chemistry 226: 497-509. FONTANA, E., HOEBERECHTS, J., NICOLA, S., CROS, V., PALMEGIANO, G.B., PEIRETTI, P.G. (2006). Nitrogen concentration and nitrate/ammonium ratio affect yield and change the oxalic acid concentration and fatty acid profile of purslane (Portulaca oleracea L.) grown in a soilless culture system. Journal of the Science of Food and Agriculture 86: 2417-2424. FROHNE, D., JENSEN, U., Eds. (1992). Systematik des Pflanzenreichs. Stuttgart, Wissenschaftliche Verlagsgesellschaft mbH. FUNK, C.D. (2001). Prostaglandins and leukotrienes: advances in eicosanoids biology. Science 294: 1871-1875. FUSSENEGGER, D., W INDHALM, K. (2003). Welches Fett das Kraut fett macht: Rapsöl und andere. Journal für Ernährungsmedizin 5: 31-35. 109 8. Literatur GALANINA, L.A., KONOVA, I.V. (1998). Synthesis of eicosapolyenoic acids in microscopic fungi of the genus Saprolegnia. Microbiology 68: 418-422. GANUZA, E., BENITEZ-SANTANA, T., ATALAH E., VEGA-ORELLANA, O., GANGA, R., IZQUIERDO, M.S. (2008). Crypthecodinium cohnii and Schizochytrium sp. as potential substitutes to fisheries-derived oils from seabream (Sparus aurata) microdiets. Aquaculture109-116. GARIBALDI, A., BERTETTI, D., GULLINO, M.L. (2007). Effect of leaf wetness duration and temperature on infection of downy mildew (Peronospora sp.) of basil. Journal of Plant Diseases and Protection 114: 6-8. GRAHAM, I.A., LARSON, T.R., NAPIER, J.A. (2007). Rational metabolic engineering of transgenic plants for biosynthesis of omega-3 polyunsaturates. Current Opinion in Biotechnology 18: 142-147. GRASHORN, M.A. (1994). Einfluss verschiedener Futterfette auf den Blut- und Dottercholesteringehalt von Legehennen. Archiv der Geflügelkunde 58: 224230. GULYA, T.J., MILLER, J.F., VIRANYI, F., SACKSTON, W.E. (1991). Proposed internationally standardized methods for race identification of Plasmopara halstedii. Helia 14: 11-20. HAASMANN, S.O. (1998). Analytical characterization of camel meat and milk fat. Chemistry, Brunel. HARRIS, W.S. (1989). Fish oils and plasma lipid and lipoprotein metabolism in humans: a critical review. Journal of Lipid Research 30: 785-807. HASLER, C.M. (2002). Functional foods: benefits, concerns and challenges- a position paper from the american council on science and health. Journal of Nutrition 132: 3772-3781. HSIAO, T.Y., BLANCH, H.W. (2006). Physiological studies of eicosapentaenoic acid production in the marine microalga Glossomastix chrysoplasta. Biotechnology and Bioengineering 93: 465-475. HUANG, J., AKI, T., HACHIDA, K., YOKOCHI, T., KAWAMOTO, S., SHIGETA, S., ONO K., SUZUKI, O. (2001). Profile of polyunsaturated fatty acids produced by Thraustochytrium sp. KK17-3. Journal of the American Oil Chemists Society 78: 605-610. ILOTT, T.W., DURGAN, M.E., MICHELMORE, R.W. (1987). Genetics of virulence in californian populations of Bremia lactucae (lettuce downy mildew). Phytopathology 77: 1381-1386. IUPAC-IUB (1978). The Nomenclature of Lipids. Journal of Lipid Research 19: 114128. JOSEPH, J.D., ACKMAN, R.G. (1992). Capillary column gas chromatographic method for analysis of encapsulated fish oils and fish oil ethyl esters: collaborative 110 8. Literatur study. Journal of the Association of Official Analytical Chemists International 75: 488-506. KAEWSUWAN, S., CAHOON, E.B., PERROUD, P.-F., W IWAT CHANPEN, PANVISAVAS, N., QUATRANO, R.S., COVE, D.J. (2006). Identification and functional characterization of the moss Physcomitrella patens ∆5-desaturase gene involved in arachidonic and eicosapentaenoic acid biosynthesis. Journal of Biological Chemistry 281: 21988-21997. KENDRICK, A., RATLEGE, C. (1992). Lipids of selected molds grown for production of n3 and n-6 polyunsaturated fatty acids. Lipids 27: 15-20. KHOZIN-GOLDBERG, I., COHEN, Z. (2006). The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyte Monodus subterraneus. Phytochemistry 67: 696-701. KOCK, J.L.F., VAN DER WALT, J.P. (1986). Fatty acid composition of Schizosaccharomyces Lindner. Systematics and Applied Microbiology 8: 163-165. KOLANOWSKI, W., LAUFENBERG, G. (2006). Enrichment of food products with polyunsaturated fatty acids by fish oil addition. European Journal of Food Research and Technology 222: 472-477. KOLB, B., Ed. (2003). Gaschromatographie in Bildern, Wiley-VCH Verlag. KORNBRUST, D.J., MAVIS, R.D. (1980). Relative susceptibility of microsomes from lung, heart, liver, kidney, brain and testes to lipid peroxidation: correlation with vitamin E content. Lipids 15: 315-322. KRIS-ETHERTON, P.M., SHAFFER TAYLOR, D., YU-POTH, S., HUTH, P., MORIARTY, K., FISHELL, V., HARGROVE, R.L., ZHAO, G., ETHERTON, T.D. (2000). Polyunsaturated fatty acids in the food chain in the United States. American Journal of Clinical Nutrition 71: 179S-188S. KRIS-ETHERTON, P.M., HARRIS, W.S., APPEL, L.J. (2002). Fish consumption, fish oil, omega-3 fatty acids and cardiovascular disease. Circulation 106: 2747-2757. LEESON, S., CASTON, L., MACLAURIN, T. (1998). Organoleptic evaluation of eggs produced by laying hens fed diets containing graded levels of flaxseed and vitamin E. Poultry Science 77: 1436-1440. LEPAGE, G., ROY, C.C. (1984). Improved recovery of fatty acid through direct transesterification without prior extraction or purification. Journal of Lipid Research 25: 1391-1396. LICHTENSTEIN, A.H., APPEL, L.J., BRANDS, M., CARNETHON, M., DANIELS, S., FRANCH, H.A., FRANKLIN, B. (2006). Summary of american heart association diet and lifestyle recommendations revision 2006. Arteriosclerosis, Thrombosis and Vascular Biology 26: 2186-2191. LOTTSPEICH, F., ENGELS, J.W., Eds. (2006). Bioanalytik, Spektrum Akademischer Verlag. 111 8. Literatur MANDAL, K., SARAVANAN, R., MAITI, S. (2008). Effect of different levels of N, P and K on downy mildew (Peronospora plantaginis) and seed yield of isabgol (Plantago ovata). Crop Protection 27: 988-995. MARSCHNER, H., Ed. (1995). Mineral nutrition of higher plants. London, Academic Press. MARSHALL, A.C., SAMS, A.R., VAN ELSWYK, M.E. (1994). Oxidative stability and sensory quality of stored eggs from hens fed 1,5% menhaden oil. Journal of Food Science 59: 561-563. MARTIN, J., LEHLE, P., ILG, W., Eds. (2005). Fertigarzneimittelkunde. Stuttgart, Wissenschaftliche Verlagsgesellschaft mbH. MEAD, J.F. (1984). The non-eicosanoid functions of the essential fatty acids. Lipid Research 25: 1517-1521. MEIER, S., MJOS, S., JOENSEN, H. (2006). Validation of a one-step extraction/methylation method for determination of fatty acids and cholesterol in marine tissues. Journal of Chromatography 1104: 291-298. MEISER, A., SCHMID-STAIGER, U., TRÖSCH, W. (2004). Optimization of eicosapentaenoic acid production by Phaeodactylum tricornutum the flat panel airlift (FPA) reactor. Journal of Applied Phycology 16: 215-225. MICHAELSON, L.V., NAPIER, J.A., LEWIS, M.J., GRIFFITHS, G., LAZARUS, C.M., STOBART, A.K. (1998). Functional characterization of a fatty acid ∆5 desaturase gene from Caenorhabditis elegans. FEBS letters 439: 215-218. MOCK, T., KROON, B.M.A. (2002). Photosynthetic energy conversion under extreme conditions-I: important role of lipids as structural modulators and energy sink under N-limited growth in Antarctic sea ice diatoms. Phytochemistry 61: 41-51. MONGRAND, S., BADOC, A., PATOUILLE, B., LACOMBLEZ, C., CHAVENT, M., CASSAGNE, C., BESSOULE, J.-J. (2001). Taxonomy of gymnospermae: multivariate analyses of leaf fatty acid composition. Phytochemistry101-115. MORRIS, M.C., TAYLOR, J.O., STAMPFER, M.J., ROSNER, B., SACKS, F. (1993). The effect of fish oil on blood pressure in mild hypersensitive subjects: a randomized crossover trial. American Journal of Clinical Nutrition 57: 59-64. NAPIER, J.A., MICHAELSON, L.V. (2001). Towards the production of pharmaceutical fatty acids in transgenic plants. Journal of the Science of Food and Agriculture 81: 883-888. NAPIER, J.A., BEAUDOIN, F., MICHAELSON, L.V., SAYANOVA, O.V. (2004). The production of long chain polyunsaturated fatty acids in transgenic plants by reverseengineering. Biochimie 86: 785-793. NAYLOR, R.L., GOLDBURG, R.J., PRIMAVERA, J.H., KAUTSKY, N., BEVERIDGE, M.C.M., CLAY, J., FOLKE, C., LUBCHENCO, J., MOONEY, H., TROELL, M. (2000). Effect of aquaculture on world fish supplies. Nature 405: 1017-1024. 112 8. Literatur NOBLE, R.C., COCCHI, M., TURCHETTO, E. (1990). Egg fat - a case for concern? World´s Poultry Science Journal 46: 109-118. O´BRIEN, D.J., KURANTZ, M., KWOCZAK, R. (1993). Production of eicosapentaenoic acid by the filamentous fungus Pythium irregulare. Applied Microbiology and Biotechnology 40: 211-214. OH, S.Y., RYUE, J., HSIEH, C.-H., BELL, D.E. (1991). Eggs enriched in n-3 fatty acids and alterations in lipid concentrations in plasma and lipoproteins and in blood pressure. American Journal of Clinical Nutrition 54: 689-695. PACETTI, D., HULAN, H.W., SCHREINER, M., BOSELLI, E., FREGA, N.G. (2005). Positional analysis of egg triacylglycerols from hens fed diets enriched with refined seal blubber oil. Journal of the Science of Food and Agriculture 85: 1703-1714. PESSARAKLI, M., TUCKER, T.C. (1985). Uptake of nitrogen-15 by cotton under salt stress. Journal of the Soil Science Society of America 49: 149-152. PESSARAKLI, M., TUCKER, T.C. (1988). Nitrogen-15 uptake by eggplant under sodium chloride stress. Journal of the Soil Science Society of America 52: 1673-1676. PFEFFER, H. (1999). Aufnahme von Bor in die Wurzel und Translokation von Bor in den Spross von Sonnenblumen (Helianthus annuus L.) mit unterschiedlichem Borversorgungsgrad: Mögliche Mechanismen und Regulation. Institut für Pflanzenernährung. Stuttgart-Hohenheim, Universität Hohenheim. PIEPHO, H.P., BÜCHSE, A., EMRICH, K. (2003). A hitchhiker´s guide to mixed moldels for randomized experiments. Journal of Agronomy and Crop Science 189: 310322. QI, B., BEAUDOIN, F., FRASER, T., STOBART, A.K., NAPIER, J.A., LAZARUS, C.M. (2002). Identification of a cDNA encoding a novel C18-∆9 polyunsaturated fatty acidspecific elongating activity from the docosahexaenoic acid (DHA)-producing microalga, Isochrysis galbana. FEBS letters 510: 159-165. QI, B. (2004). Production of very long chain polyunsaturated omega-3 and omega-6 fatty acids in plants. Nature Biotechnology 22: 739-745. RANI PALANISWAMY, U., MCAVOY, R.J., BIBLE, B.B. (2000). Omega-3-fatty acid concentration in Portulaca oleracea is altered by nitrogen source in hydroponic solution. Journal of the American Society of Horticultural Science 125: 190-194. REUTER, D.J., ROBINSON, J.B., DUTKIEWICZ, C., Eds. (1997). Plant analysis: an interpretation manual. Collingwood, VIC 3066, CSIRO. RICHTER, G., KÖHLER, H. (1998). Leinsaat erhöht Omega-3-Fettsäuren im Ei. Deutsche Gesellschaft für Saatgut intern 50: 5-6. ROBERT, S.S. (2006). Production of eicosapentaenoic and docosahexaenoic acidcontaining oils in transgenic land plants for human and aquaculture nutrition Marine Biotechnology 8: 103-109. 113 8. Literatur ROZYNEK, B. (2000). Biologie des falschen Mehltaus (Plasmopara halstedii) der Sonnenblume (Helianthus annuus) und seine Verbreitung in Süddeutschland. Institut für Botanik. Stuttgart-Hohenheim, Hohenheim: 107. ROZYNEK, B., SPRING, O. (2001). Leaf disk inoculation, a fast and precise test for the screening of metalaxyl tolerance in sunflower downy mildew. Journal of Phytopathology 149: 309-312. SACHS, L., HEDDERICH, Eds. (2006). Angewandte Statistik, Springer Verlag. SANDERS, T.A.B., LEWIS, F., SLAUGHTER, S., GRIFFIN, B.A., GRIFFIN, M., DAVIES, I., MILLWARD, D.J., COOPER, J.A., MILLER, G.J. (2006). Effect of varying the ratio of n-6 to n-3 fatty acids by increasing the dietary intake of α-linolenic acid, eicosapentaenoic and docosahexaenoic acid, or both on fibrinogen and clotting factors VII and XII in persons aged 45-70 y: the OPTILIP Study1-3. American Journal of Clinical Nutrition 84: 513-522. SANDERSON, P., FINNEGAN, Y.E., W ILLIAMS, C.M., CALDER, P.C., BURDGE, G.C., WOOTTON, S.A., GRIFFIN, B.A., MILLWARD, D.J., PEGGE, N.C., BERNELMANS, W.J.E. (2002). UK food standards agency α-linolenic acid workshop report. British Journal of Nutrition 88: 573-579. SANINA, N.M., GONCHAROVA, S.N., KOSTETSKY, E.Y. (2008). Seasonal changes of fatty acid composition and thermotropic behavior of polar lipids from marine macrophytes. Phytochemistry 69: 1517-1527. SAYANOVA, O.V., NAPIER, J.A. (2004). Eicosapentaenoic acid: biosynthesis routes and the potential for synthesis in transgenic plants. Phytochemistry147-158. SCHÄUFFELE, D. (2005). Taxonomische und phylogenetische Nutzung von Fettsäuremustern in der Systematik von Peronosporomycetidae. Institut für Botanik. Stuttgart-Hohenheim, Hohenheim. SCHERM, H., PRYOR, B., VAN BRUGGEN, A.H.C. (1993). Effects of ozonated water on sporangial germination of Bremia lactucae in vitro and in vivo. Tests of agrochemicals and cultivars: TAC/ Association of Applied Biologists 14: 40-41. SCHNEIDER, M. (2001). Phospholipids for functional food. European Journal of Lipid Science and Technology 103: 98-101. SCHOLTYSSEK, S. (1991). Fütterungseinflüsse auf den Cholesteringehalt im Ei. Lohmann Information. 11/12: 13-16. SCHOMBURG, G., Ed. (1987). Gaschromatographie. Weinheim, Verlag Chemie. SCHREINER, M., HULAN, H.W., RAZZAZI-FAZELI, E., BÖHM, J., IBEN, C. (2004). Feeding laying hens seal blubber oil: effect on egg yolk incorporation, stereospecific distribution of omega-3 fatty acids and sensory aspects. Poultry Science 83: 462-473. SCHREINER, M. (2005). Quantification of long chain polyunsaturated fatty acids by gas chromatography - Evaluation of factors affecting accuracy. Journal of Chromatography 1095: 126-130. 114 8. Literatur SCHREINER, M., MOREIRA, R.G., HULAN, H.W. (2005). Positional distribution of fatty acids in egg yolk lipids. Journal of Food Lipids 13: 36-56. SENGER, T., W ICHARD, T., KUNZE, S., GÖBEL, C., LERCHL, J., POHNERT, G., FEUSSNER, I. (2005). A multifunctional lipoxygenase with fatty acid hydroperoxide cleaving activity from the moss Physcomitrella patens. The Journal of Biological Chemistry 280: 7588-7596. SHANTHA, N.C., NAPOLITANO, G.E. (1992). Gas chromatography of fatty acids. Journal of Chromatography 624: 37-51. SIMOPOULOS, A.P., SALEM, N. (1986). Purslane: A terrestrial source of omega-3-fatty acids. New England Journal of Medicine 315: 833. SIMOPOULOS, A.P. (1989). Summary of the NATO advanced research workshop on dietary n-3 and n-6 fatty acids: Biological effects and nutritional essentiality. Journal of Nutrition 119: 521-528. SIMOPOULOS, A.P., SALEM, N. (1989). n-3 fatty acids in eggs from range-fed Greek chickens. New England Journal of Medicine 321: 1412-1415. SIMOPOULOS, A.P., SALEM, N. (1992). Egg yolk as a source of long-chain polyunsaturated fatty acids in infant feeding. American Journal of Clinical Nutrition411-4. SIMOPOULOS, A.P. (1995). Purslane in human nutrition and its potential for world agriculture. World Review of Nutrition and Diet 77: 47-74. SIMOPOULOS, A.P. (1999). Essential fatty acids in health and chronic disease. American Journal of Clinical Nutrition 70: 560S-569S. SIMOPOULOS, A.P. (2001). The mediterranean diets: What is so special about the diet of Greece? The scientific evidence. Journal of Nutrition 131: 3065S-3073S. SIMOPOULOS, A.P. (2002). Omega-3 fatty acids in inflammation and autoimmune diseases. Journal of the American College of Nutrition 21: 495-505. SINGH, A., W ARD, O.P. (1998). Docosapentaenoic acid (C22:5, ω-3) production by Pythium acanthicum. Journal of Industrial Microbiology and Biotechnology 20: 187-191. SINNHUBER, R.O., YU, T.C. (1958). Characterization of the red pigment formed in the 2-thiobarbituric acid determination of oxidative rancidity. Food Research 23: 626-634. SIRTORI, C.R., Ed. (1994). Effects of unsaturated fatty acids on high density lipoprotein metabolism. Effects on fatty acids and lipids in health and disease. Basel, Karger Verlag. SPERLING, P., HEINZ, E. (2001). Desaturases fused to their electron donor. European Journal of Lipid Science and Technology 103: 158-180. 115 8. Literatur SPRING, O., ROZYNEK, B., ZIPPER, R. (1997). Leaf disk inoculation - a useful tool for selecting infections of sunflower downy mildew at low inoculum concentration, but inappropriate to pathotype characterization. Journal of Phytopathology 145: 189-191. SPRING, O., ROZYNEK, B., ZIPPER, R. (1998). Single spore infections with sunflower downy mildew. Journal of Phytopathology 146: 577-579. SPRING, O., HAAS, K. (2002). The fatty acid composition of Plasmopara halstedii and its taxonomic significance. European Journal of Plant Pathology 108: 263-267. SPRING, O., THINES, M. (2004). On the necessity of new characters for classification and systematics of biotrophic Peronosporomycetes. Planta 10.1007: 1-7. SPRING, O., HAAS, K., LAMLA, I., THURNHOFER, S., VETTER, W. (2005). The composition and taxonomic significance of fatty acid patterns in three white rust species: Albugo amaranthi, A. candida and A. tragopogonis (Peronosporales, Albuginaceae). Mycological Progress 4: 179-184. SPRING, O., BACHOFER, M., THINES, M., RIETHMÜLLER, A., GÖKER, M., OBERWINKLER, F. (2006). Intraspecific relationship of Plasmopara halstedii isolates differing in pathogenicity and geographic origin based on ITS sequence data. European Journal of Plant Pathology 114: 309-315. STEINHILBER, S. (2003). Einfluss von genetischem Typ, Legeabschnitt und Futterfett auf die Anreicherung von Hühnereiern mit Omega-3-Fettsäuren und die Auswirkungen auf die Produktqualität. Institut für Tierhaltung und Tierzüchtung, Fachgebiet Nutztierethologie und Kleintierzucht. Stuttgart-Hohenheim, StuttgartHohenheim: 113. STULNIG, T.M. (2003). Immunomodulation by polyunsaturated fatty acids: mechanisms and effects. International Archives of Allergy and Immunology 132: 310321. SU, H., VAN BRUGGEN, A.H.C., SUBBARAO, K.V. (2000). Spore release of Bremia lactucae on lettuce is affected by timing of light initiation and decrease in relative humidity. Phytopathology 90: 67-71. SU, H., VAN BRUGGEN, A.H.C., SUBBARAO, K.V., SCHERM, H. (2004). Sporulation of Bremia lactucae affected by temperature, relative humidity, and wind in controlled conditions. Phytopathology 94: 396-401. THURNHOFER, S. (2007). Concentrations and enantioselectivity of anteiso-fatty acids in food. Institut für Lebensmittelchemie. Stuttgart-Hohenheim, Stuttgart-Hohenheim. TONON, T., HARVEY, D., LARSON, T.R., GRAHAM, I.A. (2002). Long chain polyunsaturated fatty acid production and partitioning to triacylglycerols in four microalgae. Phytochemistry15-24. TONON, T., SAYANOVA, O.V., MICHAELSON, L.V., QING, R., HARVEY, D., LARSON, T.R., NAPIER, J.A., GRAHAM, I.A. (2005). Fatty acid desaturases from the microalga Thalassiosira pseudonana. FEBS Journal 272: 3401-3412. 116 8. Literatur TRAUTWEIN, E.A. (2001). n-3 fatty acids - physiological and technical aspects for their use in food. European Journal of Lipid Science and Technology 103: 45-55. TRIPODI, K.E.J., BUTTIGLIERO, L.V., ALTABE, S.G., UTTARO, A.D. (2006). Functional characterization of front-end desaturases from trypynosomatids depicts the first polyunsaturated fatty acid biosythetic pathway from a parasitic protozoan. FEBS Journal 273: 271-290. UAUY, R., CASTILLO, C. (2003). Lipid requirements of infants: implications for nutrient composition of fortified complementary foods. Journal of Nutrition 133: 2962S2972S. ULBERTH, F., GABERNIG, R.G., SCHRAMMEL, F. (1999). Flame-Ionization detector response to methyl, ethyl, propyl, and butyl esters of fatty acids. Journal of the American Oil Chemists Society 76: 263-266. URSIN, V.M. (2003). Modification of plant lipids for human health: development of functional land-based omega-3 fatty acids. Journal of Nutrition 133: 4271-4274. VELASCO, L., GOFFMAN, F.D. (1999). Chemotaxonomic significance of fatty acids and tocopherols in Boraginaceae. Phytochemistry 52: 423-426. WARD, O.P., SINGH, A. (2005). Omega-3/6 fatty acids: Alternative sources of production. Process Biochemistry 40: 3627-3652. WEBSTER, R. (2001). Statistics to support soil research and their presentation. European Journal of Soil Science 52: 331-340. WILLIAMS, C.M. (2000). Dietary fatty acids and human health. Annals of Zootechnology 49: 165-180. WOLFRUM, C., SPENER, F. (2000). Fatty acids as regulators of lipid metabolism. European Journal of Lipid Science and Technology 102: 746-762. WU, G., TRUSKA, M., DATLA, N., VRINTEN, P., BAUER, J., ZANK, T., CIRPUS, P., HEINZ, E., QIU, X. (2005). Stepwise engineering to produce high yields of very long-chain polyunsaturated fatty acids in plants. Nature Biotechnology 23: 1013-1017. YONGMANITCHAI, W., WARD, O.P. (1991). Growth of and omega-3 fatty acid production by Phaeodactylum tricornutum under different culture conditions. Applied Environmental Microbiology 57: 419-25. 117 9. Anhang 9. Anhang I: Berechnete und in der Untersuchung verwendeten Responsefaktoren von 7 Injektionen und deren Mittelwert mit der Bezugsbasis C 20:0. Fettsäure C12:0 C13:0 C14:0 C14:1 C15:0 C15:1 C16:0 C16:1 C17:0 C17:1 C18:0 C18:1n9t C18:1n9c C 18:2n6t C18:2n6c C18:3n6 C18:3n3 C20:0 C20:1n9 C20:2 C 20:3n6 C21:0 C20:4n6 C20:3n3 C20:5n3 C22:0 C22:1n9 C 22:2 C23:0 C 24:0 C22:6n3 C24:1 1 0,67 0,71 0,74 0,72 0,83 0,77 0,85 0,84 0,90 0,86 0,94 0,90 0,92 0,88 0,87 0,93 0,87 1,00 1,04 0,97 1,04 1,00 1,00 0,96 0,91 1,11 1,23 1,00 1,20 1,19 1,16 1,05 2 0,59 0,65 0,70 0,68 0,74 0,73 0,79 0,77 0,83 0,84 0,90 0,89 0,89 0,87 0,87 0,82 0,82 1,00 0,99 0,96 1,00 0,98 0,91 0,93 0,91 1,14 1,10 1,06 1,15 1,25 1,09 1,10 Injektionen 3 4 5 0,57 0,59 0,62 0,64 0,64 0,67 0,68 0,71 0,73 0,68 0,68 0,73 0,73 0,73 0,82 0,72 0,73 0,79 0,79 0,80 0,83 0,76 0,79 0,78 0,82 0,85 0,88 0,83 0,81 0,87 0,88 0,91 0,93 0,87 0,91 0,94 0,87 0,90 0,93 0,84 0,87 0,92 0,86 0,86 0,89 0,86 0,83 0,88 0,84 0,83 0,84 1,00 1,00 1,00 0,96 1,00 0,97 0,98 0,98 0,98 0,94 0,98 1,04 0,94 0,97 1,02 0,90 0,90 0,91 0,92 0,92 0,98 0,91 0,87 0,87 1,09 1,09 1,13 1,07 1,10 1,08 1,04 1,05 1,02 1,12 1,14 1,15 1,22 1,18 1,23 0,76 1,12 1,12 1,36 1,10 1,09 118 Mittelwert 6 0,60 0,65 0,69 0,71 0,74 0,73 0,79 0,77 0,83 0,84 0,89 0,91 0,90 0,86 0,84 0,84 0,84 1,00 0,98 0,97 1,00 0,96 0,89 0,92 0,89 1,11 1,12 1,05 1,16 1,20 1,07 1,11 7 0,59 0,63 0,69 0,67 0,73 0,72 0,80 0,77 0,82 0,80 0,90 0,91 0,89 0,87 0,87 0,84 0,84 1,00 0,99 0,99 0,99 0,97 0,90 0,92 0,89 1,11 1,11 1,08 1,13 1,20 1,09 1,07 0,60 0,66 0,71 0,69 0,76 0,74 0,81 0,78 0,85 0,84 0,91 0,90 0,90 0,87 0,87 0,86 0,84 1,00 0,99 0,97 1,00 0,98 0,91 0,94 0,89 1,11 1,12 1,04 1,15 1,21 1,06 1,12 Dotter) der Eidotter der 5 Hühnergruppen mit je 8 Hühnern nach 5 Fütterungsvarianten (Kontrolle, Grüner Salat infiziert (SN+), Grüner Salat gesund (SN-), Roter Eichblatt infiziert (RE+), Roter Eichblatt gesund (RE-). II: Am GC-FID gemessene Signalflächeneinheiten (AREA) und absolute Fettsäurekonzentrationen (mg/g 9. Anhang _____________________________________________________________________________________ 119 AREA V 507 Kontrolle RF Fatty Acid STAR C 12:0 C 13:0 C 14:0 C 14:1n5 C 15:0 C 15:1n5 C 16:0 C 16:1n9c C 16:1n7t C 16:1n7c C 17:0 C 17:1n7 C 18:0 C 18:1n9t C 18:1n9c C 18:1n7 C 18:2n6t C 18:2n6c C 18:3n6 C 18:3n3 C 18:4n3 C 20:0 C 20:1n9 C 20:2n6 C 20:3n6 C 21:0 C 20:4n6 C 20:3n3 C 20:5n3 C 22:0 C 22:1n9 C 22:2n6 C 23:0 C 24:0 C 22:5n3 C 22:6n3 C 24:1n9 20.01.05 0,59 0,65 0,71 0,69 0,75 0,78 0,82 0,77 0,76 0,86 0,92 0,91 0,94 1 108 2 109 3 110 4 111 5 116 Kontrolle 6 113 7 114 8 115 1 108 2 109 3 110 4 111 5 116 6 113 7 114 8 115 153 217 185 229 292 160 162 182 0,38 0,47 0,63 0,47 0,54 0,46 0,45 0,55 18839 21521 15099 22069 25448 15477 16334 14830 53,97 54,37 59,51 52,11 54,32 52,05 52,75 52,45 2052 144 65 7091 2579 149 242 8002 1916 97 59 5956 3069 147 92 7855 3098 221 2059 154 5,48 0,38 0,19 22,68 6,07 0,35 0,64 22,57 7,04 0,35 0,24 26,21 6,75 0,32 0,23 20,71 5,87 0,43 0,22 24,03 6,20 0,46 6038 1648 149 35 5880 6,16 0,44 8339 1872 138 64 6401 21,77 5,43 0,49 0,13 23,22 33830 37920 26020 40014 39818 28941 30947 24726 110,51 109,24 116,94 107,74 96,92 110,98 113,96 99,72 16433 111 767 9601 17292 94 824 20600 124 966 30 12829 55 593 15132 82 721 11724 78 600 0,11 46,18 0,18 2,11 52,30 0,26 2,47 44,38 0,27 2,25 8145 148 172 103 5221 8715 164 161 96 9640 168 170 6119 112 99 70 6372 131 115 5818 74 82 25,00 0,39 0,30 25,00 0,46 0,41 0,33 25,00 0,52 0,46 25,00 0,32 0,36 32 1417 1860 1192 1909 121 1972 1318 1507 1168 95 127 887 184 200 1078 172 92 710 269 132 1309 169 237 1280 125 52 865 104 139 592 72 148 784 0,93 0,88 0,81 0,87 31 13543 1,00 1,01 1,01 1,16 0,88 0,82 0,99 0,87 1,15 1,11 1,12 1,20 1,27 7183 112 84 0,89 1,23 mg / g Dotter 651 442 0,10 41,53 44,44 0,27 2,05 40,50 25,00 0,46 0,53 0,37 0,10 4,06 19,87 43,70 0,22 2,06 47,06 0,26 2,19 25,00 25,00 0,48 0,47 0,32 25,00 0,44 0,45 4,70 4,70 4,51 0,28 4,21 4,44 4,87 4,13 0,42 0,71 1,04 0,98 0,55 0,65 0,52 0,39 2,76 2,96 3,04 3,36 2,97 3,16 2,08 3,01 1,98 1,85 Dotter) der Eidotter der 5 Hühnergruppen mit je 8 Hühnern nach 5 Fütterungsvarianten (Kontrolle, Grüner Salat infiziert (SN+), Grüner Salat gesund (SN-), Roter Eichblatt infiziert (RE+), Roter Eichblatt gesund (RE-). II: Am GC-FID gemessene Signalflächeneinheiten (AREA) und absolute Fettsäurekonzentrationen (mg/g 9. Anhang _______________________________________________________________________________________ 120 AR E A V 507 SN - RF Fatty Acid STAR C 12:0 C 13:0 C 14:0 C 14:1n5 C 15:0 C 15:1n5 C 16:0 C 16:1n9c C 16:1n7t C 16:1n7c C 17:0 C 17:1n7 C 18:0 C 18:1n9t C 18:1n9c C 18:1n7 C 18:2n6t C 18:2n6c C 18:3n6 C 18:3n3 C 18:4n3 C 20:0 C 20:1n9 C 20:2n6 C 20:3n6 C 21:0 C 20:4n6 C 20:3n3 C 20:5n3 C 22:0 C 22:1n9 C 22:2n6 C 23:0 C 24:0 C 22:5n3 C 22:6n3 C 24:1n9 20.01.05 0,59 0,65 0,71 0,69 0,75 0,78 0,82 0,77 0,76 0,86 0,92 0,91 0,94 0,93 0,88 0,81 0,87 1,00 1,01 1,01 1,16 0,88 0,82 0,99 0,87 1,15 1,11 1,12 1,20 1,27 0,89 1,23 mg / g Dotter 1 134 2 136 212 181 24936 15725 2168 355 3 137 4 138 SN - 5 139 6 140 7 141 168 164 13909 15184 14561 10810 15021 1392 183 73 5817 1570 198 69 7512 1687 152 23274 1744 189 83 7418 5967 1227 130 68 4882 1818 159 69 6198 41212 31037 22609 28334 26084 20205 30582 155 2099 33 9450 21516 110 1528 16955 79 1174 19974 88 1436 17302 98 1160 13229 6587 116 203 111 6080 86 148 47 6705 121 146 62 1976 1570 1069 1779 78 105 1097 77 107 905 240 8 142 265 1 134 2 136 0,40 0,49 15974 54,30 49,12 1292 186 4,40 0,71 6442 56,58 3 137 4 138 5 139 6 140 7 141 8 142 0,44 0,44 0,00 0,72 47,07 46,60 44,87 49,78 47,42 54,97 5,08 0,55 0,27 25,87 4,39 0,57 0,26 21,98 4,49 0,56 0,22 25,74 4,84 0,43 5,35 0,46 0,23 21,84 4,14 0,59 20,53 5,27 0,55 0,33 25,10 24,75 26978 22916 102,33 110,56 87,26 99,16 91,65 106,11 97,12 89,92 15610 58,36 0,19 3,99 57,49 835 17272 60 1191 6678 98 127 88 4468 55 97 67 6518 100 127 70 1342 1201 935 112 100 1198 71 121 1128 56 94 737 71,28 0,33 4,85 71,94 0,34 5,06 61,42 0,26 4,21 65,61 0,26 4,67 57,06 0,30 3,79 65,21 5980 88 100 25,00 25,00 0,45 0,78 0,49 25,00 0,36 0,62 0,22 25,00 0,46 0,55 0,27 25,00 0,37 0,48 0,38 25,00 0,31 0,55 25,00 0,39 0,49 0,31 25,00 0,37 0,42 1208 1181 4,31 4,91 3,62 4,12 3,70 4,31 3,82 4,07 87 98 911 88 127 861 0,37 0,40 0,53 0,34 0,40 0,42 0,47 3,72 3,33 4,00 3,78 3,69 3,13 3,22 1125 0,64 4,21 4,08 4,11 Dotter) der Eidotter der 5 Hühnergruppen mit je 8 Hühnern nach 5 Fütterungsvarianten (Kontrolle, Grüner Salat infiziert (SN+), Grüner Salat gesund (SN-), Roter Eichblatt infiziert (RE+), Roter Eichblatt gesund (RE-). II: Am GC-FID gemessene Signalflächeneinheiten (AREA) und absolute Fettsäurekonzentrationen (mg/g 9. Anhang _______________________________________________________________________________________ 121 AREA V 507 RE + RF Fatty Acid STAR C 12:0 C 13:0 C 14:0 C 14:1n5 C 15:0 C 15:1n5 C 16:0 C 16:1n9c C 16:1n7t C 16:1n7c C 17:0 C 17:1n7 C 18:0 C 18:1n9t C 18:1n9c C 18:1n7 C 18:2n6t C 18:2n6c C 18:3n6 C 18:3n3 C 18:4n3 C 20:0 C 20:1n9 C 20:2n6 C 20:3n6 C 21:0 C 20:4n6 C 20:3n3 C 20:5n3 C 22:0 C 22:1n9 C 22:2n6 C 23:0 C 24:0 C 22:5n3 C 22:6n3 C 24:1n9 20.01.05 0,59 0,65 0,71 0,69 0,75 0,78 0,82 mg / g Dotter 1 126 2 127 210 3 128 156 4 129 RE + 5 130 6 131 7 132 164 8 133 152 32 1 126 2 127 0,44 3 128 4 129 0,39 0,43 5 130 6 131 7 132 8 133 0,40 0,07 21163 16241 16221 15759 14307 12830 15089 16038 51,27 50,30 46,76 47,93 41,74 51,55 50,05 49,24 4,78 0,61 0,26 24,93 4,78 0,61 0,26 26,70 4,13 0,57 0,21 25,86 4,21 0,60 0,23 24,78 3,78 0,51 4,53 0,58 4,52 0,58 4,79 0,66 22,30 25,89 23,79 23,88 0,77 0,76 0,86 0,92 0,91 0,94 2118 272 104 9218 1655 214 80 7722 1537 214 69 8034 1486 214 72 7296 1391 189 1211 155 1461 188 1673 232 6845 5772 6425 6966 35811 29696 31096 27349 25120 21656 26746 29843 98,93 104,88 102,22 94,86 83,57 99,23 101,16 104,49 0,93 0,88 0,81 0,87 26033 149 1718 19751 84 1210 19626 81 1256 18899 87 1208 17096 80 1072 15593 63 1005 17620 58 1172 20548 81 1396 67,50 0,35 4,41 65,47 0,25 3,97 60,56 0,23 3,84 61,53 0,26 3,90 53,39 0,23 3,32 67,06 0,25 4,28 62,55 0,19 4,12 67,53 0,24 4,55 8494 147 213 6644 83 102 7138 110 130 114 6765 111 156 119 7053 91 134 72 5121 93 115 97 6204 106 130 56 6702 136 192 97 25,00 0,44 0,63 25,00 0,32 0,39 25,00 0,39 0,46 0,46 25,00 0,41 0,58 0,51 25,00 0,33 0,48 0,29 25,00 0,46 0,57 0,55 25,00 0,43 0,53 0,26 25,00 0,51 0,72 0,42 154 2003 41 1421 1540 1340 1237 1178 1176 1223 0,40 4,86 0,12 4,40 4,44 4,08 3,61 4,74 3,90 3,76 0,22 0,40 2,95 3,53 1,00 1,01 1,01 1,16 0,88 0,82 0,99 0,87 1,15 1,11 1,12 1,20 1,27 0,89 1,23 41 50 95 216 1487 122 1444 0,13 0,22 50 70 941 86 30 1069 965 117 903 902 89 152 1246 0,35 3,91 4,86 0,42 3,06 3,94 3,25 4,16 II: Am GC-FID gemessene Signalflächeneinheiten (AREA) und absolute Fettsäurekonzentrationen (mg/g Dotter) der Eidotter der 5 Hühnergruppen mit je 8 Hühnern nach 5 Fütterungsvarianten (Kontrolle, Grüner Salat infiziert (SN+), Grüner Salat gesund (SN-), Roter Eichblatt infiziert (RE+), Roter Eichblatt gesund (RE-). 9. Anhang _______________________________________________________________________________________ 122 V 507 RF Fatty Acid STAR C 12:0 C 13:0 C 14:0 C 14:1n5 C 15:0 C 15:1n5 C 16:0 C 16:1n9c C 16:1n7t C 16:1n7c C 17:0 C 17:1n7 C 18:0 C 18:1n9t C 18:1n9c C 18:1n7 C 18:2n6t C 18:2n6c C 18:3n6 C 18:3n3 C 18:4n3 C 20:0 C 20:1n9 C 20:2n6 C 20:3n6 C 21:0 C 20:4n6 C 20:3n3 C 20:5n3 C 22:0 C 22:1n9 C 22:2n6 C 23:0 C 24:0 C 22:5n3 C 22:6n3 C 24:1n9 20.01.05 0,59 0,65 0,71 0,69 0,75 0,78 0,82 1 117 125 91 26 13024 2 119 164 3 120 AREA mg / g Dotter RE - RE - 4 121 103 5 122 117 6 123 134 7 124 8 125 1 117 2 119 3 120 126 0,37 0,50 0,30 51,24 48,68 4,92 0,61 14593 14198 14829 14795 14499 14715 11828 0,28 0,08 44,31 1505 187 1347 106 34 6039 1222 233 6863 1537 220 26 6439 1259 206 69 6435 1265 187 40 5505 4,76 0,68 0,48 23,09 4 121 5 122 6 123 7 124 8 125 0,31 0,36 0,40 52,21 45,86 45,64 53,82 45,27 4,42 0,35 0,13 23,74 3,53 0,67 25,89 4,45 0,55 0,18 24,27 23,75 4,51 0,64 0,09 22,63 4,29 0,70 0,26 26,28 4,51 0,66 0,16 23,52 0,77 0,76 0,86 0,92 0,91 0,94 1503 216 134 6079 6603 1392 173 51 6341 24071 26567 23867 24827 24682 25638 22901 19739 93,39 106,38 93,31 99,69 87,24 92,03 95,52 86,16 0,93 0,88 0,81 0,87 31 16155 118 1169 17124 87 1234 13759 74 918 15701 18743 99 1304 18427 94 1362 14609 41 1009 0,12 58,83 0,39 4,22 64,36 0,30 4,60 50,49 0,25 3,34 59,17 987 19333 81 1365 3,69 64,14 0,25 4,49 63,15 0,31 4,35 72,14 0,34 5,28 59,85 0,15 4,10 1,00 1,01 1,01 1,16 0,88 0,82 0,99 0,87 1,15 1,11 1,12 1,20 1,27 6048 139 177 30 102 1236 49 23 5860 103 135 103 6002 86 129 72 5844 97 137 99 6639 123 207 124 6537 102 137 84 5626 83 149 88 5376 25,00 0,44 0,58 0,51 25,00 0,36 0,54 0,35 25,00 0,42 0,59 0,49 25,00 0,47 0,79 0,54 25,00 0,39 0,53 0,37 25,00 0,37 0,67 0,45 25,00 1459 1049 1137 1344 1236 1137 1125 25,00 0,58 0,74 0,14 0,37 4,21 0,20 0,08 5,13 3,60 4,01 4,17 3,89 4,16 4,31 100 128 1028 33 86 810 0,54 0,17 79 955 53 63 900 0,00 958 64 196 1077 3,73 3,92 3,02 0,89 1,23 152 1010 843 95 65 0,31 3,23 3,23 3,68 0,45 0,35 0,31 3,80 3,74 II: Am GC-FID gemessene Signalflächeneinheiten (AREA) und absolute Fettsäurekonzentrationen (mg/g Dotter) der Eidotter der 5 Hühnergruppen mit je 8 Hühnern nach 5 Fütterungsvarianten (Kontrolle, Grüner Salat infiziert (SN+), Grüner Salat gesund (SN-), Roter Eichblatt infiziert (RE+), Roter Eichblatt gesund (RE-). 9. Anhang ________________________________________________________________________________________ 123 AREA V 507 SN + RF Fatty Acid STAR C 12:0 C 13:0 C 14:0 C 14:1n5 C 15:0 C 15:1n5 C 16:0 C 16:1n9c C 16:1n7t C 16:1n7c C 17:0 C 17:1n7 C 18:0 C 18:1n9t C 18:1n9c C 18:1n7 C 18:2n6t C 18:2n6c C 18:3n6 C 18:3n3 C 18:4n3 C 20:0 C 20:1n9 C 20:2n6 C 20:3n6 C 21:0 C 20:4n6 C 20:3n3 C 20:5n3 C 22:0 C 22:1n9 C 22:2n6 C 23:0 C 24:0 C 22:5n3 C 22:6n3 C 24:1n9 20.01.05 0,59 0,65 0,71 0,69 0,75 0,78 0,82 mg / g Dotter 1 143 157 2 145 127 3 146 110 4 147 144 SN + 5 148 117 6 149 159 7 150 142 8 151 138 1 143 0,38 3 146 0,37 4 147 5 148 6 149 7 150 8 151 0,49 0,45 0,50 0,49 0,45 0,15 16654 14977 13317 14142 11825 14822 13279 14350 46,79 52,15 52,43 56,33 52,74 53,91 52,85 53,83 1787 205 1281 159 1488 147 1226 102 1533 166 4,16 0,51 5,09 0,42 5,20 0,56 5875 24,60 22,63 5,02 0,53 0,27 25,66 5,52 0,54 4737 1295 136 66 5585 4,68 0,53 5753 1404 93 59 4921 25,58 23,58 23,86 5,21 0,34 0,25 21,87 4,53 0,47 0,26 23,39 7842 5820 1367 146 66 5837 31616 24314 22348 23546 19758 24378 22436 21 23785 101,29 0,93 0,88 0,81 0,87 19485 73 1964 18234 113 1165 16383 15849 73 1026 14967 16190 73 1058 13785 41 906 16581 7324 122 175 5909 129 166 137 5226 97 131 5166 102 120 82 4614 88 115 5657 104 146 98 5170 95 114 82 1520 1305 1068 1199 965 1312 89 990 68 96 932 43 112 797 67 70 877 100 665 44 112 922 0,89 1,23 0,38 41 0,77 0,76 0,86 0,92 0,91 0,94 1,00 1,01 1,01 1,16 0,88 0,82 0,99 0,87 1,15 1,11 1,12 1,20 1,27 2 145 1150 1076 96,55 100,34 106,95 100,48 101,12 101,83 101,75 58,59 0,20 5,85 67,96 0,39 4,30 69,04 5485 97 140 54 25,00 0,42 0,60 25,00 0,55 0,71 0,67 992 1178 4,27 47 55 776 76 1177 771 3,02 67,57 0,28 4,33 71,44 25,00 0,47 0,63 25,00 0,50 0,59 0,46 4,55 4,21 4,78 0,36 0,26 0,41 3,53 3,41 3,80 4,80 63,03 0,26 4,08 58,73 0,16 3,82 66,58 25,00 0,48 0,63 25,00 0,46 0,65 0,50 25,00 0,46 0,56 0,46 25,00 0,45 0,65 0,28 4,31 4,78 3,95 4,42 0,25 0,29 0,44 3,64 3,36 3,14 5,09 3,22 4,68