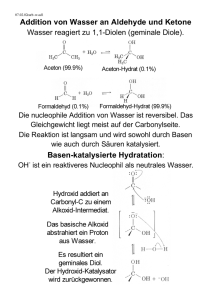
1 Radikalchemie 2. Nucleophile Substitution am gesättigten C-Atom
Werbung

Inhaltsverzeichnis: Handouts und Zusatzhandouts Um in dem Inhaltsverzeichnis relativ schnell etwas zu finden bedient man sich am besten der Suchfunktion im Adobe-Reader (Tastenkombination: Strg+F) 1 Radikalchemie 1.1 Allgemeines 1.1.1 Vorzugsgeometrien nach dem VSEPR Prinzip: 1.1.2 Relative Stabilität Einfluss der Hybridisierung auf die Stabilität der Radikale 1.1.3 Alkylradikalstabilität durch Alkylsubstitution / Hyperkonjugation Einfluss des Substitutionsmusters auf die Stabilität der Radikale: 1.4 Stabilisierung per Konjugation 1.1.5 Konjugierte Stabilisierung (kummulativ) Tritylradikal 1.1.6 Stabilisierung durch benachbarte Gruppen Elektronen ziehende Gruppen: EWG Elektronenreiche Gruppen (Electron releasing groups = ERG): Gleichzeitige Donor und Akzeptorsubstitution Captodativer Effekt. 1.2 Bell-Evans Polany Prinzip / Hammond Postulat 1.3 Radikalerzeugung 1.3.1 Homolyse schwacher Einfachbingungen a) Thermolyse b) Photolyse c) Elektrolyse 1.3.2 Folgereaktionen a) Fragmentierung b) Addition an C=C . c) Abstraktion von H aus Lösungsmittel . d) Abstraktion H aus weiterem Radikal (Disproportionierung) e) Umlagerung f) Rekombination 1.3.3 Radikalketten Substitution 1.3.3.1 Mit Halogenen 1.3.3.2 Regioselektivität bei Radikalischer Chlorierung / Bromierung b) Radikalchemie von Alkylquecksilberverbindungen c) Selektive Monochlorierung von Cyclohexan mit Sulfurylchlorid 1.3.3.3 Chemoselektivität KKK/SSS Regel Selektive Bromierung der Allylposition mit NBS (Wohl Ziegler Verfahren) 1.4 Autoxidation Phenolsynthese nach Hock Bildung von Etherperoxiden 1.5 Defunktionalisierungsreaktion über radikalische Substitutionsreaktion Barton Mc Combie Desoxygenierung: Defunktionalisierung eines Alkohols 2. Nucleophile Substitution am gesättigten C-Atom 2.1 Begriffe: Nucleophil, Elektrophil 2.2 Gute und schlechte Nucleophile Basizität, Nucleophilie, Sterische Effekte 2.2.1 Der -Effekt 2.2.2 Solvenseffekte 2.2.3 Trends im PSE 2.3 Abgangsgruppenqualität: 2.3.2 Abbau von Ringspannung 2.4 SN2-Reaktion More resources available at www.dmuller.de Inhaltsverzeichnis: Handouts und Zusatzhandouts 2.4.1 Der Übergangszustand für eine SN2 Reaktion 2.4.2 Substituenteneffekte auf die SN2 Reaktivität 2.4.3 Geschwindigkeitserhöhender Substituenteneffekt Allylsubstituent, Benzylsubstituent, -Halogenierte Ketone und Carbonsäureester 2.5 SN1-Reaktion 2.5.1 Mechanismus, Geschwindigkeitsgesetz, Energie-Profil 2.5.2 Stereochemie der SN1-Reaktion 2.5.3 Solvens und Substituenteneffekte Solvenseffekte bei SN1 Reaktionen Substituenteneffekte bei SN1 Reaktionen 2.6 Einige Faustregeln SN2 vs. SN1 2.7 Nachbargruppeneffekte Hydrolyse von Senfgas, - Systeme: Norboryl-Kation, - Systeme: Norborneyl-Kation, Phenonium Ion 3. Addition an die C=C Doppelbindung 3.1 Allgemeines 3.1 Vokabular zur stereoselektiven Synthese 3.1.1 Stereospezifisch 3.1.2 Stereokonvergent 3.2 Cis-selektive Reaktionen 3.2.1 Die Diels-Alder-Reaktion Das Dien Die Diels Alder Reaktion ist endo-spezifisch Sekundäre Orbitalreaktionen als Erlärung für die Endo-Regel in D.A. Reaktionen 3.2.2 1,3 dipolare Cycloadditionen a) Ozonolyse 3.2.3 Weitere 1,3 dipolare Cycloadditionen 3.2.4 Cyclopropanierung mit Carben 3.2.5 Epoxidierung von Alkenen Fürst Plattner Regel 3.2.6 Hydroborierung— Die Addition von Borhydriden an Alkene (oder Alkine) BH3, 9-BBN, Alpine-Borane, Dicyclohexylboran Die Hydroborierung ist regioselektiv Experimenteller Beweis für die stereospezifische Cis-Addition Unterschiedliche Aufarbeitungsmöglichkeiten Stereoselektive Hydroborierung 3.2.7 Heterogene katalytische Hydrierung Homogene Katalyse, Heterogene Katalyse 3.3 Trans-selektive Additionen über "Onium" Zwischenstufen 3.3.1 Bromierung 3.3.2 Halogenhydrinbildung mit NBS Chloramin T 3.3.3 Solvomercurierung 3.4 Additionen die Mechanismus-bedingt ohne Stereokontrolle verlaufen 3.5 Enantioselektive Addition an Alkene 3.5.1 Vokabular zu stereoselektiven Synthesen 3.5.2 Asymmetrische Hydroborierung von achiralen Olefinen Stereoselektive Synthese 3.5.3 Zusammenhang: Energetische Unterschiede der diasteromeren ÜZ Enantioselektivität. 3.6 Zusatz: Wacker oxidation 4. -Eliminierungen Einschub: und -Eliminierungen More resources available at www.dmuller.de und der Inhaltsverzeichnis: Handouts und Zusatzhandouts Dichlorcarbensynthese (Cycloporpanierung) Simmons-Smith 4.1 Mechanismen Typen Allgemein: E2, E1, E1cb 4.2 E2-Eliminierung 4.2.1 Allgemeines Stereoselektiv und Stereospezifisch 4.2.2 E2 / SN2 Konkurrenz Eliminierung, Substitution und das HSAB Prinzip Eliminierung versus Substitution 4.2.3 Regioselektivität der E2-Eliminierung Regel von Saytzew und Hoffmann Nachbargruppeneffekte Eliminierung zu Brückenkopfalkenen (Bredt Regel) 4.3 E1-Eliminierung 4.3.1 Allgemeines 4.3.2 E1 / SN1-Konkurenz 4.3.3 E1cb Eliminierung 4.4 Thermische Cis-Eliminierung 4.4.1 Pyrolyse von Carbonsäureestern 4.4.2 Tschugajew Reaktion 4.4.2 Mukayama Redoreaktion 4.4.2 Cope Eliminierung 4.5 Zusammenfassung 5 Substitution am Aromaten 5.1 Elektrophile Aromatensubstitution Allgemeines und Grundlagen Meta, para und ortho-Angriff Allgemeines zur Kekulé Schreibweise Positionen im Benzolring 5.1.1 Mechanismus 5.1.2 Reaktivität und Regioselektivität 5.1.3 Knüpfung von C-Heteroatombindung durch Ar-SE 5.1.4 Knüpfung von C-C Bindungen durch Ar-SE a) C-Alkly Friedel Crafts-Alkylierungen b) Spezielle Alkylelektrophile c) Chlormethylierung d) Friedel Crafts Acylierungen Einschub: Reduktion des entstehenden Ketons zum Alkan Wolf–Kishner Reduktion Clemmensen Reduktion Mozingo Reduktion e) Fries Verschiebung f) Ar-C(=O)H Formylierungen Vielsmeier-Haack-Formylierung Reimer-Tiemann Reaktion g) Ar-CO2H Carboxylierungen Kolbe Schmidt Synthese 5.2 Elektrophile aromatische Substitution via Arylmetallverbindungen 5.2.1 Direktsynthese 5.2.2 Via Halogenmetallaustausch 5.2.3 Direkte Deprotonierung von ArH via dirigierter ortho Metallierung MDG: Metalldirigierende Gruppen 5.3 Substitutionsreaktionen in Diazoniumsalzen 5.3.1 SN1-artig a) Phenolverkochung More resources available at www.dmuller.de Inhaltsverzeichnis: Handouts und Zusatzhandouts b) Schiemann Reaktion 5.3.2 Radikalkettenmechanismus in Anwesenheit von Cu-Salzen Sandmeyer Reaktion 5.4 Substitutionsreaktionen via Meißenheimer-analoge Zwischenstufen 5.4.1 Meißenheimer Komplex Sanger Reagenz 5.5 Nucleophile Aromatensubstitution via Arin-Zwischenstufen Dow Phenolsynthese 5.6 Zusammenfassung 6 Nucleophile Substitution am Carboxyl-Kohlenstoff 6.1 Einführung (Übersicht) 6.1.1 Einführung/Übersicht Carbonsäurederivate, Kohlensäurederivate, Ketene, Isocyanat, Nitril, Tetraederzwischenstufe 6.1.2 Ketene 6.1.3 FMO-Betrachtung des Elementarschrittes der Carbonyl / Carboxyl Addition: Stereoelektronische Betrachtungen: Die Bürgi-Dunitz Trajektorie (Einflugschneise) 6.2 Unterschiedliche Mechanismen von SN am Carboxyl-Kohlenstoff 6.2.1 Im basischen Medium 6.2.2 Im neutralen Medium 6.2.3 Grenzfälle 6.2.4 Nachweis der Reversibilität der Carboxyl-Addition bei der alkalischen Esterhydrolyse 6.2.5 Isolierbare / stabile Tetraederintermediate + 6.2.6 Im sauren Medium (H Katalyse bei Angriff schwacher Nucleophile) Säure Katalysatoren (Brønsted sowie Lewis Säuren) 6.2.7 Abgangsgruppenqualität Erläuterung der mangelnden Reaktivität von Amiden bzgl. Nucleophilen mit Hilfe der MO-Theorie: Je größer der Substituent R, desto langsamer wird die nucleophile Substitution sein. 6.2.8 Die Acylierungsreihe (Reaktivität von Acylierungsmittel) (1) Carboxylate (2) Amide (3) Carbonsäureester (4) Phenolester (5) Thioester (6) N-Acylimidazol (7) Acylisoharnstoff (8) Anhydride (9) Säurechlorid (10) N-Acylpyridiniumsalze Säure Katalysatoren (Brønsted sowie Lewis Säuren) Stereoelektronischer Effekt 6.3 Carbonsäureaktivierung Überblick über die einzelnen Acylierungsstufen 6.3.1 In Gleichgewichtsreaktionen + Via H -Katalyse Via Dimethylaminopyridin (DMAP) - Steglich Katalysator 6.3.2 Isolierbare Acyclierungsmittel Darstellung von Säurechloriden Mit Oxalylchlorid oder Thionylchlorid Mit Thionylchlorid unter DMF Katalyse Carbonsäureaktivierung im Neutralen mit Carbonyldiimidazol 6.3.3 In Situ Aktivierung von Carbonsäuren Gemischte Anhydride Aktivierung mit Carbodiimiden (Peptidsynthese) D.C.C. Dicyclohexylcarbodiimid Einsatz von Aktivestern und HOBt zur Vermeidung unerwünschter Umacylierungsreaktionen More resources available at www.dmuller.de Inhaltsverzeichnis: Handouts und Zusatzhandouts 6.4 Acylierung mit Heteroatomnucleophilen Esterhydrolyse im Sauren Esterhydrolyse im Basischen Lactonbildung Yamagyuchi: Darstellung von Makrolactonen Knüpfen von Peptidbindungen (Carbonamidbildung) 6.5 Reaktion von Carboxyl-Derivaten mit Metallhydriden bzw. Metallorganylen 6.5.1 1. Grenzfall (am häufigsten): Überreaktion 6.5.2 2. Grenzfall : Acylierungsmittel hoch reaktiv, Nucleophil besitzt nur moderate Reaktivität 6.5.3 3. Grenzfall : Tetraederintermediat ist stabil Weinreb-Amide 6.5.4 4. Grenzfall : Für spezielle Nucleophile Darstellung eines HWE-Reagenzes 7. Carboxylverbindungen und Nitrile und deren gegenseitige Umwandlung 7.1 Darstellung von Nitrilen- Dehydratisierungsreagenzien 7.1.1 Im Labor a) Phosphorpentoxid (P4O10) Dehydratisierung mit POCl3, PCl5 oder SOCl2 b) Alternativen Trifluoressigsäureanhydrid, Trifluormethansulfonsäureanhydrid c) Harnstoff als Stickstoffquelle 7.1.2 In der Industrie: Technische Adiponitrilsynthese Nylon 6.6, Acetoncyanhydrin, Methacrylsäure, Methacrylsäuremethylester, Plexiglas 7.2 Umwandlungen von Nitrilen in Carboxylderivate (Reaktion mit Het-H) 7.2.1 Hydrolyse von Nitrilen (H2O als Nucleophil) a) Im Sauren Cyanhydrinhydrolyse im Sauren Kiliani Fischer Methode (Homologisierung von Aldosen - Zuckerchemie) b) Im Basischen unter Zusatz von Wasserstoffperoxid 7.2.2 ROH als Nucleophil Alkoholyse von Nitrilen: Pinner Reaktion Ritter Reaktion 8 Kohlensäurederivate und Heterocummulene Kohlenstoffdioxid, Kohlenoxysulfid, Kohlenstoffdisulfidm Carbodiimid, Isocyansäure, Isocyanat, Keten, Isothiocyansäure, Isothiocyanat 8.1 Darstellung von Heterocummulenen aus Kohlensäurederivaten durch Kondensation (Abspaltung von H2O, NH3 etc.) a) Zerfall von Hydrogencarbonat b) Zerfall von Kohlensäurealkylestern c) Zerfall von Carbidsäure d) Zerfall der BOC-Schutzgruppe im Sauren e) Zerfall von Xanthogenaten bei der Pyrrolyse (siehe Tschugajew Reaktion) f) Darstellung von Kunstseide ("Xanthogenatseide") 8.2 Organische Heterocummulene 8.2.1 Darstellung von Isocyanaten aus Amin und Phosgen Polyurethane (Polycarbamidäureester) 8.22 Isothiocyanate 8.2.3 Technische Harnstoffsynthese 8.2.4 Darstellung von D.C.C. Aktivierung von Carbonsäuren mit DCC 8.3 Heterocummulene + HetH 8.3.1 Im Neutralen More resources available at www.dmuller.de Inhaltsverzeichnis: Handouts und Zusatzhandouts 8.3.2 8.3.3 Beispiel: Edmann Abbau Im Basischen Im Sauren Polyurethan-Schaumstoffbildung 8.4 8.4.1 Ketene Arndt Eistert Homologisierung von Carbonsäuren 9 Addition von Heteronucleophilen an die Carbonylgruppe 9.1 Allgemein 9.1.1 Substituenteneffekte am Beispiel der Hydratbildung a) Sterischer Anspruch b) Elektronische Effekte 9.2 Halbacetalbildung 9.3 Acetalbildung Acetalbildung mit Trimethylorthoformiat (Ein Orthoester) Leichte Acetalbildung mit 1,2 und 1,3 Diolen Spontane Spiroacetalbildung 9.4 S,S Acetale 9.5 Amine (Het-H) als Nucleophile a) Aminalbildung b) Iminbildung, Beckmann Umlagerung c) Enaminbildung 10 Addition "starker Carbonylgruppe Nucleophile" H- 10.1 Allgemein 10.2 Reaktivität Aldehyd vs. Keton 10.3 Diastereoselektivität 10.3.1 Allgemein Topizitäten, Homotop, Enantiotop, Diastereotop 10.3.2 Cyclische Ketone Reduktion von Norbornon Reduktion von Cyclohexanon mit großen und kleinen Nucleophilen Sterische Effekte Torsions Effekte 10.3.3 Acyclische Ketone/Aldehyde Stereoelektronischer Hintergrund Felkin-Anh vs. Chelat Kontrolle Probleme des Felkin-Anh Models-Chelat Produkt Faktoren welche das Felkin Anh-Produkt bevorzugen: Faktoren die das Chelat-Produkt begünstigen: 10.4 Enantioselektive H Addition an C=O Reduktion von C=O mit AlpineBorane 10.5 Metallorganyle: Herstellung und Eigenschaften 10.5.1 Lithiumorganyle a) Direktysnthese b) Reduktion mit Radikalanionen c) Halogen-Metallaustausch Verhinderung der Wurtz-Kupplung durch Verwendung von t-BuLi Aufbrechen der wenig reaktiven Oligomere (Tetramere für MeLi/nDonor Liganden: TMEDA, HMPT, DMPU 10.5.2 Grignard Verbindungen RMgX (bzw. R2Mg) a) Direktsynthese More resources available at www.dmuller.de bzw. MR an die - Inhaltsverzeichnis: Handouts und Zusatzhandouts b) Transmetallierung Schlenk Gleichgewicht 10.6 Addition von RM an C=O 10.6.1 Chemoselektivität a) Grignard Reduktion bei sterisch stark gehinderten Ketonen b) Grignard als Base 10.6.2 Diastereoselektivität: Analog wie bei Hydrid-Reagenzien 10.7 1,4-Addition mit Cupfer-Organylen Exkurs: HSAB Prinzip, FMO-Betrachtung a) Enolat-Alkylierung b) 1,2- vs. 1,4-Addition an -ungesättigten Carbonylverbindungen c) SN2 vs. E2 d) Ambidente Nucleophile: Beispiele: SCN und NO2 11 Umsetzung von Het-Atom-stabilisierten Nucleophilen (Yliden) an C=O Bindung 11.1 Darstellung und Bindungsverhältnisse von Yliden 11.1.1 Allgemeines 11.1.2 Acidität Aciditäten verschiedener Ylide Ursache für Acidität (FMO-Betrachtung) 11.2 Olefinierungen 11.2.1 Wittig-Olefinierung (Nobelpreis 1979) Darstellung vonCarotin 11.3 Horner-Wadsworth-Emmons (HWE) Olefinierung Acidität von Phosphonaten Vorstufe: Michealis-Arbusow Reaktion (Z)-Selektive Olefinierung: Die Still Variante der HWE-Olefinierung 11.4 Julia Lythgoe Olefinierung Die Einstufige Variante der Julia Olefinierung: Die Julia Kociensky Olefinierung 12 Enole / Enamin (Neutrales bzw. saures Medium) 12.1 Keto / Enol Gleichgewicht 12.1.1 Keto/Enol/Enolat Gleichgewicht (pH-Abhängig), Definition des pKe Keto/Enol Tautomerie Razemisierung aufgrund von Enolisierung Stabilstes Enol überhaupt: Phenol 12.1.2 -EWG-substituierte-Cabonyle 12.1.3 Enolgehalt von Carbonsäureamiden 12.1.4 Säurechloride können erhebliche Enolanteile ausbilden Epimerisierungsgefahr 12.1.5 Enamine 12.2 C-Het Bindungsknüpfung via Enole 12.2.1 Enoltitration von Acetessigester 12.2.2 Halogenisierung in der Position 12.2.3 Hell-Vollhardt-Zelinsky 12.3 C/C Bindungsknüpfung via Enole/Enamine 12.3.1 Alkylierung von Enaminen a) Mit Allylbromid b) Weitere C-Elektrophile 12.3.2 Aldolkondensation Aldolkondensation im Sauren Gekreuzte Aldolkondensationen via Enamine 12.3.3 Via Enamine (gekreuzte Aldolkondensation) More resources available at www.dmuller.de Inhaltsverzeichnis: Handouts und Zusatzhandouts 12.3.4 Knoevenagel-Kondensation im Sauren Die ursprüngliche Knoevenagel Reaktion 12.3.5 Mannich Reaktion (-Aminomethylierung eines enolisierbaren Ketons) 12.3.6 Anwendung in der Alkaloid Synthese (biomimetrische Synthese) Synthese von Tropinon (Robinson) 12.3.7 Robinson Annelierung 13 Enolatchemie (Basisches Medium) 13.1 C-H Acidität 13.2 Enolatbildung 13.2.1 Stereoelektronik der Deprotonierung 13.2.2 Kinetische vs. thermodynamische Kontrolle bei der Enolatbildung 13.2.3 Weitere Methoden der Enolat-Erzeugung Konjugierte Addition an Enonen führt zu regiospezifischen Enolaten b) Für ungehinderte Enone: L-Selektrid b) Konjugierte Addition mit R2CuLi:Unter C-C Bindungsknüpfung: 1,4 Addition von Gilman Cupraten c) Aus Silylenolethern mit MeLi 13.3 Ambidoselektivität von Enolate C-Alkylierung, O-Alkylierung Arten von Elektrophile (Einteilung nach dem HSAB-Prinzip) 1) Harte Elektrophile (Werden nucleophil vom Carbonylsauertoff angegriffen) a) Proton als Elektrophil b) Silylchloride als Elektrophile 2) Weiche Elektrophile (Werden nuceleophil vom Enolatkohlenstoff angegriffen) a) Halogene: Haloform Reaktion am Beispiel von Iodoform: b) Ph-Se-Se-Ph c) Darstellung vonDiazocarbonylverbindungen und Folgereaktionen zu Cyclopropanderivaten d) SN2-fähige C-Elektrophile d) Aldolkondensation e) Michealaddition f) Claisen Kondensation 13.4 Enolat-Alkylierung (Stabile Enolate) 13.4.1 Alkylierung von Acetessigster 13.4.2 Ketonspaltung als Folgereaktion zur Darstellung von prim./sek. Alkylketonen 13.4.3 Säurespaltung (Synthese höherer Carbonsäuren) 13.5 Aldoladdition 13.6 Aldolkondensation im Basischen Aldol versus Eliminierungsprodukt Gekreuzte Aldolkondensation Erfolgreiche gekreuzte Aldolreaktionen 13.7 Knoevenagel-Kondensation (Im Alkalischen) 13.8 Claisen Kondensation- Acylierung von Esterenolaten Dieckmann Reaktion: Intramolekulare Claisen Kondensation 13.9 Micheal Addition (Im Alkalischen) 13.10 Robinson Annelierung im Alkalischen: Domino Micheal-Aldol-Kondensation 14 Oxidation / Reduktion 14.1 Oxidation von Elefinen durch Funktionaliserung von C=C Synthese von Epoxiden mit m-CPBA Halogenhydroxylierung von Olefinen mit z.B. NBS/H2O Sharpless Epoxidierung Zweistufige Spaltung von Doppelbindungen durch Dihydroxylierung und anschließende Glykolspaltung 14.2 Oxidation in Reihe Alkohol - Aldehyd -Carbonsäure 14.2.1 Übersichtstabelle More resources available at www.dmuller.de Inhaltsverzeichnis: Handouts und Zusatzhandouts 14.2.2 Chrom-Oxidation 14.2.3 SWERN-Oxidation 14.2.4 Oxidation von Heteroatomen 14.3 Reduktion mit komplexen Hydriden "H " 14.3.1 SN2-artige Reduktionen mit LiBHEt3 "Super Hydrid" - Defunktionalisierung 14.3.2 Übesichtstabelle Chemoselektive Reduktion Funktionelle-Gruppen Umwandlung (FGI = functional group interconversion) 14.4 Metallreduktionen 14.4.1 Pinakolkupplung 14.4.2 Bouveault Blanc Reduktion und Acyloinkondensation 14.4.3 Birch Reduktion Von Aromaten Von Alkinen 14.5 Hydrierungen mit Wasserstoff 15 Umlagerungsreaktionen 15.1 Wagner–Meerwein Umlagerungen Abbau von Ringspannung kann zu Umlagerungen führen 15.2 Die Pinakol Umlagerung, Semipinakol Umlagerungen 15.3 Wanderungen zum Sauerstoff: Die Baeyer–Villiger Reaktion 15.4 Wolff-Umlagerung (Arndt-Eistert) - Wiederholung Handout 8 15.5 Beckmann Umlagerung 15.6 Hock Phenolsynthese Zusatzhandout 1: Stereochemie Enantiomere und Chiralität Weitere Arten von Chiralität Asymmetrische Heteroatome Chirale Komplexe Allen Abkömmlinge Atropisomerie Planar chirale Verbindungen Enantiomeren und Diastereomeren Meso Verbindungen Zusatzhandout 2: Postulate und Prinzipien Hammond Postulat Prinzip von Bell-Evans-Polanyi Curtin Hammet Prinzip Product development control Reaktivitäts / Selektivitäts Prinzip Zusatzhandout 3: MO und FMO Theorie MO-Theorie Hückel Molecular Orbital Theorie Frost-Musolin Kreis Möbius Molecular Orbital Theorie More resources available at www.dmuller.de