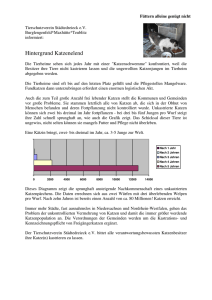
Neue Arzneimittel für Kleintiere 2004/2005*
Werbung

Neue Arzneimittel für Kleintiere 2004/2005* I. U. Emmerich, F. R. Ungemach Aus dem Institut für Pharmakologie, Pharmazie und Toxikologie (Leiter: Prof. Dr. F. R. Ungemach), Veterinärmedizinische Fakultät der Universität Leipzig Einleitung Mit diesemArtikel soll wie bereits in vorangegangenen Jahren ein Überblick über interessante Neuzulassungen auf dem Arzneimittelmarkt für Kleintiere gegeben werden (2, 4, 16–18). Für die Auswahl der Präparate waren folgende Kriterien entscheidend: 1. Präparate mit Wirkstoffen, die erstmals für die Veterinärmedizin zugelassen wurden: a) Präparate mit Wirkstoffen, die bislang ausschließlich in humanmedizinischen Präparaten zugelassen waren – Felimazole (Thiamazol, Zulassung für Katzen) – Itrafungol (Itraconazol, Zulassung für Katzen) b) Präparate mit Wirkstoffen, die bislang weder in Human- noch in Tierarzneimitteln zugelassen waren: – Previcox 57 mg bzw. 227,57 mg Kautabletten für Hunde (Firocoxib, Zulassung für Hunde) – Profender Lösung zum Auftropfen für Katzen (Emodepsid in Kombination mit Praziquantel, Zulassung für Katzen) – Vetoryl 30 mg/60 mg Hartkapsel für Hunde (Trilostan, Zulassung für Hunde) 2. Präparate mit Wirkstoffen, die für weitere Tierarten zugelassen wurden: – Advocate (Moxidectin in Kombination mit Imidacloprid, Zulassung für Hunde und Katzen) – Baytril – Das Original 2,5%-Injektionslösung (Enrofloxacin, Zulassung für Kaninchen)1 – Caninsulin (Insulin, Zulassung für Katzen) – Rimadyl Injektionslösung (Carprofen, Zulassung für Katzen) – Romidys 1 mg/ml (Romifidin, Zulassung für Hunde und Katzen) 3. Präparate, die aufgrund neuer Darreichungsform, erweiterter Indikation oder anderer Kriterien interessant sind: – Panacur PetPaste (Fenbendazol, neue Darreichungsform: Paste für Hunde und Katzen) – Advantix Spot-on Lösung für Hunde (Imidacloprid und Permethrin, neue Kombination bekannter Wirkstoffe für Hunde) * 1 Dieser Artikel steht unter www.tieraerztliche-praxis.de zum kostenlosen Download zur Verfügung. Da dieses Präparat für Lebensmittel liefernde Kaninchen zugelassen wurde, wird es im Artikel über neu zugelassene Arzneimittel in der Ausgabe Groß-/ Nutztiere der „Tierärztlichen Praxis“ besprochen. Dieser Beitrag steht ebenfalls unter www.tieraerztliche-praxis.de zum kostenlosen Download zur Verfügung. – Orisel-uno (Lindan, Wiederzulassung eines bewährten Wirkstoffes für Katzen) – Prednisolon-50 mg (Prednisolon, neue Darreichungsform [snap tab] und neue Wirkstärke für Hunde) – Ridzol 10% Bt (Ronidazol, Wiederzulassung eines bewährten Wirkstoffes für Brieftauben) – Vasotop 0,625 mg und Vasotop 10 mg (Ramipril, neue Wirkstärke für Hunde) 4. Neu zugelassene humanmedizinische Präparate. Wirkstoffe, die nicht für Tiere zugelassen sind, dürfen nur im Therapienotstand für Kleintiere umgewidmet werden. Aufgrund fehlender Erfahrung in der Veterinärmedizin sind jedoch sowohl toxische als auch therapeutische Effekte nur schwer einschätzbar (18). Da aber Entwicklungen auf dem Humanarzneimittelmarkt mittelfristig Eingang in die Veterinärmedizin finden können, sollen auch interessante neue Humanarzneimittel vorgestellt werden: – Antidiabetika: Insulindetemir (Levimir), Insulinglulisin (Apidra) – Antidiarrhoika: Racecadotril (Tiorfan) – Antiemetikum: Palonosetron (Aloxi) – Antiepileptikum: Zonisamid (Zonegran), Pregabalin (Lyrica) – Antikoagulanzien: Bivalirudin (Angiox), Melagatran (Melagatran), Ximelagatran (Exanata) – Dermatika (Antibiotika): Nadifloxacin (Nadixa) – Diuretika: Eplerenon (Inspra) – Hormone und hormonell wirksame Pharmaka: Lanreotid (Somatuline Autogel) – NichtsteroidaleAntiphologistika: Etoricoxib (Arcoxia) – Ophthalmika (Kortikosteroid): Loteprednoletabonat (Lotemax) – Osteroporosemittel (Vitamin-D-Analogon): Paricalcitol (Zemplar) – Urologika: Duloxetin (Yentreve), Solifenacin (Vesikur) Präparate mit Erstzulassung in der Tiermedizin Felimazole® (Thiamazol, Zulassung für Katzen) Das seit längerem in der Humanmedizin zugelassene Thyreostatikum Thiamazol wurde jetzt für Katzen zur Stabilisierung der Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 231 ALLGEMEINES © 2006 Schattauer GmbH Tierärztl Prax 2006; 34 (K): 231-44 ALLGEMEINES 232 Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach Hyperthyreose vor der chirurgischen Schilddrüsenentfernung und zur Langzeitbehandlung der Hyperthyreose zugelassen. Damit ist eine Umwidmung humanmedizinischer Thiamazol-Tabletten nicht mehr möglich, auch wenn damit für den Tierhalter die Arzneimittelkosten pro Jahr auf etwa das Doppelte steigen. Das Thioharnstoffderivat Thiamazol gehört zur Gruppe der Thioimidazole, die ca. zehnmal stärker wirksam sind als Thiouracile wie Propylthiouracil. Thiamazol ist ein Iodisationshemmer, der die Iodierung von Thyreoglobin und die T3- und T4-Synthese durch Hemmung der Iodidbindung an die Schilddrüsenperoxidase blockiert (21). Nach oraler Applikation von 5 mg Thiamazol werden bei Katzen maximale Blutplasmaspiegel von 1,6–1,9 µg/ml nach 1–2 Stunden erreicht. Die orale Bioverfügbarkeit beträgt bei Katzen über 75%, die Eliminationshalbwertszeit 4,5–5,0 Stunden. Thiamazol darf nicht bei Katzen angewendet werden, die an einer systemischen Krankheit (z. B. Erkrankungen der Leber, Diabetes mellitus) leiden, die Anzeichen einer Autoimmunkrankheit zeigen, bei denen die Anzahl weißer Blutkörperchen verändert ist oder bei denen Koagulopathien (v. a. Thrombozytopenie) vorliegen. Des Weiteren ist eine Anwendung bei trächtigen oder laktierenden Tieren und bei Überempfindlichkeit gegen Thiamazol oder Polyethylenglycol (Macrogol) kontraindiziert (7). Nebenwirkungen treten vor allem bei der Langzeitbehandlung mit einer Inzidenz von ca. 20% auf (21). Bei einer Tagesdosis von 10–15 mg/Tier wurden Erbrechen, Appetitmangel/Appetitlosigkeit, Lethargie, Pruritus, Exkoriationen an Kopf und Hals, hämorrhagische Diathese und Gelbsucht einhergehend mit Hepatopathie und hämatologischen Anomalien beobachtet, die nach Absetzen innerhalb von 7 bis 45 Tagen reversibel waren (7). In Verträglichkeitsstudien mit Dosen von bis zu 30 mg/Tier/Tag bei jungen, gesunden Katzen traten hämatologische und klinischchemische Veränderungen wie reduzierte Kalium- und Phosphorspiegel im Serum, erhöhte Magnesium- und Kreatininspiegel sowie antinukleäre Antikörper und bei einigen Katzen eine erhebliche Verschlechterung des klinischen Bildes auf (7). Aufgrund des Risikos einer Leukozytopenie oder hämolytischen Anämie muss während der Behandlung der hämatologische Status überprüft werden. Auch bei plötzlichem Unwohlsein während der Behandlung, insbesondere bei Auftreten von Fieber, sollte eine hämatologische und biochemische Blutuntersuchung durchgeführt werden. Besteht eine Neutropenie von unter 2,5 × 109/l, sollte neben einer unterstützenden Therapie das Tier mit bakteriziden Antiinfektiva abgeschirmt werden. Bei Auftreten immunologischer Nebenwirkungen wie Anämie, Thrombozytopenie und antinukleäre Antikörper sollte die Behandlung sofort abgebrochen und nach einer angemessen langen Erholungsphase eine alternative Therapie in Betracht gezogen werden. Bei Katzen mit Nierenfunktionsstörungen sollte die Anwendung nur nach sorgfältiger Nutzen-Risiko-Analyse erfolgen, da Thiamazol die glomeruläre Filtrationsrate reduzieren kann. In Kanzerogenitätsstudien zeigten Labortiere unter Thiamazol ein erhöhtes Risiko für eine Neoplasie der Schilddrüse. In Studien zur Embryo- und Reproduktionstoxizität an Labortieren hat sich Thiamazol als teratogen und embryotoxisch an Ratten und Mäusen erwiesen. Daher darf Felimazole nicht bei trächtigen oder laktierenden Katzen angewendet werden. Außerdem sollten Frauen im gebärfähigen Alter Handschuhe tragen, wenn sie die Katzenstreu der behandelten Tiere entsorgen. Gleichzeitig verabreichtes Phenobarbital setzt die Wirksamkeit von Thiamazol herab. Des Weiteren vermindert Thiamazol die hepatische Oxidation von Benzimidazol-Anthelminthika, was bei gleichzeitiger Gabe zu höheren Wirkstoffspiegeln führen kann. Im Zusammenhang mit Impfungen sollte beachtet werden, dass Thiamazol immunmodulatorisch wirkt. Die Dosierung beträgt für die Stabilisierung der Hyperthyreose vor der operativen Entfernung der Schilddrüse initial zweimal täglich 5 mg Thiamazol. Für die Langzeitbehandlung der Hyperthyreose werden lebenslang einmal täglich 5 mg verabreicht, wobei nach ca. 3 Wochen im Allgemeinen eine euthyreote Stoffwechsellage erreicht wird und eine Dosiskontrolle mittels Gesamt-T4 im Serum vorzunehmen ist. Bei erforderlicher Dosiserhöhung ist um 5 mg zu erhöhen, da die Tabletten nicht zerteilt werden dürfen. Die Verabreichung erfolgt dann morgens und abends. Die verabreichte Dosis darf 20 mg/Tag nicht überschreiten. Benötigt eine Katze eine geringere Dosis als 5 mg/Tag, sollte eine alternative Behandlung angedacht werden. Hämatologische und biochemische Laboruntersuchungen sowie die Bestimmung des Gesamt-T4 im Serum sind vor der Behandlung, 3, 6, 10 und 20 Wochen nach Thereapiebeginn sowie danach alle 3 Monate durchzuführen und die Dosis ist dem Bedarf anzupassen (7). Felimazole wird als 5-mg-Tablette in Dosen zu 100 Stück von der Firma Janssen Animal Health vertrieben.2 Itrafungol® (Itraconazol, Zulassung für Katzen) Das systemische Triazolantimykotikum aus der Gruppe der Imidazole, seit längerem in der Humanmedizin zugelassen, erhielt die Zulassung für Katzen zur Therapie von Dermatophytosen verursacht durch Microsporum canis. Damit ist in Deutschland neben Miconazol, das allerdings nur als Kombinationspräparat mit Polymyxin B und Prednisolon zur lokalen Anwendung verfügbar ist, ein weiteres Imidazol für Katzen zugelassen. Itraconazol hemmt wie andere Imidazole die De-novo-Synthese von Ergosterol, einem Membranlipid der Pilze, was zu Membranschäden der Zellen und zum Zelltod führt. Der Wirktyp ist fungistatisch, allerdings wird bei hohen Konzentrationen auch eine fungizide Wirkung erreicht. Das breite Wirkspektrum umfasst Dermatophyten (Trichophyton spp., Microsporum spp.), He2 Anmerkung: Die Herstellung und das Inverkehrbringen von thyreostatikahaltigen Tierarzneimitteln für alle Tierarten widerspricht der EU-Richtlinie 2003/71/EG und nationalen arzneimittelrechtlichen Vorschriften in der Verordnung über das Verbot der Verwendung bestimmter Stoffe bei der Herstellung von Arzneimitteln zur Anwendung bei Tieren (zuletzt geändert am 22. Oktober 2004). Dennoch wurde die Zulassung für das Präparat Felimazole erteilt und seine Vermarktung wird bis zur Änderung der entgegenstehenden europäischen und nationalen Rechtsvorschriften toleriert. Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. fen (Candida spp., Malassezia spp.) und verschiedene dimorphe Pilze, Zygomyceten und Eumyceten (Aspergillus spp.). Nach oraler Gabe von 5 mg/kg KM werden bei Katzen maximale Blutplasmaspiegel von 0,52 mg/l nach 2 Stunden erreicht. Die AUC0–24 h beträgt 5 mg⋅h/l, die Halbwertszeit 12 Stunden. Nach wiederholter Verabreichung von 5 mg/kg KM/Tag über eine Woche kumuliert Itraconazol, sodass sich die maximale Plasmakonzentration mehr als verdoppelt und sich die AUC0–24 h und die Halbwertszeit verdreifachen. Innerhalb einer 7-tägigen Therapiepause wird Itraconazol fast vollständig aus dem Plasma eliminiert. Itraconazol verteilt sich weit im Organismus und reichert sich in verschiedenen Geweben und in der Haut an (26). Seine Konzentration im Katzenhaar steigt während des Behandlungszyklus durchschnittlich auf 3,0 µg/g an und verringert sich nach Behandlungsende langsam auf 1,5 µg/g innerhalb von 14 Tagen. Die Konzentration des ebenfalls antimykotisch wirksamen Metaboliten Hydroxy-Itraconazol ist im Tierhaar vernachlässigbar. Itraconazol darf nicht bei Katzen mit eingeschränkter Leberoder Nierenfunktion und bei Tieren, die allergisch auf den Wirkstoff reagieren, anwendet werden. Als Nebenwirkungen wurden bei Katzen Erbrechen, Durchfall, Appetitlosigkeit, Speichelfluss, reduziertesAllgemeinbefinden,Apathie und ein vorübergehender Aktivitätsanstieg der Leberenzyme, was in sehr seltenen Fällen mit einem Ikterus verbunden war, beobachtet. Da bei Menschen Itraconazol aufgrund negativ inotroper Effekte mit Herzversagen in Verbindung gebracht wurde, sollten Katzen, die an Herzkrankheiten leiden, engmaschig überwacht werden. Außerdem sollten Kalziumantagonisten aufgrund ihrer additiv negativ inotropen Wirkung nicht zusammen mit Itraconazol verabreicht werden. Itraconazol darf nicht während der Trächtigkeit oder Laktation angewendet werden, da in Studien zur Embryo- und Fetotoxizität bei Labortieren Fehlbildungen und Resorption von Feten beobachtet wurden. Aufgrund der inhibierenden Wirkungen auf Cytochrom P 450 3A4 (CYP 3A4) und des P-Glykoprotein und Effluxtransporters erhöht Itraconazol beim Menschen die Plasmakonzentration verschiedener oral verabreichter Arzneimittel (z. B. Midazolam, Ciclosporin, Digoxin, Chloramphenicol, Makrolidantibiotika [z. B. Erythromycin], Ivermectin, Methylprednisolon und Antidiabetika). Andere Arzneistoffe wie Rifampicin, Phenytoin, Phenobarbital, die Cytochrom-P-450-Enzyme induzieren, können die Wirksamkeit von Itraconazol durch Erhöhung der Metabolisierungsrate verringern. Die Resorption von Itraconazol wird durch Antazida, H2-Antihistaminika (z. B. Cimetidin und Ranitidin) und Hemmstoffe der Protonenpumpe (z. B. Omeprazol) beträchtlich beeinflusst, da es, um maximal resorbiert zu werden, ein saures Milieu benötigt. Da bezüglich der beim Menschen beobachteten Wechselwirkungen keine Untersuchungen an der Zieltierspezies vorliegen, sollte die gleichzeitige Anwendung von Itraconazol mit diesen Arzneistoffen vermieden werden. Nach fünffacher Überdosierung über 6 Wochen wurden im Gegensatz zur dreifachen Überdosierung struppiges Fell, verminderte Nahrungsaufnahme und Körpergewichtsverlust als reversible klinische Nebenwirkungen sowie ein leichtes Ansteigen der segmentkernigen neutrophilen Granulozyten und eine leichteAbnah- me der Lymphozyten beobachtet. Veränderungen biochemischer Parameter (erhöhte Werte von ALT, AP, Bilirubin und AST) traten sowohl nach drei- als auch bei fünffacher Überdosierung über 6 Wochen auf (6, 8, 26). Die Dosierung beträgt 5 mg Itraconazol/kg KM einmal täglich oral in drei alternierenden Perioden von jeweils sieben aufeinander folgenden Tagen, wobei zwischen jeder Behandlungsperiode sieben behandlungsfreie Tage liegen. Itraconazol sollte vorzugsweise zwischen den Mahlzeiten verabreicht werden. Liegt innerhalb von 4 Wochen nach Behandlungsende eine positive Kultur vor, sollte die Behandlung wiederholt werden. Die Behandlung einer Dermatophytose sollte neben der Behandlung der infizierten Tiere auch die Desinfektion der Umgebung mit geeigneten antimykotischen Produkten umfassen, da M.-canis-Sporen bis zu 18 Monate in der Umwelt überleben können. Itrafungol wird als Lösung zu Eingeben in Flaschen zu 52 ml mit Dosierapplikator von der Firma Janssen Animal Health vertrieben. Previcox® Kautabletten für Hunde (Firocoxib, Zulassung für Hunde) Firocoxib ist der erste selektive Cyclooxygenase-2-(COX-2-) Hemmer aus der Gruppe der nichtsteroidalen Antiphlogistika für Tiere. Es wurde bei Hunden zur Linderung von Schmerzen und Entzündungen im Zusammenhang mit Osteoarthritis zugelassen. Firocoxib hemmt wie alle Coxibe selektiv die COX-2-vermittelte Prostaglandinsynthese im Entzündungsgebiet, sodass bei therapeutischen Dosen die konstitutive COX 1 nicht gehemmt wird (30). Die zur 50%igen Hemmung der COX-2-Enzyme erforderliche Firocoxib-Konzentration (d. h. die IC50) beträgt im Vollblut von Hunden ca. 0,16 µmol/l, die der COX 1 ca. 56 µmol/l. Damit wirkt Firocoxib 380fach selektiver auf die COX 2 im Vergleich zur COX 1 bzw. der Quotient der IC50 aus COX 2 und COX 1 beträgt 0,0028, womit er dem von Celecoxib mit 0,0025 vergleichbar ist (9). Im Vollblut von Katzen wurde eine 58fache Selektivität für COX 2 berichtet. Durch die in therapeutischen Dosen selektive COX-2-Hemmung bei nahezu unbeeinflusster Aktivität der konstitutiven, für viele physiologischen Funktionen (z. B. Schutz der Magenwand) wichtigen COX 1 besitzen Coxibe ein wesentlich geringeres ulzerogenes Potenzial als nichtselektive COX-Hemmstoffe. Zu beachten ist allerdings, dass die COX 2 auch als konstitutives Enzym z. B. in Niere, ZNS oder Uterus, für Organfunktionen sowie bei der Heilung von Magen-Darm-Ulzera von Bedeutung ist. Dadurch kann es infolge einer COX-Hemmung zur Beeinträchtigung der Nierenfunktion und verzögerter Abheilung von Magen-Darm-Ulzera kommen (30). Firocoxib wird von Hunden nach oraler Gabe von 5 mg/kg KM rasch resorbiert. Maximale Blutplasmaspiegel von 0,52 µg/ ml liegen nach ca. 1 Stunde vor. Die AUC0–24h beträgt 4,63 µg⋅h/ml und die Eliminationshalbwertszeit 7,6 Stunden. Die orale Bioverfügbarkeit ist mit 37% relativ gering. Resorbiertes Fi- Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 233 ALLGEMEINES Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach ALLGEMEINES 234 Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach rocoxib wird stark, zu etwa 96% an Plasmaproteine gebunden. Ein Fließgleichgewicht stellt sich nach wiederholter oraler Verabreichung bis zur dritten Tagesdosis ein. Firocoxib wird überwiegend durch Desalkylierung und Glukuronidierung in der Leber metabolisiert und hauptsächlich über die Galle mit potenziellem enterohepatischem Kreislauf ausgeschieden (9). Coxibe können die Blut-Hirn-Schranke überwinden und im Rückenmark die COX-2-abhängige Prostaglandinsynthese unterdrücken. Firocoxib darf nicht bei trächtigen oder laktierenden Hündinnen, beiTieren imAlter unter 10 Wochen oder mit weniger als 3 kg Körpergewicht, bei Tieren mit gastrointestinalen Blutungen, Veränderungen des roten und weißen Blutbildes oder Blutgerinnungsstörungen und gleichzeitig mit Kortikosteroiden oder anderen NSAIDs angewendet werden. Durch die selektive COX2-Hemmung ist die Rate gastrointestinaler Nebenwirkungen niedrig. Gelegentlich ruft Firocoxib Erbrechen und Durchfall hervor. Kardiovaskuläre Nebenwirkungen, wie sie beim Menschen beobachtet wurden und zur Rücknahme von Rofecoxib (Vioxx, H.M.) geführt haben, sind bei Tieren sehr unwahrscheinlich. Beim Menschen entstehen die kardiovaskulären Nebenwirkungen dadurch, dass die Hemmung der COX 2 zu einer verminderten Prostacyclin-Ausschüttung führt. Der Prostacyclin-Gegenspieler Thromboxan kann dann verstärkt proaggregatorisch wirken und infolge der erhöhten Gerinnungsneigung mit entsprechenden Risikofaktoren Ereignisse wie Herzinfarkt und Schlaganfall auslösen. Aufgrund erhöhter renaler Toxizität darf Firocoxib nicht bei dehydrierten, hypovolämischen oder hypotensiven Tieren oder gleichzeitig mit potenziell nephrotoxischen Arzneimitteln (z. B. Aminoglykosid-Antibiotika) angewendet werden. Ebenso darf es nicht zusammen mit anderen nichtsteroidalen Antiphlogistika oder Glukokortikoiden verabreicht werden. Bei sehr jungen Tieren oder Tieren mit beeintächtigter Nieren-, Herz- oder Leberfunktion ist Firocoxib nur nach Nutzen-Risiko-Analyse unter sorgfältiger tierärztlicher Überwachung anzuwenden. Bei wiederholt auftretendem Durchfall, okkultem Blut in den Fäzes, plötzlichem Gewichtsverlust, Appetitlosigkeit, Lethargie oder Verschlechterung von biochemischen Nieren- oder Leberwerten sollte die Therapie abgebrochen werden. Unter Firocoxib wurden bei Kaninchen materno- und fetotoxische Wirkungen in nahezu therapeutischen Dosen beobachtet. Deshalb ist die Anwendung wegen fehlender Untersuchungen an der Zieltierart bei trächtigen Hündinnen kontraindiziert (9). Bei 5facher Überdosierung über eine Behandlungsdauer von 3 Monaten wurden bei Hunden, die zu Therapiebeginn 10 Wochen alt waren, Gewichtsabnahme und geringer Appetit, Veränderungen an Leber (Lipidakkumulation), Gehirn (Vakuolisierung ohne neurotoxische Symptome) und Duodenum (Geschwüre) bzw. Tod festgestellt. Bei 3facher Überdosierung über 6 Monate kam es zu ähnlichen klinischen Symptomen von geringerer Schwere, allerdings traten keine Duodenalgeschwüre auf. Die Dosierung beträgt 5 mg/kg KM einmal täglich oral unabhängig von der Mahlzeit. Die Therapiedauer ist abhängig von Behandlungserfolg. Langfristige Behandlungen sollten nur unter regelmäßiger tierärztlicher Kontrolle erfolgen. Previcox wird als Kautablette zum Eingeben in zwei Stärken (57 mg und 227 mg) in Packungen mit einem oder drei Blistern zu je 10 Tabletten von der Firma Merial vertrieben. Profender® Lösung zum Auftropfen für Katzen (Emodepsid Zulassung für Katzen) Das gegen Askariden und Hakenwürmer wirksame Anthelminthikum Emodepsid aus der Gruppe der Depsipeptide, das erstmals und nur fürTiere in Deutschland zugelassen wurde, ist in Profender Lösung mit dem Zestozidum Praziquantel kombiniert zur Therapie parasitärer Mischinfektion verursacht durch Nematoden wie Toxocara cati,Toxascaris leonina,Ancylostoma tubaeforme und Zestoden wie Dipylidium caninum,Taenia taeniaeformis und Echinococcus multilocularis. Damit steht erstmals ein Präparat zur gleichzeitigen Bekämpfung von Nematoden und Zestoden als Spot-on-Formulierung zur Verfügung, wobei allerdings die Erfordernis solcher Kombinationen aus helminthologischer Sicht zu hinterfragen ist (29). Emodepsid ist ein halbsynthetisches Derivat eines Fermentationsprodukts des Pilzes Mycelia sterilia, der zur Mikroflora auf den Blättern der in Japan vorkommenden Pflanze Camelia japonica gehört. Emodepsid stimuliert präsynaptische Secretinrezeptoren in den neuromuskulären Synapsen der Pharynxregion und der somatischen Muskulatur, wodurch es über eine Freisetzung inhibitorischer, postsynaptisch wirkender Neurotransmitter zur Paralyse und zum Tod der Helminthen kommt. Nach topischer Verabreichung von 3 mg/kg KM wurden maximale Serumkonzentrationen von 32 pg/l nach ca. 3 Tagen erreicht, wobei die Halbwertszeit ca. 9 Tage betrug (10). Profender darf nicht bei Katzen angewendet werden, die jünger als 8 Wochen oder leichter als 0,5 kg sind. Da die oral aufgenommene Profender Lösung bei Katzen Salivation und Erbrechen verursachen kann, ist darauf zu achten, dass weder behandelte noch andere Katzen im gleichen Haushalt die Applikationsstelle ablecken können, solange diese noch nass ist. Behandelte Tiere sollten nicht gebadet werden, bevor die Applikationsstelle abgetrocknet ist, um die Wirksamkeit nicht zu beeinträchtigen. Auch sollten Kinder in den ersten 24 Stunden nach der Anwendung keinen lang dauernden, intensiven Kontakt (z. B. beim Schlafen) mit behandelten Katzen haben. Obwohl Versuche an Ratten und Kaninchen vermuten lassen, dass Emodepsid die embryofetale Entwicklung beeinträchtigt, kann Profender bei trächtigen und laktierenden Katzen angewendet werden. Schwangere Frauen sollten jedoch den Kontakt mit dem Arzneimittel vermeiden oder bei der Anwendung Einmalhandschuhe tragen. Wird Profender zur Therapie der Echinokokkose eingesetzt, müssen bei Behandlung, Nachkontrollen und dem Schutz von Personen Richtlinien beachtet werden (erhältlich bei den zuständigen Behörden), da die Echinokokkose eine meldepflichtige Zoonose darstellt. Da Emodepsid ein Substrat der P-Glykoprotein-Effluxpumpe für verschiedene Arzneimittel ist, sollte es nicht gleichzeitig mit anderen P-Glykoprotein-Substraten oder -inhibitoren wie z. B. makrozyklischen Laktonen, Erythromycin, Prednisolon und Ciclospo- Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. rin angewendet werden. Bei bis zu 10facher Überdosierung bei adulten Katzen und 5facher Überdosierung an Katzenwelpen traten gelegentlich Speicheln, Erbrechen und Tremor auf (10). Die Dosierung beträgt 3 mg Emodepsid und 12 mg Praziquantel/kg KM einmalig äußerlich auf die unversehrte Haut im oberen Nackenbereich nahe der Schädelbasis. Profender wird als Lösung zum Auftropfen in drei Stärken für kleine, mittelgroße und große Katzen in Packungen mit zwei Blistern zu je 2 Einzeldosispipetten oder mit 10 Blistern zu je 4 Einzeldosispipetten von der Firma Bayer vertrieben. Vetoryl® 30 mg/60 mg (Trilostan, Zulassung für Hunde) Obwohl grundsätzlich in diesem Artikel nur Arzneimittel besprochen werden, die in den Jahren 2004/2005 auf den Markt kamen, soll das erst seit Mitte 2006 verfügbare Vetoryl einbezogen werden, da die Behandlung des Cushing-Syndroms bei Hunden aufgrund der Zulassungssituation geeigneter Medikamente bisher eine Therapielücke darstellte. Trilostan wurde für Hunde zur Behandlung eines hypophysären oder adrenalen Hyperadrenokortizismus (Cushing-Syndrom) in Deutschland zugelassen. Nach den Vorschriften des § 56a und § 73 Abs. 3 Arzneimittelgesetz (AMG) dürfen alle Hunde mit Cushing-Syndrom zunächst nur noch mit diesem Präparat behandelt werden, da die Einfuhr des gleichnamigen englischen Präparates, das auch eine Zulassung für Hunde besitzt, nicht mehr erlaubt ist. Das in Deutschland auf dem Markt befindliche humanmedizinische Arzneimittel Lysodren (Mitotan) darf erst im Rahmen einer Umwidmung zur Anwendung kommen, wenn für Tiere kein zugelassenesArzneimittel existiert, mit dem sich dasAnwendungsziel erreichen lässt (§ 56a Abs. 2 Nr. 3 AMG). Allerdings scheint es aufgrund der neuen Situation nach der Zulassung von Vetoryl aus fachlicher Sicht nicht vertretbar, Hunde, die bereits vor der Markteinführung von Vetoryl erfolgreich mit Lysodren behandelt wurden, jetzt auf Trilostan umzustellen. Bei abrupter Umstellung besteht eine erhöhte Wahrscheinlichkeit für das Auftreten eines iatrogenen Morbus Cushing. Bei einem Wechsel zu Trilostan sollte deshalb eine mindestens vierwöchige Absetzfrist nach Lysodren eingehalten werden und der Behandlungsbeginn mit Vetoryl anhand von ACTH-Stimulationstests bestimmt werden. Trilostan hemmt kompetetiv die 3-β-Hydroxysteroidisomerase, wodurch die Synthese von Kortisol, Kortikosteron und Aldosteron reduziert wird. Die Hemmung ist reversibel und anscheinend dosisabhängig. Trilostan antagonisiert auch die Aktivität von exogenem adrenokortikotropem Hormon (ACTH). Der Wirkmechanismus ist somit grundsätzlich unterschiedlich zu Lysodren, das über einen nicht näher bekannten Mechanismus relativ selektiv zytotoxisch auf normale und neoplastische Zellen der Nebennierenrinde wirkt (31). Oral verabreichtes Trilostan wird von Hunden rasch, aber individuell ungleichmäßig resorbiert, sodass maximale Plasmakon- zentrationen nach 30–150 Minuten erreicht werden. Die orale Bioverfügbarkeit steigt durch Verabreichung mit dem Futter (15). Trilostan wird zügig aus der Blutbahn eliminiert, sodass nach 6–12 Stunden wieder der Ausgangswert vorliegt (15). Die Kortisolproduktion wird aber über mehr als 20 Stunden nach Verabreichung beeinflusst (27). Trilostan wird von Hunden in der Leber unter anderem zu dem aktiven Metaboliten Ketotrilostan abgebaut, der sich pharmakokinetisch ähnlich wie Trilostan verhält. Trilostan und seine Metaboliten scheinen nicht zu akkumulieren. Vetoryl darf nicht angewendet werden bei Tieren, die überempfindlich gegenüber Trilostan reagieren, und solchen, die weniger als 3 kg wiegen (15). An leber- oder nierengeschädigte Hunde soll Trilostan nur unter besonderer Vorsicht verabreicht werden (27). Der Einsatz von Trilostan ist nur bei exakt diagnostiziertem Hyperadrenokortizismus indiziert. Es darf nicht bei trächtigen oder säugenden Hündinnen oder bei Tieren, die für die Zucht vorgesehen sind, angewendet werden. Die gleichzeitige Anwendung von Trilostan und kaliumsparenden Diuretika oder ACE-Hemmern sollte nur nach einer Nutzen-Risiko-Abwägung erfolgen, da ein Risiko für die Entstehung einer Hyperkalämie besteht und bei Hunden, die gleichzeitig Trilostan und ACE-Hemmer erhielten, plötzliche Todesfälle auftraten. Bei Hunden, die bereits mit Lysodren behandelt wurden, kann die Funktion der Nebennierenrinde eingeschränkt sein. Diese Tiere sollten nach mindestens einmonatiger Therapiepause genau überwacht werden, da sie auf Trilostan deutlich empfindlicher reagieren können. Hunde mit Anämie müssen ebenfalls sehr sorgfältig überwacht werden, da eine weitere Reduzierung des Hämatokrits und Hämoglobingehaltes auftreten kann (15). Mögliche Nebenwirkungen der Trilostantherapie umfassen Symptome eines iatrogenen Hypoadrenokortizismus wie Schwäche, Lethargie, Appetitlosigkeit, Erbrechen und Durchfall bis hin zu einer akuten Addison-Krise, die sich nach Absetzen der Behandlung unterschiedlich rasch zurückbilden. Gelegentlich wurden bei Hunden Nebennierennekrosen beobachtet, die zu Hypoadrenokortizismus führen können. Unter Trilostanbehandlung können eine klinisch inapparente Dysfunktion der Nieren bzw. durch eine Verminderung des endogenen Kortikosteroidhormonspiegels bisher unerkannte Arthritiden manifest werden. Des Weiteren wurden vereinzelt Koordinationsstörungen, übermäßiger Speichelfluss, Blähungen, Muskelzittern und Hautveränderungen beobachtet. Nach Verabreichung der dreifachen Menge der maximalen empfohlenen Dosis traten bei gesunden Hunden keine Todesfälle auf, doch sind diese bei Hunden mit Hyperadrenokortizismus nach höheren Gaben zu erwarten. Vereinzelt wurde über plötzliche Todesfälle während der Behandlung berichtet. Gegen Trilostan gibt es kein spezifisches Gegenmittel. Bei Überdosierung erfolgt eine symptomatische Therapie mit Gabe von Kortikosteroiden und Korrektur des Elektrolyt- und Flüssigkeitshaushaltes. Da Trilostan die Testosteronsynthese vermindern kann und antigestagene Eigenschaften hat, sollten Frauen, die schwanger sind oder es werden wollen, nicht mit Vetoryl-Kapseln umgehen. Nach Anwendung oder versehentlichem Kontakt sind Hände mit Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 235 ALLGEMEINES Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach ALLGEMEINES 236 Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach Wasser und Seife zu waschen. Da der Kapselinhalt zu Augen- und Hautreizung und zu einer Sensibilisierung führen kann, dürfen die Kapseln nicht eröffnet werden (z. B. um eine Dosisanpassung vorzunehmen) (15). Anfänglich wird Trilostan mit durchschnittlich 6 mg/kg KM einmal täglich über das Futter verabreicht. Nach individueller Anpassung im Rahmen der Überwachung ließ sich die Mehrzahl der Hunde mit 2–10 mg/kg KM/Tag stabilisieren. Gehen die Symptome bei täglicher Gabe nicht zufriedenstellend zurück, kann die Dosis in kleinstmöglichen Schritten erhöht und auf zwei Gaben, morgens und abends, verteilt werden. Da die Kapseln nicht geöffnet werden dürfen, sind die Dosierungsschritte festgelegt, sodass vor allem kleinere Hunde möglicherweise nicht optimal behandelt werden. Die Überwachung erfolgt anhand klinisch-chemischer Parameter und ACTH-Stimulationstest, der 4–6 Stunden nach der Applikation durchzuführen ist. Für diese Tests werden nach Diagnosestellung und bei jeder Dosisanpassung vor Behandlungsbeginn und anschließend nach 10 Tagen, 4 Wochen, 12 Wochen und im Folgenden alle 3 Monate Blutproben entnommen. Spricht der ACTH-Stimulationstest erstmalig nicht an, ist die Behandlung mit Trilostan 7 Tage zu unterbrechen und dann mit einer geringeren Dosis erneut zu starten. Spricht der Test nach weiteren 14 Tagen erneut nicht an, wird die Trilostantherapie so lange unterbrochen, bis wieder klinische Symptome des Hyperadrenokortizismus auftreten (15). Vetoryl wird als Kapsel zum Eingeben für Hunde in zwei Stärken (30 mg und 60 mg) in Packungen mit 3 Blistern zu je 10 Kapseln von der Firma Janssen-Cilag vertrieben. Wirkstoffe, die für eine weitere Tierart zugelassen wurden Advocate® (Moxidectin in Kombination mit Imidacloprid, Zulassung für Hunde und Katzen) Das Endektozid Moxidectin aus der Gruppe der Milbemycine, das bereits für Rinder und Schafe als Cydectin und für Pferde als Equest zugelassen ist (5), erhielt in Kombination mit dem Ektoparasitizid Imidacloprid die Zulassung für Hunde zur Behandlung und Vorbeugung des Flohbefalls (Ctenocephalides felis), zur Behandlung des Ohrmilbenbefalls (Otodectes cynotis), der Sarcoptes-Räude (verursacht durch Sarcoptes scabiei var. canis) und der Demodikose (verursacht durch Demodex canis), zur Vorbeugung der Herzwurmerkrankung (L3– und L4-Larven von Dirofilaria immitis) und zur Behandlung eines Befalls mit gastrointestinalen Nematoden (L4-Larven, unreife adulte und adulte Stadien von Toxocara canis, Ancylostoma caninum und Uncinaria stenocephala, adulte Stadien von Toxascaris leonina und Trichuris vulpis). Die Zulassung für Katzen erstreckt sich auf die Behandlung und Vorbeugung des Flohbefalls (Ctenocephalides felis), die Behandlung des Ohrmilbenbefalls (Otodectes cynotis), die Vorbeu- gung der Herzwurmerkrankung (L3– und L4-Larven von Dirofilaria immitis) und die Behandlung eines Befalls mit gastrointestinalen Nematoden (L4-Larven, unreife adulte und adulte Stadien von Toxocara cati und Ancylostoma tubaeforme). Aufgrund der Kombination mit dem Chlornicotinyl-Insektizid Imidacloprid kann Advocate bei Hunden und Katzen als Teil der Behandlungsstrategie bei allergischer Flohdermatitis (FAD) verwendet werden. Die Erfordernis einer fixen Kombination von Moxidectin und Imidacloprid für diese Indikation ist allerdings fraglich. Moxidectin wird im Gegensatz zu Imidacloprid, das sich über die Haut des Tieres verteilt, transdermal resorbiert und erreicht bei Hunden etwa 4–9 Tage und bei Katzen etwa 1–2 Tage nach der topischen Verabreichung maximale Blutplasmaspiegel. Die Elimination von Moxidectin erfolgt bei Hunden und Katzen langsam, sodass es einen Monat im Blutplasma nachweisbar ist. Advocate darf nicht bei Katzenwelpen, die jünger als 9 Wochen und Hundewelpen, die jünger als 7 Wochen sind, angewendet werden. Die Behandlung von kranken und geschwächten Tieren bzw. von Tieren unter 1 kg Körpermassse sollte nur nach entsprechender Nutzen-Risiko-Analyse erfolgen. Die Anwendung von Advocate kann bei Hunden und Katzen vorübergehenden Juckreiz auslösen. In seltenen Fällen wurden Symptome wie fettiges Haar, Hautrötung und Erbrechen beobachtet, die spontan wieder verschwinden. Vorübergehende neurologische Erscheinungen sowie Speicheln können auftreten, wenn das Tier nach der Behandlung an der Applikationsstelle leckt. Daher sollte darauf geachtet werden, dass frisch behandelte Tiere nicht ihre oder die Applikationsstelle eines anderen Tieres ablecken. Wie bei allen Arzneimitteln, die makrozyklische Laktone enthalten, sollte die Anwendung bei Collies, Bobtails und mit ihnen verwandten Hunderassen und -kreuzungen (z. B. englische Hirtenhunde) vermieden werden. Vor Beginn der Herzwurmprophylaxe ist der Infektionsstatus des Tieres mit Herzwürmern abzuklären. Obwohl bei Studien zur Embryo- und Reproduktionstoxizität an Labortieren (Ratten, Kaninchen) keine teratogenen, fetotoxischen oder maternotoxischen Effekte durch Moxidectin und Imidacloprid nachweisbar waren, sollte die Anwendung von Advocate während Trächtigkeit und Laktation nur nach einer Nutzen-Risiko-Abschätzung erfolgen, da keine Studien an der Zielspezies vorliegen. Während der Behandlung mit Advocate sollten keine anderen makrozyklischen Laktone verabreicht werden. Wechselwirkungen mit anderen routinemäßig angewendeten Tierarzneimitteln wurden nicht beobachtet. Bei Hunden waren eine 5fache Überdosierung von Advocate über 8 Wochen bzw. eine bis zu 8fache einmalige Überdosierung und bei Katzen eine 10fache einmalige Überdosierung gut verträglich. Lediglich Katzenwelpen zeigten nach 6-maliger Anwendung von Advocate im Abstand von jeweils 2 Wochen mit einer bis zu 5fachen Überdosierung vorübergehende Mydriasis, Speichelfluss, Erbrechen und erhöhte Atemfrequenz. Nach versehentlicher oraler Aufnahme kann es in Einzelfällen zu vorübergehenden neurologischen Symptomen wie Ataxie, generalisiertem Tremor, Augensymptomatik (Mydriasis, verminderter Pupillenreflex, Nystagmus), Atemstörungen, Speichelfluss und Erbrechen kommen. Da kein spezifischesAntidot bekannt ist, sollte ne- Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. ben der Verabreichung von Aktivkohle symptomatisch therapiert werden. Moxidectin ist hochgiftig für Wasserorganismen. Daher sollten behandelte Tiere während der ersten vier Tage nach der Anwendung nicht in offenen Gewässern baden (12). Die Mindestdosierung von Imidacloprid beträgt für Hunde und Katzen jeweils 10 mg/kg KM. Moxidectin wird jedoch bei Hunden mit 2,5 mg/kg KM höher als bei Katzen mit 1,0 mg/kg KM dosiert. Daher sollten die Pipetten nur für die jeweils zugelassene Tierart verwendet werden. Zur Behandlung und Vorbeugung von Flohbefall sowie zur Herwurmprophylaxe wird Advocate in regelmäßigen monatlichen Abständen angewendet. Zur Therapie ist eine einmalige Anwendung ausreichend. Advocate wird im oberen Nackenberich nahe der Schädelbasis nach Scheiteln des Fells direkt auf die Haut des Tieres aufgetragen. Advocate wird als Lösung zum Auftropfen in vier Stärken für kleine, mittelgroße, große und sehr große Hunde und in zwei Stärken für kleine und große Katzen in Packungen mit einem Blistern zu je 3 Einzeldosispipetten von der Firma Bayer vertrieben. Caninsulin® (Insulin, Zulassung für Katzen) Das vom Schwein stammende Zink-Insulin in Caninsulin wurde jetzt auch für Katzen zur Behandlung des Diabetes mellitus zugelassen. Für den Hund ist dieses Antidiabetikum seit 1995 auf dem Markt. Caninsulin ist das einzige insulinhaltige Fertigarzneimittel, das derzeit für Tiere zur Verfügung steht. Das Präparat enthält Altinsulin ohne Depoteffekt, bestehend aus 30% amorphem, schneller wirksamem Insulin und 70% kristallinem, verzögert wirkendem Insulin (21). Nach subkutaner Injektion von Caninsulin wurden bei Katzen maximale Insulinkonzentrationen im Blutplasma nach 1 bis 2 Stunden festgestellt. Die maximale Wirkung trat zeitversetzt nach Tab. 1 Übersicht über die neuen veterinärmedizinischen Arzneimittel. Die Neuerungen, die zur Aufnahme der Arzneimittel in den Artikel geführt haben, sind rot hervorgehoben. Wirkstoffgruppe/ Wirkstoff Präparat Darreichungsform und Art der Anwendung Tierart Vertreiber Vasotop 0,625 mg Vasotop 10 mg Tablette zum Eingeben Hund Intervet Caninsulin Injektionssuspension zur subkutanen Anwendung Katze, Hund Intervet Itrafungol Lösung zum Eingeben Katze Janssen Animal Health Emodepsid mit Praziquantel Profender Lösung Lösung zum Auftropfen Katze Bayer Vital Fenbendazol Panacur PetPaste Paste zum Eingeben Hund, Katze Intervet ACE-Hemmer Ramipril Antidiabetika Insulin Antimykotika Itraconazol Antiparasitika Imidacloprid und Permethrin Advantix Spot-on Lösung zum Auftropfen auf die Haut Hund Bayer Vital Lindan Orisel-uno Gel zum Einbringen ins Ohr Katze Selectavet Moxidectin mit Imidacloprid Advocate Lösung zum Auftropfen Hund, Katze Bayer Vital Ronidazol Ridzol 10% Bt Pulver zum Eingeben über das Trinkwasser Brieftaube Dr. Hesse Tierpharma Vetoryl Kapsel zum Eingeben Hund Janssen Animal Health Prednisolon-50 mg Tablette (snap tab) zum Eingeben Hund CP-Pharma Carprofen Rimadyl Injektionslösung Injektionslösung zur subkutanen und intravenösen Anwendung Katze, Hund Pfizer Firocoxib Previcox Kautablette zum Eingeben Hund Merial Romidys 1 mg/ml Injektionslösung zur intramuskulären, intravenösen und subkutanen (nur Hund) Anwendung Hund, Katze Virbac Felimazole Tablette zum Eingeben Katze Janssen Animal Health Hormone und hormonell wirksame Pharmaka Trilostan Kortikosteroide Prednisolon Nichtsteroidale Antiphlogistika Pharmaka mit Wirkung auf das Zentralnervensystem Romifidin Thyreostatika Thiamazol Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 237 ALLGEMEINES Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach ALLGEMEINES 238 Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach 4–8 Stunden bei den meisten an Diabetes mellitus erkrankten Katzen ein. Nach ungefähr 8 Stunden erreichte die Insulinkonzentration im Blutplasma wieder den Ausgangswert. Die Wirkungsdauer von Caninsulin betrug bei Katzen 8–12 Stunden. Da Eintritt und Dauer der Caninsulin-Wirkung hohen individuellen Schwankungen unterliegen, können die Blutglukose-Werte bei einigen Katzen auch schon 1–2 Stunden nach Applikation abfallen (11). Caninsulin darf nicht bei Überempfindlichkeit gegen Bestandteile des Arzneimittels und zur initialen Behandlung eines schweren, akuten Diabetes mit Ketoazidose angewendet werden. Als Nebenwirkungen wurden hypoglykämische Zustände beobachtet. Um gute Behandlungsergebnisse zu erzielen, ist in Absprache mit dem Tierhalter ein strikt einzuhaltendes Fütterungskonzept zu erstellen. Außerdem darf die Katze nur einem Minimum an Stress oder unregelmäßiger zusätzlicher körperlicher Belastung ausgesetzt werden. Der Glukoseblutspiegel ist nach Ermittlung der Insulin-Erhaltungsdosis regelmäßig zu überprüfen. Trächtige und laktierende Katzen sind aufgrund der geänderten Stoffwechsellage genau zu überwachen. Die Anwendung von Glukokortikoiden und Gestagenen z. B. zur Läufigkeitsunterdrückung kann die blutzuckersenkende Wirkung von Caninsulin vermindern (11). Caninsulin sollte bei Katzen zweimal im Abstand von 12 Stunden verabreicht werden. Die erforderliche Insulindosis ist für jeden Patienten unterschiedlich, da sie sich nach der InsulinEigenproduktion richtet. Sie muss durch serielle Bestimmungen des Blutglukose-Wertes ermittelt werden. Bei einem basalen Blutglukose-Wert von mindestens 20 mmol/l beträgt dieAnfangsdosis zweimal täglich 0,5 IE/kg KM, bei unter 20 mmol/l werden zweimal täglich 0,25 IE/kg KM verabreicht. Die Anpassung der Erhaltungsdosis sollte nur in Abständen von 3–4 Tagen in einer Höhe von jeweils 1 IE pro Injektion erfolgen. Nach Ermittlung der Erhaltungsdosis ist der Tierhalter über die klinischen Symptome eines erniedrigten oder erhöhten Blutglukose-Wertes aufzuklären, damit er rechtzeitig gegensteuern kann. Liegen keine Probleme vor, sollten die Tiere alle 3–6 Monate vom Tierarzt untersucht werden, wobei zu beachten ist, dass eine Remission des klinischen Diabetes bei Katzen möglich ist und sich die Ansprechbarkeit auf Insulin mit der Zeit verändern kann. Caninsulin wird als Injektionssuspension in den Handelsformen 10 × 2,5 ml und 1 × 10 ml von der Firma Intervet Deutschland vertrieben. Rimadyl® Injektionslösung (Carprofen, Zulassung für Katzen) Das nichtsteroidale Antiphlogistikum Carprofen, ein nichtselektiver Hemmstoff der Cyclooxygenase 1 und 2 aus der Arylpropionsäure-Gruppe, der bereits für Hunde und Rinder zugelassen ist (4, 17, 18), wurde jetzt auch für Katzen zur Kontrolle und Linderung leichter bis mäßig starker postoperativer Schmerzen zugelassen, wie sie bei kleineren oder mit mäßigen Schmerzen verbundenen Weichteiloperationen (wie z. B. Ovariohysterektomie, Kastration) auftreten. Damit ist Carprofen das dritte nichtsteroidale Antiphlogistikum, das neben Meloxicam und Tolfenaminsäure die Zulassung für Katzen erhielt. Nach subkutanerVerabreichung von 4,0 mg/kg KM an Katzen wurden maximale Blutplasmaspiegel von 26 µg/ml nach 4,3 Stunden erreicht. Die Bioverfügbarkeit beträgt bei Katzen mehr als 90%, die Halbwertszeit ca. 20 Stunden. Die Plasmaproteinbindung liegt über 99%. Carprofen darf nicht bei Herz-, Leber- oder Nierenerkrankungen sowie bei Verdacht auf gastrointestinale Ulzeration oder Blutungsneigung, nach Operationen, die mit größeren Blutverlusten verbunden waren, sowie bei Überempfindlichkeit gegenüber Carprofen oder andere nichtsteroidale Antiphlogistika angewendet werden. Des Weiteren darf es nicht gleichzeitig oder innerhalb von 24 Stunden mit anderen steroidalen und nichtsteroidalen Antiphlogistika und bei dehydrierten, hypovolämischen und hypotonischen Katzen sowie Katzen, die jünger als 4 Monate sind, angewendet werden. Rimadyl darf nicht intramuskulär injiziert werden. Es ist bei Katzen nur für eine einmalige Anwendung vorgesehen. Eine wiederholte Behandlung soll deshalb ebenso wie eine orale Weiterbehandlung mit Carprofen oder anderen nichtsteroidalen Antiphlogistika nicht erfolgen. Obwohl bei Studien zur Embryo- und Reproduktionstoxizität an Labortieren (Ratten, Kaninchen) keine teratogenen, mutagenen oder kanzerogenen Effekte durch Carprofen nachweisbar waren, sollte Rimadyl nicht bei trächtigen oder säugenden Tieren angewendet werden, da keine Studien an der Zielspezies vorliegen. Carprofen weist die für nichtsteroidale Antiphlogistika typischen Nebenwirkungen auf, wobei die Rate gastrointestinaler Nebenwirkungen relativ gering ist. Die gleichzeitige Anwendung von Carprofen mit anderen NSAID und Antikoagulanzien ist kontraindiziert, da die Nebenwirkungen verstärkt werden. Bei perioperativer Verabreichung kann die Blutungsneigung erhöht sein. Des Weiteren ist eine Beeinträchtigung der Nierenfunktion bei gleichzeitiger Verabreichung von Anästhetika und nichtsteroidalen Antiphlogistika nicht auszuschließen. Da für Carprofen in vitro photosensibilisierende Eigenschaften nachgewiesen wurden, ist der Hautkontakt mit dem Arzneimittel zu vermeiden bzw. nach versehentlichem Kontakt die betroffene Hautfläche sofort gründlich abzuwaschen (13). Die Dosierung beträgt bei Katzen einmalig 4,0 mg/kg KM. Sie sollte kurz vor oder unmittelbar nach einer Operation zur Linderung der postoperativen Schmerzen verabreicht werden, wobei unter diesen Voraussetzungen die Wirkdauer 18–24 Stunden betragen kann (30). Die Wirkung reicht bei starken postoperativen Schmerzen nicht aus. Rimadyl Injektionslösung zur subkutanen und intravenösen Anwendung wird als Injektionslösung in 20-ml-Flaschen von der Firma Pfizer vertrieben. Romidys® 1 mg/ml (Romifidin, Zulassung für Hunde und Katzen) Der α2-Rezeptoragonist Romifidin aus der Gruppe der IminoImidazolidine, der bereits für Pferde zugelassen ist, erhielt die Zu- Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. lassung als Sedativum für Hunde und Katzen zur Ruhigstellung, zur leichteren Durchführung von klinischen Untersuchungen, kleinen chirurgischen Eingriffen und Manipulationen und als Prämedikation vor der Einleitung der Allgemeinanästhesie. Für eine tiefe Sedation/Analgesie bei Hunden kann es in Kombination mit einem Anästhetikum verwendet werden. Bei Katzen führt die Kombination mit Ketamin zu einer chirurgischen Anästhesie. Mit Romifidin stehen jetzt neben Xylazin und Medetomidin drei Sedativa/Analgetika vom Typ des Xylazins für Hunde und Katzen zur Verfügung. Nach intramuskulärer Verabreichung beträgt die Bioverfügbarkeit bei Hunden 86% und bei Katzen 95%. Nach subkutaner Injektion ist sie bei Hunden mit 92% etwas höher. Maximale Plasmakonzentrationen werden bei Hunden ca. 50 Minuten nach subkutaner und intramuskulärer Injektion und bei Katzen ca. 25 Minuten nach intramuskulärer Injektion erreicht. Das Verteilungsvolumen von Romifidin ist hoch und beträgt bei Hunden ca. 3 l/kg und bei Katzen 6 l/kg, die Halbwertszeit liegt bei Hunden bei ca. 2 Stunden und bei Katzen bei ungefähr 6 Stunden. Romifidin wird von beiden Tierarten in der Leber metabolisiert und von Hunden zu ca. 80% über den Urin und zu ca. 20% über die Fäzes ausgeschieden (14). Romifidin darf aufgrund der α-mimetischen Wirkung nicht bei tragenden, insbesondere nicht bei hochträchtigen Tieren (Gefahr von Frühgeburt) und aufgrund der insulindepressiven Wirkung nicht bei Patienten mit Diabetes mellitus angewendet werden (22). Die Nebenwirkungen bei Hunden und Katzen sind die für α2-Agonisten typischen wie Bradykardie bis hin zum AV-Block, reversible Herzrhythmusstörungen und Hypotension, anhaltender Abfall der Körpertemperatur durch Ausfall der Temperaturregulation, Mydriasis, Ptosis, Erregungserscheinungen, unregelmäßige Atmung (Abfall der Atemfrequenz) und Erbrechen, das besonders nach kurz vorher erfolgter Fütterung auftritt. Katzen können jedoch auch bis zu 24 Stunden nach der Verabreichung von Romifidin erbrechen. Aufgrund der insulindepressiven Wirkung kann dosisabhängig der Blutglukose-Spiegel während der Sedation bei Hunden und Katzen ansteigen. Bei Hunden wurden zusätzlich Muskelzuckungen, Hecheln und Speichelfluss beobachtet. Katzen zeigten leichte und vorübergehende Reaktionen nach intramuskulärer Applikation an der Injektionsstelle und einen dosisabhängigen Anstieg des Blutharnstoff-Wertes, weshalb eine genügende Flüssigkeitsaufnahme sichergestellt sein sollte (15). Der sedative Effekt von Romifidin kann durch andere Psychopharmaka, wie z. B. Tranquilizer (z. B. Benzodiazepine), andere Sedativa oder Opioid-Analgetika potenziert werden. Des Weiteren werden die sedativen Effekte antikonvulsiver Substanzen durch Romifidin verstärkt (15). Hunde zeigten bei 10facher intravenöser Überdosierung über 4 Wochen keine schwerwiegenden Nebenwirkungen. Bei Katzen wurde nach wiederholter intramuskulärer Verabreichung der Maximaldosis und späteren Überdosierung in 2-Tages-Intervallen über 6 Tage Pankreatitis beobachtet (14). Die Dosierung von Romifidin zur Sedation beträgt bei Hunden 40–120 µg/kg KM i. m., i. v., s. c. und bei Katzen 200–400 µg/ kg KM i. m., i. v. Romifidin sollte nur an mindestens 12 Stunden gefastete Tiere verabreicht werden. Zur Prämedikation wird Ro- mifidin bei Hunden genauso wie zur Sedation dosiert. Bei Katzen wird die unterste Sedationsdosis zur Prämedikation verwendet. Die sich anschließendeAnästhesie sollte 10–15 Minuten nach der Prämedikation erfolgen. Bei Hunden führt die intravenöse Injektion innerhalb von ca. 5 Minuten zur Sedation, die 60–120 Minuten anhält. Nach subkutaner oder intramuskulärer Applikation setzt bei Hunden die Sedation verzögert ein und ist innerhalb der ersten 30 Minuten nach Injektion flacher als nach intravenöser Applikation, kann jedoch verlängert sein. Bei Katzen setzt die Sedation nach intravenöser Applikation ebenfalls nach 5 Minuten, nach intramuskulärer Applikation leicht verzögert nach 10 Minuten ein und hält ca. 60 Minuten an. Die Wirkungen von Romifidin können z. B. bei einem Narkosezwischenfall mit einem α2-Antagonisten wie Atipamezol bei Hunden (120 µg Romifidin/ 200 µg Atipamezol/kg KM) und Katzen (400 µg Romifidin/ 400 µg Atipamezol/kg KM) reduziert bzw. aufgehoben werden (15). Atipamezol ist derzeit jedoch nur für Hunde als Antisedan zugelassen. Romidys 1 mg/ml wird als Injektionslösung zur intramuskulären, intravenösen und subkutanen Anwendung bei Hunden und zur intramuskulären und intravenösen Anwendung bei Katzen in 20-ml-Flaschen von der Firma Virbac vertrieben. Weitere interessante Neuzulassungen Nachfolgend finden neu zugelassene Arzneimittel mit bekannten Wirkstoffen Erwähnung, die aufgrund einer neuen Darreichungsform, einer neuen Kombination bekannter Wirkstoffe, neuer Wirkstärken oder aufgrund der Wiederzulassung bewährter Wirkstoffe interessant erscheinen. Neue Darreichungsform Das Anthelminthikum Fenbendazol stand bislang als Tablette für Hunde und Katzen und als Gel für Katzen zur Verfügung. Es wurde jetzt von der Firma Intervet auch als Paste unter der Bezeichnung Panacur PetPaste zum Eingeben für Hunde und Katzen zur Behandlung von Infektionen mit Magen-Darm-Nematoden und bei Hunden außerdem als Unterstützung zur Kontrolle der Protozooen Giardia spp. zugelassen. Das Glukokortikoid Prednisolon war als Tablette in Monopräparation bislang nur als 5-mg-Tablette von der Firma CP-Pharma für Hunde und Katzen verfügbar. Die gleiche Firma brachte eine weitere Wirkstärke in verbesserter Darreichungsform für Hunde zur Zulassung. Prednisolon 50 mg wurde als sicher viertelbare Tablette in Snap-Tab-Technologie zugelassen, die eine feiner abgestufte Dosierung ermöglicht. Neue Kombination bekannter Wirkstoffe InAdvantix Spot-on Lösung wurde das bereits für Hunde und Katzen zugelassene Insektizid Imidacloprid mit dem Pyrethroid Perme- Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 239 ALLGEMEINES Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach ALLGEMEINES 240 Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach thrin kombiniert, das bereits eine Zulassung für Rinder, Pferde, Hunde und Katzen besitzt. Die Wirkung erstreckt sich auf Flöhe, Zecken, Schmetterlings- und Stechmücken. Advantix ist in vier Wirkstärken (bis 4 kg, 4–10 kg, 10–25 kg, über 25 kg) zur Anwendung bei Hunden von der Firma Bayer Vital erhältlich und ermöglicht die Bekämpfung einer breiten Palette von Ektoparasiten mit einer 2–4 Wochen anhaltenden adultiziden und repellierenden Wirkung. Wiederzulassung bewährter Wirkstoffe Der chlorierte zyklische Kohlenwasserstoff Lindan war seit dem 30. Juni 2003 nicht mehr als Tierarzneimittel verfügbar. Jetzt wurde Lindan als Monozubereitung im Ohrengel Orisel-uno für Katzen zur Behandlung der durch Räudemilben hervorgerufenen Otitis externa von der Firma Selectavet zugelassen. Auch das ronidazolhaltige Tierarzneimittel Ronida Bt verlor zum 30. Juni 2003 seine Zulassung für Brieftauben. Jetzt steht das Nitroimidazol Ronidazol wieder als Pulver zum Eingeben über das Trinkwasser als Ridzol 10% Bt von der Firma Dr. Hesse Tierpharma zur Verfügung. Es dient der metaphylaktischen Bekämpfung des gelben Knopfes (Trichomoniasis), verursacht durch ronidazolempfindliche Trichomonaden (Trichomonas gallinae) auf den Schleimhäuten im Rachen- und Kropfbereich von Brieftauben (Reise- und Jungtauben). Neue Wirkstärke Der ACE-Hemmer Ramipril, der seit längerem als Vasotop für Hunde in drei Wirkstärken (1,25 mg, 2,5 mg, 5 mg) verfügbar ist, wurde in Wirkstärken von 0,625 mg und 10 mg pro Tablette von der Firma Intervet zugelassen. Humanmedizinische Präparate Antidiabetika Insulindetemir (Levemir Injektionslösung) ist ein neues, lang wirkendes Insulinanalogon zur Anwendung als Basalinsulin in Kombination mit einem mahlzeitbezogenen kurz bzw. schnell wirkenden Insulin beim Menschen. Durch den neuen Verzögerungsmechanismus reduziert sich das Risiko für nächtliche Hypoglykämien deutlich. Zusätzlich wiesen Studien nach, dass mit Insulindetemir behandelte Diabetiker ihr Gewicht halten konnten, während mit NPH-Insulin (neutrales Protamin-Hagedorn-Insulin = Basalinsulin) behandelte Patienten im Durchschnitt an Gewicht zunahmen. Da die Wirkdauer bis zu 24 Stunden beim Menschen beträgt, ergibt sich eine ein- bis zweimal tägliche subkutane Verabreichung . Die Dosierung von Levemir muss individuell angepasst werden. Eine Einheit Insulindetemir entspricht einer IE Humaninsulin. Häufigste Nebenwirkungen neben der Hypoglykämie waren beim Menschen Rötungen, Schwellungen und Juckreiz an der Injektionsstelle (25). Insulinglulisin (Apidra Injektionslösung) ist ein rekombinantes Insulinanalogon, das im Vergleich zum Normalinsulin über einen schnelleren Wirkeintritt und eine kürzere Wirkdauer verfügt. Es wird beim Menschen nahezu dosisunabhängig aus dem subkutanen Fettgewebe resorbiert und erreicht im Vergleich zum humanen Normalinsulin doppelt so schnell zweimal so hohe Maximalkonzentrationen im Blutplasma. Dadurch ist es, selbst nach einer Mahlzeit gegeben und nicht 0–15 Minuten davor, dem 30–45 Minuten vor einer Mahlzeit gespritzten humanen Normalinsulin in der Regulierung des Blutzuckerprofils mindestens ebenbürtig (25). Da für Hunde und Katzen eine Mischung aus 70% kurz wirksamem kristallinem (Alt- bzw. Normalinsulin) und 30% länger wirksamem Zink-Insulin (Intermediär- bzw. Basalinsulin) vom Schwein als Caninsulin zugelassen ist, können diese beiden genannten für den Menschen neu zugelassenen Insulinanaloga nur bei vorliegendem Therapienotstand umgewidmet werden. Antidiarrhoika Racecadotril (Tiorfan Granulat) ist ein Prodrug des Enkephalinase-Hemmstoffs Thiorphan. Es wurde zur symptomatischen Behandlung der Diarrhö bei Säuglingen ab einem Alter von 3 Monaten und Kindern ergänzend zu einer peroralen Rehydratation und den üblichen unterstützenden Maßnahmen zugelassen. Racecadotril wird nach peroraler Einnahme rasch resorbiert und zum aktiven Metaboliten Thiorphan hydrolysiert, der selektiv den Abbau endogener Enkephaline schützt, die im Verdauungstrakt physiologisch aktiv sind. Dies führt zu einer Verlängerung des antisekretorischen Effekts. Thiorphan wirkt ausschließlich im Darm antisekretorisch, wobei die durch Entzündungen bedingte intestinale Hypersekretion von Wasser und Elektrolyten verringert, die basale Sekretion jedoch nicht beeinflusst wird. Die tägliche Dosierung beträgt 4,5 mg Racecadotril/kg KM verteilt auf drei Einzeldosen über maximal 7 Tage. Bei Kindern tritt die Hemmung der PlasmaEnkephalinase 30 Minuten nach der Einnahme auf und dauert bis zu 8 Stunden. Als Nebenwirkungen wurden Hypokaliämie, Ileus, Bronchospasmus und vereinzelt Hautausschlag beschrieben (25). Antiemetika Palonosetron (Aloxi Injektionslösung) ist der fünfte Vertreter der Serotonin-5HT3-Antagonisten nach Ondansetron, Dolasetron, Granisetron undTropisetron. 5HT3-Antagonisten wirken bevorzugt bei metabolischem und arzneimittelinduziertem Erbrechen, das durch in der Blutbahn befindliche emetische Substanzen ausgelöst wird, die durch Reizung von Dopamin-D2-und HT3-Rezeptoren in der Area postrema das Brechzentrum stimulieren. Einsatzgebiet für diese Wirkstoffe ist vor allem schweres, sonst kaum therapierbares Erbrechen z. B. durch Zytostatika (29). Palonosetron unterscheidet sich von seinen Vorgängern durch eine längere Halbwertszeit von 40 Stunden gegenüber 4 Stunden bei Ondansetron und 9 Stunden bei Granisetron und eine stärkere Bindung an den 5-HT3-Rezeptorsubtyp. Die neue Substanz Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. Tab. 2 Übersicht über für die Veterinärmedizin interessante, neu zugelassene humanmedizinische Arzneimittel Wirkstoffgruppe/ Wirkstoff Präparat Darreichungsform und Art der Anwendung Hersteller Insulindetemir Levemir Injektionslösung zur subkutanen Injektion Novo Nordisk Insulinglulisin Apidra Injektionslösung zur subkutanen Injektion Sanofi Aventis Tiorfan Granulat zum Einnehmen Trommsdorff Aloxi Injektionslösung zur intravenösen Injektion Ribosepharm Zonisamid Zonegran Kapsel zum Einnehmen Eisai Pregabalin Lyrica Hartkapsel zum Einnehmen Pfizer Bivalirudin Angiox Injektionslösung zur intravenösen Injektion Nycomed Pharma Melagatran Melagatran Injektionslösung zur subkutanen Anwendung Astra Zeneca Ximelagatran Exanta Tabletten zum Einnehmen Astra Zeneca Nadixa Creme zum Auftragen auf die Haut Dr. R. Pfleger Inspra Filmtabletten zum Einnehmen Pfizer Somatuline Autogel Injektionslösung zur subkutanen Injektion Amgen Arcoxia Filmtabletten zum Einnehmen MSD Sharp & Dohme Lotemax Augentropfen zum Eintropfen in den Bindehautsack Dr. Mann Pharma Zemplar Lösung zur intravenösen Injektion Abbott Yentreve Hartkapseln zum Einnehmen Lilly Filmtabletten zum Einnehmen Yamanouchi Antidiabetika Antidiarrhoika Racecadotril Antiemetika Palonosetron Antiepileptika Antikoagulanzien Dermatika Nadifloxacin Diuretika Eplerenon Hormone und hormonell wirksame Pharmaka Lanreotid Nichtsteroidale Antiphlogistika Etoricoxib Ophthalmika Loteprednoletabonat Osteoporosemittel (Vitamin-D-Analogon) Paricalcitol Urologika Duloxetin Solifenacin Vesikur schützt beim Menschen verglichen mit ihren Vorgängern genauso gut gegenüber akutem, aber wesentlich besser gegenüber verzögertem Erbrechen. Häufigste Nebenwirkungen waren Kopfschmerzen und Obstipation (24). Derzeit ist als Tierarzneimittel nur das Phenothiazin Acepromazin zur Behandlung von Erbrechen für Hunde zugelassen, das gegenüber hirnorganischem, metabolischem, medikamentösem und toxin-induziertem Erbrechen wirksam ist und sich weniger bei Kinetosen eignet. Antiepileptika Den weitaus größten Teil der Epilepsien bei Hunden und Katzen machen Anfälle vom Grand-mal-Typ aus, die häufig mit fokalen Anfallsformen kombiniert auftreten. Daher sind für die Tiermedi- zin vor allem diejenigenAntiepileptika interessant, die gegen große generalisierte und fokaleAnfälle wirken, wie z. B. Phenobarbital eventuell in Kombination mit Kaliumbromid, Primidon, Phenytoin oder Diazepam. Da jedoch bei 20–40% aller epileptischen Hunde mit den verfügbarenAntiepileptika, selbst in hohen Dosen, keine ausreichende Anfallsfreiheit erzielt werden kann, werden hier alle neuen humanmedizinischen Antiepileptika besprochen, auch wenn bei den meisten pharmakoresistenten Epileptikern ein Wechsel auf ein anderes Antiepileptikum oder eine Kombination verschiedener Antiepileptika nicht hilft. Zusätzlich zeigte sich, dass zahlreiche in der Humanmedizin eingesetzte Antiepileptika bei Hunden und Katzen für eine Dauertherapie pharmakokinetisch ungeeignet sind (23). Derzeit ist für Hunde und Katzen kein Antiepileptikum zugelassen, sodass in jedem Fall ein humanmedizinisches Arzeimittel umgewidmet werden muss. Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 241 ALLGEMEINES Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach ALLGEMEINES 242 Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach Das Benzisoxazol-Derivat Zonisamid (Zonegran Kapseln), das in Japan bereits seit 17 Jahren auf dem Markt ist, wurde in Deutschland bei Erwachsenen zur Zusatztherapie fokaler epileptischer Anfälle mit und ohne sekundäre Generalisierung zugelassen. Auf Zonisamid werden große Hoffnungen gesetzt, da sich in Studien bei Patienten, bei denen das primäre Therapieziel der Anfallsfreiheit nicht erreicht wurde, Responderraten von bis zu 50% ergaben. Auch bei Hunden wirkte Zonisamid in Kombination mit Phenobarbital und anderen Antiepileptika bei 58% bislang pharmakoresistenter Tiere und reduzierte die Anfallsfrequenz um mindestens 50% (1). Der genaue Wirkungsmechanismus ist ungeklärt. Zum einen scheint die Substanz hemmend auf spannungsabhängige Natrium- und Kalziumkanäle zu wirken und so die synchronisierende neuronale Entladung zu unterbrechen und zum anderen eine modulatorische Wirkung auf die GABA-vermittelte neuronale Inhibition zu besitzen (24). Als Dosierung wird für Hunde 5–10 mg/kg KM/Tag zweimal täglich oral empfohlen (1). Die beschriebenen Nebenwirkungen bei Hunden umfassten Sedation, Ataxie, Erbrechen und Keratoconjunctivitis sicca (1). Im Gegensatz zu älteren Antiepileptika beeinflusst Zonisamid weder das Cytochrom-P-450-System relevant noch verändert es durch Autoinduktion die eigene Metabolisierung (24). Mit Pregabalin (Lyrica Hartkapsel) wurde der Nachfolger des GABA-Analogons Gabapentin als Add-on-Therapeutikum bei partiellen epileptischen Anfällen mit und ohne sekundäre Generalisierung im Erwachsenenalter und zur Therapie peripherer neuropathischer Schmerzen zugelassen. Wie sein Vorgänger, jedoch stärker, bindet das S-Enantiomer der 3-Isobutyl-γ-aminobuttersäure an die α2δ-Untereinheit spannungsabhängiger Kalziumkanäle und wirkt hemmend auf Neurone des ZNS. Im Gegensatz zu Gabapentin muss Pregabalin nicht auftitriert werden. Die empfohlene, bereits wirksame, orale Tagesdosis beträgt zu Beginn der Behandlung 2,5 mg/kg KM und kann auf insgesamt 10 mg/kg KM gesteigert werden. BeimAbsetzen wird empfohlen, die Dosis ausschleichend über mindestens eine Woche zu verringern. Da Pregabalin nicht an Plasmaproteine bindet und in der Leber kaum metabolisiert wird, wurden bisher keine relevanten pharmakokinetischen Interaktionen mit anderen Arzneimitteln beim Menschen beobachtet. Als Nebenwirkungen fanden sich in erster Linie Benommenheit, Ataxie, Schwindel oder verschwommenes Sehen, Mundtrockenheit, erektile Dysfunktion, periphere Ödeme und Gewichtszunahme, die imAllgemeinen leicht bis mittelschwer ausgeprägt waren und selten zum Therapieabbruch führten (25). Antikoagulanzien Das Hirudin-Analogon Bivalirudin (Angiox Injektionslösung) ist ein reversibler Thrombininhibitor, der alle Thrombinwirkungen, die eine zentrale Rolle bei der Entwickung einer Thrombose spielen, durch Interaktion am aktiven Zentrum und an einer allosterischen Bindungsstelle des Thrombins reversibel hemmt. Im Gegensatz dazu bewirkt Hirudin eine irreversible Thromninhemmung. Bivalirudin wurde beim Menschen zur intravenösen An- wendung bei Koronarpatienten zugelassen, bei denen ein Herzkatheter gelegt werden muss. Die empfohlene Dosis umfasst eine initiale intravenöse Bolusgabe von 0,75 mg/kg KM und eine unmittelbar folgende intravenöse Infusion von 1,75 mg/kg KM/h für die Dauer des Eingriffs (25). Ximelagatran (Exanata Tabletten), das im Körper zum aktiven Metaboliten Melagatran (Exanta Injektionslösung) verstoffwechselt wird, ist der erste Vertreter der oral applizierbaren direkten Thrombininhibitoren, die zur Prophylaxe venöser thromboembolischer Ereignisse beim Menschen nach einer Hüftersatzoder Kniegelenkersatz-Operation zugelassen sind. Als kompetitiver und reversibler niedermolekularer direkter Inhibitor der Serinprotease α-Thrombin unterscheidet sich Melagatran in seiner Wirkweise von den Vitamin-K-Antagonisten und Heparinen, die die Blutgerinnung irreversibel hemmen. Ximelagatran reduzierte beim Menschen das Auftreten von Thromboembolien um 24% im Vergleich zu dem niedermolekularen Heparin Enoxaparin. Bezüglich schwerer Blutungskomplikationen und blutungsassoziierter Folgeoperationen waren keine signifikanten Unterschiede zwischen Ximelagatran und Enoxaparin nachzuweisen. Ximelagatran ist alsTablette und Melagatran als Injektionslösung verfügbar. Unmittelbar präoperativ werden 0,033 mg/kg KM Melagatran verabreicht, gefolgt von einer postoperativen Dosis von 0,05 mg/kg KM. Die orale Weiterbehandlung erfolgt mit 0,4 mg/ kg KM Ximelagatran zweimal täglich (25). Als Antikoagulans ist für die Tiermedizin nur Heparin als Gel zum Auftregen auf die Haut von Pferden zugelassen. Somit besteht für die systemische Anwendung von Antikoagulanzien in jedem Fall ein so genannter Therapienotstand, der eine Umwidmung rechtfertigt. Dermatika (Antibiotika) Nadifloxacin ist ein Fluorchinolon-Derivat mit einem breiten antibakteriellen Spektrum gegenüber grampositiven und gramnegativen Aerobiern sowie Anaerobiern, das wie alle Gyrasehemmer seine bakterizide Wirkung durch Hemmung der bakteriellen Topoisomerase entfaltet. Die nadifloxacinhaltige Creme Nadixa ist beim Menschen zur äußerlichen Anwendung bei leichten bis mittelschweren Ausprägungen entzündlicher Formen der Akne vulgaris zugelassen. Sie soll zweimal täglich nach Reinigung der Haut auf die betroffenen Hautareale mit einem Wattestäbchen über 8 bis maximal 12 Wochen aufgetragen werden. Als häufigste Nebenwirkungen wurden Juckreiz, Wärmegefühl, Erythembildung, Kontaktdermatitis und Urtikaria beobachtet. Da phototoxische und photoallergische Reaktionen nicht ausgeschlossen werden können, sollte die Exposition gegenüber Sonnenlicht unter der Behandlung vermieden werden (25). Da für Hunde und Katzen keine fluorchinolonhaltigen Zubereitungen als Dermatikum zugelassen sind, kann Nadixa im so genannten Therapienotstand umgewidmet werden. Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. Diuretika Mit Eplerenon (Inspra Filmtabletten) steht neben Spironolacton, das ebenfalls nicht fürTiere zugelassen ist, ein weitererAldosteronantagonist für den Menschen zur Verfügung. Aldosteronantagonisten sind kaliumsparende Diuretika, die Aldosteron von seinem Rezeptor im distalen Tubulus und in den Sammelrohren kompetitiv verdrängen, was eine verringerte Natriumrückresorption und eine verminderte Kaliumausscheidung zur Folge hat. Durch die damit verbundene vermehrte Wasserausscheidung wird eine Senkung der Vorlast des Herzens erreicht. Eplerenon wurde als Kombinationspartner zu einer Standardtherapie mit Betablockern zur Verringerung des Risikos der kardiovaskulären Mortalität und Morbidität bei stabilen Patienten mit linksventrikulärer Dysfunktion und klinischen Zeichen einer Herzinsuffizienz nach kürzlich aufgetretenem Herzinfarkt zugelassen. Die Behandlung wird 3–14 Tage nach einem akuten Myokardinfarkt mit 0,42 mg/kg KM einmal täglich begonnen und dann, unter Berücksichtigung des Serumkaliumspiegels, auf 0,83 mg/kg KM einmal täglich gesteigert (25). Hormone und hormonell wirksame Pharmaka Lanreotid (Somatuline Autogel ) ist nach Octreotid das zweite für den Menschen zugelassene Octapeptid-Analogon des Somatostatins, das die Ausschüttung von Somatotropin inhibiert, indem es hochaffin an Somatostatin-Rezeptoren vor allem vom Typ 2, 3 und 5 bindet. Darüber hinaus werden viele andere Funktionen wie z. B. die Sekretion von Insulin und Glukagon, die Gallenblasenmotilität und die Sekretion von Wasser, Kalium, Natrium und Chlorid im Dünndarm gehemmt. Lanreotid wurde für die Therapie der Akromegalie zugelassen und soll die abnormal erhöhten Spiegel an Somatotropin (Wachstumshormon) und Insulin-like Growth Factor 1 (IGF-1) reduzieren und möglichst normalisieren. Die Dosierung beginnt mit 1 mg/kg KM alle 28 Tage tief subkutan. Je nach Ansprechen kann die Dosis nach 3 Monaten erhöht bzw. reduziert werden. Die häufigsten Nebenwirkungen waren Durchfall, Bauchschmerzen, Übelkeit, Erbrechen, Dyspepsie, Blähungen, Gallensteinleiden, Kopfschmerzen und Lokalreaktionen an der Injektionsstelle (25). Nichtsteroidale Antiphlogistika Etoricoxib (Arcoxia Filmtabletten) ist ein selektiver COX2-Hemmer aus der Gruppe der Coxibe. Die Zulassung des Präparats erfolgte kurz bevor der erste humanmedizinische COX2-Hemmer Rofecoxib wegen kardiovaskulärer Nebenwirkungen vom Markt genommen wurde. Etoricoxib ist zur Behandlung von Arthrosen, rheumatoider Arthritis sowie Schmerzen und Entzündungen bei einem Gichtanfall in der akuten symptomatischen Phase zugelassen. Seine Verträglichkeit wurde bisher als gut bewertet. Die Nebenwirkungen weisen das für nichtsteroidale Antiphlogistika typische Spektrum auf, wobei am häufigsten Kopfscherzen, gastrointestinale Beschwerden, Müdigkeit und grippe- artige Erkrankungen auftraten. Die Inzidenz für Perforation, Ulzera und Blutungen des oberen Magen-Darm-Traktes ist bei Etoricoxib weniger als halb so hoch wie unter nicht COX-selektiven NSAID. Aufgrund des Wirkmechanismus von Etoricoxib können die bei bei Rofecoxib festgestellten kardiovaskulären Nebenwirkungen nicht ausgeschlossen werden. Die Dosierung beträgt beim Menschen aufgrund der langen Halbwertzeit von 22 Stunden einmal täglich 1–2 mg/kg KM oral (25). Vor der Umwidmung von Etoricoxib für Kleintiere ist zu beachten, dass vor kurzem der selektive COX-2-Hemmer Firocoxib als Previcox für Hunde zugelassen wurde (siehe oben). Ophthalmika (Glukokortikoid) Das Glukokortikoid Loteprednol als Etabonatester (Lotemax Augentropfen) wurde beim Menschen zur Behandlung von Entzündungen nach operativen Eingriffen amAuge zugelassen. Loteprednol zeichnet sich durch eine stark entzündungshemmende Wirkung aus und besitzt im Gegensatz zu Prednisolon ein geringeres Potenzial, den Augeninnendruck zu steigern. Der hochlipophile Ebabonatester, der gut in die Kornea penetriert, wird rasch zu inaktiven Metaboliten abgebaut, sodass systemische Spiegel unterhalb der Nachweisgrenze lagen. Häufige Nebenwirkungen am Auge sind Sehstörungen, Jucken und Brennen, tränendes oder trockenes Auge, Fremdkörpergefühl oder Photophobie. Die Dosierung beträgt 1–2 Tropfen viermal täglich. Die Behandlung soll spätestens 24 Stunden nach dem operativen Eingriff begonnen und während der postoperativen Phase aufrechterhalten werden. Die Behandlungsdauer darf 2 Wochen nicht überschreiten (24). Für Hunde und Katzen ist das Glukokortikoid Hydrocortison als Augensalbe zugelassen, allerdings handelt es sich um Kombinationspräparate mit Lidocain, Neomycin und Vitamin A. Osteroporosemittel (Vitamin-D-Analogon) Das synthetische Vitamin-D-Analogon Paricalcitol (Zemplar Injektionslösung) wurde beim Menschen zur Prävention und Therapie eines sekundären Hyperparathyreoidismus bei chronischem Nierenversagen zugelassen. Paricalcitol senkt wie Vitamin D, das für Hunde und Katzen eine Zulassung als Monopräparat besitzt, den Parathormonspiegel, ohne jedoch die Kalzium- und Phosphatspiegel wesentlich zu beeinflussen. Paricalcitol wird als intravenöse Bolusinjektion (5 µg) verabreicht. ImVergleich zu Calcitriol senkt es den Parathormonspiegel schneller und ausreichend tief, um den therapeutischen Zielbereich von 100–300 pg/ml zu erreichen. Als häufigste Nebenwirkungen traten Hyperkalzämie, Hypophosphatämie, Funktionsstörungen der Nebenschilddrüse, Juckreiz und Geschmacksveränderungen auf. Hinweisen zufolge ist die Überlebensrate von Paricalcitol- imVergleich zu Calcitriol-Behandelten um 16% besser (24). Urologika Duloxetin (Yentreve Hartkapsel) ist ein zentral wirksamer kombinierter Serotonin (5-HT)- und Noradrenalin (NA)-Wiederauf- Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved. 243 ALLGEMEINES Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach ALLGEMEINES 244 Neue Arzneimittel für Kleintiere 2004/2005 I. U. Emmerich, F. R. Ungemach nahmehemmer, der zur Therapie von mittelschwerer bis schwerer Belastungsinkontinenz, der bei Frauen häufigsten Form der Harninkontinenz, zugelassen wurde. Duloxetin soll die Wiederaufnahme von Serotonin und Noradrenalin hemmen und so deren Konzentration im synaptischen Spalt erhöhen, wodurch der Tonus des quer gestreiften Harnröhrenschließmuskels erhöht und damit dem unfreiwilligen Harnabgang vorgebeugt wird. Kontraindiziert ist Duloxetin bei Leberinsuffizienz und in Kombination mit Cytochrom-P450-1A2-Hemmern wie Fluvoxamin, Ciprofloxacin und Enocacin sowie mit irreversiblen MAO-Hemmern wie Tranylcypromin. Häufigste Nebenwirkungen waren Übelkeit, Schlaflosigkeit, trockener Mund, Müdigkeit und Obstipation. Die Dosierung beträgt beim Menschen zweimal täglich 0,67 mg/kg KM. Beim Absetzen ist die Dosis ausschleichend zu reduzieren (25). Der Muskarinrezeptor-Antagonist Solifenacin (Vesikur Filmtabletten), der zur symptomatischen Therapie der Dranginkontinenz und Pollakisurie beim Menschen zugelassen wurde, bietet einen anderen Wirkmechanismus als Duloxetin. Da die Harnblase von parasympathischen cholinergen Nerven innerviert wird, kann Acetylcholin über Muskarinrezeptoren, vor allem vom Syptyp M3, eine Kontraktion der glatten Muskulatur der Blasenwand auslösen. Anticholinergika wie Solifenacin dämpfen die Harnblasenübererregbarkeit durch Blockade der Muskarinrezeptoren. Solifenacin hemmt den Muscarin M3-Rezeptor kompetitiv. Eine Selektivität für Blasenzellen ist vorhanden, aber gering ausgeprägt. Erwartungsgemäß dominieren cholinerge Nebenwirkungen wie Mundtrockenheit, Verstopfung und verschwommenes Sehen. Die Dosierung beträgt 0,08–0,16 mg/kg KM einmal täglich (24). Derzeit stehen für Hunde zur Behandlung der Harninkontinenz die indirekt wirkenden Sympathomimetika Ephedrin und Norephedrin (Synonym Phenylpropanolamin) und die steroidalen Sexualhomone Estradiol-17β und Estriol zurVerfügung. Die indirekten Sympathomimetika bewirken die Freisetzung von Noradrenalin aus noradrenergen Varikositäten bei gleichzeitiger Hemmung der Wiederaufnahme von Noradrenalin aus dem synaptischen Spalt. Hierdurch wird der Verschlussmechanismus der hauptsächlich von adrenergen Nerven versorgten Harnröhre verbessert und stabilisiert. Die steroidalen Sexualhormone erhöhen die durch eine Kastration verminderte Aktivität der Rezeptoren in Harnblase und Urethra und verbessern die allgemeine Bindegewebsschwäche kastrierter Tiere. Aufgrund Letzterer verlagert sich die Harnblase nach kaudal und der Sphinkter weit ins Becken, wodurch er sich dem Druck aus dem Bauchraum entzieht, der normalerweise seinen Verschluss unterstützt. Somit verbessern die Sexualhomone letztendlich den Harnröhrenverschluss (19). Humanmedizinische Arzneimittel zur Therapie der Harninkontinenz dürfen bei Kleintieren erst angewendet werden, wenn mit den für Tiere zugelassenen Arzneimitteln das Therapieziel nicht erreicht werden konnte. Literatur 1. Dewey et al. Zonisamide Therapy for Refractory Idiopathic Epilepsy in Dogs. J. Am. Anim. Hosp. Assoc. 40:285–291 (2004). 2. Emmerich IU, Kluge K, Ungemach FR. Neue Arzneimittel für Kleintiere 2000/2001. Tierärztl Prax 2002; 30 (K): 81–7. 3. Emmerich IU, Ungemach FR. Neue Arzneimittel für Großtiere und Pferde 2000/2001. Tierärztl Prax 2002; 30 (G): 350–6. 4. Emmerich IU, Ungemach FR. Neue Arzneimittel für Kleintiere 2002/2003. Tierärztl Prax 2004; 32 (K): 266–75. 5. Emmerich IU, Ungemach FR. Neue Arzneimittel für Pferde und landwirtschaftliche Nutztiere seitAnfang 1998.Tierärztl Prax 2000; 28 (G): 240–9. 6. Estler C-J. Azole. In: Pharmakologie und Toxikologie. Estler C-J Hrsg. Stuttgart, New York: Schattauer 2000; 647–9. 7. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Felimazole. 2004. 8. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Itrafungol. 2004. 9. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Firocoxib. 2005. 10. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Profender. 2005. 11. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Caninsulin. 2005. 12. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Advocate. 2005. 13. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Rimadyl. 2004. 14. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Romidys. 2004. 15. Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels Vetoryl. 2006. 16. Kluge K, Ungemach FR. Neue Arzneimittel für Kleintiere 1999. Tierärztl Prax 2000; 28 (K): 209–15. 17. Kluge K, Ungemach FR. Veränderungen auf dem Arzneimittelmarkt 1996/1997. Tierärztl Prax 1998; 26 (K): 150–3. 18. Kluge K, Ungemach FR. Veränderungen auf dem Arzneimittelmarkt 1998. Tierärztl Prax 1999; 27 (K): 218–23. 19. Kraft W. Incontinentia urinae. In: Kleintierkrankheiten, Band 1, Innere Medizin. Stuttgart: Ulmer 1990; 407. 20. Kroker R. Diabetes mellitus. In: Pharmakotherapie bei Haus- und Nutztieren. Löscher W, Ungemach FR, Kroker R, Hrsg. Berlin: Parey 2006; 361–2. 21. Kroker R. Thiamazol. In: Pharmakotherapie bei Haus- und Nutztieren. Löscher W, Ungemach FR, Kroker R, Hrsg. Berlin: Parey 2006; 352. 22. Löscher W. Analgetika vom Typ des Xylazins. In: Pharmakotherapie bei Haus- und Nutztieren. Löscher W, Ungemach FR, Kroker R, Hrsg. Berlin: Parey 2006; 99–103. 23. Löscher W. Antiepileptika. In: Pharmakotherapie bei Haus- und Nutztieren. Löscher W, Ungemach FR, Kroker R, Hrsg. Berlin: Parey 2006; 115–21. 24. Neue Arzneistoffe 2005. Pharmazeutische Zeitung 2006; 9:4–15. 25. Neue Arzneistoffe 2004. Pharmazeutische Zeitung 2005; 9:4–24. 26. Plumb DC. Itraconazol. In: Plumb´s Veterinary Drug Handbook. Plumb DC Hrsg. Ames, Iowa: Blackwell 2005; 619. 27. Plumb DC. Trilostan. In: Plumb´s Veterinary Drug Handbook. Plumb DC Hrsg. Ames, Iowa: Blackwell 2005; 1120–22. 28. Ungemach FR.Anthelminthika gegen Nematoden. In: Pharmakotherapie bei Haus- und Nutztieren. Löscher W, Ungemach FR, Kroker R, Hrsg. Berlin: Parey 2006; 382. 29. Ungemach FR. Antiemetika. In: Pharmakotherapie bei Haus- und Nutztieren. Löscher W, Ungemach FR, Kroker R, Hrsg. Berlin: Parey 2006; 211–17. 30. Ungemach FR. Nicht-steroidale Antiphlogistika. In: Pharmakotherapie bei Haus- und Nutztieren. Löscher W, Ungemach FR, Kroker R, Hrsg. Berlin: Parey 2006; 364–78. 31. Plumb DC. Mitotane. In: Plumb’s Veterinary Drug Handbook. Plumb DC Hrsg. Ames, Iowa: Blackwell 2005; 772–5. Dr. Ilka Ute Emmerich Prof. Dr. Fritz Rupert Ungemach Institut für Pharmakologie, Pharmazie und Toxikologie Veterinärmedizinische Fakultät der Universität Leipzig An den Tierkliniken 15, 04103 Leipzig www.vetidata.de Downloaded from www.tieraerztliche-praxis.de on 2017-06-03 | IP: 88.99.70.242 For personal or educational use only. No other uses without permission. All rights reserved.