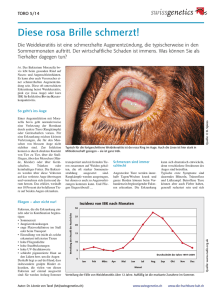
Mycoplasma bovis - TiHo Bibliothek elib
Werbung

M. bovis ISH Aus dem Institut für Pathologie der Tierärztlichen Hochschule Hannover ISBN 3-939902-10-1 Verlag: DVG-Service GmbH Frankfurter Straße 89 · 35392 Gießen Telefon (06 41) 2 44 66 · Telefax (06 41) 2 53 75 · E-mail: [email protected] · http://www.dvg.net Björn Jacobsen 2006 Nachweis von Mycoplasma bovis in der Lunge von experimentell infizierten Kälbern mittels in situ-Hybridisierung INAUGURAL-DISSERTATION zur Erlangung des Grades eines Doktors der Veterinärmedizin Björn Jacobsen Hannover 2006 Bibliografische Informationen der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; Detaillierte bibliografische Daten sind im Internet über http://dnb.ddb.de abrufbar. 1. Auflage 2006 © 2006 by Verlag: Deutsche Veterinärmedizinische Gesellschaft Service GmbH, Gießen Printed in Germany ISBN 3-939902-10-1 Verlag: DVG Service GmbH Frankfurter Straße 89 35392 Gießen 0641/24466 [email protected] www.dvg.net Aus dem Institut für Pathologie der Tierärztlichen Hochschule Hannover Nachweis von Mycoplasma bovis in der Lunge von experimentell infizierten Kälbern mittels in situ-Hybridisierung INAUGURAL-DISSERTATION zur Erlangung des Grades eines Doktors der Veterinärmedizin (Dr. med. vet.) durch die Tierärztliche Hochschule Hannover Vorgelegt von Björn Andreas Jacobsen aus Husum/Nordsee Hannover 2006 2 Inhaltsverzeichnis Wissenschaftliche Betreuung: Univ.-Prof. Dr. Marion Hewicker-Trautwein 1. Gutachter: Univ.-Prof. Dr. Marion Hewicker-Trautwein 2. Gutachter: Univ.-Prof. Dr. Peter Valentin-Weigand Tag der mündlichen Prüfung: 15.11.2006 Diese Arbeit wurde gefördert durch ein Stipendium der Friedrich-Ebert-Stiftung e. V., Bonn Eigentlich ist alles gleichgültig, wenn man Menschen hat, die man liebt. Peter Iljitsch Tschaikowsky Meiner Familie 6 Inhaltsverzeichnis Teile der hier vorliegenden Arbeit wurden bereits als Kongressbeitrag präsentiert: B. Jacobsen, W. Jechlinger, M. Zimmermann, J. Spergser, R. Rosengarten, M. Hewicker-Trautwein (2006): Detection and Localisation of Mycoplasma bovis in Lungs of Experimentally Infected Calves by in situ-Hybridization. 16. internationaler Kongress der IOM (International Organization for Mycoplasmology), 09.-14.06.2006, Cambridge, UK Inhaltsverzeichnis I Inhaltsverzeichnis 1 Einleitung............................................................................................................1 2 Literaturübersicht ..............................................................................................3 2.1 2.1.1 Charakteristika und Taxonomie .............................................................3 2.1.2 Pathogenitätsmechanismen bei Mykoplasmen ......................................5 2.1.3 Mykoplasmen als Krankheitserreger......................................................6 2.2 Mykoplasmosen des Rindes .........................................................................8 2.2.1 Lungenseuche .......................................................................................8 2.2.2 Mycoplasma bovis .................................................................................8 2.2.3 Sonstige Infektionen mit Mykoplasmen beim Rind.................................8 2.3 Mycoplasma bovis.........................................................................................9 2.3.1 Verbreitung ............................................................................................9 2.3.2 Erkrankung des Respirationstraktes ....................................................10 2.3.3 Weitere Erkrankungen durch Mycoplasma bovis .................................15 2.3.4 Immunantwort ......................................................................................17 2.3.5 Antigen- und Phasenvariation ..............................................................17 2.3.6 Immunprophylaxe ................................................................................19 2.3.7 Therapie...............................................................................................19 2.3.8 Diagnostik zum Erregernachweis.........................................................20 2.4 3 Mykoplasmen ................................................................................................3 In situ-Hybridisierung ..................................................................................20 2.4.1 Methode...............................................................................................20 2.4.2 Anwendung ..........................................................................................21 Material und Methoden ....................................................................................23 3.1 Kälber..........................................................................................................23 3.1.1 Gruppe 1 (Kontrollgruppe) ...................................................................23 3.1.2 Gruppe 2..............................................................................................23 3.1.3 Gruppe 3..............................................................................................25 3.1.4 Gruppe 4..............................................................................................27 3.2 Pathologisch-anatomische Untersuchung der Lungen................................28 3.3 Lungengewebeproben ................................................................................29 3.4 Histochemische Färbemethoden ................................................................30 3.4.1 Übersichtsfärbung mit Hämatoxylin und Eosin.....................................30 3.4.2 Azanfärbung nach Heidenhain.............................................................31 II Inhaltsverzeichnis 3.4.3 3.5 In situ-Hybridisierung.................................................................................. 32 3.5.1 Sondensynthese.................................................................................. 32 3.5.2 Primer.................................................................................................. 33 3.5.3 PCR..................................................................................................... 33 3.5.4 Sondentests ........................................................................................ 34 3.5.5 Durchführung der in situ-Hybridisierung .............................................. 35 3.5.6 Chromogen.......................................................................................... 35 3.5.7 Kontrollmaterial ................................................................................... 36 3.5.8 Protokoll für die in situ-Hybridisierung ................................................. 36 3.5.9 Kontrolle der endogenen Peroxidasen ................................................ 38 3.5.10 Auswertung ......................................................................................... 38 3.6 Immunhistochemie ..................................................................................... 38 3.6.1 Antikörper ............................................................................................ 38 3.6.2 Chromogen.......................................................................................... 39 3.6.3 Kontrollen ............................................................................................ 39 3.6.4 Protokoll für die Immunhistochemie mit MAB970 ................................ 39 3.6.5 Auswertung ......................................................................................... 41 3.7 4 Siriusrot-Färbung F3B Technik............................................................ 32 Befunderhebung und Auswertung der Daten ............................................. 41 Ergebnisse ....................................................................................................... 43 4.1 Ergebnisse der Sondentestung .................................................................. 43 4.1.1 Nachweis von Mycoplasma bovis-DNA im Southern Blot ................... 43 4.1.2 Spezifitätstest ...................................................................................... 44 4.2 Histopathologische Ergebnisse .................................................................. 44 4.2.1 Gruppe 1 (Kontrollgruppe)................................................................... 44 4.2.2 Gruppe 2 ............................................................................................. 45 4.2.3 Gruppe 3 ............................................................................................. 45 4.2.4 Gruppe 4 ............................................................................................. 47 4.2.5 Zusammenfassung.............................................................................. 48 4.3 Ergebnisse der in situ-Hybridisierung ......................................................... 48 4.3.1 Gruppe 1 (Kontrollgruppe)................................................................... 48 4.3.2 Gruppe 2 ............................................................................................. 49 4.3.3 Gruppe 3 ............................................................................................. 49 Inhaltsverzeichnis 4.3.4 Gruppe 4..............................................................................................51 4.3.5 Zusammenfassung ..............................................................................53 4.4 Ergebnisse der immunhistochemischen Untersuchung ..............................53 4.4.1 Gruppe 1 (Kontrollgruppe) ...................................................................53 4.4.2 Gruppe 2..............................................................................................54 4.4.3 Gruppe 3..............................................................................................54 4.4.4 Gruppe 4..............................................................................................56 4.4.5 Zusammenfassung ..............................................................................58 4.5 5 III Fotographische Dokumentation ..................................................................58 Diskussion ........................................................................................................67 5.1 Histopathologische Befunde .......................................................................67 5.2 Die Methode der in situ-Hybridisierung .......................................................72 5.3 Ergebnisse der in situ-Hybridisierung..........................................................74 5.4 Persistenz von Mycoplasma bovis ..............................................................77 5.5 Immunhistochemie ......................................................................................79 5.6 Diagnostik ...................................................................................................81 5.7 Schlussfolgerung ........................................................................................82 6 Zusammenfassung ..........................................................................................83 7 Summary...........................................................................................................87 8 Literaturverzeichnis .........................................................................................89 9 Anhang............................................................................................................107 9.1 Ergebnisse der Gruppen 1 bis 4 in tabellarischer Form ............................107 9.2 Lösungen für die Azanfärbung nach Heidenhain ......................................109 9.3 Siriusrot-Farblösung..................................................................................110 9.4 Lösungen für die Sondensynthese und- spezifizierung.............................110 9.5 Lösungen für die in situ-Hybridisierung .....................................................111 9.6 Lösungen für die Immunhistochemie ........................................................115 9.7 Bezugsquellen für Chemikalien.................................................................115 9.8 Bezugsquellen für Geräte und Einmalartikel .............................................118 Abkürzungsverzeichnis I Abkürzungsverzeichnis A Abb. AP Aqua bidest. Aqua dest. Adenin Abbildung alkalische Phosphatase Aqua bidestillata Aqua destillata BALF BALT bronchioalveoläre Lavage-Flüssigkeit engl. bronchus-associated lymphoid tissue (Bronchusassoziiertes lymphatisches Gewebe) 5-Brom-4-Chlor-3-Indolyl-Phosphat Bestellnummer engl. basepairs (Basenpaare) bovines respiratorisches Synzytialvirus bovines Serumalbumin bovines Virusdiarrhoe-Virus beziehungsweise BCIP Best. Nr. bp BRSV BSA BVDV bzw. ca. C °C CD CFU circa Cytosin Grad Celsius engl. cluster of differentiation (System zur Bezeichnung von Leukozytendifferenzierungsantigenen) engl. colony forming units (koloniebildende Einheiten) d DAB d. h. DIG DNA lat. dies (Tage) 3,3’-Diaminobenzidin-tetrahydrochlorid das heißt Digoxigenin engl. deoxyribonucleic acid (Desoxyribonukleinsäure) EDTA ELISA engl. et al. Ethylendiamintetraessigsäure engl. enzyme-linked immunosorbent assay (Enzym gekoppeltes, immunologisch-adsorbierendes Nachweisverfahren) englisch lat. et alii (= und andere) Fa. Firma g G grie. Gramm Guanin griechisch HE Hämatoxylin-Eosin IHC Immunhistochemie II Abkürzungsverzeichnis ISH in situ-Hybridisierung kbp kDa Kilobasenpaare Kilo Dalton lat. lateinisch M mg ml mm µl µm M. Min. Molarität Milligramm Milliliter Millimeter Mikroliter Mikrometer Mycoplasma Minuten n N N. N. Nr. Anzahl Normalität lat. nomen nescio (nicht bekannt) Nummer p. a. p. i. PBS lat. pro analysis (für analytische Zwecke) lat. post infectionem engl. phosphate-buffered saline (Phosphat-gepufferte Kochsalzlösung) engl. polymerase chain reaction (PolymeraseKettenreaktion) PCR RNA engl. ribonucleic acid (Ribonukleinsäure) SC SPF spp. subsp. small colony spezifiziert pathogenfrei lat. species Subspezies T Tab. Tris Thymin Tabelle Tris-(hydroxymethyl)-aminomethan U u. Uracil und Vlp Vsa engl. variable lipoprotein (variables Lipoprotein) engl. variable surface antigen (variables Oberflächenantigen) engl. variable surface protein (variables Oberflächenprotein) Vsp z. B. zum Beispiel Einleitung 1 1 Einleitung Mycoplasma (M.) bovis ist neben M. mycoides subsp. mycoides die wichtigste pathogene Mykoplasmenart des Rindes, die weltweit auftritt und zunehmend an Bedeutung gewinnt. Die häufigsten Erkrankungen durch M. bovis sind hierbei Pneumonien und Arthritiden bei Kälbern und Mastitiden bei Kühen. Durch die Erkrankungen entstehen Verluste, die gerade bei der Pneumonie der Kälber zu großen wirtschaftlichen Schäden führen. Meist handelt es sich um therapieresistente Erkrankungen des Respirationstraktes, für die zur Zeit noch kein zufrieden stellender Impfschutz erhältlich ist. Ziel dieser Arbeit war es, neben der histopathologischen Beschreibung von Lungenveränderungen bei experimentell infizierten Kälbern die Methode der in situHybridisierung für M. bovis an Formalin-fixiertem und Paraffin-eingebettetem Lungengewebe von diesen Kälbern zu etablieren. Dabei sollten die Verteilung und die Lokalisation der DNA analysiert und mit immunhistochemischen Befunden korreliert werden. Hierfür wurden Paraffinschnitte aus den Lungen experimentell infizierter Kälber untersucht. Die verwendeten spezifischen Sonden detektierten die Sequenz des Gens von VspA, einem variablen Oberflächenprotein (engl. variable surface protein) von M. bovis. Frühere Untersuchungen zeigten, dass M. bovis diverse variable Oberflächenproteine exprimiert. Es wird diskutiert, ob diese durch eine Antigenvariation an der Persistenz des Erregers im Respirationstrakt beteiligt bzw. für die fehlende Elimination desselben mitverantwortlich sind. Dabei war es von besonderem Interesse, ob in den verschiedenen Gewebelokalisationen, in denen immunhistochemisch Vsp-Antigene nachweisbar waren, auch die genomische Sequenz des VspA von M. bovis aufgefunden werden kann. Literaturübersicht 3 2 Literaturübersicht 2.1 Mykoplasmen 2.1.1 Charakteristika und Taxonomie Die erste Mykoplasmenspezies wurde 1896 von NOCARD und ROUX (1896) beschrieben. Hierbei handelte es sich um Mycoplasma (M.) mycoides subsp. mycoides small colony (SC), dem Erreger der kontagiösen Pleuropneumonie beim Rind. Seither wurden über 100 Mykoplasmenarten dokumentiert, welche sowohl aus warm- und kaltblütigen Wirbeltieren als auch aus Insekten und Pflanzen sowie Abwässern isoliert wurden (BOONE et al. 2001). Taxonomisch werden die Mykoplasmen in die Klasse der Mollicutes (lat. mollis – weich, cutis – Haut) eingeordnet. Hier werden vier Ordnungen unterschieden (Tabelle 1). Im Gegensatz zu anderen Bakterien besitzen die Mykoplasmen keine Zellwand (RAZIN 1992). Dieses führt zum einen zu einer pleomorphen Gestalt der 0,3 bis 0,8 µm großen Bakterien (RAZIN 1978). Zum anderen bedingt sich dadurch eine natürliche Resistenz gegenüber Antibiotika, die in die Zellwandsynthese eingreifen, wie beispielsweise β-Laktam-Antibiotika. Auf Grund ihrer geringen Größe und der Pleomorphie sind Mykoplasmen in der Lage, Bakterienfilter mit einer Porengröße von 0,45 µm zu passieren. Hierauf basierte die ursprüngliche Annahme zu Beginn des 20. Jahrhunderts, es handele sich um Viren (MASOVER u. HAYFLICK 1985; RAZIN 1992). Mykoplasmen sind unter bestimmten Bedingungen in der Lage, verzweigte und unverzweigte, bis 150 µm lange Filamente auszubilden. Dieses pilzartige Wachstum führte zu der Namensgebung (grie. myco – Pilz, plasma – Form) (RAZIN 1981). Ihrer geringen Größe entsprechend, besitzen Mykoplasmen das kleinste Genom prokaryotischer Bakterien mit 600 bis 1350 kbp je nach Spezies und Stamm. Daraus resultiert eine im Vergleich zu beispielsweise Escherichia coli auf ein Fünftel verminderte Genausstattung (RAZIN 1992). Eine Besonderheit der Mykoplasmen ist es, dass das Genom einen erstaunlich geringen Anteil an Guanin und Cytosin aufweist (DYBVIG u. VOELKER 1996). 4 Literaturübersicht Tabelle 1: Taxonomie und Eigenschaften der Klasse Mollicutis (modifiziert nach TULLY et al. 1993 und BOONE et al. 2001) G/CGehalt (in mol%) Genomgröße (in kbp) Vorkommen 1. Gattung: Mycoplasma (112) 23-40 600-1350 Mensch, Tier 2. Gattung: Ureaplasma (7) 27-30 760-1170 Mensch, Tier 1. Gattung: Entomoplasma (6) 27-29 790-1140 Insekten, Pflanzen 2. Gattung: Mesoplasma (12) 27-30 870-1100 Insekten, Pflanzen 25-30 940-2200 Insekten, Pflanzen Klassifizierung (Anzahl bekannter Spezies) 1. Ordnung: Mycoplasmatales Familie: Mycoplasmataceae 2. Ordnung: Entomoplasmatales 1. Familie: Entomoplasmataceae 2. Familie: Spiroplasmataceae Gattung: Spiroplasma (34) 3. Ordnung: Acholeplasmatales Familie: Acholeplasmataceae Gattung: Acholeplasma (14) Tiere, Pflanzen, Insekten 26-30 1500-1650 1. Gattung: Anaeroplasma (4) 29-30 1500-1600 Pansen Rd. & Schf. 2. Gattung: Asteroleplasma (1) 40 1500 Pansen Rd. & Schf. 4. Ordnung: Anaeroplasmatales Familie: Anaeroplasmataceae G: Guanin, C: Cytosin, kbp: Kilobasenpaare, Rd.: Rind, Schf.: Schaf Das Genom entstand während der Evolution wahrscheinlich aus einer Reduktion ehemals Gram-positiver Bakterien (WOESE 1987). Dadurch haben Mykoplasmen eingeschränkte Stoffwechsel- und Biosynthesewege, die eine überwiegend parasitäre Lebensform bedingen (RAZIN 1992). Diese führt auch zu einigen Problemen bei der Kultivierung der anspruchsvollen Mykoplasmen, die nur durch Literaturübersicht 5 spezielle Nährmedien gewährleistet werden kann (RAZIN 1978). Auf festen Nährböden zeigen Mykoplasmen ein charakteristisches Wachstum in Form von Spiegelei-förmigen Kolonien von bis zu 600 µm Durchmesser, deren Zentrum durch das Einwachsen der Zellen in den Agar dunkler als die Peripherie erscheint (HAYFLICK 1969). Die meisten Mykoplasmenspezies sind unbeweglich. Bei einigen Arten konnte jedoch eine aktive, gleitende Bewegung nachgewiesen werden (KIRCHHOFF 1982). 2.1.2 Pathogenitätsmechanismen bei Mykoplasmen Mykoplasmen besitzen als anspruchsvolle Mikroorganismen eine ausgesprochene Wirts- und Speziesspezifität (BREDT 1976a). Sie besiedeln als Kommensale oder Parasit überwiegend Schleimhautoberflächen des Respirations- und Urogenitaltraktes, aber auch Augen, Gelenke, Milchdrüse und andere Organe. Hierbei nutzen sie Kapsel- und Adhärenzstrukturen, die zu einer engen Anlagerung der Mykoplasmen zur Wirtszellmembran führt (RAZIN u. JACOBS 1992; SACHSE et al. 1996). Einige Mykoplasmen des Menschen und der Tiere sind auch in der Lage, in die Wirtszelle einzudringen (LO et al. 1992), wie es schon länger für die Mykoplasmen der Insekten und Pflanzen bekannt war. Diese Eigenschaft findet sich zum Teil auch in den Namen neu dokumentierter Arten wie M. penetrans des Menschen wieder. Da sie keine Zellwand besitzen, sind sie durch gegen Bakterien gerichtete lysosomale Enzyme des Wirtes nicht angreifbar (BREDT 1976a). Des Weiteren vermögen sie durch Nährstoffentzug und Stoffwechselprodukte wie Wasserstoffperoxid und Ammoniak zu einer Schädigung des Wirtes zu führen (RAZIN 1981). Eine weitere Besonderheit ist die Fähigkeit der Mykoplasmen, die wirtseigene Abwehr zu unterlaufen. Hierzu zählt zum einen die Hemmung ziliarer Aktivitäten im Respirationstrakt (GABRIDGE et al. 1985). Zum anderen sind einige Mykoplasmen in der Lage, in Form einer molekularen Mimikry eine Angleichung der antigenen Strukturen an den Wirt zu erlangen, so dass bei einer Abwehrreaktion des Wirtes eine Autoimmunreaktion hervorgerufen werden kann (TANGEN u. KIRCHHOFF 1995). Zudem zeigen einige Mykoplasmen eine ausgeprägte Variabilität in den Oberflächenproteinen, die zu einer ständigen Änderung der 6 Literaturübersicht antigenen Strukturen führt, wie sie beispielsweise für M. hyorhinis und M. bovis beschrieben sind (ROSENGARTEN u. WISE 1991; ROSENGARTEN et al. 1994). Zusätzlich ist für einige Mykoplasmenspezies eine Suppression von neutrophilen Granulozyten, Lymphozyten und Makrophagen beschrieben (ALMEIDA et al. 1992; BENNET u. JASPER 1977; THOMAS et al. 1991). Die im Rahmen einer Infektion mit Mykoplasmen entstehenden Läsionen werden möglicherweise eher durch die Abwehrmechanismen des Wirtes verursacht, als durch eine Mykoplasmen-vermittelte Zerstörung von Gewebe (BREDT 1976b). 2.1.3 Mykoplasmen als Krankheitserreger Mykoplasmen treten bei fast allen Spezies meist als Kommensalen auf. Es sind aber auch verschiedene pathogene Arten beschrieben, wobei der Schweregrad der Erkrankung von zahlreichen äußeren Einflüssen abhängt. Dadurch werden viele Mykoplasmosen zu den so genannten Faktorenerkrankungen gezählt (KIRCHHOFF u. RUNGE 1998). Ursprünglich ging man von einer extremen Wirtsspezifität der Mykoplasmen aus. Doch gibt es zunehmend Beschreibungen von Isolierungen aus „wirtsfremden“ Tieren. Dieses als „crossing“ bezeichnete Wechseln der Wirte hat eine besondere Bedeutung bei Fällen von immunsupprimierten Patienten (PITCHER u. NICHOLAS 2005). In der Schweinehaltung ist M. hyopneumoniae weit verbreitet. Dieser führt als alleiniger Erreger zu einer interstitiellen meist subklinisch verlaufenden Pneumonie mit Vermehrung des Bronchus-assoziierten lymphatischen Gewebes (engl. bronchus-associated lymphatic tissue, BALT). Durch die hierdurch beeinträchtigte Abwehrleistung der Lunge kommt es in der Regel zu einer sekundären bakteriellen Infektion, meist mit Bordetellen, Pasteurellen, aber auch Streptokokken und Hämophilus parasuis. Daraus ergibt sich das Bild der enzootischen Pneumonie (MAES et al. 1996; KIRCHHOFF u. RUNGE 1998). Als weitere pathogene Mykoplasmenart beim Schwein wäre M. hyorhinis als Erreger von respiratorischen Erkrankungen, Polyserositiden und Arthritiden zu nennen. Arthritiden werden auch durch Infektionen mit M. hyosynoviae hervorgerufen (KIRCHHOFF u. RUNGE 1998). Eperythrozoon suis, der Erreger einer Literaturübersicht 7 hämolytischen Anämie beim Schwein, wurde als M. haemosuis nachträglich in das Genus der Mykoplasmen eingruppiert (NEIMARK et al. 2001). Schafe und Ziegen entwickeln nach einer Infektion mit M. mycoides subsp. capri eine kontagiöse Pleuropneumonie mit ähnlichem Krankheitsbild wie beim Rind. Respiratorische Entzündungen werden ebenfalls durch M. ovipneumoniae und M. capricolum subsp. capripneumoniae verursacht (KIRCHHOFF u. RUNGE 1998). M. agalactiae führt zu dem Krankheitsbild der kontagiösen Agalaktie, ist aber auch in der Lage, entzündliche Veränderungen an Gelenken, Augen und Urogenitaltrakt zu verursachen (KIRCHHOFF u. RUNGE 1998). An Ratten und Mäusen konnten durch experimentelle Infektionen mit M. arthritidis wertvolle Erkenntnisse über die Entwicklung von Polyarthritiden, wie sie auch beim Menschen vorkommen, gewonnen werden. Wie bei den oben genannten Tieren gibt es auch bei Ratte und Maus mit M. pulmonis eine Spezies, die zu einer Infektion des Respirationstraktes führt, wobei auch Arthritiden, Otitiden und Genitalinfektionen möglich sind (KIRCHHOFF u. RUNGE 1998). Eine Besonderheit stellt die bei Mäusen durch M. neurolyticum verursachte Rollkrankheit dar. Hierbei werden die neuronalen Veränderungen durch ein Exotoxin des Erregers hervorgerufen (KIRCHHOFF u. RUNGE 1998). Für die bei Katzen (M. felis), Hunden (M. canis und M. cynos) und Pferden (M. equirhinis und M. equigenitalis) isolierten Arten ist die definitive pathogene Bedeutung noch unklar (KIRCHHOFF u. RUNGE 1998). Durch Neueingruppierung von Haemobartonella felis als M. haemofelis in die Art der Mykoplasmen findet sich eine für Katzen pathogene Art, welche zu einer hämolytischen Anämie führen kann (NEIMARK et al. 2001). Beim Menschen haben Infektionen mit M. pneumoniae als Erreger von respiratorischen Erkrankungen große Bedeutung. Die ebenfalls beim Menschen nachgewiesenen Mykoplasmen M. genitalium, M. penetrans und M. fermentans führen zunehmend, vor allem bei Patienten mit Immunschwäche wie bei Infektionen mit dem humanen Immundefizienzvirus (HIV), zu ernst zu nehmenden Erkrankungen (DOMINGUES et al. 2005). 8 Literaturübersicht 2.2 Mykoplasmosen des Rindes 2.2.1 Lungenseuche Das Krankheitsbild der kontagiösen Pleuropneumonie (Lungenseuche), ist seit dem 18. Jahrhundert bekannt, allerdings gelang erst 1896 NOCARD und ROUX (1896) die Isolierung des Erregers und damit auch die Isolierung der ersten Mykoplasmenart. Der Erreger M. mycoides subsp. mycoides SC wurde 1929 das letzte Mal in Deutschland nachgewiesen. In West- und Südeuropa kommt es sporadisch zu Ausbrüchen, während die Erkrankung in Afrika und Asien trotz Impfmaßnahmen noch sehr verbreitet ist und zu hohen wirtschaftlichen Verlusten führt (KIRCHHOFF u. RUNGE 1998). Klinisch treten vor allem bei adulten Tieren respiratorische Symptome auf, wobei Kälber eher Arthritiden, Endokarditiden und Myokarditiden aufweisen. Es sind auch chronische, klinisch meist unauffällige Erkrankungen möglich, die für die Epidemiologie des Erregers von großer Bedeutung sind (KIRCHHOFF u. RUNGE 1998). 2.2.2 Mycoplasma bovis Nach der Erstisolierung aus Milch Mitte der fünfziger Jahre in Schweden (ALSTRØM 1955) und der erstmaligen Beschreibung im Zusammenhang mit entzündlichen Veränderungen bei einem Mastitisausbruch in Connecticut/USA 1961 (HALE et al. 1962) konnte M. bovis im Laufe der Jahre in nahezu allen Ländern der Erde nachgewiesen werden. Wegen der Beteiligung an Mastitiden wurde der Erreger zunächst M. agalactiae var. bovis genannt. Auf Grund phänotypischer Charakterisierung und Nukleinsäure-Hybridisierung erfolgte eine Einteilung in eine eigene Spezies (ASKAA u. ERNØ 1976). Auf die Eigenschaften und die durch M. bovis verursachten Erkrankungen wird in Kapitel 2.3 näher eingegangen. 2.2.3 Sonstige Infektionen mit Mykoplasmen beim Rind Neben M. bovis werden auch M. dispar und M. bovirhinis aus den Lungen gesunder und erkrankter Rinder isoliert. Hierbei sind allerdings die beobachteten Veränderungen weniger stark ausgeprägt als bei Infektionen mit M. bovis (DUNGWORTH 1993). Da M. bovirhinis bei bis zu 40% gesunder Kälber Literaturübersicht 9 beispielsweise in Norddeutschland aus dem Nasenraum isoliert werden konnte, handelt es sich hierbei möglicherweise um eine apathogene Mykoplasmenart (KIRCHHOFF u. BINDER 1986). Zusätzlich konnten experimentell Pneumonien mit M. bovigenitalium verursacht werden; diese Spezies wird allerdings selten aus pneumonischem Lungengewebe isoliert (DUNGWORTH 1993). Mastitiden können durch eine Vielzahl von Mykoplasmen beim Rind verursacht werden. Zu der ersten mit einer Entzündung des Euters in Zusammenhang gebrachten Art gehört M. bovigenitalium (STUART et al. 1963), wobei der Erreger auch zu Entzündungen im Genitaltrakt führen kann (KIRCHHOFF 1982). Ebenfalls zu den Erregern von Mastitiden werden M. canadense, M. alkalescens, M. arginini, M. dispar und M. californicum genannt (GONZALES u. WILSON 2003). Letztere Art wird auch im Zusammenhang mit Arthritiden beschrieben (HEWICKER-TRAUTWEIN et al. 2002). Da M. californicum auch Pneumonien verursachen kann, hat diese Art neben M. bovis eine große Bedeutung bei dem so genannten „Pneumonie-ArthritisSyndrom“ der Kälber (SPERGSER et al. 2001; HEWICKER-TRAUTWEIN et al. 2002). Bei der Infektiösen Bovinen Keratokonjunktivitis (IBK) wird M. bovoculi eine ätiologische Rolle zugesprochen, möglicherweise als Wegbereiter für eine Infektion mit Moraxella bovis (ERNØ u. PERREAU 1985). 2.3 Mycoplasma bovis 2.3.1 Verbreitung M. bovis ist neben dem Erreger der Lungenseuche M. mycoides subsp. mycoides SC die für das Rind pathogenste Mykoplasmenart. M. bovis gilt als streng wirtsspezifisch, wobei allerdings neben dem Rind natürliche Infektionen bei Schafen beschrieben sind (PFÜTZNER u. SACHSE 1996). Experimentell können zudem Ziegen mit M. bovis infiziert werden (RODRÍGUEZ et al. 2000). Nach der Erstisolierung aus einem Mastitisfall 1961 (HALE et al. 1962) folgte ein Nachweis des Erregers, mutmaßlich verstärkt durch internationale Tiertransporte in vielen Staaten unter anderem auch in Deutschland im Jahr 1975 (WEHNERT et al. 1977). In einzelnen Regionen findet sich eine sehr unterschiedliche Prävalenz (NICOLET 10 Literaturübersicht 1994), wobei zu berücksichtigen ist, dass M. bovis nicht bei allen Untersuchungen routinemäßig erfasst wird. Gerade bei den Lungenveränderungen treten sekundär Keime wie Mannheimia haemolytica, Pasteurella multocida und Histophilus somni (ehemals Haemophilus somnus, ANGEN et al. 2003) auf, die eine Infektion mit M. bovis in den Hintergrund drängen (NICHOLAS u. AYLING 2003). Neuere Untersuchungen in verschiedenen Ländern Europas zeigen, dass eine zunehmende M. bovis-Prävalenz zu verzeichnen ist. So konnten KUSILUKA et al. (2000) in Dänemark einen Anstieg der M. bovis-Prävalenz innerhalb von fünf Jahren von 2% auf 24% feststellen. In Irland und Nordirland, die bis Anfang der 90er Jahre des letzten Jahrhunderts als M. bovis frei galten (REILLY et al. 1993), konnten bei 18% bzw. 15% der pneumonischen Kälberlungen M. bovis isoliert werden (BRICE et al. 2000; BYRNE et al. 2001). Untersuchungen von VOGEL et al. (2001) ergaben sogar eine M. bovis-Prävalenz von 69% in pneumonisch veränderten Lungen von Kälbern in der Schweiz. LE GRAND et al. (2001) konnten zeigen, dass in Frankreich 2% bis 13% der Tiere serologisch positiv für M. bovis waren. In Australien wiesen sogar 60% der Tiere Antikörper gegen M. bovis auf (GHADERSOHI et al. 2005). Auf Grund jüngster Untersuchungen in den Niederlanden ist zu vermuten, dass 25% bis 30% der Pneumonien beim Kalb primär durch M. bovis verursacht werden und dass daraus ein wirtschaftlicher Schaden von 45 bis 55 Euro pro Kalb in einem Milchviehbetrieb und sogar bis zu 117,50 Euro pro Kalb in einem Mastbetrieb entstehen (GEVAERT 2006). REEVE-JOHNSON (1999) schätzt den jährlichen Schaden durch M. bovis bedingte Pneumonien und damit einhergehende Verluste auf bis zu 576 Millionen Euro für den europäischen Raum. Epidemiologischen Untersuchungen zu Folge war der wesentliche Risikofaktor für eine Einschleppung von M. bovis in Milchviehbestände der Zukauf von Kälbern wie auch von Milchkühen (BURNENS et al. 1999). Trotz einer wachsenden Bedeutung wäre eine Eradikation möglich, solange wenige Tiere positiv sind, womit allerdings eine ständige serologische Kontrolle unabdingbar wäre (TER LAAK et al. 1992). 2.3.2 Erkrankung des Respirationstraktes Die in der Lunge von Kälbern nach spontaner oder experimenteller Infektion mit M. bovis beschriebenen Läsionen variieren zwischen interstitiellen pneumonischen Literaturübersicht Veränderungen, 11 katarrhalisch-eitrigen Bronchopneumonien unterschiedlichen Ausmaßes bis hin zu schwerwiegenden Pneumonien, bei denen multiple Nekroseherde und obliterierende Bronchiolitiden im Lungenparenchym auftreten (THOMAS et al. 1975; GOURLAY et al. 1989; ADEGBOYE et al. 1995a; RODRÍGUEZ et al. 1996a; HEWICKER-TRAUTWEIN et al. 2002; BUCHENAU 2003). Bei M. bovis handelt es sich um einen Keim, der Infektionen mit anderen bakteriellen wie viralen Erregern durch eine Beeinträchtigung der Abwehrlage des Wirtes begünstigt (POUMARAT et al. 2001). BUCHVAROVA und VESSILINOVA (1989) zeigten durch Untersuchungen von Lungen an Pneumonie verendeter Kälber, dass ein Drittel eine alleinige Infektion mit M. bovis aufwies, während die verbliebenen zwei Drittel eine Kombination von M. bovis mit Pasteurella multocida und/oder Histophilus somni zeigten. 2.3.2.1 Spontaninfektionen Kälber unterschiedlichen Alters sind empfänglich für eine respiratorische M. bovisInfektion. Meist tritt diese in den betroffenen Betrieben enzootisch auf, wobei häufig zeitnah ein Auftreten von Mykoplasmenmastitiden bei Kühen zu beobachten ist (BOCKLISCH et al. 1983). Nach einer primär respiratorischen Infektion kann eine hämatogene Ausbreitung stattfinden (BOCKLISCH et al. 1983). Meist kommt es zwischen der ersten und dritten Lebenswoche zu den ersten Anzeichen einer respiratorischen Erkrankung in Form von Dyspnoe, Husten und Nasenausfluss. Begleitend tritt häufig Fieber bis 41°C, Inappetenz und allgemeine Schwäche auf. Das zeitnahe Auftreten von Gelenksentzündungen wurde von ROMVÁRY et al. (1979) als „Pneumonie-Arthritis-Syndrom“ bezeichnet. Vereinzelt kommt es zu Todesfällen, in der Regel allerdings zu einer verminderten Gewichtszunahme (STIPKOVITS et al. 2000b). Die pathologisch-anatomischen Veränderungen variieren zwischen geringgradigen lobulär begrenzten katarrhalisch-eitrigen Bronchopneumonien in den Spitzenlappen, vorwiegend bei alleiniger Isolierung von M. bovis, bis hin zu schweren fibrinös-nekrotisierenden Pleuropneumonien, die große Teile der Lunge bis hin zu den kranioventralen Anteilen der Zwerchfellslappen betreffen (BOCKLISCH et al. 1983; STIPKOVITS et al. 2000b). Die interlobulären 12 Literaturübersicht Septen sind verdickt und weisen ein fibrinreiches Ödem auf, und aus den Bronchien ist ein muköses bis eitriges Exsudat abpressbar (STIPKOVITS et al. 2000b). Schwere Infektionen sind meist Folge einer Mischinfektion mit beispielsweise Pasteurellen (BOCKLISCH et al. 1983). Bei der histologischen Untersuchung des Lungengewebes zeigt sich das Bild einer exsudativen Bronchopneumonie mit z. T. zerfallenden neutrophilen Granulozyten, mononukleären Entzündungszellen und fibrinreicher Ödemflüssigkeit in Alveolen und Bronchioli. Durch Zellinfiltrate und Ödeme sind auch die alveolären Septen erweitert und verdickt (THOMAS et al. 1975; GOURLAY et al. 1989; RODRÍGUEZ et al. 1996a; STIPKOVITS et al. 2000b). Verschiedene Autoren beschrieben eine nekrotisierende Bronchiolitis sowie fokale Koagulationsnekrosen mit amorphem eosinophilen Material im Zentrum, umgeben von einem schmalen Saum pyknotischer Zellkerne (meist von neutrophilen Granulozyten) und einer breiten Schicht aus überwiegend mononukleären Entzündungszellen (GOURLAY et al. 1989; ADEGBOYE et al. 1995a; RODRÍGUEZ et al. 1996a). KHODAKARAM-TAFTI und LÓPEZ (2004) beschrieben zwei unterschiedliche Formen von Nekrosen, die sie bei Kälbern mit natürlicher Infektion fanden. Zum einen fand sich eine Koagulationsnekrose mit noch erkennbaren alveolären Strukturen mit Massen von neutrophilen Granulozyten und Fibrin. Zum anderen war eine verkäsende Form der Nekrose ohne erkennbare Lungenstruktur mit umgebendem Granulationsgewebe nachweisbar, wobei beide Nekroseformen zeitgleich in der Lunge eines Tieres vorkamen. 2.3.2.2 Experimentelle Infektionen Durch die endobronchiale bzw. intratracheale Infektion drei bis sieben Wochen alter gnotobiotischer Kälber mit einem bei einem Ausbruch respiratorischer Erkrankungen in England isolierten Stamm bewiesen GOURLAY et al. (1976) die Pathogenität von M. bovis im Lungengewebe. Seitdem wurde eine Vielzahl von Infektionsversuchen durchgeführt, welche die Pathogenität und deren Mechanismen von M. bovis erhellen sollten. Hierbei gab es zum einen Arbeitsgruppen, die Versuche an gnotobiotisch gehaltenen Kälbern durchführten (THOMAS et al. 1986; HOWARD et al. 1987a). Andere Gruppen griffen auf konventionell gehaltene Kälber zurück (MARTIN et al. 1983; PFÜTZNER et al. 1983; BRYS et al. 1989; STIPKOVITS et al. Literaturübersicht 13 2000a). Für die Versuche wurden jeweils aus natürlichen Infektionen stammende Feldisolate verwendet. Diese wurden entweder intratracheal, endobronchial, intranasal oder mittels eines Sprays im Abstand von 10 cm vor der Nase appliziert. Die Tötung der Tiere erfolgte nach 10 bis 14 Tagen bzw. 21 Tagen nach der Infektion. Trotz des unterschiedlichen Versuchsaufbaus wurden ähnliche Ergebnisse erlangt. Wenige der Kälber zeigten klinische Symptome. Diese waren vorübergehende Pyrexie, Tachypnoe, Husten, Apathie und Lahmheit (GOURLAY et al. 1976; RODRÍGUEZ et al. 1996a). Meist blieben seröser, zum Teil auch mukopurolenter (BRYS et al. 1989) Nasenausfluss oder vorübergehendes Fieber das einzige Symptom (PFÜTZNER et al. 1983; RODRÍGUEZ et al. 1996a). Lediglich in den von STIPKOVITS et al. (2000a) durchgeführten Versuchen kam es zu einzelnen Todesfällen, die auf eine Sekundärinfektion mit Pasteurella multocida und damit einhergehender verstärkter Entzündungsreaktion zurückzuführen waren. Die anschließende Sektion der Tiere ergab auch bei klinisch gesunden Tieren eine Verfestigung des Lungenparenchyms, die bis zu 25% des Gewebes ausmachte. Diese fand sich in der Regel in den Spitzen- und Mittellappen sowie im Lobus accessorius und wies nur bei stark veränderten Lungen eine Ausbreitung in die kranioventralen Bereiche der Hauptlappen auf (MARTIN et al. 1983). Histologisch zeigten Kälber mit geringen makroskopischen Veränderungen ein überwiegend aus neutrophilen Granulozyten zusammengesetztes entzündliches Exsudat in den Lumina von Bronchiolen. Um die Bronchien akzentuiert fand sich eine interstitielle Pneumonie sowie eine Proliferation der Lymphfollikel des BALT (MARTIN et al. 1983). Mit Zunahme der Entzündungsprozesse bei Tieren mit makroskopischen Veränderungen zeigten sich katarrhalische bis katarrhalisch-eitrige Bronchopneumonien, die durch Einbeziehung von Nachbarläppchen konfluierend auftraten. Bei den Tieren mit den ausgeprägtesten Lungenveränderungen wurden lobuläre eitrige Bronchopneumonien mit Tendenz zur Einschmelzung, fibrinöse Exsudationen und Abszessbildung gefunden (MARTIN et al. 1983). Meist wurden in diesen Fällen außer M. bovis noch weitere Bakterien wie Mannheimia haemolytica aus den veränderten Arealen isoliert. Auch HOWARD et al. (1987a) und STIPKOVITS et al. (2000a) konnten bei den experimentell infizierten Kälbern 14 Literaturübersicht Koagulationsnekrosen unterschiedlicher Ausprägung nachweisen. Die zentralen Nekrosen wurden von einem schmalen Saum untergehender Zellen sowie einer sich daran anschließenden breite Schicht aus mononukleären Entzündungszellen umgeben. Gleichartige Nekrosen wurden auch von THOMAS et al. (1986) beschrieben, wobei hier in größeren Nekrosearealen Überreste von Alveolen und kleinen Bronchioli gefunden wurden, die als „ghost lung structures“ bezeichnet wurden. Eine Proliferation des peribronchiolären lymphatischen Gewebes wurde von allen Autoren in unterschiedlicher Ausprägung beschrieben. Diese führt zum Teil zu einer vollständig die Bronchien umgebenden Lymphozytenscheide, welche auch als „cuff“-Bildung bezeichnet wird (BRYS et al. 1989). STIPKOVITS et al. (2000a) stellten zudem mikroskopisch Zilienverluste und degenerative Veränderungen zilientragender Zellen des Epithels der mit M. bovis infizierten Kälber fest. 2.3.2.3 Immunhistologische Befunde In mehreren Untersuchungen wurde mittels immunhistochemischer Methoden M. bovis-Antigen mit polyklonalen und monoklonalen Antikörpern nachgewiesen (THOMAS et al. 1986; HOWARD et al. 1987a; GOURLAY et al. 1989; ADEGBOYE et al. 1995a; RODRÍGUEZ et al. 1996a; LINKNER et al. 2000; BUCHENAU 2003; KHODAKARAM-TAFTI u. LÓPEZ 2004). Gerade im Randbereich nekrotischer Veränderungen wurde mittels Immunperoxidase-Technik mit gegen M. bovis gerichtetem Kaninchenserum als primärer Antikörper Antigen nachgewiesen. Dieses lag in Assoziation zu den untergehenden Zellen oder extrazellulär (THOMAS et al. 1986; HOWARD et al. 1987a; GOURLAY et al. 1989; RODRÍGUEZ et al. 1996a). Die Darstellung von M. bovis-Antigen in der Umgebung von Nekrosearealen gelingt RODRÍGUEZ et al. (1996a, b) zudem mit einem monoklonalen Antikörper der Bezeichnung 5A10 sowie ADEGBOYE et al. (1995a) mit einem Antikörperpool aus drei monoklonalen Antikörpern aus Mäuseaszitesflüssigkeit (Bezeichnung der Klone: MYB57, MYB87, MYB163), die mit dem M. bovis-Stamm M23 erzeugt wurden. Auch im Zentrum von Nekrosen konnten RODRÍGUEZ et al. (1996a) und HOWARD et al. (1987a) M. bovis-Antigen darstellen. In den beiden Nekroseformen, die von KHODAKARAM-TAFTI und LÓPEZ (2004) beschrieben wurden, fanden sich in allen Bereichen der Nekrosen M. bovis-Antigen, wobei in der Koagulationsnekrose eine Literaturübersicht 15 deutliche Akzentuierung im Randbereich vorhanden war. Im Bereich der Luftwege konnte M. bovis-Antigen im Exsudat im Bronchiallumen nachgewiesen werden (THOMAS et al. 1986; HOWARD et al. 1987a; GOURLAY et al. 1989; RODRÍGUEZ et al. 1996a). Aber auch Antigen in Form granulärer Strukturen in Bronchial- und Bronchiolarepithelzellen fanden ADEGBOYE et al. (1995a, b) mit einem monoklonalen Antikörperpool gegen M. bovis, GOURLAY et al. (1989) mit Kaninchenantiserum und RODRÍGUEZ et al. (1996a) mit einem monoklonalen Antikörper (Klon 5A10). RODRÍGUEZ et al. (1996a) konnten zudem bei experimentell infizierten Kälbern an der Oberfläche von Epithelzellen kleinerer Bronchien und Bronchiolen Antigen nachweisen. LINKNER et al. (2000) sowie BUCHENAU (2003) fanden in ihren Untersuchungen ähnliche Verteilungen von Antigen. Zusätzlich konnte hier M. bovis-Antigen im Bereich der Alveolarwände mittels monoklonaler Antikörper (1E5, 1A1, 4D7) nachgewiesen werden. 2.3.3 Weitere Erkrankungen durch Mycoplasma bovis Durch eine hämatogene Streuung treten bei Kälbern im Gefolge von Pneumonien häufig Polyarthritiden Gelenkkapselgewebes auf, die mit zum durch schwerwiegende Nekrosen des destruierenden Knorpel- und Teil Knochenveränderungen gekennzeichnet sind (ROMVÁRY et al. 1979; CORBOZ et al. 1980; HEWICKER-TRAUTWEIN et al. 2003). Diesem Krankheitsbild wurde der Begriff „Pneumonie-Arthritis-Syndrom“ gegeben (ROMVÁRY et al. 1979). Die Veränderungen von meist fibrinopurulentem Charakter können sich auch auf die die Gelenke umgebenden Strukturen ausweiten und somit beispielsweise zu Tendovaginitiden führen (ADEGBOYE et al. 1996). GAGEA et al. (2006) diagnostizierten in einer Studie an natürlich mit M. bovis infizierten Kälbern bei 46% der Tiere mit pneumonischen Lungen zusätzlich eine Arthritis. Einige Autoren beschreiben bei Kälbern mit entzündlichen Lungenveränderungen mit Nachweis von M. bovis eitrige Otitiden, aus denen ebenfalls M. bovis isoliert werden konnte (WALZ et al. 1997; MAEDA et al. 2003). STIPKOVITS et al. (1993) und AYLING et al. (2005) beschreiben den Nachweis von M. bovis aus entzündlich verändertem Gehirn bei Kälbern, und KINDE et al. (1993) wiesen M. bovis aus Dekubitalabszessen bei 16 Literaturübersicht Kälbern nach. Eine Keratokonjunktivitis kann ebenfalls Folge einer Infektion mit M. bovis sein (KIRBY u. NICHOLAS 1996). Bei Kühen kommt es durch eine aufsteigende Infektion durch den Zitzenkanal zu der enzootischen Mastitis, wobei subklinische Infektionen mit der Tendenz zur Persistenz relativ häufig auftreten (GONZALEZ u. WILSON 2003). Diese sind epidemiologisch ein kritischer Faktor, zumal durch den Melkvorgang als auch über mit kontaminierter Milch verschmutzte Liegeflächen ein Infektionsrisiko für die restlichen Tiere der Herde gegeben ist (PFÜTZNER u. SACHSE 1996). Die Mykoplasmenmastitis, die zu jedem Zeitpunkt der Laktation, allerdings gehäuft zum Zeitpunkt des Abkalbens auftreten kann, beginnt meist akut (PFÜTZNER u. SACHSE 1996). Die verhärteten und vergrößerten Viertel sind nicht schmerzempfindlich, und der Milchcharakter ist stark verändert. Die Milchleistung nimmt stark ab, wobei es auch zum völligen Sistieren der Milchproduktion kommen kann (PFÜTZNER 1990). Durch die Ausscheidung von M. bovis über die Milch ist auch eine mögliche Infektionsquelle für Kälber bei der Aufnahme der Kolostralmilch bzw. bei der Aufzucht mit Vollmilch gegeben. GHADERSOHI et al. (1999) untersuchten die Prävalenz von M. bovis in Milchviehbeständen in Australien. Bei 77% der Kühe mit hoher Zellzahl konnte M. bovis nachgewiesen werden. Ob durch eine hämatogene Streuung von einer Mastitis eine Besiedelung des Genitaltraktes möglich ist, oder ob es sich hierbei um aszendierende Infektionen handelt, ist unklar (PFÜTZNER u. SACHSE 1996). Infektionen des Genitaltraktes führen zu Endometritis und Salpingitis (HARTMANN et al. 1964; KIRCHHOFF 1982). Eine Infektion des Uterus kann zudem zu einer verschlechterten Fertilisation (EAGLESOME u. GARCIA 1990) und verlängerten Rast- und Zwischenkalbezeit führen (UHAA et al. 1990a, b). Ebenfalls beschrieben sind Spätaborte mit Nachweis von M. bovis (BOCKLISCH et al. 1986) sowie die Geburt lebensschwacher Kälber und Nachgeburtsverhaltung (GRUNERT et al. 1992). GRUNERT et al. (1992) beschrieben auch das Auftreten von Arthritiden, Tendovaginitiden, Gliedmaßenverkrümmung und Pneumonie bei in utero infizierten Kälbern. Bei Bullen führt eine aufsteigende Infektion im Genitaltrakt zu einer seminalen Vesikulitis, Epididymitis, Periorchitis und Ampullitis (KIRCHHOFF 1982). Literaturübersicht 17 Über das kontaminierte Sperma ergibt sich eine mögliche Route für die Einschleppung des Erregers in einen Bestand. 2.3.4 Immunantwort Mehrere Untersuchungen zeigen, dass der Wirtsorganismus nach einer Infektion mit M. bovis mit einer humoralen Immunantwort, das heißt mit der Bildung von Immunglobulinen reagiert. Diese sind in der Tracheobronchialflüssigkeit und im Zytoplasma von Immunzellen nachweisbar, die im Lungengewebe akkumulieren (HOWARD et al. 1986, 1987a). Des Weiteren kommt es im Lungengewebe zu einer Proliferation des peribronchialen und –bronchiolären lymphatischen Gewebes (so genanntes bronchus-associated lymphoid tissue, BALT) (GOURLAY et al. 1976; MARTIN et al. 1983; RODRÍGUEZ et al. 1996a; HEWICKER-TRAUTWEIN et al. 2002; BUCHENAU 2003). Trotz dieser sich bei infizierten Tieren entwickelnden Immunantwort ist der Erreger bzw. das Erregerantigen noch mehrere Wochen nach der Infektion in den Lungen der Tiere nachweisbar. Bislang ist der Mechanismus, der es M. bovis ermöglicht, im Respirationstrakt des Wirtes zu persistieren, unklar. Es wird jedoch angenommen, dass eine in der Lunge des Wirtes erfolgende Antigenvariation des Erregers an der Persistenz beteiligt bzw. für die fehlende Elimination desselben mitverantwortlich ist (NICHOLAS u. AYLING 2003; ROSENGARTEN et al. 2000). Zudem gibt es Untersuchungen von beispielsweise M. dispar, die zeigen, dass Kapselbestandteile einen inhibitorischen Effekt auf bovine Alveolarmakrophagen haben und somit für die Ausbreitung während der Infektion von Bedeutung sind (ALMEIDA et al. 1992). VANDEN BUSH u. ROSENBUSCH (2004) konnten ein die Lymphozyten hemmendes Peptid nachweisen, welches von M. bovis synthetisiert wird. 2.3.5 Antigen- und Phasenvariation Bei dem auch als „Phasenvariation“ oder „Switching“ bezeichneten Phänomen der Antigenvariation kommt es durch spontanes An- und Abschalten der Synthese von Membranproteinen zur ständigen Änderung der antigenen und strukturellen Eigenschaften der Membranoberfläche des Erregers. Die variablen Oberflächenproteinantigene von M. bovis, bei denen es sich um Lipoproteine handelt, werden als „variable surface proteins“ (Vsps) bezeichnet (BEHRENS et al. 18 Literaturübersicht 1994). Bislang kennt man die Nukleotidsequenzen von 13 verschiedenen Genen, die jeweils ein Vsp exprimieren (LYSNYANSKY et al. 2001b). Darüber hinaus besitzt M. bovis ein weiteres, nicht mit den Vsps verwandtes Oberflächenprotein, welches die Bezeichnung pMB67 trägt (BEHRENS et al. 1996). Untersuchungen an natürlich und experimentell mit M. bovis infizierten Kälbern zeigen, dass drei Mitglieder der Vsp-Familie, nämlich VspA, VspB und VspC, stark immunogen sind und die humorale Immunantwort stimulieren, wobei Antikörper produziert werden, die spezifisch mit den Vsps von M. bovis reagieren (BRANK et al. 1999). Die bislang zur Antigenvariation von M. bovis existierenden Erkenntnisse sprechen dafür, dass die Vsps nicht nur beim Vorgang der Adhärenz an Wirtszellen beteiligt sind, sondern dass es dem Erreger aufgrund des Phänomens der Antigenvariation gelingt, sich trotz der Immunantwort des Wirtes der Elimination aus dem Respirationstrakt zu entziehen (SACHSE et al. 1996, 2000; LYSNYANSKY et al. 2001b). Die zur Antigenvariation von M. bovis bislang vorliegenden Erkenntnisse beruhen im Wesentlichen auf Untersuchungen an kultivierten Mikroorganismen, d. h. auf in vitro durchgeführten Experimenten. Immunhistochemische Untersuchungsergebnisse sprechen jedoch dafür, dass es auch in vivo, also im Wirtsgewebe, zur Expression variabler Oberflächenproteinantigene von M. bovis kommt. In diesen immunhistochemischen Untersuchungen konnten in Paraffin- bzw. Gefrierschnitten aus Lungen experimentell infizierter Kälber Vsp-Antigene und pMB67-Antigen von M. bovis mit verschiedenen monoklonalen Antikörpern (Klone 1E5, 1A1, 4D7, I2) nachgewiesen werden (LINKNER et al. 2000; BUCHENAU 2003). Die verwendeten monoklonalen Antikörper besitzen Spezifitäten für VspA, B und C (Klone 1E5 und 4D7), für VspA, C und andere, noch nicht definierte Vsps (Klon 1A1) oder für pMB67 (Klon I2) (ROSENGARTEN et al. 1994; LE GRAND et al. 1996; BEIER et al. 1998). So wurde in Lungengewebe experimentell infizierter Kälber mit den genannten monoklonalen Antikörpern eine immunhistochemische Reaktivität für Vsp-Antigene an der Bronchialepitheloberfläche, im Bronchialexsudat, auf der Alveolaroberfläche, in interalveolären Septen, im Randbereich von Nekrosen und im Zytoplasma von Makrophagen und neutrophilen Granulozyten festgestellt (LINKNER et al. 2000; BUCHENAU 2003). Des Weiteren wurde in diesen Untersuchungen ein Literaturübersicht Reaktionsprodukt Basalmembran 19 auch des im Zytoplasma Bronchialepithels von und Bronchialepithelzellen, im Bereich des an der proliferierten peribronchiolären Gewebes gefunden. 2.3.6 Immunprophylaxe Zur Zeit ist keine kommerzielle Vakzine gegen M. bovis verfügbar, die einen vollständigen Schutz vor einer Infektion geben würde. Bei den im Schrifttum beschriebenen Vakzinationsversuchen, in denen mit Formaldehyd oder Saponin inaktivierte M. bovis-Stämme eingesetzt wurden, war zwar eine deutliche Reduktion des Ausmaßes der Lungenveränderungen und der Todesfälle zu verzeichnen, ein vollständiger Infektionsschutz wurde jedoch nicht erzielt (HOWARD et al. 1987a; BRYSON et al. 1999; NICHOLAS et al. 2002). 2.3.7 Therapie Die Behandlung mit M. bovis infizierter Kälber ist in der Regel erfolglos, da bei vielen europäischen Stämmen eine zunehmende Resistenz gegenüber Antibiotika festgestellt wurde (AYLING et al. 2000). Die antibiotische Therapie hat allerdings ihre Berechtigung zur Eindämmung sekundärer Infektionen. Fluoroquinolone wie beispielsweise das Danofloxacin und Tylosin zeigten sich 1993 in vitro noch gegen M. bovis antimikrobiell wirksam (COOPER et al. 1993), wobei sich gegen Tylosin mittlerweile Resistenzen ausgebildet haben, welche auch für Oxytetracyclin und Tetracykline auftreten (THOMAS et al. 2003). Gentamycin, Lincomycin und Spectinomycin haben sich als wenig effektiv bei der Behandlung bzw. Vorbeuge von M. bovis bedingter Erkrankungen erwiesen (THOMAS et al. 2003; VISSER et al. 1999). Somit zeigt zur Zeit nur Danofloxacin einen befriedigenden Therapieansatz zur Bekämpfung von M. bovis. Vorbeugende Maßnahmen bei M. bovis-Infektionen umfassen allgemeine Beachtung technischer, hygienischer und anderer Managementfaktoren, regelmäßige Bestandskontrollen, die schnelle und sichere Erkennung erkrankter Tiere sowie die rasche und konsequente Merzung positiver Rinder (BAUMGÄRTNER 1999). 20 Literaturübersicht 2.3.8 Diagnostik zum Erregernachweis Auf Grund der Schwierigkeiten der Therapie und der Prophylaxe gegen Infektionen durch M. bovis kommt der bestandsumfassenden Diagnostik eine besondere Bedeutung zu. Die Anzüchtung der anspruchsvollen Keime erweist sich oft als langwierig und schwierig und ist somit nicht das Mittel der Wahl für ein zügiges Ergebnis. In den frühen 90er Jahren wurden Enzym-gekoppelte, immunologischadsorbierende Nachweisverfahren (engl. enzyme-linked immunosorbent assay, ELISA) entwickelt, die gerade bei der Diagnostik von Milchproben sehr erfolgreich sind (HELLER et al. 1993). Zum Nachweis von M. bovis-Antigen ist auf dem Markt ein kommerzielles Kit erhältlich, welches von BALL und FINLEY (1998) entwickelt wurde (Bio X, Luxemburg). In den 90ern kam zunehmend die PolymeraseKettenreaktion (engl. polymerase chain reaction, PCR) zum Einsatz (GHADERSOHI et al. 1997). HOTZEL et al. (1999) beschreiben sogar ein kombiniertes Verfahren, bei dem durch monoklonale Antikörper eine Aufkonzentrierung von M. bovis für eine PCR erreicht werden konnte. Bei der Diagnostik der respiratorischen Mykoplasmose ist zu berücksichtigen, dass sich ein Nasentupfer zwar als die bequemere Art der Probensammlung erweist, allerdings eine deutlich geringere Sensitivität aufweist wie die zurückgewonnene Flüssigkeit einer bronchioalveoläre Lavage (bronchioalveoläre Lavage-Flüssigkeit, BALF) (THOMAS et al. 2002). 2.4 In situ-Hybridisierung Die Methode der in situ-Hybridisierung (ISH) hat sich als ein wertvolles Instrument zur Lokalisierung von Erregernukleinsäuren im infizierten Wirtsgewebe erwiesen (LEITCH et al. 1994). 2.4.1 Methode Bei der ISH kann man genomische DNA im histologischen Schnitt nachweisen, indem man die Fähigkeit von Nukleotidsträngen nutzt, sich komplementär aneinander zu legen. Die Methode wurde 1969 von PARDUE und GALL (1969) sowie JOHN et al. (1969) unabhängig voneinander entwickelt. Am Anfang war es lediglich möglich, die Sonden mittels Einbau radioaktiver Moleküle in Nukleotide Literaturübersicht (Phosphor 32 21 P, Schwefel 35 S, Jod 125 I und Wasserstoff 3H) zu markieren. Das Problem bei diesen radioaktiven Sonden ist zum einen die durch die Strahlung bedingte mögliche Belastung der damit hantierenden Personen. Zum anderen werden für radioaktive Stoffe bestimmte Anforderungen an die Räume gestellt, in denen gearbeitet wird. Ein weiterer Nachteil ist der relativ schnelle Aktivitätsverlust dieser Sonden (LEITCH et al. 1994). Dieses führte zu der Entwicklung nicht radioaktiv markierter Sonden, wobei direkte und indirekte Verfahren unterschieden werden. Zu den direkten Verfahren gehört beispielsweise der Einbau von Fluoreszenzfarbstoffen wie Tetramethylrhodaminisothiocyanat. Die indirekten Verfahren arbeiten mit Markermolekülen wie Biotin und Digoxigenin, die in Nukleinsäuren eingebaut werden. Diese werden anschließend mittels immunhistochemischer Verfahren mit enzymgekoppelten Antikörpern detektiert (LEITCH et al. 1994). Als Sonden können sowohl DNA- als auch RNA-Abschnitte - je nach zu suchender Sequenz - verwendet werden, die zudem in unterschiedlichen Längen eingesetzt werden können (WILKINSON 1999). 2.4.2 Anwendung Die ISH wurde schon in vielen Untersuchungen zur Detektion bestimmter Organismen im Gewebe verwendet. So findet sie ihre Anwendung bei Viren wie beispielsweise bei dem porzinen Circovirus Typ 2 (KIM u. CHAE 2001), Bakterien wie beispielsweise bei Neorickettsia risticii (CHAE et al. 2002) und Pilzen wie beispielsweise bei Aspergillus fumigatus (HANAZAWA et al. 2000). Bislang gibt es nur wenige Arbeiten, in denen Gensonden zur Darstellung von Mykoplasmen-DNA im Gewebe eingesetzt wurden. So gelang es einigen Autoren (KWON u. CHAE 1999; BOYE et al. 2001; KWON et al. 2002), im Lungengewebe von natürlich oder experimentell infizierten Schweinen erregerspezifische DNA von M. hyopneumoniae und anderen pathogenen Mykoplasmenspezies des Schweines nachzuweisen. Über den Nachweis von M. bovis-DNA in Gewebeproben infizierter Kälber mittels der Methode der ISH gibt es bislang keine Untersuchungen. MC CULLY und BROCK (1992) veröffentlichten 1992 eine DNA-Hybridisierung im Southern Blot mit einer mit radioaktivem Phosphor markierten Sonde an extrahierter M. bovis-DNA. Diese 22 Literaturübersicht Sonde wies eine Länge von 1150 bp auf und fand keine weitere Verwendung in einer ISH. Material und Methoden 23 3 Material und Methoden 3.1 Kälber Zur Untersuchung lagen Lungengewebeproben von insgesamt 35 Kälbern vor. Diese stammten aus verschiedenen Infektionsversuchen und wurden je nach verwendetem M. bovis-Stamm, Sektionszeitpunkt und eventuelle Vorbehandlung in drei Gruppen sowie eine Kontrollgruppe eingeteilt. 3.1.1 Gruppe 1 (Kontrollgruppe) In Gruppe 1 fanden sich fünf Kälber, die in den nachfolgend angeführten Infektionsversuchen als negative Kontrolltiere dienten. Diese waren in der bakteriologischen Untersuchung (BU) mittels kultureller Nachweisverfahren und in der PCR frei von M. bovis. Andere Mykoplasmen und weitere Bakterien konnten ebenfalls nicht nachgewiesen werden. Die Daten der Kälber sind in Tabelle 2 wiedergegeben. Tabelle 2: Daten der Kälber aus Gruppe 1 (Kontrollgruppe) Lfd. Nr. TierNr. E-Nr. 1 3444 2934/00 60 Kontrolle 2 4835 2935/00 81 3 307 1504/99 4 4261 5 N. N. Alter in M. bovis- Sektion p. i. Tagen Stamm in Tagen BU Lunge M. bovis BU Lunge and. M. BU and. Bakt. 21 n n n Kontrolle 21 n n n 28 Kontrolle 21 n n n 1505/99 28 Kontrolle 21 n n n 1650/99 28 Kontrolle 21 n n n Lfd. Nr.: laufende Nummer; Tier-Nr.: Tiernummer (während der Infektionsversuche); N. N.: nicht bekannt, E-Nr.: Einsendungsnummer; p. i.: post infectionem; BU: bakteriologische Untersuchung; M. bovis: Mycoplasma bovis; and. M.: andere Mykoplasmen; and. Bakt.: andere Bakterien; n: nicht nachgewiesen 3.1.2 Gruppe 2 In Gruppe 2 fanden sich acht Kälber, die aus einem Infektionsversuch stammten, der am damaligen Centre National d´Études Vétérinaires et Alimentaires (CNEVA, jetzt 24 Material und Methoden Agence Française de Sécurité des Aliments, AFSSA) in Lyon, Frankreich, im Januar 1997 durchgeführt worden war. Die Kälber wiesen zum Zeitpunkt der Infektion ein Alter von 21 Tagen auf. Für die Infektion wurden 20 bis 40 ml Mykoplasmensuspension verwendet, die aus einer klonalen Variante des TypStammes PG45 bestand. Diese klonale Variante exprimiert ausschließlich das variable Oberflächenprotein VspA 64 kDa. Es wurde eine Suspension mit einem Titer von ca. 4 x 1010 CFU/ml intratracheal inokuliert. Die Kälber stammten aus Herden seronegativer Kühe, deren Kälber im vorangegangenen Jahr weder Symptome von Pneumonie noch von Arthritis gezeigt hatten. Die Tiere waren serologisch negativ, und es wurde sichergestellt, dass keine der Kühe im vorangegangenen Jahr Anzeichen einer Mastitis gezeigt hatte. Vor Versuchsbeginn wurden alle Tiere auf eine bereits bestehende Infektion mit M. bovis oder andere Mykoplasmen durch Bronchialwaschungen und serologische Tests untersucht. Die Tiere wurden zu unterschiedlichen Zeitpunkten nach der Infektion getötet und anschließend seziert. Bei vier der acht Kälber konnte eine Infektion mit M. bovis postmortal nachgewiesen werden. Bei drei Tieren konnten zum Teil zusätzlich andere Mykoplasmen festgestellt werden. Je ein Tier wies des Weiteren eine Infektion mit Pasteurella multocida bzw. Mannheimia haemolytica auf. Bei einem Kalb wurden nicht genauer bestimmte Bacillus-Spezies nachgewiesen. Die Daten der Tiere sowie die Ergebnisse der Rückisolierung von bakteriellen Keimen aus der Lunge sind in Tabelle 3 wiedergegeben. Material und Methoden 25 Tabelle 3: Daten der Kälber aus Gruppe 2 Lfd. Nr. E-Nr. Alter in Tagen M. bovisStamm Dosis (CFU/ml) Sektion p. i. in Tagen BU Lunge M. bovis BU Lunge and. M. BU and. Bakt. 6 2 21 PG45 4 x 1010 10 n n n 7 5 21 PG45 4 x 1010 4 j j M. h. 8 7 21 PG45 4 x 1010 2 n n n 9 8 21 PG45 4 x 1010 10 n n n 10 9 21 PG45 4 x 1010 6 j n n 11 10 21 PG45 4 x 1010 6 j j Bac. 12 12 21 PG45 4 x 1010 2 j n n 13 13 21 PG45 4 x 1010 4 n j P. m. Lfd. Nr.: laufende Nummer; E-Nr.: Einsendungsnummer; CFU: koloniebildende Einheiten (engl.: colony forming units); p. i.: post infectionem; BU: bakteriologische Untersuchung; M. bovis: Mycoplasma bovis; and. M.: andere Mykoplasmen; and. Bakt.: andere Bakterien; n: nicht nachgewiesen j: nachgewiesen; M. h.: Mannheimia haemolytica; Bac.: Bacillus-Spezies; P. m.: Pasteurella multocida 3.1.3 Gruppe 3 In Gruppe 3 wurden Kälber zusammengefasst, die aus Infektionsversuchen eines gemeinsamen Forschungsprojektes der Arbeitsgruppen von Prof. Dr. Renate Rosengarten (Institut für Bakteriologie, Mykologie und Hygiene, Veterinärmedizinische Universität Wien, Österreich) und Prof. Dr. Marion HewickerTrautwein (Institut für Pathologie, Tierärztliche Hochschule Hannover) entstammten. Die Versuche wurden im April 1999 und Juli 2000 durchgeführt. Es handelte sich zum einen um Tiere, die mit 30 ml einer bakteriellen Suspension des M. bovisStammes 1067 inokuliert wurden. Als Inokulationsroute wurde die Trachea gewählt. Vier Tiere erhielten die Suspension mit einem Titer von 7,4 x 109 CFU/ml, je zwei Tiere mit einem Titer von 108 bzw. 1010 CFU/ml. Zum anderen wurden vier weitere Tiere mit einem französischen Feldstamm infiziert, der aus einem Bestand in Frankreich isoliert wurde. Dieser wurde je zwei Kälbern mit einem Titer von 108 bzw. 1010 CFU/ml intratracheal inokuliert. Die aus Niederösterreich stammenden Tiere gehörten alle der Rasse Simmentaler an. Während einer zweiwöchigen Akklimatisationsphase zu Beginn des Versuches wurde durch Untersuchungen 26 Material und Methoden mittels bronchioalveolärer Lavage und serologischer Tests wie der Western Blot Technik sichergestellt, dass bei den Kälbern keine natürliche M. bovis-Infektion vorlag. 18 Tage später wurden die Tiere mit der oben beschriebenen M. bovis-Kultur infiziert und 21 Tage nach der Infektion getötet und seziert. Tabelle 4: Lfd. TierNr. Nr. Daten der Kälber aus Gruppe 3 E-Nr. Alter in Tagen M. bovisStamm Dosis (CFU/ml) Sektion p. i. in Tagen BU Lunge M. bovis BU Lunge and. M. BU and. Bakt. 14 176 2936/00 57 1067 7,4 x 109 21 j n Arc. 15 998 2937/00 57 1067 7,4 x 109 21 j n Arc. 16 4838 2938/00 67 1067 7,4 x 109 21 j n n 17 341 2939/00 63 1067 7,4 x 109 21 j n n 18 7701 1506/99 28 1067 1 x 108 21 j n n 19 3688 1507/99 28 1067 1 x 1010 21 j n P. m. 20 3051 1508/99 28 1067 1 x 108 21 j n n 21 353 1509/99 28 1067 1 x 1010 21 j n P. m. 22 7393 1510/99 28 franz. Feldstamm 1 x 1010 21 j n P. m. 23 6079 1511/99 28 franz. Feldstamm 1 x 108 21 j n n 24 7672 1512/99 28 franz. Feldstamm 1 x 1010 21 j n P.m. 25 7102 1513/99 28 franz. Feldstamm 1 x 108 21 j n n Lfd. Nr.: laufende Nummer; Tier-Nr.: Tiernummer (während der Infektionsversuche); E-Nr.: Einsendungsnummer; franz. Feldstamm: französischer Feldstamm; CFU: koloniebildende Einheiten (engl.: colony forming units); p. i.: post infectionem; BU: bakteriologische Untersuchung; M. bovis: Mycoplasma bovis; and. M.: andere Mykoplasmen; and. Bakt.: andere Bakterien; n: nicht nachgewiesen; j: nachgewiesen; Arc.: Arcanobacterium pyogenes; P. m.: Pasteurella multocida Bei allen zwölf Tieren wurde postmortal M. bovis in der Lunge nachgewiesen. Andere Mykoplasmen konnten nicht festgestellt werden. Zwei Tiere wiesen eine Infektion mit Arcanobacterium pyogenes und vier andere Kälber eine Infektion mit Pasteurella Material und Methoden 27 multocida auf. Die Daten der Tiere sowie die Ergebnisse der Reisolierung von bakteriellen Keimen aus der Lunge sind in Tabelle 4 dargestellt. 3.1.4 Gruppe 4 In der letzten Gruppe wurden zehn Kälber zusammengefasst, die ebenfalls aus dem Infektionsversuch des gemeinsamen Forschungsprojektes von Prof. Dr. Rosengarten und Prof. Dr. Hewicker-Trautwein stammten. Diesen Tieren wurde im Alter von ca. 21 bis 35 Tagen ein aufgereinigtes, rekombinantes M. bovis-VspA-Fusionsprotein verabreicht. So wurde zum einen eine 2 ml umfassende Dosis von 1 mg aufgereinigtem M. bovis-VspA-Fusionsprotein, welches mit dem Montanide® IMS 1314 adjuviert wurde, verwendet. Hierbei handelt es sich um wasserlösliche, immunologisch aktive organische Komponenten. Einer anderen Gruppe wurde zweimal im Abstand von 21 Tagen eine 2 ml umfassende Dosis von 1 mg aufgereinigtem M. bovis-VspA-Fusionsprotein verabreicht, welches in diesem Fall mit 2%igem Alum/HS adjuviert wurde. 18 Tage später wurde diesen Tieren 30 ml einer Bakteriensuspension von M. bovis 1067 mit einem Titer von 7,4 x 109 CFU/ml intratracheal inokuliert. Auch hierbei handelte es sich um Kälber der Rasse Simmentaler, in deren Serum weder Antikörper gegen Mycoplasma bovis nachgewiesen noch Mykoplasmen aus der bronchioalveolären Lavage isoliert werden konnten. Alle Tiere dieser Gruppe wurden 21 Tage nach der Infektion getötet und anschließend seziert. Bei neun der zehn Kälber wurde postmortal M. bovis in der Lunge nachgewiesen. Andere Mykoplasmen konnten nicht festgestellt werden. Sieben Tiere wiesen eine Infektion mit Arcanobacterium pyogenes auf, ein Kalb zusätzlich mit Pasteurella multocida. Die Daten der Kälber sowie die Ergebnisse der Rückisolierung von bakteriellen Keimen aus der Lunge sind in Tabelle 5 zusammengestellt. 28 Material und Methoden Tabelle 5: Daten der Kälber aus Gruppe 4 BU and. Bakt. M. bovisStamm 26 4812 2940/00 67 1067 2x VspA/ 7,4 x 109 IMS 1314 21 j n n 27 192 2941/00 60 1067 7,4 x 109 VspA/2% Alum/HS 21 j n Arc. 28 6004 2942/00 74 1067 2x VspA/ 7,4 x 109 IMS 1314 21 j n Arc. 29 2943/00 57 1067 2x VspA/ 7,4 x 109 IMS 1314 21 j n n 30 342 2944/00 60 1067 2x VspA/ 7,4 x 109 IMS 1314 21 j n Arc. 31 657 2945/00 67 1067 2x VspA/ 7,4 x 109 IMS 1314 21 j n n 32 16 2946/00 67 1067 7,4 x 109 VspA/2% Alum/HS 21 j n Arc. 33 6006 2947/00 60 1067 7,4 x 109 VspA/2% Alum/HS 21 j n P. m. Arc. 34 4813 2948/00 67 1067 7,4 x 109 VspA/2% Alum/HS 21 n n Arc. 35 3443 2949/00 60 1067 7,4 x 109 VspA/2% Alum/HS 21 j n Arc. 0 E-Nr. Dosis (CFU/ml) Sektion BU BU p. i. in Lunge Lunge Tagen M. bovis and. M. Alter in Tagen Lfd. TierNr. Nr. Vakz. Lfd. Nr.: laufende Nummer; Tier-Nr.: Tiernummer (während der Infektionsversuche); E-Nr.: Einsendungsnummer; CFU: koloniebildende Einheiten (engl.: colony forming units); Vakz.: Vakzinierung; p. i.: post infectionem; BU: bakteriologische Untersuchung; M. bovis: Mycoplasma bovis; and. M.: andere Mykoplasmen; and. Bakt.: andere Bakterien; n: nicht nachgewiesen; j: nachgewiesen; Arc.: Arcanobacterium pyogenes; P. m.: Pasteurella multocida 3.2 Pathologisch-anatomische Untersuchung der Lungen Die makroskopische Beurteilung der bei den Kälbern der vier Gruppen festgestellten Lungenveränderungen erfolgte durch eine Pathologin der Ecole Nationale Vétérinaire de Lyon (Dr. D. Le Grand, Gruppe 2) bzw. durch Prof. Dr. Hewicker-Trautwein, Tierärztliche Hochschule Hannover (Gruppe 1, 3 und 4). Makroskopisch wies Tier E2936/00 hochgradige Lungenveränderungen mit atelektatischen Bezirken und Material und Methoden 29 multiplen Abszessen auf, von denen ca. 40% der Lunge betroffen waren. Alle anderen Tiere zeigten nur geringggradige Veränderungen, von denen maximal 20% der Lunge betroffen waren. Auch hier traten gelegentlich Abszesse auf. Entzündliche Veränderungen der Pleura wurden nur zwischen einzelnen Lappen gefunden. Diese traten allerdings nicht bei allen Kälbern auf. 3.3 Lungengewebeproben Es lagen von allen Tieren der vier Gruppen mehrere Lungengewebeproben vor. Diese wurden während der pathologisch-anatomischen Untersuchung aus sechs vorher definierten Lokalisationen der linken und rechten Lunge gewonnen. Hierbei handelte es sich in der linken Lunge um je eine Probe des Lobus cranialis pars cranialis (Lokalisation 1), des Lobus cranialis pars caudalis (Lokalisation 2) und des Lobus caudalis (Lokalisation 3). In der rechten Lunge wurde je eine Probe des Lobus caudalis (Lokalisation 4), des Lobus medius (Lokalisation 5) und des Lobus cranialis pars caudalis (Lokalisation 6) entnommen (Abbildung 1). Die Proben der Gruppe 2 wurden für 24 Stunden in 4%igem gepufferten Formalin (pH 7,4 bis 7,6) fixiert. Die Fixierung der Proben aus den Gruppen 1, 3 und 4 erfolgte über 72 Stunden ebenfalls in neutralem, gepufferten 4%igem Formalin. Anschließend wurden die Proben routinemäßig in Paraffin eingebettet, wobei pro Lungenlokalisation zwei bis drei Paraffinblöcke hergestellt wurden. Auf einem Schlittenmikrotom (HM 400, Fa. Microm International GmbH, Walldorf) wurden Schnitte von einer Dicke von ca. 5 µm angefertigt. Die Schnitte wurden in einem Wasserbad bei 40°C gestreckt und auf Superfrost Plus®-Objektträger (Fa. Gerhard Menzel Glasbearbeitungswerk GmbH & Co. KG, Braunschweig) aufgezogen. Anschließend folgte eine Trocknung für 60 Min. in einem Wärmeschrank bei 70°C (Fa. Heraeus Sepatech GmbH, Osterode) und eine weitere mögliche Lagerung bei Raumtemperatur. 30 Material und Methoden Abbildung 1: Entnahmelokalisationen der Lungengewebsproben (Schema der Rinderlunge, Dorsalansicht, modifiziert nach NICKEL et al. 1999) 3.4 Histochemische Färbemethoden 3.4.1 Übersichtsfärbung mit Hämatoxylin und Eosin Jeweils ein Schnitt jeder untersuchten Lokalisation wurde in einem automatisierten Färbecenter (Leica ST 4040, Leica Mikrosystems Nussloch GmbH, Nussloch) nach einem standardisierten Laborprotokoll mit Hämatoxylin und Eosin (HE) gefärbt. Diese Schnitte dienten zur Auswertung und Beschreibung der histologischen Veränderungen und zur Orientierung der Untersuchung mittels in situ-Hybridisierung und Immunhistochemie. Material und Methoden 1. 31 Entparaffinieren der Schnitte in absteigender Alkoholreihe (dreimal 5 Min. in Roti®-Histol, 5 Min. in Isopropanol, 2 bis 3 Min. in 96%igem Ethanol, 2 bis 3 Min. in 70%igem Ethanol, anschließend in Aqua dest.; 2. 15 Min. Hämalaun nach Mayer (Fa. Roth GmbH, Karlsruhe); 3. 10 Min. Bläuen in Leitungswasser; 4. 1 Min in Eosin 1%ig (Zugabe von 1 Tropfen Eisessig pro Küvette); 5. Spülen in Aqua dest.; 6. Entwässern der Schnitte in aufsteigender Alkoholreihe (2 bis 3 Min. in 70%igem Ethanol, 2 bis 3 Min. in 96%igem Ethanol, 5 Min. in Isopropanol, dreimal 5 Min. in Roti®-Histol); 7. Eindecken mit Corbit-Balsam (Fa. Hecht, Kiel). 3.4.2 Azanfärbung nach Heidenhain Zur Darstellung von kollagenem und retikulärem Bindegewebe wurden einzelne Schnitte mittels Azanfärbung nach Heidenhain gefärbt. Hierbei färbt sich extrazelluläres Kollagen intensiv blau. 1. Entparaffinieren der Schnitte in absteigender Alkoholreihe (dreimal 5 Min. in Roti®-Histol, 5 Min. in Isopropanol, 2 bis 3 Min. in 96%igem Ethanol, 2 bis 3 Min. in 70%igem Ethanol, anschließend in Aqua dest.; 2. 30 Min. Azokarmin bei 60°C im Brutschrank (Lösung gut vorwärmen); 3. Spülen in Aqua dest.; 4. 3 Min. in alkalischer 0,1%iger Anilinlösung; 5. 1 Min. in essigsaurem 15%igem Alkohol; 6. bis zu 20 Min. in 5%iger Phosphorwolframsäure (Kontrolle nach 10 Min.); 7. kurz Spülen in Aqua dest.; 8. 20 Min. in Anilinblau-Orange-Essigsäure-Gebrauchslösung; 9. kurz Spülen in Aqua dest.; 10. kurz in 96%igem Alkohol; 11. 2 Min. in Propanol; 12. 5 Min. in Essigsäurebutylester (EBE); 13. Eindecken mit Corbit-Balsam (Fa. Hecht, Kiel). 32 Material und Methoden 3.4.3 Siriusrot-Färbung F3B Technik Um eine Unterscheidung von neutrophilen Granulozyten von eosinophilen Granulozyten zu gewährleisten, wurden unklare Fälle mit der Siriusrot-Färbung F3B Technik nach BOGOMOLETZ (1980) gefärbt. Hierbei stellen sich die Granula der eosinophilen Granulozyten intensiv rot dar. 1. Entparaffinieren der Schnitte in absteigender Alkoholreihe (dreimal 5 Min. in Roti®-Histol, 5 Min. in Isopropanol, 2 bis 3 Min. in 96%igem Ethanol, 2 bis 3 Min. in 70%igem Ethanol, anschließend in Aqua dest.; 2. 5 Min. in Aqua dest. Spülen; 3. ca. dreimal in 70%igem Ethanol tauchen bis keine Schlieren mehr auf dem Objektträger sichtbar sind; 4. 24 Stunden Siriusrot-Farblösung bei Raumtemperatur; 5. 10 Min. Spülen in Aqua dest.; 6. einmal in frisches Hämalaun nach Mayer (Fa. Roth GmbH, Karlsruhe) tauchen; 7. ca. 5 Min. Wässern unter Leitungswasser bis der Schnitt leicht bläulich ist; 8. einmal in 70%iges Ethanol tauchen; 9. 2 Min in 80%iges Ethanol; 10. 30 Sek. in 96%iges Ethanol; 11. 30 Sek. in Isopropanol; 12. 5 Min. in Essigsäurebutylester (EBE); 13. Eindecken mit Corbit-Balsam (Fa. Hecht, Kiel). 3.5 In situ-Hybridisierung 3.5.1 Sondensynthese Für die Untersuchung mittels in situ-Hybridisierung wurde in Zusammenarbeit mit dem Institut für Bakteriologie, Mykologie und Hygiene der Veterinärmedizinischen Universität in Wien eine Digoxigenin (DIG)-markierte Sonde zum Nachweis von M. bovis-DNA synthetisiert. Hierfür wurde die von LYSNYANSKY et al. (1996, 2001a) veröffentlichte Sequenz des VspA-Gens des M. bovis-Stammes PG45 zu Grunde gelegt. Material und Methoden 33 3.5.2 Primer Es wurden Primer mit folgender Sequenz produziert: Zunächst wurde ein vorwärts gerichteter Primer (3´ nach 5´) mit der Bezeichnung vsp-69/26m synthetisiert. Dieser kodiert in der vis-box, der Region der vsp inversion sequence, (Position ab -69 N-terminales Ende nach LYSNYANSKY et al. 2001a) und besitzt die Sequenz GATATTTATTGATAGATTTATAAAGC. Als zweites wurde ein vorwärts gerichteter Primer (3´ nach 5´) mit der Bezeichnung ON25m hergestellt. Dieser kodiert in der Region vor der vis-box (sofern ein Vsp angeschaltet ist, Position -115 nach LYSNYANSKY et al. 2001a) und besitzt die Sequenz GTTTGATTAAGCTTTTATTTAGTTC. Als rückwärts gerichteter Primer (5´ nach 3´) wurde ein Primer mit der Bezeichnung Vsp+100/24m synthetisiert. Dieser kodiert am Ende der Signalsequenz ab der Position +102 nach LYSNYANSKY et al. (2001a) bzw. ab der Position +162 nach LYSNYANSKY et al. (1996) und trägt die Sequenz TGGTTTATTTTCTTCTTTGGTCTC. Daraus entstanden zwei unterschiedlich große mögliche Sonden: Zum einen ergab die Primerkombination vsp-69/26m und vsp+100/24m eine Sonde von 171bp Größe (bezeichnet mit VspAI) zum anderen die Primerkombination ON25m und vsp+100/24m eine Sonde von 217bp Größe (bezeichnet mit VspAII). Während VspAI lediglich Anteile der Sequenz nachwies, die für Proteinstrukturen des Oberflächenantigens codieren, detektierte VspAII zusätzlich die vorgeschaltete Sequenz des vspA-Gens, welche benötigt wird, wenn das VspA auf der Oberfläche von M. bovis exprimiert werden soll, also „eingeschaltet“ ist. 3.5.3 PCR Die Bedingungen für die PCR mit den jeweiligen Primerpaaren für spezifische Banden aus M. bovis-DNA lagen bei 94°C für 2 Min. mit anschließend 30 Zyklen mit einer Denaturierungstemperatur von 94°C für 1 Min., einer Anlagerungstemperatur 34 Material und Methoden von 56°C für 70 Sek. und einer Verlängerungstemperatur von 72°C für 20 Sek. Die Konzentration von Magnesium lag bei 2,5 mM. Während der PCR wurden die regulären Nukleotide desoxy-Adenin-Tri-Phosphat (dATP), desoxy-Cytosin-Tri-Phosphat (dCTP) und desoxy-Guanin-Tri-Phosphat (dGTP) in der Konzentration von 1 mM und desoxy-Thymin-Tri-Phosphat (dTTP) in der Konzentration von 0,65 mM zugegeben. Zusätzlich wurde Digoxigenin-11desoxy-Uracil-Tri-Phosphat (Digoxigenin-dUTP) in der Konzentration von 0,35 mM zugefügt. Dieses wird teilweise an Stelle der Pyrimidinbase dTTP in den neu synthetisierten DNA-Strang eingebaut. 3.5.4 Sondentests 3.5.4.1 Hybridisierung im Southern Blot Für eine Hybridisierung im Southern Blot wurde M. bovis-DNA isoliert, enzymatisch mit HindIII gespalten und in einem Agarosegel elektrophoretisch aufgetrennt. Die aufgetrennte DNA wurde anschließend auf eine Nitrozellulosemembran übertragen (geblottet). Die Nitrozellulosemembran wurde für 16 Stunden in 10 ml eines 4 µl VspAI-Sonde enthaltenden Church-Puffers bei 50°C hybridisiert. Anschließend wurde die Membran 2 x 5 Min. bei Raumtemperatur in 0,1%iger SDS in 2 x SSC gewaschen. Es folgten zwei weitere Waschschritte für 20 Min. in 0,1%iger SDS in 0,5 x SSC bei 50°C. Die Visualisierung der hybridisierten Sonde erfolgte analog zu dem Protokoll der in situ-Hybridisierung (siehe dort) mit alkalischer Phosphatasegekoppelten, gegen Digoxigenin gerichteten Antikörpern. 3.5.4.2 Ausschluss von Kreuzreaktionen Um auch mögliche Kreuzreaktivitäten der Sonden mit anderen Bakterien, speziell den bei einigen Kälbern nachgewiesenen Keimen der Spezies Arcanobacterium pyogenes, Pasteurella multocida und M. bovirhinis ausschließen zu können, wurde von diesen Bakterien sowie von weiteren nachgewiesenen Keimen ebenfalls DNA extrahiert, mittels HindIII enzymatisch verdaut und einer Hybridisierung mit den Sonden VspAI und VspAII in einem Southern Blot-Verfahren unterzogen. Um sicherzustellen, dass sich DNA dieser Bakterien im Blot befanden, wurde mit einer DIG-markierten Sonde hybridisiert, welche die bei allen Bakterien vorhandene Material und Methoden 35 eubakterische 16S rDNA nachweist („universal eubacterial“ 16S rDNA). Diese Sonde wurde nach LANE (1991) mit den Primern 27f und 1492r synthetisiert. 3.5.5 Durchführung der in situ-Hybridisierung Die Durchführung der in situ-Hybridisierung erfolgte nach einem speziell für den Nachweis von M. bovis-DNA mittels der erwähnten VspA-Sonden modifizierten Protokoll der von KWON und CHAE (1999) beschriebenen Methode. Alle Lösungen und Puffer wurden vor Gebrauch autoklaviert und die Glaswaren mit Heißluft sterilisiert. Während der Durchführung wurden Einmal-Handschuhe getragen. Die Inkubation erfolgte bei Raumtemperatur in Standküvetten mit bis zu 16 Schnitten. Bei von der Raumtemperatur abweichenden Temperaturen wurden die entsprechenden Lösungen im Wasserbad vorgewärmt und die Inkubation in diesem durchgeführt. Die Herstellung aller verwendeten Puffer und Lösungen ist im Anhang beschrieben. 3.5.6 Chromogen Als Chromogen wurde Nitroblau-Tetrazoliumchlorid (NTB) eingesetzt. Es wurden eine NBT-Stammlösung aus 1 g Nitroblau-Tetrazoliumchlorid (NBT; Fa. SigmaAldrich Chemie GmbH, Taufkirchen) und 13 ml 70%igem Dimethylformamid (30 ml Aqua bidest. + 70 ml Dimethylformamid, Fa. Merck KGaA, Darmstadt), sowie eine 5Brom-4-Chlor-3-Indolyl-Phosphat- (X-Phosphat, BCIP) Stammlösung aus 500 mg XPhosphat (Fa. Sigma-Aldrich Chemie GmbH, Taufkirchen) und 10 ml 100%igem Dimethylformamid hergestellt. Beide Lösungen wurden nicht autoklaviert und während der in situ-Hybridisierung wie folgt weiterverarbeitet: 270 µl NBT und 210 µl BCIP sowie 15 mg Levamisol (Fa. Sigma-Aldrich Chemie GmbH, Taufkirchen) werden mit Puffer 3 auf 60 ml aufgefüllt. Durch die an dem gegen Digoxigenin gerichteten Antikörper gekoppelte alkalische Phosphatase (Anti-Digoxigenin-AP, Fa. Roche Diagnostics GmbH, Mannheim) wird das Gemisch NBT/BCIP zu einem violetten Reaktionsprodukt umgewandelt. Dieser Farbniederschlag ist sehr stabil und lagert sich in unmittelbarer Nähe des Entstehungsortes ab. 36 Material und Methoden 3.5.7 Kontrollmaterial Als positives Kontrollmaterial wurde zum Nachweis der M. bovis-DNA unverändertes bovines Lungengewebe vom Schlachthof (Fa. Vossding, Gleidingen) verwendet. Dieses stammte von einem männlichen, lungengesunden Rind mit einem Alter von 23 Monaten. Hiervon wurden in Anlehnung an BOYE et al. (2001) Lungenproben mit konzentrierter M. bovis-Suspension injiziert. Die Mykoplasmensuspension wurde freundlicherweise von dem Institut für Bakteriologie, Mykologie und Hygiene, Veterinärmedizinische Universität Wien, zur Verfügung gestellt. Diese wurde zuvor mehrmals zentrifugiert und mit 1 x PBS gewaschen, um eine möglichst konzentrierte Mykoplasmensuspension zu erhalten. Anschließend wurden die Lungenproben routinemäßig in Formalin fixiert und in Paraffin eingebettet. Als Negativkontrolle wurde von jeder Gewebelokalisation zusätzlich ein Kontrollschnitt mit Hybridisierungspuffer ohne Sondenzusatz inkubiert. 3.5.8 Protokoll für die in situ-Hybridisierung 1. Paraffinschnitte auf Superfrost® plus Objektträger aufziehen und im Wärmeschrank bei 70°C 60 Min. trocknen lassen; 2. Entparaffinierung der Schnitte, dreimal für 5 Min. in Roti®-Histol und je 5 Min. in Isopropanol, 96%igem und 70%igem Ethanol, anschließend für 5 Min. und dann 1 Min. in Aqua bidest. (ab Aqua bidest. in Standküvette verbringen); 3. Spülen der Schnitte, einmal für 5 Min. in 1 x PBS; 4. zum Aufschluss der Zellmembranen Inkubation für 20 Min. in 0,2 M HCl; 5. Spülen der Schnitte, zweimal für 30 Min. mit 2 x SSC + 5 mM EDTA-Na2 bei 50°C; 6. Proteolyse mit 7,5 µg/ml Proteinase K für 15 Min. bei 37°C (1 ml 1 M Tris, pH 8,0 + 1 ml 0,1 M CaCl2 + 22,5 µl Proteinase K ad 60 ml Aqua bidest.); 7. Abstoppen der Proteolyse durch Inkubation in 0,2%igem Glycin-PBS für 5 Min.; 8. Nachfixierung der Schnitte in 4%igem Paraformaldehyd für 4 Min.; 9. Spülen der Schnitte, zweimal für 1 Min. in 1 x PBS; Material und Methoden 10. 37 Spülen der Schnitte für 15 Min. mit 1 x PBS + 5 mM MgCl2 (frisch herstellen); 11. Azetylierung in 0,25%igem Azetanhydrid in 0,1 M Triethanolamin, pH 7,5, für 10 Min. (frisch herstellen); 12. Spülen der Schnitte, zweimal für 1 Min. und anschließend für 15 Min. in 1 x PBS; 13. Prähybridisierung für mindestens 60 Min. bei 37°C im Prähybridisierungspuffer (unter Verwendung einer eingefrorenen Stammlösung frisch herstellen); 14. Hybridisierungspuffer herstellen (unter Verwendung einer eingefrorenen Stammlösung, frisch) mit bzw. ohne den Zusatz der spezifischen Sonde und Überschichten der Schnitte mit 35 µl; mit Gel-bond®-Film (Fa. FMCR® bioproducts, Göttingen) abdecken und mit Fix-O-Gum® (Fa. Marabuwerke GmbH & Co KG, Tamm) gut abdichten; 15. Denaturieren für 10 Min. waagrecht auf einer Heizplatte mit 95°C; 16. Hybridisierung für 16 Stunden bei 37°C im Wärmeschrank und feuchter Kammer; 17. Posthybridisierungswaschung (nach Abheben des Gel-bond®-Films und des Fix-O-Gum® mit einer Pinzette) zweimal für 15 Min. bei 42°C mit 6 x SSC+45%iges Formamid (frisch herstellen); 18. Spülen der Schnitte, zweimal für 5 Min. mit 2 x SSC; 19. Spülen der Schnitte, zweimal für 15 Min. mit 0,2 x SSC bei 42°C; 20. Spülen der Schnitte, für 1 Min. mit Puffer 1; 21. Inkubation für 30 Min. mit Block-Lösung (Puffer 2, frisch herstellen); 22. Inkubation der Schnitte für 2 Stunden mit Anti-DIG-Antikörper (Fa. Roche Diagnostics GmbH, Mannheim; alkalische Phosphatase-konjugiert) 1:200 verdünnt in Antikörperpuffer (frisch herstellen); 23. Spülen der Schnitte, zweimal für 15 Min. mit Puffer 1; 24. Spülen der Schnitte, zweimal für 5 Min. mit Puffer 3; 25. Inkubation der Schnitte mit der Färbelösung (s. Abschnitt 3.5.6) für ca. 16 Stunden im Dunkeln (Färbelösung frisch herstellen aus Stammlösung); 38 Material und Methoden 26. Abstoppen der enzymatischen Reaktion in Puffer 4, zweimal für 10 Min.; 27. Spülen der Schnitte für zweimal 2 Min. in Aqua bidest. und anschließend unter fließendem Leitungswasser; 28. Gegenfärben mit Hämalaun nach Mayer (Fa. Roth GmbH, Karlsruhe) für 15 Sekunden; 29. Wässern und Bläuen unter fließendem Leitungswasser für 15 Min.; 30. Eindecken mit auf 50°C vorgewärmtem Glycergel® (Fa. DakoCytomation GmbH, Hamburg). 3.5.9 Kontrolle der endogenen Peroxidasen Um sicherzustellen, dass das nachgewiesene Präzipitat des durch alkalische Phosphatase katalysierten Chromogens NBT/BCIP nicht durch endogene Peroxidasen katalysiert wurde, wurde während der Etablierung der Methode versuchsweise eine Vorbehandlung der Schnitte mit einer 0,5%igen Wasserstoffperoxidlösung durchgeführt. Diese führt zu einer Hemmung der vorhandenen Peroxidasen. Hierfür wurden die Schnitte zunächst entparaffiniert und dann für 30 Min. in 85%igem Ethanol und 0,5%iger Wasserstoffperoxidlösung inkubiert und anschließend mit 1 x PBS gespült. Es folgte das Protokoll der ISH wie oben aufgeführt ab Punkt 4. 3.5.10 Auswertung Als positiv gewertet wurden NBT-Präzipitate, die sich in derselben Ebene wie der Schnitt befanden und in den nur mit Hybridisierungspuffer inkubierten, negativen Kontrollen nicht vorhanden waren. 3.6 Immunhistochemie 3.6.1 Antikörper Für die immunhistologische Darstellung von M. bovis-Antigen wurde ein monoklonaler Maus-anti-Mycoplasma bovis-Antikörper verwendet. Dieser wurde erstmalig von ADEGBOYE et al. (1995a) beschrieben und ist unter der Bezeichnung MAB970 kommerziell erhältlich (Fa. Chemicon international, Temecula, USA). Der Antikörper der Subklasse IgG wurde mit dem M. bovis-Stamm M23 produziert und Material und Methoden 39 richtet sich gegen nicht genauer definierte Epitope von M. bovis (ADEGBOYE et al. (1995a). Das Protokoll für die Verwendung am Formalin-fixierten und Paraffineingebetteten Material wurde in Anlehnung an die von ADEGBOYE et al. (1995b) beschriebene Methode als Avidin-Biotin-Peroxidase-Komplex-Methode modifiziert. Die Verdünnung des Antikörpers betrug 1:1000. 3.6.2 Chromogen Als Chromogen für die immunhistochemische Diaminobenzidin-tetrahydrochlorid (DAB, Fa. Untersuchung Sigma-Aldrich diente Chemie 3,3’- GmbH, Taufkirchen) in PBS-Puffer. Dieses wird durch die an den sekundären Antikörper angelagerte Peroxidase des Avidin-Biotin-Peroxidase-Komplexes unter Zusatz von Wasserstoffperoxid (H2O2, Fa. Sigma-Aldrich) zu einem braunen Reaktionsprodukt umgewandelt. Dieser Farbniederschlag ist sehr stabil und lagert sich in unmittelbarer Nähe des Entstehungsortes ab. 3.6.3 Kontrollen Als positives Kontrollmaterial wurde zum Nachweis von M. bovis-Antigen analog zu der ISH Lungenmaterial vom Schlachthof (Fa. Vossding, Gleidingen) verwendet. Hiervon wurden Lungenproben mit konzentrierter M. bovis-Suspension injiziert. Die Mykoplasmensuspension wurde freundlicherweise von dem Institut für Bakteriologie, Mykologie und Hygiene, Veterinärmedizinische Universität Wien zur Verfügung gestellt. Von jedem Gewebe wurde als Negativkontrolle zusätzlich ein Kontrollschnitt nach gleichem Protokoll behandelt, indem anstelle des primären Antikörpers mit Aszitesflüssigkeit von nicht-immunisierten Balb/C Mäusen (Balb/C-Serum, Fa. Biologo, Kronshagen) in einer Konzentration von 1:10000 inkubiert wurde. 3.6.4 Protokoll für die Immunhistochemie mit MAB970 1. Entparaffinierung der Schnitte, dreimal für 5 Min. in Roti®-Histol und je 5 Min. in Isopropanol, 96%igem und 70%igem Ethanol; 2. Hemmung der endogenen Peroxidase in 0,5%igem H2O2 in 85%igem Alkohol für 30 Min. bei Raumtemperatur auf einem Magnetrührer; 3. dreimaliges Waschen der Schnitte in 1 x PBS für je 5 Min.; 40 Material und Methoden 4. Demaskierung: Proteolytische Vorbehandlung in 0,05%iger Protease XIVLösung in vorgewärmter 1 x PBS (Protease XIV, Fa. Merck KGaA, Darmstadt) mit 0,02% CaCl2, pH 7,4; 5. dreimaliges Waschen der Schnitte in 1 x PBS für je 5 Min.; 6. Verbringen der Schnitte in CoverplatesTM und Sequenza®-Einsätze (Thermo Electron GmbH, Dreieich); 7. Überschichten mit 1:5 verdünntem inaktiviertem Ziegen-Normalserum (normal goat serum, NGS) in 1 x PBS für 20 Min.; 8. Auftragen des Primärantikörpers Maus-anti-Mycolasma bovis monoklonaler Antikörper MAB970 (Fa. Chemicon international, Temecula, USA) verdünnt 1:1000 in 1 x PBS mit 1%igem bovinem Serumalbumin (BSA) und Inkubation der Schnitte für 16 Stunden bei 4°C im Kühlschrank; 9. dreimaliges Waschen der Schnitte in 1 x PBS mit 0,05% Tween 20 für je 5 Min.; 10. Auftragen des Sekundärantikörpers biotiniliertes Ziege-anti-Maus-Serum (GAM-b, BA-9200, Fa. Vector, Burlingame, USA) 1:200 verdünnt in 1 x PBS und Inkubation für 30 Min.; 11. dreimaliges Waschen der Schnitte in 1 x PBS mit 0,05% Tween 20 für je 5 Min., anschließend noch einmal in reinem 1 x PBS für 5 Min.; 12. Inkubation der Schnitte mit dem Avidin-Biotin-Peroxidase-Komplex Vectastain Elite ABC Kit (PK-6100, Fa. Vector, Burlingame, USA) für 30 Min. bei Raumtemperatur (Herstellung des ABC-Komplexes mindestens 30 Min. vor Gebrauch); 13. dreimaliges Waschen der Schnitte in 1 x PBS für je 5 Min.; 14. Inkubation der Schnitte mit 0,05% 3,3’-Diaminobenzidin-tetrahydrochlorid (DAB) in 1 x PBS, pH 7,2, mit Zusatz von 3%iger H2O2-Lösung (Endkonzentration 0,03%) für 5 Min. auf dem Magnetrührer bei Raumtemperatur; 15. dreimaliges Waschen der Schnitte in 1 x PBS für je 5 Min.; 16. Spülen der Schnitte unter fließendem Leitungswasser; Material und Methoden 17. 41 Färben der Schnitte für einige Sekunden (ca. 15 bis 20 Sekunden) bis zur gewünschten Farbintensität in Hämalaun nach Mayer (Fa. Roth GmbH, Karlsruhe); 18. Bläuen der Schnitte unter fließendem Leitungswasser für 15 Min.; 19. Entwässern der Schnitte in einer aufsteigenden Alkoholreihe: 50%iger, 70%iger, 96%iger Alkohol für jeweils 3 Min., Isopropylalkohol (5 Min.), Roti®-Histol dreimal je 5 Min.; 20. Eindecken mit Corbit-Balsam (Fa. Hecht, Kiel).; 3.6.5 Auswertung Als positiv gewertet wurden braune Pigmentablagerungen, die sich in derselben Ebene wie der Schnitt befanden und in den nur mit Balb/C inkubierten negativen Kontrollen nicht vorhanden waren. 3.7 Befunderhebung und Auswertung der Daten Die Schnittpräparate der Untersuchungen mittels HE-Färbung, Azan-Färbung, ISH und IHC wurden mit Hilfe eines Standard-Binokular-Lichtmikroskops (Fa. Carl Zeiss AG, Oberkochen) lichtmikroskopisch ausgewertet. Die Schnitte wurden mäanderförmig abgefahren und die histopathologischen Veränderungen bzw. positiven Signale semiquantitativ nach ihrem geschätzten Schweregrad (0 = keine, 1 = vereinzelt, 2 = geringgradige, 3 = mittelgradige, 4 = hochgradige Veränderungen) bzw. nach ihrem Vorhandensein (j = Signal vorhanden, n = kein Signal detektierbar) ausgewertet. Vorhandene Nekrosen wurden zur besseren Orientierung im Schnitt nach ihrer Ausdehnung eingeteilt, gezählt und jeweils durchnummeriert. Zwecks Einteilung nach Größe wurden unter 5 mm Durchmesser, 5 bis 10 mm Durchmesser und über 10 mm Durchmesser festgelegt. Die fotographische Dokumentation erfolgte mit einem Mikroskop Axiophot (Fa. Carl Zeiss AG, Oberkochen) und mit Elite Chrome 160 T Diafilmen (Fa. Kodak GmbH, Stuttgart). Ergebnisse 43 4 Ergebnisse 4.1 Ergebnisse der Sondentestung 4.1.1 Nachweis von Mycoplasma bovis-DNA im Southern Blot Die mittels HindIII gespaltene DNA von M. bovis PG45 wurde einem Southern Blot Verfahren unterzogen und anschließend mit in Church-Puffer zugefügten VspAIbzw. VspAII-Sonden hybridisiert. Hierbei konnten positive Signale in einzelnen Banden der aufgetrennten M. bovis-DNA nachgewiesen werden. Somit konnte gezeigt werden, dass die Sonde spezifisch mit M. bovis-DNA hybridisierte. Das Ergebnis des Southern Blots für die Sonde VspAI ist in Abbildung 2b Spur 10 dargestellt. Genomische DNA von 1: Histophilus somni 2: Arcanobacterium pyogenes 3: Acholeplasma laidlawii 4: Enterococcus sp. 5: M. bovirhinis 6: Pasteurella multocida 7: α-hämolysierende Streptococcus spp. 8: Staphylococcus spp. 9: Mannheimia haemolytica 10: M. bovis PG45 Abbildung 2: Southern Blot (DNA verdaut mit HindIII): a) DIG-markierte Sonde für „universal eubacterial“ 16S rDNA, b) VspAI-Sonde DIG: Digoxigenin; M.: Mycoplasma; spp.: species; 44 Ergebnisse 4.1.2 Spezifitätstest Ebenfalls mittels HindIII wurde die DNA von allen sonstigen in den Proben von den Tieren der Gruppen 3 und 4 nachgewiesenen Keimen enzymatisch gespalten und ebenfalls im Southern Blot Verfahren untersucht. Hierzu gehörten unter anderem Arcanobacterium pyogenes, Mannheimia haemolytica, Pasteurella multocida und M. bovirhinis. Mit der Sonde für „universal eubacterial“ 16S rDNA konnte gezeigt werden, dass sich aufgetrennte DNA im Blot befand. Mit der Sonde VspAI konnten nur bei der parallel erfolgten Kontrolle von aufgetrennter M. bovis-DNA Signale detektiert werden. Die Ergebnisse der jeweiligen Southern Blots sind in Abbildung 2a und b zu sehen. 4.2 Histopathologische Ergebnisse Für die Auswertung der histopathologischen Ergebnisse dienten HE-gefärbte Schnitte sowie mit Spezialfärbungen in Form von Azan- und Siriusrot-Färbung behandelte Schnitte. Die Anzahl der untersuchten Blöcke, sowie die Anzahl der Blöcke mit Lungenveränderungen in Form von Nekrosen, katarrhalisch-eitriger Bronchopneumonie und obliterierender Bronchiolitis der einzelnen Kälber sind in den Tabelle 6 bis Tabelle 9 im Anhang zusammengefasst. 4.2.1 Gruppe 1 (Kontrollgruppe) In der Kontrollgruppe zeigten zwei Tiere (E2934/00 und E2935/00) keine histopathologischen Veränderungen. Die Tiere E1504/99, E1505/99 und E1650/99 wiesen vereinzelte bis geringgradige, in einem Fall (E1650/99) auch mittelgradige, katarrhalisch-eitrige Bronchopneumonien in mehreren Lokalisationen auf. Des Weiteren fand sich in allen untersuchten Lokalisationen eine geringgradige, interstitielle Pneumonie. Bei Tier E1505/99 konnten zudem in einer Lokalisation obliterierende Bronchiolitiden nachgewiesen werden. Hierbei wird das Lumen des Bronchiolus durch Bindegewebszubildungen nach Alteration des Epithels verlegt (Abbildung 28, Kap. 4.5). Der Nachweis des neu gebildeten Bindegewebes erfolgte mit der Azanfärbung. Diese führt zu einer blauen Färbung des extrazellulär gelegenen Kollagens (Abbildung 29, Kap. 4.5). Zusätzlich fand sich bei Tier E1505/99 in einer Lokalisation eine über 10 mm im Durchmesser messende Nekrose. Diese zeigte ein wolkiges Erscheinungsbild, deren einzelne Unterregionen Ergebnisse 45 durch dünne Bindegewebssepten abgeteilt wurden. Dadurch ergab sich eine Formation, die an ehemalige Alveolen erinnerte. An der Peripherie der nekrotischen Areale fanden sich wenige Bindegewebsfasern mit einzelnen Makrophagen und neutrophilen Granulozyten. Die gesamte Nekrose war sehr fibrinreich, welches besonders an den Grenzen zu gesundem Gewebe zu beobachten war. Dieses entspricht dem Bild einer fibrinösen Pneumonie (siehe Abbildung 9, Kap.4.5). 4.2.2 Gruppe 2 Bei den Tieren der Gruppe 2 wies das Tier mit der Nummer 5 in mehreren Lokalisationen nekrotische Areale auf (5 von 10) (Abbildung 9, Kap. 4.5). Diese zeigten ein wolkiges Erscheinungsbild, deren einzelnen Unterregionen durch dünne Bindegewebssepten abgeteilt wurden. Dadurch ergab sich eine Formation, die an ehemalige Alveolen erinnerte (Abbildung 10 und Abbildung 11, Kap. 4.5). An der Peripherie der nekrotischen Areale fanden sich wenige Bindegewebsfasern mit einzelnen Makrophagen und neutrophilen Granulozyten. Fünf Tiere (2, 5, 10, 12 und 13) zeigten in mehreren Lokalisationen eine bis zu mittelgradige, katarrhalisch-eitrige Bronchopneumonie. Eine interstitielle Pneumonie fand sich in nahezu allen untersuchten Lokalisationen. Hierbei war diese zum Teil mittelgradig, wobei bei Tier 5 einmal eine hochgradige, interstitielle Pneumonie diagnostiziert wurde. Obliterierende Bronchiolitiden konnten bei keinem der Tiere nachgewiesen werden. 4.2.3 Gruppe 3 Die Tiere dieser Gruppe wiesen ein sehr heterogenes histopathologisches Bild auf. Zum einen zeigte Tier Nummer E2936/00 Nekrosen (Abbildung 15, Kap. 4.5) in mehreren Blöcken verschiedener Lokalisationen (10 von 18). Die Nekrosen zeigten eine deutliche bindegewebige Kapsel (Abbildung 16 und Abbildung 14, Kap. 4.5), umgeben von einem Wall von Makrophagen, der von Lymphozyten und Plasmazellen infiltriert wurde (Abbildung 13, Kap. 4.5). Die nächste Schicht wurde durch zahlreiche neutrophile Granulozyten gebildet, die sich zum Teil im Untergang befanden. Zentral zeigte sich eine amorphe, in der HE-Färbung eosinophile Masse (Abbildung 12, Kap. 4.5). Gleichartige Nekrosen fanden sich auch bei den Tieren E1507/99 und E1512/99, die mit einer hohen Dosis einer Mykoplasmensuspension infiziert wurden (1010 CFU/ml). Von den Tieren, die mit einer niedrigeren Dosis an 46 Ergebnisse Mykoplasmensuspension infiziert wurden (108 CFU /ml), konnte nur bei Tier 1511/99 in einer Lokalisation eine Nekrose nachgewiesen werden. Am häufigsten wurden Nekrosen unter 5 mm gefunden (88 von 135), gefolgt von Nekrosen zwischen 5 und 10 mm (37 von 135). Am wenigsten waren über 10 mm große Nekrosen vorhanden (10 von 135). Die meisten Nekrosen fanden sich mit 85 von 135 in den mittleren Lungenabschnitten (Lokalisation 2 und 5). Die prozentuale Verteilung der Nekrosen bezogen auf die einzelnen Lokalisationen und Nekrosengrößen ist in Abbildung 3 dargestellt. 70.00% 60.00% 50.00% 40.00% Lok. 3/4 30.00% Lok. 2/5 20.00% Lok. 1/6 10.00% 0.00% < 5 mm 5 -10 mm 10 mm Summe Abbildung 3: Prozentuale Verteilung der Nekrosen (n = 135) in Gruppe 3. Lok.: Lungenlokalisationen (vergleiche Abbildung 1) Eine katarrhalisch-eitrige Bronchopneumonie zeigte sich bei allen Tieren in mehreren Lokalisationen. Diese war meist gering- bis mittelgradig, vereinzelt auch hochgradig, wobei zum einen die vorderen Lokalisationen (Lokalisation 1 und 6 sowie 2 und 5) häufiger betroffen waren als die kaudalen (Lokalisation 3 und 4). Zum anderen wiesen die Tiere mit der höheren Infektionsdosis häufiger und stärkere Veränderungen auf, als die Tiere der geringeren Infektionsdosis. Bei einem Tier (E2937/00) konnte mittels der Siriusrot-Färbung eine interstitielle Pneumonie mit hochgradiger Infiltration eosinophilen Granulozyten nachgewiesen werden. Obliterierende Bronchiolitiden fanden sich bei sechs dieser zwölf Tiere in meist mehreren Lokalisationen (Abbildung 28 und Abbildung 29, Kap. 4.5), wobei alle Tiere der höheren Infektionsdosis diese aufwiesen, während sie bei den Tieren der Ergebnisse 47 geringeren Infektionsdosis in keiner Lokalisation gefunden wurden. Alle Tiere wiesen in nahezu allen Lokalisationen eine meist geringgradige, vereinzelt mittelgradige, interstitielle Pneumonie auf. 4.2.4 Gruppe 4 Von den zehn vakzinierten Tieren der Gruppe 4 wiesen sechs in einzelnen Lokalisationen Nekrosen auf. Auch hier erfolgte die Einteilung in drei Größen. Die Verteilung der 31 Nekrosen auf die drei Größen war mit 15-mal unter 5 mm, siebenmal zwischen 5 und 10 mm und neunmal über 10 mm relativ ausgeglichen. Diese waren hauptsächlich in den mittleren (Lokalisation 2 und 5) und hinteren (Lokalisation 3 und 4) Lungenabschnitten zu finden. In Abbildung 4 ist die prozentuale Verteilung der Nekrosen bezogen auf die einzelnen Lokalisationen und Nekrosegrößen graphisch dargestellt ist. 80.00% 70.00% 60.00% 50.00% 40.00% 30.00% 20.00% 10.00% 0.00% Lok. 1/6 Lok. 2/5 Lok. 3/4 < 5 mm 5 -10 mm 10 mm Summe Abbildung 4: Prozentuale Verteilung der Nekrosen (n = 31) in Gruppe 4. Lok: Lungenlokalisationen (vergleiche Abbildung 1) Alle Tiere zeigten in der Mehrzahl der Lokalisationen eine gering- bis mittelgradige, katarrhalisch-eitrige Bronchopneumonie (Abbildung 25, Kap. 4.5). Obliterierende Bronchiolitiden fanden sich bei sieben der zehn Kälber in einzelnen Lokalisationen. Hierbei wurden diese bei Tier E2941/00 mit acht von 18 Blöcken in mehreren Lokalisationen am häufigsten festgestellt. Die Tiere E2940/00 und E2941/00 wiesen eine mittel- bis hochgradige, interstitielle Pneumonie in nahezu allen Lokalisationen auf. Bei den anderen Tieren war diese nur geringgradig ausgeprägt. 48 Ergebnisse 4.2.5 Zusammenfassung Zusammenfassend zeigten sich in allen vier Gruppen Tiere mit histopathologischen Veränderungen in Form von Nekrosen, katarrhalisch-eitriger Bronchopneumonie, obliterierenden Bronchiolitiden und interstitieller Pneumonie. Diese Veränderungen fanden sich bei den Tieren der Kontrollgruppe (Gruppe 1) und der Gruppe mit einer kurzen Infektionsdauer von unter 10 Tagen (Gruppe 2) nur vereinzelt und wiesen maximal eine mittelgradige Ausprägung auf. Bei fast allen Tieren, die 21 Tage nach der Infektion getötet und seziert wurden (Gruppe 3 und Gruppe 4), konnten in den meisten Lokalisationen Veränderungen wie Nekrosen, katarrhalisch-eitrige Bronchopneumonien, obliterierende Bronchiolitiden und interstitielle Pneumonien gefunden werden. Diese waren zum Teil auch von hochgradiger Ausprägung. 4.3 Ergebnisse der in situ-Hybridisierung Die durch Injektion von M. bovis-Suspension in gesundes Lungengewebe erstellte Positivkotrolle zeigte sowohl mit der Sonde VspAI als auch mit der Sonde VspAII deutliche Signale, die in den verbreiterten, interlobulären Interstitien hochgradig auftraten. Diese violetten Signale lagen bei mit reinem Hybridisierungspuffer behandelten Schnitten nicht vor. Für die im Versuchsmaterial nachgewiesenen Hybridisierungssignale konnten zwischen den beiden verwendeten Sonden (VspAI und VspAII) hinsichtlich Lokalisation und Ausprägung keine Unterschiede festgestellt werden. Vereinzelt zeigte sich im direkten Vergleich ein geringgradig stärkeres Signal bei der kürzeren Sonde VspAI. Eine Behandlung der Schnitte mit Wasserstoffperoxid zur Hemmung der endogenen Peroxidasen vor der ISH hatte keinen Einfluss auf Lokalisation und Ausprägung der Signale. 4.3.1 Gruppe 1 (Kontrollgruppe) Bei den Lungen der Tiere der Kontrollgruppe konnte weder in unveränderten noch in Lungenarealen mit Nekrosen, katarrhalisch-eitriger Bronchopneumonie, obliterierender Bronchiolitis oder interstitieller Pneumonie ein positives ISH-Signal detektiert werden. Die Ergebnisse der ISH für die einzelnen Kälber der Gruppe 1 sind in Tabelle 6 im Anhang zusammengefasst. Ergebnisse 49 4.3.2 Gruppe 2 Bei den Lungen der Tiere der Gruppe 2 konnte weder in unveränderten noch in Lungenarealen mit Nekrosen, katarrhalisch-eitriger Bronchopneumonie oder interstitieller Pneumonie ein positives ISH-Signal detektiert werden. Die Ergebnisse der ISH für die einzelnen Kälber der Gruppe 2 sind in Tabelle 7 im Anhang zusammengefasst. 4.3.3 Gruppe 3 Von den zwölf Tieren der Gruppe 3 wiesen sechs Tiere sowohl in den Nekrosen als auch in Arealen mit katarrhalisch-eitriger Bronchopneumonie positive ISH-Signale auf. In letzteren waren die Signale im Exsudat in den Lumina von Bronchien zu beobachten. Der prozentuale Anteil der Nekrosen (n = 135) sowie der Blöcke mit katarrhalisch-eitriger Bronchopneumonie (n = 72) und mit obliterierender Bronchiolitis (n = 31) mit ISH-Signalen sind als zusammenfassende Graphik in Abbildung 5 dargestellt; die Ergebnisse der ISH für die einzelnen Kälber der Gruppe 3 sind in Tabelle 8 im Anhang aufgeführt. 4.3.3.1 Nekrosen Vier Tiere dieser Gruppe (E2936/00, E1507/99, E1511/99 und E1512/99) wiesen zum Teil in mehreren Lokalisationen Nekrosen auf. Hierbei wurden drei Verteilungsmuster für das Auftreten von ISH-Signalen unterschieden: Erstens gab es eine Akzentuierung von Signalen im Randbereich der Nekrose in Höhe des Walls aus neutrophilen Granulozyten (Abbildung 19, Kap. 4.5). Bei anderen Formen wurden zentral in der Nekrose Signale in Form von wolkigen Akkumulationen gefunden (Abbildung 20, Kap. 4.5). Das dritte Verteilungsmuster war ein diffus über die ganze Nekrose verteiltes Auftreten von Signalen (Abbildung 21, Kap. 4.5). Mischformen sowie unterschiedliche Ausprägungen waren vorhanden. Das Tier E2936/00 zeigte die meisten Nekrosen (84), welche alle ein positives ISHSignal aufwiesen. Hier gab es zum Teil auch hochgradige Ansammlungen von Signalen im Randbereich. In den anderen Nekrosen konnten zumeist gering- bis mittelgradige Konzentrationen von Signalen im Randbereich, wie auch zentral und diffus festgestellt werden, wobei am häufigsten gering- bis mittelgradige Ansammlungen von Signalen gefunden wurden (Abbildung 17, Kap. 4.5). 50 Ergebnisse 100.0% 90.0% 80.0% 70.0% 60.0% 50.0% 40.0% 30.0% 20.0% 10.0% 0.0% Nekrosen Katarrhalisch-eitrige Bronchopneumonie obliterierende Bronchiolitiden Abbildung 5: Prozentualer Anteil positiver Nekrosen bzw. positiver Gewebeproben in der ISH in Gruppe 3 Von den 16 Nekrosen, die bei Tier E1507/99 in vier Lokalisationen gefunden wurden, wiesen sieben kein Hybridisierungssignal auf. Bei den verbleibenden neun, verteilt auf alle vier Lokalisationen, traten meist gering- bis mittelgradige Ansammlungen von Signalen in allen drei Verteilungsmustern auf. Das Tier E1511/99 wies in den beiden Nekrosen, welche in einer Lokalisation gefunden wurden, keine ISH-Signale auf. Somit zeigte keines der Kälber, die mit einer geringeren Dosis einer Mykoplasmensuspension infiziert wurden, positive Signale mit der ISH in einer Nekrose. Bei dem Tier E1512/99 konnten in 31 der 33 Nekrosen aus sieben verschiedenen Lokalisationen gering- bis mittelgradige Hybridisierungssignale fast ausschließlich im Randbereich der Nekrosen nachgewiesen werden (Abbildung 22, Abbildung 23 und Abbildung 24, Kap. 4.5). Zwei Nekrosen wiesen kein Signal auf. Von den insgesamt 135 Nekrosen bei den Tieren dieser Gruppe konnten in 124 Nekrosen positive ISH-Signale detektiert werden. Dieses entspricht einem Prozentsatz von 91,8%. Wie schon bei der histopathologischen Untersuchung fanden sich die meisten Nekrosen, die auch positive ISH-Signale aufwiesen, überwiegend in den mittleren Lungenabschnitten (Lokalisation 2 und 5). Ergebnisse 51 4.3.3.2 Katarrhalisch-eitrige Bronchopneumonie Die bei allen Tieren dieser Gruppe auftretenden katarrhalisch-eitrigen Bronchopneumonien wiesen bei sechs Tieren positive Signale im eitrigen Exsudat in einigen Lokalisationen auf. Hierbei wurden überwiegend Signale geringgradiger Ausprägung gefunden. Die meisten positiven Blöcke fanden sich bei Tier E2936/00 und E1512/99. Insgesamt waren von 72 untersuchten Blöcken 23 positiv in der ISH, welches einem Prozentsatz von 31,9% entspricht. In zwei Lokalisationen von Tier E2937/00, bei dem eine eosinophile Pneumonie diagnostiziert wurde, wurden ebenfalls positive ISH-Signale gefunden. Bei den Tieren, die mit einer geringen Dosis einer Mykoplasmensuspension infiziert wurden, konnten keine positiven Signale mit der ISH im Bereich der katarrhalisch-eitrigen Bronchopneumonie festgestellt werden. 4.3.3.3 Obliterierende Bronchiolitiden Von den sechs Tieren, bei denen in insgesamt 31 Blöcken obliterierende Bronchiolitiden gefunden wurden, konnten nur bei Tier E2936/00 in zwei Blöcken einzelne positive ISH-Signale gefunden werden. Dieses entspricht einem Prozentsatz von 6,5%. In den anderen gefundenen obliterierenden Bronchiolitiden konnte kein ISH-Signal detektiert werden (Abbildung 31, Kap. 4.5). 4.3.3.4 Interstitielle Pneumonie In den verbreiterten Interstitien der untersuchten Lungengewebeproben, in denen eine interstitielle Pneumonie vorlag, konnten keine positiven ISH-Signale gefunden werden. 4.3.4 Gruppe 4 Alle Tiere der Gruppe 4 wiesen positive ISH-Signale auf. Diese fanden sich sowohl in Nekrosen als auch im Exsudat katarrhalisch-eitriger Bronchopneumonien. Der prozentuale Anteil der Nekrosen (n = 31) sowie der Blöcke mit katarrhalisch-eitriger Bronchopneumonie (n = 128) und mit obliterierender Bronchiolitis (n = 18) mit ISHSignalen sind als zusammenfassende Graphik ist in Abbildung 6 dargestellt, die Ergebnisse der ISH für die einzelnen Kälber der Gruppe 4 sind in Tabelle 9 im Anhang aufgeführt. 52 Ergebnisse 100.0% 90.0% 80.0% 70.0% 60.0% 50.0% 40.0% 30.0% 20.0% 10.0% 0.0% Nekrosen Katarrhalisch-eitrige Bronchopneumonie obliterierende Bronchiolitiden Abbildung 6: Prozentualer Anteil positiver Nekrosen bzw. positiver Gewebeproben in der ISH in Gruppe 4 4.3.4.1 Nekrosen Sechs der zehn Tiere wiesen Nekrosen unterschiedlicher Größe in jeweils einigen Lokalisationen auf. In allen Nekrosen (n = 31) konnten zumeist mittelgradige Ansammlungen von in situ-Hybridisierungssignalen im Randbereich sowie geringgradig Signale zentral in der Nekrose festgestellt werden. Bei den meisten Nekrosen waren gemischte Verteilungsformen vorhanden. 4.3.4.2 Katarrhalisch-eitrige Bronchopneumonie Alle Kälber wiesen katarrhalisch-eitrige Bronchopneumonien in nahezu allen untersuchten Lungenlokalisationen auf. Bei allen Tieren konnten positive in situHybridisierungssignale im Exsudat von Bronchien und größeren Bronchioli gefunden werden (Abbildung 26, Kap. 4.5). Die meisten Lokalisationen (85 von 128) wiesen allerdings im Exsudat kein positives Signal auf. Dieses entspricht einem Prozentsatz von 66,4%. Somit waren 33,6% der Blöcke mit katarrhalisch-eitriger Bronchopneumonie positiv in der ISH. 4.3.4.3 Obliterierende Bronchiolitiden Von den sieben Tieren, bei denen in insgesamt 18 Blöcken obliterierende Bronchiolitiden gefunden wurden, konnten nur bei Tier E2941/00 in einem Block Ergebnisse 53 einzelne positive in situ-Hybridisierungssignale gefunden werden. Dieses entspricht einem Prozentsatz von 5,6%. 4.3.4.4 Interstitielle Pneumonie In den verbreiterten Interstitien der untersuchten Lungengewebeproben, in denen eine interstitielle Pneumonie vorlag, konnten keine positiven in situ- Hybridisierungssignale gefunden werden. 4.3.5 Zusammenfassung Sowohl in der Kontrollgruppe als auch in der Gruppe 2 mit Kälbern, welche spätestens zehn Tage nach der Infektion seziert wurden, konnten keine positiven ISH-Signale nachgewiesen werden. Die Kälber der Gruppen 3 und 4 wiesen nahezu in allen vorhandenen Nekrosen positive Signale auf (91,8% in Gruppe 3 und 100% in Gruppe 4). Hierbei ergaben sich mit randständig, zentral und diffus drei Verteilungsmuster, die meist in Mischformen auftraten. Die bei allen Tieren dieser Gruppen nachgewiesenen katarrhalisch-eitrigen Bronchopneumonien zeigten nur in 31,9% (Gruppe 3) bzw. 33,6% (Gruppe 4) der Blöcke ein positives Signal im Exsudat. Bei obliterierenden Bronchiolitiden konnten nur bei zwei Tieren in insgesamt drei Blöcken vereinzelt positive Signale gefunden werden. Das entspricht einem Prozentsatz von 6,1%. In den verbreiterten Interstitien der untersuchten Lungenlokalisationen, in denen eine interstitielle Pneumonie vorlag, wurden keine ISH-Signale nachgewiesen. 4.4 Ergebnisse der immunhistochemischen Untersuchung Die durch Injektion von M. bovis-Suspension in gesundes Lungengewebe gewonnene Positivkontrolle zeigte nach Behandlung mit dem Antikörper MAB970 schwache Signale, die in den verbreiterten interlobulären Interstitien auftraten. Diese braunen und granulären Signale lagen bei mit Balb/C behandelten Schnitten nicht vor. Im Zytoplasma der Epithelzellen von Bronchioli und Bronchien fanden sich schwache, braune Ablagerungen. 4.4.1 Gruppe 1 (Kontrollgruppe) Das Tier E1505/99 wies im Randbereich der Nekrose, die sich in einer Lokalisation befand, geringgradig positive Reaktionen auf. Andere veränderte Bereiche zeigten 54 Ergebnisse keine positiven Reaktionen. In den Lungen der anderen Kälber der Kontrollgruppe wurden in Arealen mit katarrhalisch-eitriger Bronchopneumonie, obliterierender Bronchiolitis und interstitieller Pneumonie keine positiven Signale mit dem Antikörper MAB970 detektiert. Im Zytoplasma des Epithels von Bronchioli und Bronchien fanden sich schwache, braune Ablagerungen. Die Ergebnisse für die IHC der einzelnen Kälber der Gruppe 1 sind in Tabelle 6 im Anhang zusammengefasst. 4.4.2 Gruppe 2 In den Lungen der Kälber der Gruppe 2 wurden in Arealen mit Nekrosen, katarrhalisch-eitriger Bronchopneumonie und interstitieller Pneumonie keine positiven Signale mit dem Antikörper MAB970 detektiert. Im Zytoplasma des Epithels von Bronchioli und Bronchien fanden sich schwache, braune Ablagerungen. Die Ergebnisse der IHC für die einzelnen Kälber der Gruppe 2 sind in Tabelle 7 im Anhang zusammengefasst. 4.4.3 Gruppe 3 Von den zwölf Tieren der Gruppe 3 wiesen sieben Tiere, die auch schon bei der Untersuchung mittels ISH positive Signale aufwiesen, positive Reaktionen mit dem Antikörper MAB970 auf. Diese waren sowohl in Nekrosen, in Arealen mit katarrhalisch-eitriger Bronchopneumonie als auch in obliterierten Bronchioli nachweisbar. Im Zytoplasma des Epithels von Bronchioli und Bronchien fanden sich schwache, braune Ablagerungen. Der prozentuale Anteil der Nekrosen (n = 135) sowie der Blöcke mit katarrhalisch-eitriger Bronchopneumonie (n = 56) und mit obliterierender Bronchiolitis (n = 26) mit IHC-Signalen sind als zusammenfassende Graphik ist in Abbildung 7 dargestellt, die Ergebnisse der IHC für die einzelnen Kälber der Gruppe 3 sind in Tabelle 8 im Anhang aufgeführt. Ergebnisse 55 100.0% 90.0% 80.0% 70.0% 60.0% 50.0% 40.0% 30.0% 20.0% 10.0% 0.0% Nekrosen Katarrhalischeitrige Bronchopneumonie obliterierende Bronchiolitiden Epithelien von Bronchien und Bonchioli Abbildung 7: Prozentualer Anteil positiver Nekrosen bzw. positiver Gewebeproben in der IHC mit dem monoklonalen Antikörper MAB970 in Gruppe 3 4.4.3.1 Nekrosen Vier Tiere dieser Gruppe (E2936/00, E1507/99, E1511/99 und E1512/99) wiesen zum Teil in mehreren Lokalisationen Nekrosen auf. Bis auf die Nekrosen in einer Lokalisation bei Tier E1507/99 konnten in allen anderen Lokalisationen schwache positive Reaktionen im Randbereich der nekrotischen Areale unterhalb des Walls aus Makrophagen gefunden werden (Abbildung 18, Kap. 4.5). Diese traten in der Regel geringgradig auf, in wenigen Nekrosen kam es nur vereinzelt zu Reaktionen. Insgesamt waren 71,85% der Nekrosen (97 von 135) in der immunhistochemischen Untersuchung mit MAB970 positiv. 4.4.3.2 Katarrhalisch-eitrige Bronchopneumonie Die bei allen Tieren dieser Gruppe auftretenden katarrhalisch-eitrigen Bronchopneumonien wiesen bei sechs Tieren positive Reaktionen in einigen Lokalisationen auf. Die Reaktionen traten in der Regel vereinzelt auf. Allerdings wiesen 53,6% der Blöcke (30 von 56) keine positiven Reaktionen im eitrigen Exsudat auf. Bei den Tieren, die mit einer geringeren Dosis einer Mykoplasmensuspension infiziert wurden, konnte keine positive immunhistochemische Reaktion nachgewiesen werden. 56 Ergebnisse 4.4.3.3 Obliterierende Bronchiolitiden Von den sechs Tieren, bei denen in einigen Lokalisationen obliterierende Bronchiolitiden gefunden wurden, konnten nur bei Tier E2936/00 und Tier E2939/00 positive Reaktionen mit MAB970 nachgewiesen werden (Abbildung 30, Kap. 4.5). Insgesamt waren 38,5% der untersuchten Blöcke (10 von 26) mit obliterierender Bronchiolitis in der immunhistologischen Untersuchung positiv. 4.4.3.4 Interstitielle Pneumonie In den verbreiterten Interstitien der untersuchten Lungengewebeproben, in denen eine interstitielle Pneumonie vorlag, konnten keine positiven Reaktionen mit MAB970 gefunden werden. 4.4.4 Gruppe 4 Bis auf Tier E2943/00 wiesen alle Tiere der Gruppe 4 positive Reaktionen in der immunhistochemischen Untersuchung mit MAB970 auf. Diese fanden sich sowohl in Nekrosen und obliterierenden Bronchiolitiden als auch im Exsudat katarrhalischeitriger Bronchopneumonien. Im Zytoplasma des Epithels von Bronchioli und Bronchien fanden sich schwache, braune Ablagerungen. Der prozentuale Anteil der Nekrosen (n = 31) sowie der Blöcke mit katarrhalisch-eitriger Bronchopneumonie (n = 50) und mit obliterierender Bronchiolitis (n = 8) mit IHC-Signalen sind als zusammenfassende Graphik ist in Abbildung 8 dargestellt, die Ergebnisse der IHC für die einzelnen Kälber der Gruppe 4 sind in Tabelle 9 im Anhang aufgeführt. 4.4.4.1 Nekrosen Sechs der zehn Tiere wiesen Nekrosen unterschiedlicher Größe in einigen Lokalisationen auf. Bis auf fünf Nekrosen konnten in allen übrigen positive Signale detektiert werden. Das entspricht einem Prozentsatz von 83,87% (26 von 31). Diese waren in der Regel geringgradig ausgeprägt und im Randbereich der Nekrose unterhalb des Walls aus Makrophagen lokalisiert. Vereinzelt konnten auch zentrale (vier Nekrosen) und diffuse (vier Nekrosen) Verteilungsmuster gefunden werden. Ergebnisse 57 100.0% 90.0% 80.0% 70.0% 60.0% 50.0% 40.0% 30.0% 20.0% 10.0% 0.0% Nekrosen Katarrhalischeitrige Bronchopneumonie obliterierende Bronchiolitiden Epithelien von Bronchien und Bonchioli Abbildung 8: Prozentualer Anteil positiver Nekrosen bzw. positiver Gewebeproben in der IHC mit dem monoklonalem Antikörper MAB970 in Gruppe 4 4.4.4.2 Katarrhalisch-eitrige Bronchopneumonie Die bei allen Tieren dieser Gruppe in nahezu allen Lungenlokalisationen auftretenden katarrhalisch-eitrigen Bronchopneumonien wiesen bei neun Tieren positive Reaktionen im eitrigen Exsudat in einigen Lokalisationen auf (Abbildung 27, Kap. 4.5). Nur bei Tier E2943/00 konnten keine positiven Reaktionen detektiert werden. Die Reaktionen traten in der Regel vereinzelt auf. Allerdings wiesen 36,0% der Blöcke keine positiven Reaktionen im eitrigen Exsudat auf. Somit waren 64% der Blöcke mit katarrhalisch-eitriger Bronchopneumonie (32 von 50) positiv in der IHC. 4.4.4.3 Obliterierende Bronchiolitiden Von den sieben Tieren, bei denen in einigen Lokalisationen obliterierende Bronchiolitiden gefunden wurden, konnten nur bei Tier E2941/00 positive Reaktionen mit MAB970 nachgewiesen werden. Insgesamt waren 25,0% der untersuchten Blöcke mit obliterierender Bronchiolitis (2 von 8) positiv in der immunhistologischen Untersuchung. 4.4.4.4 Interstitielle Pneumonie In den verbreiterten Interstitien der untersuchten Lungengewebeproben mit interstitieller Pneumonie konnten keine positiven Reaktionen mit MAB970 gefunden werden. 58 Ergebnisse 4.4.5 Zusammenfassung Sowohl in der Kontrollgruppe als auch in der Gruppe 2 mit Kälbern, welche spätestens zehn Tage nach Infektion seziert wurden, konnten keine positiven Reaktionen mit MAB970 nachgewiesen werden. Eine Ausnahme bildete das Tier E1505/99, bei dem in einer Lokalisation eine Nekrose gefunden wurde. Diese zeigte im Randbereich geringgradige Ablagerung von Reaktionsprodukt. Die Kälber der Gruppen 3 und 4 wiesen in nahezu allen vorhandenen Nekrosen positive Reaktionen auf. Hierbei waren allerdings nicht alle bei der ISH positiv reagierenden Nekrosen auch in der IHC positiv. In der Regel war das Reaktionsprodukt randständig unterhalb des Walls aus Makrophagen lokalisiert. Die bei allen Tieren dieser Gruppen nachgewiesene katarrhalisch-eitrige Bronchopneumonie zeigte in 46,4% (Gruppe 3) bzw. 64,0% (Gruppe 4) der Blöcke eine positive Reaktion im Exsudat. Bei obliterierenden Bronchiolitiden konnten nur bei drei Tieren in insgesamt zwölf Blöcken vereinzelt positive Signale gefunden werden. Das entspricht einem Prozentsatz von 35,3%. Im Zytoplasma des Epithels von Bronchioli und Bronchien fanden sich bei allen Tieren in allen untersuchten Lokalisationen schwache, braune Ablagerungen. In den verbreiterten Interstitien bei Tieren mit interstitieller Pneumonie wurden keine positiven immunhistochemischen Reaktionen nachgewiesen. 4.5 Fotographische Dokumentation Auf den folgenden Seiten finden sich die Abbildung 9 bis Abbildung 31, welche die beschriebenen histopathologischen Veränderungen der Kälberlungen sowie die Ergebnisse der ISH und IHC fotographisch dokumentieren. Ergebnisse 59 Abbildung 9: Lunge, Mannheimia haemolytica-Infektion Tier 5 aus Gruppe 2 Lokalisation 6 Fibrinöse Pneumonie mit Nekrose N: zentrale Nekrose HE-Färbung Balken: 200 µm Abbildung 10: Lunge, Mannheimia haemolytica-Infektion Tier 5 aus Gruppe 2 Lokalisation 6 Randbereich der Nekrose aus Abbildung 9 N: nekrotisches Material NG: Ansammlung neutrophiler Granulozyten Pfeile: ehemalige Alveolarwand HE-Färbung Balken = 25 µm Abbildung 11: Lunge, Mannheimia haemolytica-Infektion Tier 5 aus Gruppe 2 Lokalisation 6 selber Bereich wie in Abbildung 10 Pfeile: ehemalige Alveolarwand Azan-Färbung Balken = 25 µm 60 Ergebnisse Abbildung 12: Lunge, M. bovis-Infektion Tier E2936/00 Lokalisation 3 Randbereich einer Nekrose N: zentrale Nekrose NG: Demarkationslinie aus überwiegend neutrophilen Granulozyten M: Makrophagenwall HE-Färbung Balken = 25 µm Abbildung 13: Lunge, M. bovis-Infektion Tier E2936/00 Lokalisation 3 Randbereich einer Nekrose mit ausgeprägter bindegewebiger Kapsel M: Makrophagenwall mit Infiltration von Lymphozyten und Plasmazellen BG: umgebendes Bindegewebe HE-Färbung Balken = 25 µm Abbildung 14: Lunge, M. bovis-Infektion Tier E2936/00 Lokalisation 3 Randbereich einer Nekrose NG: Demarkationslinie aus überwiegend neutrophilen Granulozyten M: Makrophagenwall BG: umgebendes Bindegewebe Azan-Färbung Balken = 25 µm Ergebnisse 61 Abbildung 15: Lunge, M. bovis-Infektion Tier E2936/00, Lokalisation 3, Nekrose N: zentrale Nekrose NG: Demarkationslinie aus überwiegend neutrophilen Granulozyten M: Makrophagenwall BG: umgebendes Bindegewebe HE-Färbung Balken = 200 µm Abbildung 16: Lunge, M. bovis-Infektion Tier E2936/00, Lokalisation 3 selbe Nekrose wie in Abbildung 15 in der Azan-Färbung blaues Kollagen des Bindegewebes als Abgrenzung der Nekrose (Pfeile) N: zentrale Nekrose Azan-Färbung Balken = 200 µm Abbildung 17: Lunge, M. bovis-Infektion Tier E2936/00, Lokalisation 3 selbe Nekrose wie in Abbildung 15 M. bovis-DNA-Nachweis in Form eines violettbraunen Präzipitats innerhalb der Nekrose (Stern) N: zentrale Nekrose VspAI-ISH Balken = 200 µm Abbildung 18: Lunge, M. bovis-Infektion Tier E2936/00, Lokalisation 3 selbe Nekrose wie in Abbildung 15 M. bovis-Antigen-Nachweis im Randbereich der Nekrose (Pfeile) N: zentrale Nekrose MAB970-Immunhistologie (DAB) Balken = 200 µm 62 Ergebnisse Abbildung 19: Lunge, M. bovis-Infektion Tier E2936/00 Lokalisation 5 M. bovis-DNA-Nachweis in Form eines violett-braunen Präzipitats im Randbereich der Nekrose (Pfeile) N: zentrale Nekrose VspAI-ISH Balken = 100 µm Abbildung 20: Lunge, M. bovis-Infektion Tier E2936/00 Lokalisation 3 M. bovis-DNA-Nachweis in Form eines violett-braunen Präzipitats im Zentrum der Nekrose N: zentrale Nekrose VspAI-ISH Balken = 100 µm Abbildung 21: Lunge, M. bovis-Infektion Tier E2936/00 Lokalisation 3 M. bovis-DNA-Nachweis in Form eines violett-braunen Präzipitats über die gesamte Fläche der Nekrose verteilt N: zentrale Nekrose VspAI-ISH Balken = 100 µm Ergebnisse 63 Abbildung 22: Lunge, M. bovis-Infektion Tier E1512/99 Lokalisation 2 M. bovis-DNA-Nachweis in Form eines violett-braunen Präzipitats im Randbereich der Nekrose (Pfeile) N: zentrale Nekrose VspAI-ISH Balken = 200 µm Abbildung 23: Lunge, M. bovis-Infektion Tier E1512/99 Lokalisation 2 selber Bereich wie in Abbildung 22 M. bovis-DNA-Nachweis in Form eines violett-braunen Präzipitats im Randbereich der Nekrose (Pfeile) N: zentrale Nekrose VspAI-ISH Balken = 50 µm Abbildung 24: Lunge, M. bovis-Infektion Tier E1512/99 Lokalisation 2 selber Bereich wie in Abbildung 22 M. bovis-DNA-Nachweis in Form eines violett-braunen Präzipitats im Randbereich der Nekrose (Pfeile) N: zentrale Nekrose VspAI-ISH Balken = 25 µm 64 Ergebnisse Abbildung 25: Lunge, M. bovis-Infektion Tier E2941/00 Lokalisation 4 hochgradig eitriges Exsudat im Lumen (L) eines Bronchus HE-Färbung Balken = 100 µm Abbildung 26: Lunge, M. bovis-Infektion Tier E2941/00 Lokalisation 4 selber Bronchus wie in Abbildung 25 M. bovis-DNA-Nachweis in Form eines violett-braunen Präzipitats (Stern) im eitrigen Exsudat im Lumen (L) des Bronchus VspAI-ISH Balken = 100 µm Abbildung 27: Lunge, M. bovis-Infektion Tier E2941/00 Lokalisation 4 selber Bronchus wie in Abbildung 25 M. bovis-Antigen-Nachweis im Randbereich (Pfeile) und innerhalb des eitrigen Exsudats (Stern) im Lumen (L) des Bronchus MAB970-Immunhistologie (DAB) Balken = 100 µm Ergebnisse 65 Abbildung 28: Lunge, M. bovis-Infektion Tier E2936/00, Lokalisation 3 durch obliterierende Bronchiolitis (oB) verschlossener Bronchiolus mit Vakuolisierung der Epithelzellen (Pfeile) HE-Färbung Balken = 25 µm Abbildung 29: Lunge, M. bovis-Infektion Tier E2936/00, Lokalisation 3 selber Bronchiolus wie in Abbildung 28 durch obliterierende Bronchiolitis (oB) verschlossener Bronchiolus mit in der AzanFärbung blauen kollagenen Fasern und Vakuolisierung der Epithelzellen (Pfeile) Azan-Färbung Balken = 25 µm Abbildung 30: Lunge, M. bovis-Infektion Tier E2936/00, Lokalisation 3 selber Bronchiolus wie in Abbildung 28 durch obliterierende Bronchiolitis (oB) verschlossener Bronchiolus mit positiver Reaktion im Epithel (Pfeile) MAB970-Immunhistologie (DAB) Balken = 25 µm Abbildung 31: Lunge, M. bovis-Infektion Tier E2936/00, Lokalisation 3 selber Bronchiolus wie in Abbildung 28 durch obliterierende Bronchiolitis (oB) verschlossener Bronchiolus ohne Hybridisierungssignale VspAI-ISH Balken = 25 µm Diskussion 67 5 Diskussion Ziel dieser Arbeit war es, neben der histopathologischen Beschreibung von Lungenveränderungen bei experimentell infizierten Kälbern die Methode der in situHybridisierung für M. bovis an Formalin-fixiertem und Paraffin-eingebettetem Lungengewebe von diesen Kälbern zu etablieren. Dabei sollten die Verteilung und die Lokalisation der DNA analysiert und mit immunhistochemischen Befunden korreliert werden. 5.1 Histopathologische Befunde Die histopathologischen Befunde an den in der vorliegenden Arbeit verwendeten Lungenproben von 35 Kälbern wurden in Teilen bereits von BUCHENAU (2003) beschrieben. Die Tiere wiesen Veränderungen auf, wie sie auch von anderen Autoren für experimentell mit M. bovis infizierte Kälber aufgeführt wurden (MARTIN et al. 1983; RODRÍGUEZ et al. 1996a; STIPKOVITS et al. 2000a). So wurden Infiltrationen der Alveolarsepten mit Entzündungszellen, katarrhalisch-eitrige Entzündungsprozesse in Bronchien, Bronchiolen und Alveolen, eine Hyperplasie des peribronchiolären lymphatischen Gewebes sowie nekrotische Areale im Lungenparenchym gefunden. Für die Infektionsversuche wurden verschiedene M. bovis-Stämme verwendet. Hierbei handelte es sich um M. bovis PG45 (Gruppe 1), M. bovis 1067 (ein Teil der Tiere aus Gruppe 3 und Gruppe 4) sowie um einen französischen Feldstamm (Teile der Gruppe 3). Von den 30 untersuchten Kälbern, die mit M. bovis infiziert wurden, wiesen 16 (53,3%) eine Infektion mit weiteren bakteriellen Erregern wie Mannheimia haemolytica, Arcanobacterium pyogenes und Pasteurella multocida auf. Besonders auffällig ist hierbei die Gruppe 4, deren Kälbern 18 Tage vor der Inokulation von M. bovis ein aufgereinigtes M. bovis-VspA-Fusionsprotein verabreicht wurde. Hier wurde bei sieben von zehn Tieren (70%) Arcanobacterium pyogenes nachgewiesen. HOUGHTON und GOURLAY (1983) wiesen schon auf das Zusammenspiel von Infektionen mit Mannheimia haemolytica und M. bovis hin. M. bovis ist demnach in der Lage, Infektionen mit anderen bakteriellen Erregern zu begünstigen. Mit viralen 68 Diskussion Erregern wie dem Virus der bovinen Virusdiarrhoe (BVD) konnte ebenfalls ein Synergismus festgestellt werden (SHAHRIAR et al. 2002). Über den virologischen Status der Kälber für die vorliegenden Untersuchungen lagen allerdings keine Daten vor. Bei Tier E1505/99 der Kontrollgruppe (Gruppe 1) sowie Tier 5 aus Gruppe 2, welches nach vier Tagen p. i. getötet wurde, fanden sich Nekrosen in den kranialen Anteilen der Lunge (Lokalisation 1 und 6), die zudem das Bild einer fibrinösen Pneumonie zeigten. Bei E1505/99 konnte in der bakteriologischen Untersuchung der Lunge M. bovis nicht nachgewiesen werden. Bei Tier 5 konnte bakteriologisch M. bovis nachgewiesen werden, allerdings war in der ISH keine M. bovis-DNA darstellbar. Fibrinöse Pneumonien mit Nekrosen werden in der Literatur im Rahmen einer Pasteurellose beschrieben (DUNGWORTH 1993). Bei Tier 5 aus Gruppe 2 wurde Mannheimia haemolytica (ehemals Pasteurella haemolytica) nachgewiesen. Bei dem anderen Tier blieb die Ätiologie für die nekrotischen Veränderungen unklar. Bei drei Kälbern der Gruppe 1 (E1504/99, E1505/99 und E1650/99) konnte zudem eine interstitielle Pneumonie und eine katarrhalisch-eitrige Bronchopneumonie festgestellt werden. Da bei diesen Tieren bakteriologisch weder Mykoplasmen noch andere Erreger nachgewiesen werden konnten, blieb die Ursache dieser Veränderungen unklar. Eventuell sind sie Folge mechanischer Irritationen durch die intratracheale Inokulation der Mykoplasmensuspension bzw. der durchgeführten bronchioalveolären Lavage. So zeigten in einer Studie von PRINGLE et al. (1988) lungengesunde Kälber zehn Tage nach einer bronchioalveolären Lavage geringgradige Infiltrationen von Entzündungszellen in Alveolen und Interstitien. Die Kälber der Gruppe 2 wiesen bereits wenige Tage nach der Infektion geringgradige Veränderungen im Lungenparenchym auf. Diese reichten von milden interstitiellen Infiltrationen bis zu mittelgradigen katarrhalisch-eitrigen Pneumonien. Bei den Kälbern mit den stärksten Veränderungen in Form einer katarrhalischeitrigen Bronchopneumonie wurden als mögliche Erreger Mannheimia haemolytica, Pasteurella multocida und Bacillus-Spezies isoliert. M. bovis konnte nur bei vier der acht Tiere bakteriologisch nachgewiesen werden. In Fällen, in denen nur M. bovis Diskussion 69 aus der Lunge isolierte wurde, fanden sich nur milde entzündliche Infiltrate. M. bovisDNA konnte mittels ISH bei keinem der Tiere der Gruppe 2 nachgewiesen werden. Die Tiere der Gruppe 3 wiesen ein sehr heterogenes histopathologisches Bild auf. Zum einen fand sich hier mit Tier E2936/00 das Kalb mit den stärksten Lungenveränderungen, die hauptsächlich durch Nekrosen gekennzeichnet waren. Diese Nekrosen zeigten einen regelmäßigen Aufbau aus einer bindegewebigen Kapsel, gefolgt von einem Wall aus Makrophagen mit Infiltration von Lymphozyten und Plasmazellen. Die nächste Schicht wurde durch eine Ansammlung zum Teil untergehender neutrophiler Granulozyten gebildet, die um eine zentrale amorphe Masse lagen. Gleichartige Nekrosen wurden auch von anderen Autoren beschrieben (GOURLAY u. HOWARD 1982; RODRÍGUEZ et al. 1996b). Nekrosen mit identischem Aufbau wiesen auch die Tiere E1507/99, E1511/99 und E1512/99 auf, wenn auch in deutlich geringerer Anzahl. Die Nekrosen fanden sich überwiegend in den mittleren Lungenlokalisationen (Lokalisation 2 und 5). Dieses entspricht dem Verteilungsmuster der Lungenveränderungen, die in der Regel im Rahmen einer M. bovis-Infektion gefunden werden, wie es auch von anderen Autoren beschrieben wurde (GOURLAY u. HOWARD 1982; RODRÍGUEZ et al. 1996b). Vier Kälber dieser Gruppe (E1507/99, E1509/99, E1510/99, E1512/99) wurden mit einer höheren Dosis einer M. bovis-Kultur (1010 CFU/ml) infiziert. Alle diese Tiere wiesen eine zusätzliche Infektion mit Pasteurella multocida auf. Bei allen Tieren wurden mittel- bis hochgradige katarrhalisch-eitrige Bronchopneumonien sowie bei zwei Kälbern Nekrosen in kranialen und mittleren Lungenabschnitten gefunden. Im Lungengewebe der vier Kälber (E1506/99, E1508/99, E1511/99, E1513/99), die mit einer geringeren Dosis (108 CFU/ml) einer M. bovis-Kultur infiziert wurden, wurden keine anderen Keime nachgewiesen. Bei diesen Tieren waren die histologischen Veränderungen deutlich weniger stark ausgeprägt. Somit wies nur ein Tier in einer Lokalisation eine Nekrose auf, und die katarrhalisch-eitrige Bronchopneumonie war nur geringgradig ausgeprägt. Eine Infektion mit M. bovis führt demzufolge mit einer höheren Infektionsdosis zu ausgeprägteren Veränderungen in der Lunge als bei einer geringeren Infektionsdosis. Gleichzeitig wird die Ansiedlung anderer pathogener Keime begünstigt, die nachfolgend oder synergistisch zu stärker 70 Diskussion ausgeprägten Pneumonien führen, wie es auch von anderen Autoren beschrieben wurde (HOUGHTON u. GOURLAY 1983; SHAHRIAR et al. 2002). Bei den eben erwähnten Kälbern E1506/99 bis E1513/99 wurden zwei verschiedene M. bovis-Stämme verwendet. Vier Tiere wurden mit M. bovis 1067 infiziert, die vier anderen Kälber wurden mit einem französischen Feldstamm inokuliert. Ein Unterschied in der Ausprägung, Lokalisation und Verbreitung der gefunden Lungenveränderungen konnte zwischen diesen beiden Stämmen nicht festgestellt werden. Bei dem Tier E2937/00 wurde eine interstitielle Pneumonie mit Infiltration eosinophiler Granulozyten gefunden. Während die interstitielle Pneumonie auf die Infektion mit M. bovis zurückzuführen war, blieb die genaue Ätiologie der Infiltration mit eosinophilen Granulozyten unklar. In der Regel werden eosinophile Entzündungsprozesse in der Lunge im Zusammenhang mit einer Infektion mit Parasiten gefunden. Beim Rind kämen Dictylocauliden und Protostrongyliden in Betracht (BÜRGER 1992). Allerdings konnten in den vorhandenen Gewebeproben keine Larven oder Eier der jeweiligen Parasiten nachgewiesen werden, die in der Regel gefunden werden. Eosinophile Granulozyten treten auch bei Überempfindlichkeitsreaktionen vom anaphylaktischen Typ auf (MESSOW u. HERMANNS 1990). THOMASMEYER (2006) konnte zeigen, dass in den Lungen von Jungtieren und von lungengesunden Schlachttieren regelmäßig eosinophile Granulozyten vorkommen. Somit stellt diese Veränderung bei dem Kalb E2937/00 möglicherweise einen Nebenbefund ohne bedeutende Relevanz dar. Die Tiere der Gruppe 4 zeigten ein relativ einheitliches pathohistologisches Bild mit einzelnen Nekrosen und zum Teil ausgeprägten katarrhalisch-eitrigen Bronchopneumonien. Entgegen der Verteilung der Nekrosen bei Gruppe 3 fanden sich diese verstärkt auch in den kaudalen Lokalisationen der Lunge (Lokalisation 3 und 4). Hierbei handelt es um untypische Bereiche für Lungenveränderungen bei einer Infektion mit M. bovis, welcher aus nahezu allen Lungen der Kälber postmortal isoliert wurde. Die überwiegende Zahl der Tiere wies, wie oben erwähnt, zusätzlich eine Infektion mit Arcanobacterium pyogenes auf. Auch dieser Erreger wird nicht in Zusammenhang mit nekrotischen Veränderungen in den kaudalen Diskussion 71 Lungenabschnitten gebracht. Somit ist unklar, worauf die ungewöhnliche Häufung auf die kaudalen Abschnitte zurückzuführen ist. MARTIN et al. (1983) führt auf, dass bei starken Veränderungen in den kranialen und mittleren Lungenabschnitten sich diese im weiteren Krankheitsverlauf auf die kaudalen Lokalisationen ausbreiten. Allerdings wiesen Kälber aus der Gruppe 3 zum Teil umfangreichere Veränderungen in den kranialen Abschnitten der Lunge auf, welche nur vereinzelt in den kaudalen Lokalisationen der Lunge zu finden waren. In wie weit die vorherige Eingabe von aufgereinigtem, rekombinanten M. bovis-VspA-Fusionsprotein einen Einfluss auf die veränderte Ausbreitung der Läsionen in der Lunge hatte, konnte nicht abschließend geklärt werden. KHODAKARAM-TAFTI und LÓPEZ (2004) fanden in ihrer Untersuchung zwei Arten von Nekrosen, die durch M. bovis verursacht werden. Zum einen eine Koagulationsnekrose (in 33,3% der Fälle) mit vielen neutrophilen Granulozyten und einer fibrinopurulenten Bronchopneumonie. Zum anderen verkäsende Nekrosen (in 100% der Fälle), die von Granulationsgewebe umgeben sind. Bei den untersuchten Kälbern waren zum Teil Infektionen mit weiteren bakteriellen Erregern vorhanden. So wurden Pasteurella multocida, Mannheimia haemolytica und Arcanobacterium pyogenes regelmäßig isoliert. Die gefundenen Nekrosen der Kälber, die in dieser Arbeit untersucht wurden, entsprechen von ihrem Erscheinungsbild eher dem einer verkäsenden Nekrose mit eosinophilem, azellulärem Zentrum, umgeben von untergehenden Leukozyten und einem Band aus Fibroblasten gemischt mit Makrophagen. Bei anderen Autoren (ADEGBOYE et al. 1995b; RODRÍGUEZ et al. 1996a) wird diese Art der Nekrose Koagulationsnekrose genannt. Die von KHODAKARAM-TAFTI und LÓPEZ (2004) beschriebenen Koagulationsnekrosen entsprechen eher dem Bild, wie es bei dem Tier E1505/99 aus der Kontrollgruppe und Tier Nr. 5 aus Gruppe 2 in Folge einer Infektion mit Mannheimia haemolytica gefunden wurde. Allerdings konnten KHODAKARAM-TAFTI und LÓPEZ (2004) in diesen Nekrosen M. bovis-Antigen nachweisen, was bei den Fällen der vorliegenden Untersuchung immunhistochemisch nicht möglich war. Lediglich das Kontrolltier E1505/99 wies am Rand einer Nekrose geringgradige Ablagerungen von Reaktionsprodukt auf, wobei bei diesem Tier keine Infektion mit M. bovis erfolgte, der 72 Diskussion Erreger nicht isoliert werden konnte und auch sonst nicht nachgewiesen wurde. Möglicherweise handelte es sich hierbei um eine Kreuzreaktion des Antikörpers mit wirtseigenen Strukturen. Mittels ISH konnte ebenfalls keine M. bovis-DNA bei diesem Tier wie auch bei Tier Nr. 5 aus Gruppe 2 nachgewiesen werden. Obliterierende Bronchiolitiden fanden sich bei mehreren Tieren aus den Gruppen 3 und 4 in einzelnen Lungenlokalisationen. Diese Veränderung wurde in der Literatur bisher nicht im Zusammenhang mit einer M. bovis-Infektion aufgeführt. STIPKOVITS et al. (2000a, b) beschrieben Zerstörungen und Degenerationen des Bronchialepithels bei natürlich und experimentell mit M. bovis infizierten Kälbern. RODRÍGUEZ et al. (1996a) wiesen zudem nekrotisierende Bronchiolitiden bei Kälbern nach. Hierbei handelte es sich möglicherweise um Vorstufen einer obliterierenden Bronchiolitis. Obliterierende Bronchiolitiden werden beim Rind üblicherweise im Zusammenhang mit Infektionen mit dem bovinen respiratorischen Synzytialvirus (PIRIE et al. 1981; PHILIPPOU et al. 2000), mit Mannheimia haemolytica (FRIEND et al. 1977; HAZIROGLU et al. 1997) sowie mit M. dispar (BRYSON et al. 1978) beschrieben. Mannheimia haemolytica konnte nur bei Tier 5 aus Gruppe 2 nachgewiesen werden. Bei diesem Tier wurde allerdings keine obliterierende Bronchiolitis festgestellt. Somit ist die obliterierende Bronchiolitis wahrscheinlich Folge der M. bovis-Infektion. 5.2 Die Methode der in situ-Hybridisierung Mit der ISH sollten genomische Sequenzen von M. bovis nachgewiesen werden. Für den Nachweis von RNA ist entweder Gefriermaterial oder nach bestimmten Protokollen für nur einen kurzen Zeitraum von max. 3 Stunden in Formalin-fixiertes und Paraffin-eingebettetes Material notwendig (LEITCH et al. 1994). Ansonsten kommt es schnell zu einem Abbau der RNA durch ubiquitäre RNAsen. DNA ist im Gegensatz dazu weniger anfällig und wird zu einem geringeren Prozentsatz enzymatisch abgebaut (LEITCH et al. 1994). Für die hier durchgeführten Untersuchungen stand für nur 24 bzw. 72 Stunden in Formalin-fixiertes und Paraffineingebettetes Material aus dem Archiv zu Verfügung. Damit war die Wahrscheinlichkeit, in dem Probenmaterial DNA zu detektieren deutlich größer als für einen RNA-Nachweis. DNA hybridisiert allerdings nur mit einer DNA-Sonde stabil. Diskussion 73 Die optimale Länge einer Sonde beträgt 100 bis 300 Basenpaare (bp). Kürzere Sonden bilden nicht so stabile Nukleinsäurepaare, längere Sonden (insbesondere solche, die länger als 1 kbp sind) dringen dagegen unter Umständen nur schlecht in das Gewebe ein (LEITCH et al. 1994). So wurde im Rahmen dieser Untersuchung zunächst eine Sonde mit einer Länge von ca. 1 kbp aus dem Genombereich des vspA-Gens verwendet. Mit dieser Sonde war es trotz Variation der meisten Parameter des ISH-Protokolls nicht möglich, ein positives Signal zu erhalten. MC CULLY und BROCK (1992) synthetisierten eine Sonde mit 1150 bp, mit der sie M. bovis in einem Southern Blot nachwiesen. Diese Sonde fand jedoch trotz Ankündigung in der Veröffentlichung keine weitere Benutzung in einer ISH, was an der Länge gelegen haben könnte. Von der Verwendung einer Oligonukleotidsonde wurde in der vorliegenden Arbeit abgesehen, da diese den Nachteil haben, dass nur eine begrenzte Anzahl an Markermolekülen eingebaut wird. Somit können zum einen bei geringer Anzahl an Zielsequenzen unter Umständen nur wenige Signale detektiert werden, was eine geringere Sensitivität der Methode zur Folge hat. Zum anderen können bereits wenige fehlgepaarte Nukleotide die Stabilität der entstehenden Doppelhelix erheblich beinträchtigen (LEITCH et al. 1994). Somit wurden für die hier vorgelegte Untersuchung zwei Sonden synthetisiert, die mit 171 bzw. 217 bp im optimalen Längenbereich liegen. In der Literatur wurde bis jetzt keine ISH für M. bovis beschrieben, somit handelt es sich bei der vorliegenden Arbeit um die Erstbeschreibung dieser Methode für den Nachweis von M. bovis-DNA. Es wurde mit Digoxigenin eine nicht radioaktive, indirekte Markierung der Sonde gewählt. Der Vorteil nichtradioaktiv markierter Sonden ist die längere Haltbarkeit. Radioaktive Elemente, die in die genomische Sequenz eingebaut werden, haben Halbwertzeiten von einigen Wochen. Zum anderen ist die Expositionszeit auf Grund ihrer schwachen Strahlung mehrere Tage bis zu Wochen lang, weshalb sie ebenfalls wenig praktikabel ist. Zusätzlich besteht auf Grund der Emission radioaktiver Strahlung ein erhöhter räumlicher und sicherheitstechnischer Aufwand (LEITCH et al. 1994). Im Gegensatz zu anderen Markermolekülen wie beispielsweise Biotin kommt Digoxigenin als antigene Struktur nicht natürlich im tierischen Gewebe vor, so dass falsch positive Ergebnisse durch Bindung des mit alkalischer Phosphatase 74 Diskussion gekoppelten Antikörpers gegen Digoxigenin an wirtseigenes Gewebe vermieden werden können (HERRINGTON et al. 1989). Die Methode der ISH für M. bovis-DNA wurde mittels einer DIG-markierter DNASonde etabliert. Um während der Etablierung sicher zu stellen, dass die einzelnen Arbeitsschritte korrekt getätigt wurden, wurde zu Beginn eine ISH für porzines Circovirus Typ 2 (PCV-2) mit positiver und negativer Kontrolle parallel durchgeführt. Diese wurde im Institut für Pathologie der Tierärztlichen Hochschule Hannover entwickelt (KRÜGER 2005). Die Sonden VspAI und VspAII wurden zunächst an unverändertem Lungengewebe getestet, welches mit einer konzentrierten M. bovisSuspension injiziert worden war. Als negative Kontrolle dienten zum einen gleich behandelte, allerdings nicht mit Sonde inkubierte Schnitte (nicht mit Sonde versetzter Hybridisierungspuffer), sowie Lungengewebe, welches nur mit dem Suspensionsmedium (ohne M. bovis) injiziert wurde. Nach Optimierung der einzelnen Arbeitsschritte und Prozeduren erfolgte die Untersuchung der 35 Kälber mit dem in Kapitel 3.5.8 aufgeführten Protokoll. Eine Entstehung des durch alkalische Phosphatase katalysierten farbigen Niederschlags durch endogene Peroxidasen wurde mittels Hemmung derselbigen durch Wasserstoffperoxid getestet. Zudem wiesen die ohne Sonde inkubierten Schnitte keine Signale auf, so dass in diesen Kontrollen die inaktive endogene Peroxidase regelmäßig mitgetestet wurde. 5.3 Ergebnisse der in situ-Hybridisierung Bei den untersuchten Kälbern konnte mittels der ISH mit den Sonden VspAI und VspAII M. bovis-DNA in den Nekrosen und im Exsudat bei katarrhalisch-eitrigen Bronchopneumonien nachgewiesen werden. Es konnten hinsichtlich Lokalisation und Verbreitung von M. bovis-DNA keine Unterschiede zwischen den beiden Sonden festgestellt werden. Mit dem hier vorgelegten Protokoll sind somit beide Sonden in der Lage, in das Zielgewebe einzudringen und mit M. bovis-DNA zu hybridisieren. Demzufolge besitzen der M. bovis-Stamm 1067 und der französische Feldstamm, die zur Infektion der Kälber aus Gruppe 3 und 4 verwendet wurden, ein vspA-Gen (detektierbar mit der Sonde VspAI) sowie auch die vorgeschaltete Sequenz, die zum Anschalten und damit zur Expression des VspA-Proteins notwendig ist (detektierbar mit der Sonde VspAII). Die Sonden wurden anhand der Sequenz des M. bovis- Diskussion 75 Stammes PG45 nach den von LYSNYANSKY et al. (1996, 2001a) veröffentlichten Sequenzen synthetisiert. Von den zur Untersuchung vorliegenden Lungengewebeproben der Kälber waren die Tiere der Gruppe 2 mit einer klonalen Variante des M. bovis-Stammes PG45 infiziert worden. Bei keinem dieser Tiere konnte ein Hybridisierungssignal detektiert werden. Möglicherweise war die Methode der ISH in diesem Fall nicht sensitiv genug, wobei die Sensitivität der Sonden an infiziertem Gewebe nicht ermittelt wurde. Die Probengewinnung innerhalb von maximal 10 Tagen p. i. hatte wahrscheinlich noch nicht dazu geführt, dass M. bovis sich stärker vermehrt und in bestimmten Arealen der Lunge im Zusammenhang mit hochgradigen Gewebealterationen persistiert. Im Gegensatz dazu konnten bei den Kälbern der Gruppen 3 und 4 zum Teil hochgradige Hybridisierungssignale nachgewiesen werden. Diese Kälber waren mit dem Stamm M. bovis 1067 bzw. einem nicht genauer bezeichneten französischen Feldstamm infiziert worden. Diese Stämme besitzen somit auf Grund der hier vorliegenden Hybridisierungsergebnisse das vspA-Gen. BUCHENAU (2003) konnte in ihrer Untersuchung an einem Teil der Kälber der Gruppe 3 und 4 mittels Antikörpern, die speziell gegen die variablen Oberflächenproteine VspA, VspB und VspC gerichtet sind, diese Antigene im infizierten Lungengewebe nachweisen. Somit exprimieren ein Teil der hier untersuchten Kälber VspA in vivo, wie es BUCHENAU (2003) mit spezifischen Antikörpern nachgewiesen hatte, und auch die dazugehörige Gensequenz von vspA konnte mittels der ISH detektiert werden. BUCHENAU (2003) fand in ihrer immunhistochemischen Untersuchung mit spezifischen Antikörpern gegen variable Oberflächenproteine zudem Reaktionsprodukte, welche ein lineares Ablagerungsmuster an der Oberfläche der Alveolen zeigten. Es wurde hier diskutiert, dass es sich in diesem Fall möglicherweise um Kreuzreaktionen der Antikörper mit Surfaktant handeln könnte. Es konnte in der hier vorliegenden Untersuchung mit der ISH keine M. bovis-DNA in diesen Bereichen detektiert werden. Somit liegt nahe, dass es sich um Surfaktant handelt, auch wenn dieses nicht bewiesen wurde. Eine andere Möglichkeit, dass keine Hybridisierungssignale nachgewiesen wurden, könnte auch eine zu geringe 76 Diskussion Sensitivität der Sonden sein, welche allerdings nicht an infiziertem Gewebe getestet wurde. Mittels der ISH konnten in der Gruppe 3 und 4 in nahezu allen vorhandenen Nekrosearealen Hybridisierungssignale detektiert werden (91,8% bzw. 100%). Diese fanden sich hauptsächlich randständig, wobei allerdings zentrale und diffuse Verteilungen, meist in Mischformen, auftraten. Somit entspricht das Verteilungsmuster für M. bovis-DNA dem, wie es auch KHODAKARAM-TAFTI und LÓPEZ (2004) mittels Immunhistochemie für M. bovis-Antigen beschrieben haben. Auch RODRÍGUEZ et al. (1996a) konnten mittels Immunhistochemie M. bovisAntigen verstärkt in den Randzonen und auch im Zentrum der Nekrosen nachweisen. Die von RODRÍGUEZ et al. (1996a) und BUCHENAU (2003) nachgewiesenen Antigene von M. bovis im Bereich der Oberflächen von Bronchiolen und Bronchioli konnten mittels der ISH nicht nachvollzogen werden. Entweder waren in diesen Bereichen zu wenige Mykoplasmen vorhanden, so dass die Sonde nur einzelne Möglichkeiten hatte, mit M. bovis-DNA zu hybridisieren. Andererseits könnte es sich bei den von RODRÍGUEZ et al. (1996a) und BUCHENAU (2003) gefundenen Ergebnissen um Kreuzreaktionen der jeweiligen Antikörper mit Surfaktant oder Wirtsgewebe handeln. KWON und CHAE (1999) sowie KWON et al. (2002) untersuchten natürlich und experimentell mit M. hyopneumoniae infizierte Schweinelungen mit der ISH. Sie konnten M. hyopneumoniae-DNA massenhaft am Epithel der Bronchien und Bronchioli nachweisen, aber nie im Epithel. Des Weiteren fanden sie Signale in Alveolar- und interstitiellen Makrophagen sowie Pneumozyten Typ I. In der vorliegenden Untersuchung konnte keine M. bovis-DNA in Assoziation zum Epithel nachgewiesen werden. Zu gleichen Ergebnissen kamen THOMAS et al. (1987), die mit M. bovis infizierte, bovine Trachealkulturen mit Immunperoxidasefärbung und Elektronenmikroskopie untersuchten. Sie konnten bei dieser Untersuchung zudem keine Schädigung des Epithels feststellen, allerdings war das darunter liegende Gewebe zum Teil nekrotisch. GEARY et al. (1981) beschrieben ein von M. bovis produziertes Toxin, welches möglicherweise für die Veränderungen in der Lunge verantwortlich war (HOWARD et al. 1987b). Allerdings wurde bis jetzt bei keinem M. Diskussion 77 bovis-Stamm die genetische Ausstattung für die Produktion eines Toxins gefunden (ROSENGARTEN, persönliche Mitteilung). Bei Schweinen kommt es ähnlich der M. bovis-Infektion beim Rind zu einer Hyperplasie des BALT (MAES et al. 1996). Innerhalb des hyperplastischen peribronchiolären lymphatischen Gewebe konnten KWON und CHAE (1999) sowie KWON et al. (2002) keine Hybridisierungssignale nachweisen. Dadurch ergibt sich, dass die BALT-Hyperplasie nicht direkt durch den Erreger verursacht wird, sondern durch mitogene Effekte, wie sie MESSIER und ROSS (1991) mit M. hyopneumoniae Membranen nachweisen konnten. Auch in der vorliegenden Untersuchung konnte innerhalb des hyperplastischen peribronchiolären lymphatischen Gewebes keine M. bovis-DNA nachgewiesen werden. Analog zu M. hyopneumoniae konnten VANDEN BUSH und ROSENBUSCH (2003) für M. bovis zeigen, dass abgetötete Erreger die Aktivierung von CD4+ und CD8+ Zellen stimulieren. Möglicherweise kam es auch in den vorliegenden Fällen durch eine ständige Prozessierung von M. bovis-Antigen durch Makrophagen und deren Präsentation im lymphatischen Gewebe zu dessen Hyperplasie und „Cuff“-Bildung. HOWARD et al. (1976) und THOMAS et al. (1991) beschrieben, dass es in vitro zur Adhärenz von M. bovis an die Oberfläche boviner neutrophiler Granulozyten kommt. In vorliegender Untersuchung konnte in der Randzone der Nekrosen, die überwiegend von neutrophilen Granulozyten gebildet wird, und im Exsudat katarrhalisch-eitriger Bronchopneumonien M. bovis-DNA mit der ISH nachgewiesen werden. Dieses lässt vermuten, dass auch in vivo eine Adhärenz von M. bovis an neutrophile Granulozyten auftritt. 5.4 Persistenz von Mycoplasma bovis Regelmäßig wurde mittel- bis hochgradig M. bovis-DNA innerhalb der durch Bindegewebe und Makrophagen demarkierten Nekrosen sowie gering- bis mittelgradig im Exsudat katarrhalisch-eitriger Bronchopneumonien der 21 Tage p. i. getöteten Kälber nachgewiesen. Im chronischen Krankheitsgeschehen zeigt sich somit eine Persistenz des Erregers, der zudem im Exsudat vorhanden ist und dadurch wahrscheinlich weiterhin von den infizierten Kälbern ausgeschieden werden 78 Diskussion kann. Dieses ist für die Epidemiologie von M. bovis auch gerade innerhalb eines Bestandes von Bedeutung. Seit der Entdeckung der variablen Oberflächenproteine von M. bovis (BEHRENS et al. 1994) wird diesen eine Rolle an der Persistenz des Erregers im Respirationstrakt zugesprochen. Diese bilden als Lipoproteine immunogene Oberflächenstrukturen, die beim Wirt zur Bildung von Antikörpern führen (SACHSE et al. 2000). Innerhalb eines Stammes können diese Oberflächenstrukturen während einer Infektion stark variieren. Durch eine ständige Änderung dieser kommt es beim Wirt zu einer Immunmodulation, die es M. bovis ermöglicht, sich der Elimination aus dem Respirationstrakt zu entziehen, wobei der genaue Vorgang noch nicht bekannt ist (ROSENGARTEN et al. 2000). Jüngste Untersuchungen haben gezeigt, dass einige Mykoplasmen, darunter auch M. bovis, in der Lage sind, Biofilme zu produzieren (MC AULIFFE et al. 2006). Bei Biofilmen handelt es sich um strukturierte Gemeinschaften von bakteriellen Zellen in einer selbst produzierten Matrix aus polymeren Substanzen, meist Polysaccharide, auf einer inerten oder belebten Oberfläche (COSTERTON et al. 1999). So konnten MC AULIFFE et al. (2006) zeigen, dass M. bovis in der Lage ist, einen Biofilm zu produzieren und innerhalb dessen eine große Resistenz gegen Stressoren wie Trockenheit und Hitze aufwies. Eine erhöhte Resistenz gegen Antibiotika, wie sie von anderen Autoren für Keime innerhalb eines Biofilms beschrieben wird (MELCHIOR et al. 2006), konnte bei M. bovis nicht festgestellt werden. Innerhalb der M. bovisStämme konnten Unterschiede hinsichtlich der Fähigkeit, Biofilme zu produzieren, gefunden werden. So waren Stämme, die an der Oberfläche VspO und VspB exprimierten deutlich besser in der Lage, Biofilme zu produzieren als Stämme, die beispielsweise VspF exprimierten (MC AULIFFE et al. 2006). Möglicherweise findet M. bovis innerhalb der Nekrosen ein Milieu vor, welches -ähnlich dem eines Biofilmes- die Eliminierung durch den Wirt verhindert und gleichzeitig die Vermehrung sicherstellt. In diesem Fall wäre es interessant, die Zusammensetzung der extrazellulären Substanzen innerhalb der Nekrosen zu bestimmen und die Ergebnisse mit denen normaler Biofilme zu vergleichen. Eine Beteiligung von VspA an der Entwicklung von Biofilmen ist noch unklar. Weiterführende Untersuchungen Diskussion 79 müssten die immunhistochemische Detektion andere Mitglieder der Vsp-Familie mittels spezieller Antikörper beinhalten. Eine weitere Möglichkeit stellt die ISH dar, mit der sich die Sequenzen der einzelnen vsp-Gene, wie im vorliegenden Fall mit vspA, nachweisen lassen. 5.5 Immunhistochemie Mit dem monoklonalen Antikörper MAB970 konnte in den gleichen Lokalisationen, in denen mit der ISH M. bovis-DNA detektiert wurde, M. bovis-Antigen nachgewiesen werden. In den Nekrosen war dieses jedoch meist im Randbereich angesiedelt. Auch im Exsudat der katarrhalisch-eitrigen Bronchopneumonien wurde regelmäßig M. bovis-Antigen detektiert. Während im Exsudat deutlich häufiger positive Reaktionen (46,4% bzw. 64,0%) als in der ISH (31,9% bzw. 33,6%) gefunden wurden, zeigten die Nekrosen in geringfügig weniger Fällen eine positive Reaktion (71,85% bzw. 83,87% in der IHC positiv, 91,8% bzw. 100,0% in der ISH positiv). Allerdings wurde mit dem Antikörper regelmäßig Zytoplasma von Epithelzellen in Form feingranulärer, brauner Ablagerungen angefärbt. Diese positive Reaktion fand sich nicht nur bei den infizierten Kälbern der Gruppen 2, 3 und 4, sondern auch bei den nicht infizierten Kälbern der Kontrollgruppe, bei denen kein M. bovis aus den Lungen isoliert wurde. Auch BUCHENAU (2003) fand im Bronchial- und Bronchiolarepithel positive Reaktionen mit den für Vsps spezifischen Antikörpern. ADEGBOYE et al. (1995a, b) fanden braune Ablagerungen von Reaktionsprodukt in Epithelzellen von Bronchien und Bronchiolen, die bei den Kontrolltieren allerdings nicht auftraten. Somit schlussfolgerten diese Autoren, dass M. bovis intraepithelial vorhanden sei. Die Entstehung der Nekrosen im Rahmen einer M. bovis-Infektion wurde in fünf Stadien unterteilt (ADEGBOYE et al. 1995b). Im ersten Stadium finden sich Makrophagen und neutrophile Granulozyten im Lumen von kleinen Bronchiolen, in deren Epithel M. bovis-Antigen nachgewiesen werden. Darauf folgt eine Akkumulation von Entzündungszellen sowie eine peribronchioläre, mononukleäre Zellansammlung („Cuffing“). Das nächste Stadium besteht aus einer beginnenden Degeneration und Zusammenhangstrennung des Epithels durch infiltrierende Makrophagen und neutrophile Granulozyten. Danach kommt es zu einem Verlust des Bronchialepithels mit Ausbildung einer Koagulationsnekrose, in deren Randbereich 80 Diskussion hochgradig M. bovis-Antigen nachgewiesen werden kann. Abschließend entsteht eine Koagulationsnekrose mit einem schwachen positiven Signal für M. bovisAntigen (ADEGBOYE et al. 1995b). Die einzelnen Stadien der Nekroseentstehung konnten in der vorliegenden Untersuchung nicht nachvollzogen werden. In wie weit es sich bei den obliterierenden Bronchiolitiden um Vorstufen von Nekrosen handelt, ist noch unklar. Mit der IHC wurden mit 35,3% der untersuchten Lokalisationen deutlich mehr positive Reaktionen in obliterierenden Bronchiolitiden detektiert als mit der ISH M. bovis-DNA nachgewiesen wurde (6,1%). Dieses Ergebnis ist auf das im Epithel von Bronchien und Bronchioli falsch positive Reaktionsprodukt mit dem Antikörper MAB970 zurückzuführen. Für die Untersuchungen von ADEGBOYE et al. (1995b) wurden Lungengewebeproben von natürlich infizierten Kälbern verwendet, die verschieden lange an chronischer Pneumonie litten. Somit wurden in diesen Fällen unterschiedliche Stadien der Infektion erfasst, wobei sich die Kälber wahrscheinlich mit individuellen Erregermengen infizierten. In der vorliegenden Untersuchung waren die Tiere, die Nekrosen mit Nachweis von M. bovis-DNA und -Antigen aufwiesen, einheitlich 21 Tage nach der experimentellen Infektion getötet worden, wobei bis auf einige Tiere aus Gruppe 3 einheitliche Infektionsdosen eingesetzt wurden. Somit wäre es von besonderem Interesse, bei natürlich infizierten Kälbern bzw. Kälbern, die zu unterschiedlichen Zeitpunkten nach der Infektion getötet wurden, das Vorkommen von M. bovis-DNA mit der ISH zu analysieren. Um pathomorphologische Veränderungen im Rahmen einer Infektion mit M. bovis ohne die Beteiligung von sekundären Erregern zu untersuchen, benötigt man Tiermaterial aus spezifiziert pathogenfreien Haltungen (SPF-Haltung). Dieses ist jedoch mit einem hohen Material- und somit auch Kostenaufwand verbunden. GOURLAY et al. (1976) bewiesen zwar in Infektionsversuch mit gnotobiotischen Kälbern die Pathogenität von M. bovis für Lungengewebe, allerdings kam es hier zu nicht genauer beschriebenen bakteriellen Kontaminationen der Kälber. HOWARD et al. (1987a) untersuchten ebenfalls gnotobiotische Kälber nach experimenteller M. bovis-Infektion. Allerdings wurden hier nur vier Tiere untersucht. Die Autoren führten Diskussion 81 auch immunhistochemische Untersuchungen durch, die M. bovis-Antigen in den Randbereichen nekrotischer Areale nachwiesen. Eine Untersuchung zur Verteilung von M. bovis-DNA, wie sie mit der ISH möglich ist, wurde nicht durchgeführt. KHODAKARAM-TAFTI und LÓPEZ (2004) fanden innerhalb des Zytoplasmas von mononukleären Zellen in den lymphatischen Follikeln geringe Mengen von M. bovisAntigen. RODRÍGUEZ et al. (1996a) beschrieben allerdings in dieser Region keine Signale. Zu gleichen Ergebnissen kommt die vorliegende Untersuchung, in der mit dem Antikörper MAB970 wie auch mit der ISH kein positives Signal nachgewiesen werden konnte. Somit ist die Hyperplasie des BALT wahrscheinlich nur eine Folge der immunologischen Abwehr und nicht einer direkten Infektion mit dem Erreger. 5.6 Diagnostik Für die Routinediagnostik ist dem Nachweis von M. bovis mittels ISH kein bedeutender Stellenwert beizumessen, da es sich um eine zeit- und materialintensive Methode handelt. So dauert der Vorgang nach dem hier vorgestellten Protokoll drei Tage, während die IHC maximal zwei Tage in Anspruch nimmt. Da die ISH an Formalin-fixiertem und Paraffin-eingebettetem Material durchgeführt wird, können keine Proben von lebenden Tieren untersucht werden. Ausnahmen würden hier Lungenbioptate bilden, die allerdings in der Praxis am sedierten Rind auf Grund des hohen Aufwandes selten entnommen werden. Die ISH ist allerdings ein gutes Werkzeug zur Lokalisation von Erregern oder bestimmter genomischer Sequenzen und hat somit bei der Erforschung der Pathogenese von Krankheiten einen hohen Stellenwert (LEITCH et al. 1994). Für die intravitale und postmortale Diagnostik einer M. bovis-Infektion stehen mehrere Möglichkeiten zur Auswahl. Zum einen kann der Erregernachweis mittels PCR erbracht werden, was im Gegensatz zur kulturellen Anzüchtung des Erregers deutlich weniger Zeit in Anspruch nimmt (FREY et al. 1999). Zur Identifizierung von mit M. bovis infizierten Tieren innerhalb eines Bestandes werden serologische Tests angeboten, die mittels ELISA den Antikörpertiter aus dem Blut bestimmen (NICHOLAS et al. 2000). 82 Diskussion 5.7 Schlussfolgerung Zusammenfassend lässt sich feststellen, dass mit einer DIG-markierten Sonde für VspA in der ISH M. bovis-DNA nachgewiesen werden kann. Vor allem in Nekrosen sowie zum Teil im Exsudat katarrhalisch-eitriger Bronchopneumonien von Kälbern, die 21 Tage p. i. getötet wurden, konnte diese detektiert werden. Die Mechanismen, die es M. bovis ermöglichen, in den Nekrosen zu persistieren, bedürfen weitergehender Untersuchungen. Bei Kälbern, die in der frühen Phase der Infektion (bis maximal 10 Tage p. i.) untersucht wurden, konnte kein Hybridisierungssignal detektiert werden. Mit der IHC mit dem Antikörper MAB970, welcher gegen nicht genauer definierte Epitope von M. bovis gerichtet ist, konnte in den gleichen veränderten Lungenbereichen M. bovis-Antigen nachgewiesen werden, in denen auch M. bovisDNA detektierbar war. Allerdings kommt es mit dem monoklonalen Antikörper MAB970 auch im Epithel von Bronchien und Bronchiolen zu Ablagerungen von Reaktionsprodukt, die mit der ISH nicht bestätigt werden konnten. Hierbei handelt es sich wahrscheinlich um falsch positive Reaktionen, da sie auch bei nicht infizierten Kälbern auftraten. Zusammenfassung 83 6 Zusammenfassung Björn Jacobsen (2006): Nachweis von Mycoplasma bovis in der Lunge von experimentell infizierten Kälbern mittels in situ-Hybridisierung Mycoplasma (M.) bovis ist neben M. mycoides subsp. mycoides small colony (SC), dem Erreger der kontagiösen bovinen Pleuropneumonie, einer der bedeutendsten Erreger boviner Mykoplasmosen. Erkrankungen treten hauptsächlich in Form von Pneumonien und Arthritiden speziell bei Kälbern und Mastitiden bei Kühen auf und verursachen weltweit erhebliche wirtschaftliche Verluste. Bislang ist kein wirksamer, kommerziell erhältlicher Impfstoff vorhanden, und es treten zunehmend Resistenzen gegenüber Antibiotika auf. Die Kenntnisse über Pathogenese und Persistenz von M. bovis speziell im Respirationstrakt sind zum Teil noch unzureichend. Ziel dieser Arbeit war es, neben der histopathologischen Beschreibung von Lungenveränderungen bei experimentell infizierten Kälbern die Methode der in situHybridisierung für M. bovis an Formalin-fixiertem und Paraffin-eingebettetem Lungengewebe von diesen Kälbern zu etablieren. Dabei sollten die Verteilung und die Lokalisation der DNA analysiert und mit immunhistochemischen Befunden korreliert werden. Frühere Untersuchungen von BUCHENAU (2003) haben gezeigt, dass M. bovis im Respirationstrakt experimentell infizierter Kälber verschiedene variable Oberflächenproteine (engl.: variable surface proteins, Vsps) exprimiert, welche mittels verschiedener monoklonaler Antikörper nachgewiesen werden konnten. Allerdings wurden mit diesen Antikörpern Reaktionsprodukte unter anderem an Alveolen, Bronchiolen und Bronchioli nachgewiesen, wobei es unklar blieb, ob es sich um mögliche Kreuzreaktionen der Antikörper mit wirtseigenen Strukturen handelte. Die Sequenz des Gens, welches für VspA codiert, diente zur Herstellung zweier Digoxigenin markierter DNA-Sonden für die Hybridisierung mit M. bovis-DNA im experimentell infizierten Lungengewebe. 84 Als Zusammenfassung Material standen Formalin-fixierte und Paraffin-eingebettete Lungengewebeproben von fünf nicht infizierten Kontrollkälbern (Gruppe 1) sowie von 30 Kälbern aus verschiedenen Infektionsversuchen (Gruppe 2 bis 4) zur Verfügung. Die Kälber aus Gruppe 2 wurden innerhalb von zwei bis maximal zehn Tagen nach der Infektion getötet. Histopathologisch wiesen diese wie auch die Kontrollkälber nur geringgradige Veränderungen auf. M. bovis-DNA konnte bei keinem dieser Tiere detektiert werden. Die Kälber aus den Gruppen 3 und 4, die 21 Tage nach einer Infektion mit M. bovis getötet wurden, wiesen zum Teil hochgradige histopathologische Veränderungen in Form von Nekrosen, katarrhalisch-eitriger Bronchopneumonie, obliterierender Bronchiolitis und interstitieller Pneumonie auf. Häufig wurden neben M. bovis noch weitere bakterielle Erreger aus dem Lungengewebe isoliert, so dass eine in der Literatur beschriebene Begünstigung von sekundären bakteriellen Infektionen durch M. bovis nachvollzogen werden konnte. Die Veränderungen entsprachen im Wesentlichen den in der Literatur beschriebenen Läsionen. Innerhalb der Nekrosen und im Exsudat der katarrhalisch-eitrigen Bronchopneumonien konnte zum Teil hochgradig M. bovis-DNA mittels der für vorliegende Untersuchung etablierten Methode der in situ-Hybridisierung mit den Sonden VspAI und VspAII nachgewiesen werden. In Alveolen, Interstitien, peribronchiolärem lymphatischen Gewebe und Epithelien konnte keine M. bovis-DNA detektiert werden, wie es von BUCHENAU (2003) mittels spezifisch gegen variable Oberflächenproteine gerichteten Antikörpern beschrieben wurde. Bei einer Untersuchung der Lungenproben mit einem kommerziell erhältlichen, monoklonalen Antikörper (MAB970) konnte in vergleichbaren Arealen wie auch bei der ISH M. bovis-Antigen detektiert werden. Allerdings wurden auch regelmäßig positive Signale im Epithel von Bronchien und Bronchiolen gefunden, die auch bei den M. bovis-negativen Kontrollkälbern auftraten. Hierbei handelte es sich wahrscheinlich um Kreuzreaktionen des Antikörpers mit wirtseigenen Strukturen. Es konnte gezeigt werden, dass M. bovis innerhalb von Nekrosen und im Exsudat katarrhalisch-eitriger Bronchopneumonien im Respirationstrakt experimentell infizierter Kälber persistiert. Dieses lässt die Vermutung zu, dass M. bovis über das Zusammenfassung 85 Exsudat bei katarrhalisch-eitriger Bronchopneumonie mindestens noch 21 Tage ausgeschieden werden kann. Die Faktoren, die eine Persistenz von M. bovis in der Lunge von infizierten Rindern ermöglichen, sind bislang unvollständig geklärt. Mit der in situ-Hybridisierung für M. bovis-DNA wurde ein weiteres Werkzeug etabliert, mit der neben vspA auch weitere Gensequenzen im Lungengewebe des Wirtes untersucht werden können. Künftige Untersuchungen sollten auch die mögliche Beteiligung variabler Oberflächenproteine an der Fähigkeit von M. bovis zur Produktion von Biofilmen berücksichtigen. Summary 87 7 Summary Björn Jacobsen (2006): Detection of Mycoplasma bovis in the lung of experimentally infected calves by in situ-hybridization Mycoplasma (M.) bovis, beside M. mycoides subsp. mycoides small colony (SC), the agent of contagious bovine pleuropneumonia, is one of the most important pathogens of bovine mycoplasmosis. The disease includes pneumonia and arthritis especially in calves, and mastitis in dairy cows resulting in extensive losses for the cattle industry. Commercial vaccines are presently not available and increasing numbers of M. bovis strains are developing resistance to antibiotics. Knowledge of pathogenesis and persistence of M. bovis especially in the respiratory tract is still insufficient. The aim of this study was to describe the histopathological lesions in lungs of experimentally infected calves and to establish the in situ-hybridization (ISH) method for M. bovis in formalin-fixed and paraffin-embedded lung tissues of these calves. A further aim was to analyse the distribution and localisation of M. bovis-DNA and correlate these findings with immunohistochemical results. Earlier investigations of BUCHENAU (2003) revealed expression of several variable surface proteins (Vsp) of M. bovis in the respiratory tract of experimentally infected calves detected by different monoclonal antibodies. With these antibodies, immunohistochemical staining was also found in alveoli, bronchi and bronchioli, raising the question, if this was due to cross reactions of the antibodies with host structures. The sequence of the gene coding for VspA was used to synthesise two digoxigeninlabelled DNA probes for hybridization of M. bovis-DNA in lung tissue. Formalin-fixed and paraffin-embedded lung samples of five non-infected control calves (group 1) as well as 30 calves originating from different infection experiments (group 2 to group 4) were used. Calves from group 2 euthanised two to ten days post infection showed mild histopathological changes like calves of the control group. M. bovis-DNA was not detectable in any of these animals. 88 Histopathology Summary revealed partly severe lesions with necrosis, suppurative bronchopneumonia, obliterative bronchiolitis and interstitial pneumonia in calves of group 3 and 4 euthanised 21 days post infection with M. bovis. The lesions were consistent with those described in literature. Beside M. bovis, other bacterial agents were detected in lung tissues indicating promotion of secondary bacterial infections due to M. bovis as described in literature. Partly, abundant M. bovis-DNA could be found within necrotic areas and in the exudate of suppurative bronchopneumonia by the in situ-hybridization method established for this investigation. M. bovis-DNA was not detectable in the alveoli, interstitial tissue, peribronchiolar lymphatic tissue and epithelium of the air ways as described by BUCHENAU (2003) with specific antibodies directed against variable surface proteins. The investigation of the lung samples with a commercial monoclonal antibody (MAB970), directed against not defined epitops of M. bovis, revealed M. bovisantigen in similar areas as M. bovis-DNA detected by ISH. However, positive reactions were found within the epithelium of bronchi and bronchioli also seen in M. bovis negative control animals. These are possibly cross reactions of the antibody with host structures. It can be postulated, that M. bovis persists in the respiratory tract of experimentally infected calves and is possibly excreted with the exudate in cases of suppurative bronchopneumonia. The factors, which enable M. bovis to persist in the lungs of infected cattle, are poorly understood. With the in situ-hybridization another tool was established to investigate, beside vspA, other gene sequences. Further investigations should also include the possible participation of variable surface proteins in the ability of M. bovis to produce biofilms. Literaturverzeichnis 89 8 Literaturverzeichnis ADEGBOYE, D. S., U. RASBERRY, P. G. HALBUR, J. J. ANDREWS, R. F. ROSENBUSCH (1995a) Monoclonal antibody-based immunohistochemical technique for the detection of Mycoplasma bovis in formalin-fixed, paraffin-embedded calf lung tissues. J. Vet. Diagn. Invest. 7, 261-265 ADEGBOYE, D. S., P. G. HALLBUR, D. L. CAVANAUGH, R. E. WERDIN, C. C. CHASE, D. W. MISKIMINS, R. F. ROSENBUSCH (1995b) Immunohistochemical and pathological study of Mycoplasma bovis-associated lung abscesses in calves. J. Vet. Diagn. Invest. 7, 333-337 ADEGBOYE, D.S., P. G. HALBUR, R. G. NUTSCH, R. G. KADLEC, R. F. ROSENBUSCH (1996) Mycoplasma bovis-associated pneumonia and arthritis complicated with pyogranulomatous tenosynovitis in calves. J. Am. Vet. Med. Assoc. 209, 647-649 ALMEIDA, R. A., M. J. WANNEMUEHLER, R. F. ROSENBUSCH (1992) Interaction of Mycoplasma dispar with bovine alveolar macrophages. Infect. Immun. 60, 2914-2919 ALSTRØM, I. (1955) Filterable pleomorphic organisms resistant to antibiotics and pasteurization isolated from milk. Nord. Hyg. Tidskr. 36, 230-232 ANGEN, O., P. AHRENS, P. KUHNERT, H. CHRISTENSEN, R. MUTTERS (2003) Proposal of Histophilus somni gen. nov., sp. nov for the three species incertae sedis ‘Haemophilus somnus’, ‘Haemophilus agni’ and ‘Histophilus ovis’. Int. J. Syst. Evol. Microbiol. 53, 1449–1456 ASKAA, G. u. H. ERNØ (1976) Elevation of Mycoplasma agalactiae subsp. bovis to species rank: Mycoplasma bovis (Hale et al.) comb. nov.. Int. J. Syst. Bacteriol. 26, 323-325 AYLING, R. D., S. E. BAKER, M. L. PEEK, A. J. SIMON, R. A. NICHOLAS (2000) Comparison of in vitro activity of danofloxacin, florfenicol, oxytetracycline, spectinomycin and tilmicosin against recent field isolates of Mycoplasma bovis. Vet. Rec. 46, 745-747 90 Literaturverzeichnis AYLING, R., R. NICHOLAS, R. HOGG, J. WESSELS, S. SCHOLES, W. BYRNE, M. HILL, J. MORIARTY, T. O'BRIEN (2005) Mycoplasma bovis isolated from brain tissue of calves. Vet. Rec. 156, 391-392 BALL, H. J. u. D. FINLAY (1998) Diagnostic application of monoclonal antibody (MAb)-based sandwich ELISAs. Methods. Mol. Biol. 104, 127-132 BAUMGÄRTNER, B. (1999) Diagnostik und Bekämpfung von Mykoplasmen-Mastitiden des Rindes im westlichen Teil des Landes Brandenburg – ein Rückblick. Prakt. Tierarzt 80, 894-898 BEHRENS, A., F. POUMARAT, D. LE GRAND, M. HELLER, R. ROSENGARTEN (1996) A newly identified immunodominant membrane protein (pMB67) involved in Mycoplasma bovis surface antigenic variation. Microbiology 142, 2463-2470 BEHRENS, A., M. HELLER, H. KIRCHHOFF, D. YOGEV, R. ROSENGARTEN (1994) A family of phase- and size-variant membrane surface lipoprotein antigens (Vsps) of Mycoplasma bovis. Infect. Immun. 62, 5075-5084 BEIER, T., H. HOTZEL, I. LYSNYANSKY, C. GRAJETZKI, M. HELLER, B. RABELING, D. YOGEV, K. SACHSE (1998) Intraspecies polymorphism of vsp genes and expression profiles of variable surface protein antigens (Vsps) in field isolates of Mycoplasma bovis. Vet. Microbiol. 63, 189-203 BENNETT, R. H. u. D. E. JASPER (1977) Immunosuppression of humoral and cell-mediated responses in calves associated with inoculation of Mycoplasma bovis. Am. J. Vet. Res. 38, 1731-1738 BOCKLISCH, H., H. PFÜTZNER, J. MARTIN, G. TEMPLIN, S. KREUSEL (1986) Mycoplasma bovis Aborte bei Kühen nach experimenteller Infektion. Arch. Exp. Veterinärmed. 40, 48-55 BOCKLISCH, H., H. PFÜTZNER, W. ZEPEZAUER, U. KUHN, H. J. LUDWIG (1983) Untersuchung zur Mykoplasmeninfektion des Kalbes. 1. Mitteilung: Mykoplasmennachweise bei Pneumonien und Arthritiden von Kälbern. Arch. Exp. Veterinärmed. 37, 435-443 Literaturverzeichnis 91 BOGOMOLETZ, W. (1980) Advantages of the Sirius red staining method for amyloid and eosinophils. Arch. Anat. Cytol. Pathol. 28, 252-253 BOONE, D. R., R. W. CASTENHOLZ, G. M. GARRITY (2001) The archaea and the deeply branching and phototrophic bacteria. in: Bergey´s manual of systematic bacteriology, Bd. 1 2. Auflg., Springer-Verlag, New York BOYE, M., T. K. JENSEN, P. AHRENS, T. HAGEDORN-OLSEN, N. F. FRIIS (2001) In situ-hybridisation for identification and differentiation of Mycoplasma hyopneumoniae, Mycoplasma hyosynoviae and Mycoplasma hyorhinis in formalin-fixed porcine tissue sections. APMIS 109, 656-664 BRANK, M., D. LE GRAND, F. POUMARAT, P. BEZILLE, R. ROSENGARTEN, C. CITTI (1999) Development of a recombinant antigen for antibody-based diagnosis of Mycoplasma bovis infection in cattle. Clin. Diagn. Lab. Immunol. 6, 861-867 BREDT, W. (1976a) Biologische Besonderheiten der Mykoplasmen in ihrer möglichen Beziehung zur Pathogenität. Zentralbl. Bakteriol. Orig. A. 235, 114-121 BREDT, W. (1976b) Pathogenicity factors of mycoplasmas. Infection 4, Suppl., 9-12 BRICE, N., D. FINLAY, D. G. BRYSON, J. HENDERSON, W. MC CONNELL, H. J. BALL (2000) Isolation of Mycoplasma bovis from cattle in Northern Ireland, 1993 to 1998. Vet. Rec. 146, 643-644 BRYS, A., H. GUNTHER, D. SCHIMMEL (1989) Die experimentelle Mycoplasma bovis Infektion des Respirationstraktes des Kalbes. Arch. Exp. Veterinärmed. 43, 667-676 BRYSON, D. G., J. B. MC FERRAN, H. J. BALL, S. D. NEILL (1978) Observations on outbreaks of respiratory disease in housed calves (2) Pathological and microbiological findings. Vet. Rec. 103, 503-509 92 Literaturverzeichnis BRYSON, D., H. J. BALL, N. BRICE, F. FORSTER, D. S. POLLOCK (1999) Pathology of induced Mycoplasma bovis calf pneumonia in experimentally vaccinated animals. in: STIPKOVITS, L., R. ROSENGARTEN, J. FREY (Hrsg.): Mycoplasmas of Ruminants: Pathogenicity, Diagnostics, Epidemiology and Molecular Genetics Bd. 3, Office for Official Publications of the European Commission, Luxembourg, S. 128-131 BUCHENAU, I. (2003) Immunhistologische Untersuchungen zur Expression variabler Oberflächenantigene von Mycoplasma bovis und zur Immunreaktion in der Lunge von experimentell infizierten Rindern. Hannover, Tierärztliche Hochschule, Diss. BUCHVAROVA, Y. u. A. VESSELINOVA (1989) Über die Ätiopathogenese der Mykoplasmenpneumonie beim Kalb. Arch. Exp. Veterinärmed. 43, 685-689 BÜRGER, H. J. (1992) Nematoden des Atmungsapparates. in : ECKERT, J., E. KUTZER, M. ROMMEL, H. J. BÜRGER, W. KÖRTLING (Hrsg.): Veterinärmedizinische Parasitologie. 4. Auflg., Verlag Paul Parey, Berlin, S. 294 - 304 BURNENS, A. P., P. BONNEMAIN, U. BRUDERER, L. SCHALCH, L. AUDIGE, D. LE GRAND, F. POUMARAT, J. NICOLET (1999) Etude sur la séroprévalence de Mycoplasma bovis chez la vache laitiére en Suisse, en particulier dans la République et Canton du Jura. Schweiz. Arch. Tierheilkd. 141, 455-460 BYRNE, W. J., R. MC CORMACK, N. BRICE, J. EGAN, B. MARKEY, H. J. BALL (2001) Isolation of Mycoplasma bovis from bovine clinical samples in the Republic of Ireland. Vet. Rec. 148, 331-333 CHAE, J. S., M. S. KIM, J. MADIGAN (2002) Detection of Neorickettsia (Ehrlichia) risticii in tissues of mice experimentally infected with cercariae of trematodes by in situ-hybridization. Vet. Microbiol. 88, 233-243 COOPER, A. C., J. R. FULLER, M. K. FULLER, P. WHITTLESTONE, D. R. WISE (1993) In vitro activity of danofloxacin, tylosin and oxytetracycline against mycoplasmas of veterinary importance. Res. Vet. Sci. 54, 329-334 Literaturverzeichnis 93 CORBOZ, L., H. KELLER, A. WALDVOGEL, U. WEIDELI (1980) Über Spontan- und Experimentalfälle von Polyarthritis und Synovitis bei Kälbern, verursacht durch Mykoplasmen. II. Bakteriologische und pathologisch-anatomische Befunde. Schweiz. Arch. Tierheilkd. 122, 479-491 COSTERTON, J. W., P. S. STEWART, E. P. GREENBERG (1999) Bacterial biofilms: a common cause of persistent infections. Science 284, 1318-1322 DOMINGUES, D, F. NOGUEIRA, L. TAVIRA, F. EXPOSTO (2005) Mycoplasmas: What is the role in human infections? Acta. Med. Port. 18, 377-383 DUNGWORTH, D. L. (1993) The Respiratory System in: JUBB, K. V. F., P. C. KENNEDY, N. PALMER (Hrsg): Pathology of Domestic Animals, Bd. 2. 4. Auflg. Academic press inc., San Diego, S. 539-700 DYBVIG, K., u. L. L. VOELKER (1996) Molecular biology of mycoplasmas. Annu. Rev. Microbiol. 50, 25-57 EAGLESOME, M. D., u. M. M. GARCIA (1990) The effect of Mycoplasma bovis on fertilization processes in vitro with bull spermatozoa and zona-free hamster oocytes. Vet. Microbiol. 21, 329-37 ERNØ, H. u. P. PERREAU (1985) Mycoplasmal infections in cattle. in: I. GYLSTORFF (Hrsg): Infektionen durch Mycoplasmatales. Gustav Fischer Verlag, Jena, S. 300-345 FREY, J., S. SUBRAMANIAM, D. BORGONIER, J. NICOLET (1999) DNA repair genes uvrC as genetic targets for discrimination of closely related mycoplasmas. in: STIPKOVITS, L., R. ROSENGARTEN, J. FREY (Hrsg.): Mycoplasmas of Ruminants: Pathogenicity, Diagnostics, Epidemiology and Molecular Genetics Bd. 3, Office for Official Publications of the European Commission, Luxembourg, S. 40-43 FRIEND, S. C., R. G. THOMSON, B. N. WILKIE (1977) Pulmonary lesions induced by Pasteurella hemolytica in cattle. Can. J. Comp. Med. 41, 219-223 94 Literaturverzeichnis GABRIDGE, M. G., D. K. F. CHANDLER u. M. J. DANIELS (1985) Pathogenicity factors in Mycoplasmas and Spiroplasmas in: S. RAZIN, M. F. BARILE, J. G. TULLY, R. F. WHITCOMB (Hrsg): The Mycoplasmas. Bd. IV. Academic Press, New York/ London, S. 313-351 GAGEA, M. I., K. G. BATEMAN, R. A. SHANAHAN, T. VAN DREUMEL, B. J. MC EWEN, S. CARMAN, M. ARCHAMBAULT, J. L. CASWELL (2006) Naturally occurring Mycoplasma bovis-associated pneumonia and polyarthritis in feedlot beef calves. J. Vet. Diagn. Invest. 18, 29-40 GEARY, S. J., M. E. TOURTELLOTTE, J. A. CAMERON (1981) Inflammatory toxin from Mycoplasma bovis: isolation and characterization. Science 212, 1032-1033 GEVAERT, D. (2006) The importance of Mycoplasma bovis in bovine respiratory disease. Tijdschr. Diergeneeskd. 131, 124-126 GHADERSOHI, A., R. G. HIRST, J. FORBES-FAULKENER, R. J. COELEN (1999) Preliminary studies on the prevalence of Mycoplasma bovis mastitis in dairy in cattle in Australia. Vet. Microbiol. 65, 185-194 GHADERSOHI, A., R. J. COELEN, R. G. HIRST (1997) Development of a specific DNA probe and PCR for the detection of Mycoplasma bovis. Vet. Microbiol. 56, 87-98 GHADERSOHI, A., Z. FAYAZI, R. G. HIRST (2005) Development of a monoclonal blocking ELISA for the detection of antibody to Mycoplasma bovis in dairy cattle and comparison to detection by PCR. Vet. Immunol. Immunopathol. 104, 183-193 GONZALEZ, R. N., u. D. J. WILSON (2003) Mycoplasmal mastitis in dairy herds. Vet. Clin. North. Am. Food. Anim. Pract. 19, 199-221 GOURLAY, R. N., L. H. THOMAS, C. J. HOWARD (1976) Pneumonia and arthritis in gnotobiotic calves following inoculation with Mycoplasma agalactiae subsp. bovis. Vet. Rec. 98, 506-507 GOURLAY, R. N., C. J. HOWARD (1982) Respiratory mycoplasmosis. Adv. Vet. Sci. Comp. Med. 26, 289-332 Literaturverzeichnis 95 GOURLAY, R. N., L. H. THOMAS, S. G. WYLD (1989) Increased severity of calf pneumonia associated with the appearance of Mycoplasma bovis in a rearing herd. Vet. Rec. 124, 420-422 GRUNERT, E., D. BÖLTING, N. STOCKHOFE, M. PICKEL (1992) Zur Symptomatik der Mycoplasma bovis Infektion bei neugeborenen Kälbern. Tierärztliche Umschau 47, 99-104 HALE, H. H., C. F. HELMBOLDT, W. N. PLASTRIDGE, E. F. STULA (1962) Bovine mastitis caused by a Mycoplasma species. Cornell. Vet. 52, 582-591 HANAZAWA, R., S. Y. MURAYAMA, H. YAMAGUCHI (2000) In-situ detection of Aspergillus fumigatus. J. Med. Microbiol. 49, 285-90 HARTMANN, H. A., M. E. TOURTELOTTE, S. W. NIELSEN, W. N. PLASTRIDGE (1964) Experimental bovine uterine mycoplasmosis. Res. Vet. Sci. 5, 303-310 HAYFLICK, L. (1969) Fundamental biology of class Mollicutes, order Mycoplasmatales. in: HAYFLICK, L. (Hrsg): The Mycoplasmatales and the L-phase of bacteria. Appleton-Century-Crofts Meredith Corporation, New York, S. 15-47 HAZIROGLU, R., J. ERDEGER, M. Y. GULBAHAR, O. KUL (1997) Association of Pasteurella haemolytica, Pasteurella multocida and Haemophilus somnus with pneumonia in calves. Dtsch. Tierärztl. Wochenschr. 104, 150-153 HELLER, M., E. BERTHOLD, H. PFÜTZNER, R. LEIRER, K. SACHSE (1993) Antigen capture ELISA using monoclonal antibodies for the detection of Mycoplasma bovis in milk. Vet. Microbiol. 37, 127-133 HERRINGTON, C. S., J. BURNS, A. K. GRAHAM, M. EVANS, J. O. MC GEE (1989) Interphase cytogenetics using biotin and digoxigenin-labelled probes I: relative sensitivity of both reporter molecules for detection of HPV16 in CaSki cells. J. Clin. Pathol. 42, 592-600 HEWICKER-TRAUTWEIN, M., M. FELDMANN, W. KEHLER, R. SCHMIDT, S. THIEDE, F. SEELIGER, P. WOHLSEIN, H. J. BALL, I. BUCHENAU, J. SPERGSER, R. ROSENGARTEN (2002) Outbreak of pneumonia and arthritis in beef calves associated with Mycoplasma bovis and Mycoplasma californicum. Vet. Rec. 151, 699-703 96 Literaturverzeichnis HEWICKER-TRAUTWEIN, M., M. PETERS, A. GRUBER, B. BAUM, I. LEVERKOEHNE, I. BUCHENAU, S. KLEINSCHMIDT (2003) Bronchopneumonie und Polyarthritis mit Nachweis von Mycoplasma bovis bei einem Rind. Dtsch. Tierärztl. Wochenschr. 110, 147-50 HOTZEL, H., M. HELLER, K. SACHSE (1999) Enhancement of Mycoplasma bovis detection in milk samples by antigen capture prior to PCR. Mol. Cell. Probes. 13, 75-78 HOUGHTON, S. B., u. R. N. GOURLAY (1983) Synergism between Mycoplasma bovis and Pasteurella haemolytica in calf pneumonia. Vet. Rec. 113, 41-42 HOWARD, C. J., K. R. PARSONS, L. H. THOMAS (1986) Systemic and local immune responses of gnotobiotic calves to respiratory infection with Mycoplasma bovis. Vet. Immunol. Immunopathol. 11, 291-300 HOWARD, C. J., L. H. THOMAS, K. R. PARSONS (1987a) Immune response of cattle to respiratory mycoplasmas. Vet. Immunol. Immunopathol. 17, 401-412 HOWARD, C. J., L. H. THOMAS, K. R. PARSONS (1987b) Comparative pathogenicity of Mycoplasma bovis and Mycoplasma dispar for the respiratory tract of calves. Isr. J. Med. Sci. 23, 621-624 HOWARD, C. J., G. TAYLOR, J. COLLINS, R. N. GOURLAY (1976) Interaction of Mycoplasma dispar and Mycoplasma agalactiae subsp. bovis with bovine alveolar macrophages and bovine lacteal polymorphonuclear leukocytes. Infect. Immun. 14, 11-17 JOHN, H. A., M. L. BIRNSTIEL, K. W. JONES (1969) RNA-DNA hybrids at the cytological level. Nature 223, 582-587 KHODAKARAM-TAFTI, A., u. A. LOPEZ (2004) Immunohistopathological findings in the lungs of calves naturally infected with Mycoplasma bovis. J. Vet. Med. A. 51, 10-14 Literaturverzeichnis 97 KIM, J., u. C. CHAE (2001) Differentiation of porcine circovirus 1 and 2 in formalin-fixed, paraffin-waxembedded tissues from pigs with postweaning multisystemic wasting syndrome by in situ-hybridisation. Res. Vet. Sci. 70, 265-269 KINDE, H., B. M. DAFT, R. L. WALKER, B. R. CHARLTON, R. PETTY (1993) Mycoplasma bovis associated with decubital abscesses in Holstein calves. J. Vet. Diagn. Invest. 5, 194-197 KIRBY, F. D., u. R. A.NICHOLAS (1996) Isolation of Mycoplasma bovis from bullocks' eyes. Vet. Rec. 138, 552 KIRCHHOFF, H. (1982) Die Bedeutung der Mykoplasmen in den Genitalorganen von Rind, Pferd und Schwein. Berl. Münch. Tierärztl. Wochenschr. 95, 121-125 KIRCHHOFF, H., u. A. BINDER (1986) Untersuchungen zur Verbreitung von Mycoplasma bovis und anderen Mykoplasmen-Spezies bei Rindern des norddeutschen Raumes. Zentralbl. Veterinärmed. B 33, 68-72 KIRCHHOFF, H., u. M. RUNGE (1998) 100 Jahre Mykoplasmen – Pathogenität für Nutz- und Haustiere. Berl. Münch. Tierärztl. Wochenschr. 111, 387-392 KRÜGER, L. (2005) Retrospektive Untersuchung auf das Vorliegen von porzinen Circovirus 2Infektionen im Sektionsmaterial des Instituts für Pathologie der Tierärztlichen Hochschule Hannover mittels der in situ-Hybridisierung. Hannover, Tierärztliche Hochschule, Diss. KUSILUKA, L. J., B. OJENIYI, N. F. FRIIS (2000) Increasing prevalence of Mycoplasma bovis in Danish cattle. Acta. Vet. Scand. 41, 139-146 KWON, D., C. CHOI, C. CHAE (2002) Chronologic localization of Mycoplasma hyopneumoniae in experimentally infected pigs. Vet. Pathol. 39, 584-587 KWON, D., u. C. CHAE (1999) Detection and localization of Mycoplasma hyopneumoniae DNA in lungs from naturally infected pigs by in situ-hybridization using a digoxigenin-labeled probe. Vet. Pathol. 36, 308-313 98 Literaturverzeichnis LANE, D. J. (1991) 16S/23S rRNA sequencing. in: STACKEBRAND, E u. M. GOODFELLOW: Nucleic Acid Techniques in Bacterial Systematics. Wiley & Sons LE GRAND, D., M. SOLSONA, R. ROSENGARTEN, F. POUMARAT (1996) Adaptive surface antigen variation in Mycoplasma bovis to the host immune response. FEMS Microbiol. Lett. 144, 267-275 LE GRAND, D., S. PHILLIPPE, D. CALAVALAS, P. BEZILLE, F. POUMARAT (2001) Prevalence of Mycoplasma bovis infection in France. in: POVEDA, J. B., A. FERNÁNDEZ, J. FREY, K. E. JOHNANSSON (Hrsg): Mycoplasmas of ruminants: Pathogenicity, diagnostics, epidemiology and molecular genetics. Bd. 5, Office for Official Publications of the European Commission, Luxembourg, S. 106-109 LEITCH, A. R., T. SCHWARZACHER, D. JACKSON, I. J. LEITCH (1994) In situ-Hybridisierung. Spektrum Akademischer Verlag, Heidelberg LINKNER, H., F. POUMARAT, D. LE GRAND, P. BELLI, C. CITTI, R. ROSENGARTEN, M. HEWICKER-TRAUTWEIN (2000) Pathology and immunhistochemical findings in calf lungs after experimental infection with a clonal variant derived from Mycoplasma bovis strain PG45. in: BERGONIER, D., X. BERTHELOT, J. FREY (Hrsg): Mycoplasmas of ruminants: Pathogenicity, diagnostics, epidemiology and molecular genetics. Bd. 4, Office for Official Publications of the European Commission, Luxembourg, S. 67-70 LO, S. C., M. M. HAYES, J. G. TULLY, R. Y. WANG, H. KOTANI, P. F. PIERCE, D. L. ROSE, J. W. SHIH (1992) Mycoplasma penetrans sp. nov., from the urogenital tract of patients with AIDS. Int. J. Syst. Bacteriol. 42, 357-64 LYSNYANSKY, I., R. ROSENGARTEN, D. YOGEV (1996) Phenotypic switching of variable surface lipoproteins in Mycoplasma bovis involves high-frequency chromosomal rearrangements. J. Bacteriol. 178, 5395-5401 LYSNYANSKY, I., Y. RON, D. YOGEV (2001a) Juxtaposition of an active promoter to vsp genes via site-specific DNA inversions generates antigenic variation in Mycoplasma bovis. J. Bacteriol. 183, 5698-5708 Literaturverzeichnis 99 LYSNYANSKY, I., Y. RON, K. SACHSE, D. YOGEV (2001b) Intrachromosomal recombination within the vsp locus of Mycoplasma bovis generates a chimeric variable surface lipoprotein antigen. Infect. Immun. 69, 3703-3712 MAEDA, T., T. SHIBAHARA, K. KIMURA, Y. WADA, K. SATO, Y. IMADA, Y. ISHIKAWA, K. KADOTA (2003) Mycoplasma bovis-associated suppurative otitis media and pneumonia in bull calves. J. Comp. Pathol. 129, 100-110 MAES, D., M. VERDOCK, H. DELUYKER, A. DE KRUIF (1996) Enzootic pneumonia in pigs. Vet. Q. 18, 104-109 MARTIN, J., H. BOCKLISCH, H- PFUTZNER, V. ZEPEZAUER (1983) Untersuchungen zur Mykoplasmeninfektion des Kalbes. 3. Mitteilung: Histologisches Bild der durch Mycoplasma bovis bedingten Pneumonien. Arch. Exp. Veterinärmed. 37, 499-507 MASOVER, G. K. u. J. HAYFLICK (1985) Fundamental biology of the class Mollicutes. in: I. GYLSTORFF (Hrsg.): Infektionen durch Mycoplasmatales. Gustav Fischer Verlag, Jena, S. 15-29 MC AULIFFE, L., R. J. ELLIS, K. MILES, R. D. AYLING, R. A. NICHOLAS (2006) Biofilm formation by mycoplasma species and its role in environmental persistence and survival. Microbiology 152, 913-22 MC CULLY, M. A., K. V. BROCK (1992) Development of a DNA hybridization probe for detection of Mycoplasma bovis. J. Vet. Diagn. Invest. 4, 464-467 MELCHIOR, M. B., H. VAARKAMP, J. FINK-GREMMELS (2006) Biofilms: a role in recurrent mastitis infections? Vet. J. 171, 398-407 MESSIER, S., R. F. ROSS (1991) Interactions of Mycoplasma hyopneumoniae membranes with porcine lymphocytes. Am. J. Vet. Res. 52, 1497-1502 MESSOW, C u. W. HERMANNS (1990) Entzündung. in: Schulz, L.-C. (Hrsg.): Lehrbuch der Allgemeinen Pathologie für Tierärzte und Studierende der Tiermedizin. 10. Auflg., Ferdinand Enke Verlag, Stuttgart, S. 275-311 100 Literaturverzeichnis NEIMARK, H., K. E. JOHANSSON, Y. RIKIHISA, J. G. TULLY (2001) Proposal to transfer some members of the genera Haemobartonella and Eperythrozoon to the genus Mycoplasma with descriptions of 'Candidatus Mycoplasma haemofelis', 'Candidatus Mycoplasma haemomuris', 'Candidatus Mycoplasma haemosuis' and 'Candidatus Mycoplasma wenyonii'. Int. J. Syst. Evol. Microbiol. 51, 891-899 NICHOLAS, R. A., R. D. AYLING (2003) Mycoplasma bovis: disease, diagnosis, and control. Res. Vet. Sci. 74, 105-112 NICHOLAS, R. A., R. D. AYLING, L. P. STIPKOVITS (2002) An experimental vaccine for calf pneumonia caused by Mycoplasma bovis: clinical, cultural, serological and pathological findings. Vaccine 20, 3569-3575 NICHOLAS, R. A., S. BAKER, R. D. AYLING, L. STIPKOVITS (2000) Mycoplasma infections in growing cattle. Cattle Practice 8, 115-118 NICKEL, R., A. SCHUMMER, E. SEIFERLE (1999) Lehrbuch der Anatomie der Haustiere. Band II: Eingeweide. Hrsg.: J. FREWEIN, H. GASSE, R. LEISER, H. ROOS, H. THOMÉ, B. VOLLMERHAUS, H. WAIBL 8. Auflg., Verlag Parey, Berlin, S. 269 NICOLET J. (1994) Mycoplasma bovis. Ausbreitung eines neuen pathogenen Erregers beim Rindvieh in der Schweiz? Schweiz. Arch. Tierheilkd. 136, 81-82 NOCARD, E. u. E. R. ROUX (1896) The microbe of pleuropneumonia. Ann. Inst. Pasteur. 12, 240-262 PARDUE, M. L., J. G. GALL (1969) Molecular hybridization of radioactive DNA to the DNA of cytological preparations. Proc. Natl. Acad. Sci. USA. 64, 600-604 PFÜTZNER, H. (1990) Epizootiology of the Mycoplasma bovis-infection of cattle. in: G. STANEK, . H. CASSELL, J. G. TULLY, R. F. WHITCOMB (Hrsg.): Recent advances in mycoplasmology. Zentralbl. Bakteriol., Suppl. 20, 394-399 Literaturverzeichnis 101 PFÜTZNER, H. u. K. SACHSE (1996) Mycoplasma bovis as an agent of mastitis, pneumonia, arthritis and genital disorders in cattle. Rev. Sci. Tech. 15, 1477-1494 PFÜTZNER, H., P. KIELSTEIN, J. MARTIN, D. SCHIMMEL (1983) Untersuchungen zur Mykoplasmeninfektione des Kalbes. 2. Mitteilung: Experimentelle Infektion des Kalbes mit Mycoplasma bovis. Arch. Exp. Veterinärmed. 37, 445-451 PHILIPPOU, S., P. OTTO, P. REINHOLD, M. ELSCHNER, H. J. STRECKERT (2000) Respiratory syncytial virus-induced chronic bronchiolitis in experimentally infected calves. Virchows Arch. 436, 617-621 PIRIE, H. M., L. PETRIE, C. G. PRINGLE, E. M. ALLEN, G. J. KENNEDY (1981) Acute fatal pneumonia in calves due to respiratory syncytial virus. Vet. Rec. 108, 411-416 PITCHER, D. G. u. R. A. NICHOLAS (2005) Mycoplasma host specificity: fact or fiction? Vet. J. 170, 300-306 POUMARAT, F., D. LE GRAND, S. PHILIPPE, D. CALAVAS, F. SCHELCHER, P. CABANIE, P. TESSIER, H. NAVETAT (2001) Efficacy of spectinomycin against Mycoplasma bovis induced pneumonia in conventionally reared calves. Vet. Microbiol. 80, 23-35 PRINGLE, J. K., L. VIEL, P. E. SHEWEN, R. A. WILLOUGHBY, S. W. MARTIN, V. E. VALLI (1988) Bronchoalveolar lavage of cranial and caudal lung regions in selected normal calves: cellular, microbiological, immunoglobulin, serological and histological variables. Can. J. Vet. Res. 52, 239-248 RAZIN, S. (1978) The mycoplasmas. Microbiol. Rev. 42, 414-470 RAZIN, S. (1981) Mycoplasmas: the smallest pathogenic procaryotes. Isr. J. Med. Sci. 17, 510-515 RAZIN, S. (1992) Peculiar properties of mycoplasmas: the smallest self-replicating prokaryotes. FEMS Microbiol. Lett. 79, 423-431 102 Literaturverzeichnis RAZIN, S., E. JACOBS (1992) Mycoplasma adhesion. J. Gen. Microbiol. 138, 407-422 REEVE-JOHNSON, L. (1999) The impact of Mycoplasma infections in respiratory diseases of cattle in Europe. in: STIPKOVITS, L., R. ROSENGARTEN, J. FREY (Hrsg.): Mycoplasmas of Ruminants: Pathogenicity, Diagnostics, Epidemiology and Molecular Genetics. Bd. 3, Office for Official Publications of the European Commission, Luxembourg, S. 18-31 REILLY, G. A., H. J. BALL, J. P. CASSIDY, T. D. BRYSON (1993) First reported isolation of Mycoplasma bovis from pneumonic calves in Northern Ireland. Vet. Rec. 133, 550-551 RODRÍGUEZ, F., D. G. BRYSON, H. J. BALL, F. FORSTER (1996a) Pathological and immunohistochemical studies of natural and experimental Mycoplasma bovis pneumonia in calves. J. Comp. Pathol. 115, 151-162 RODRÍGUEZ, F., S. KENNEDY, T. D. BRYSON, A. FERNÁNDEZ, J. L. RODRÍGUEZ, H. J. BALL (1996b) An immunohistochemical method of detecting Mycoplasma species antigens by use of monoclonal antibodies on paraffin sections of pneumonic bovine and caprine lungs. Zentralbl. Veterinärmed. B 43, 429-438 RODRÍGUEZ, F., J. SARRADELL, J. B. POVEDA, H. J. BALL, A. FERNANDEZ (2000) Immunohistochemical characterization of lung lesions induced experimentally by Mycoplasma agalactiae and Mycoplasma bovis in goats. J. Comp. Pathol. 123, 285-293 ROMVÁRY, J., J. ROZSA, L. STIPKOVITS, J. MESZAROS (1979) Incidence of diseases due to Mycoplasma bovis in a cattle herd. I. Pneumoarthritis syndrome in calves. Acta. Vet. Acad. Sci. Hung. 27, 29-37 ROSENGARTEN, R. u. K. S. WISE (1991) The Vlp system of Mycoplasma hyorhinis: combinatorial expression of distinct size variant lipoproteins generating high-frequency surface antigenic variation. J. Bacteriol. 173, 4782-4793 Literaturverzeichnis 103 ROSENGARTEN, R., A. BEHRENS, A. STETEFELD, M. HELLER, M. AHRENS, K. SACHSE, D. YOGEV, H. KIRCHHOFF (1994) Antigen heterogeneity among isolates of Mycoplasma bovis is generated by high-frequency variation of diverse membrane surface proteins. Infect. Immun. 62, 5066-5074 ROSENGARTEN, R., C. CITTI, M. GLEW, A. LISCHEWSKI, M. DROESSE, P. MUCH, F. WINNER, M. BRANK, J. SPERGSER (2000) Host-pathogen interactions in mycoplasma pathogenesis: virulence and survival strategies of minimalist prokaryotes. Int. J. Med. Microbiol. 290, 15-25 SACHSE, K., C. GRAJETZKI, R. ROSENGARTEN, I. HANEL, M. HELLER, H. PFÜTZNER (1996) Mechanisms and factors involved in Mycoplasma bovis adhesion to host cells. Zentralbl. Bakteriol. 284, 80-92 SACHSE, K., J. H. HELBIG, I. LYSNYANSKY, C. GRAJETZKI, W. MULLER, E. JACOBS, D. YOGEV (2000) Epitope mapping of immunogenic and adhesive structures in repetitive domains of Mycoplasma bovis variable surface lipoproteins. Infect. Immun. 68, 680-687 SHAHRIAR, F. M., E. G. CLARK, E. JANZEN, K. WEST, G. WOBESER (2002) Coinfection with bovine viral diarrhea virus and Mycoplasma bovis in feedlot cattle with chronic pneumonia. Can. Vet. J. 43, 863-868 SPERGSER, J., R. SCHMIDT, M. FELDMANN, W. KEHLER, M. WUKOVITS, M, HEWICKER-TRAUTWEIN, R. ROSENGARTEN (2001) Detection of Mycoplasma californicum in outbreaks of calf pneumonia and arthritis in northern Germany. in: POVEDA, J. B. (Hrsg.): Mycoplasmas of Ruminants: Pathogenicity, Diagnostics, Epidemiology and Molecular Genetics. Bd. 5, Office for Official Publications of the European Commission, Luxembourg, S. 98-101 STIPKOVITS, L., M. RADY, R. GLAVITS (1993) Mycoplasmal arthritis and meningitis in calves. Acta. Vet. Hung. 41, 73-88 STIPKOVITS, L., R. GLAVITS, P. RIPLEY, T. MOLNAR, M. TENK, L. SZEREDI (2000a) Pathology and Immunhistochemical studies of pneumonia in calves experimentally induced by Mycoplasma bovis. in: BERGONIER, D., X. BERTHELOT, J. FREY (Hrsg.): Mycoplasmas of Ruminants: Pathogenicity, Diagnostics, Epidemiology and Molecular Genetics. Bd. 4, Office for Official Publications of the European Commission, Luxembourg, S. 27-30 104 Literaturverzeichnis STIPKOVITS, L., P. RIPLEY, J. VARGA, V. PALFI (2000b) Clinical study of the disease of calves associated with Mycoplasma bovis infection. Acta. Vet. Hung. 48, 387-395 STUART, P., I. DAVIDSON, G. SLAVIN, F. A. EDGSON, D. HOWELL (1963) Bovine Mastitis caused by Mycoplasma. Vet. Rec. 75, 59-64 TANGEN, G.u. H. KIRCHHOFF (1995) Investigation into the origin of the antigens of Mycoplasma arthritidis crossreacting with host tissue antigens. FEMS Immunol. Med. Microbiol. 12, 9-15 TER LAAK, E. A., G. H. WENTINK, G. M. ZIMMER (1992) Increased prevalence of Mycoplasma bovis in the Netherlands. Vet. Q. 14, 100-104 THOMAS, A., C. NICOLAS, I. DIZIER, J. MAINIL, A. LINDEN (2003) Antibiotic susceptibilities of recent isolates of Mycoplasma bovis in Belgium. Vet. Rec. 153, 428-431 THOMAS, A., H. J. BALL, I. DIZIER, A. TROLIN, C. BELL, J. MAINIL, A. LINDEN (2002) Isolation of mycoplasma species from the lower respiratory tract of healthy cattle and cattle with respiratory disease in Belgium. Vet. Rec. 151, 472-476 THOMAS, C. B., P. VAN ESS, L. J. WOLFGRAM, J. RIEBE, P. SHARP, R. D. SCHULTZ (1991) Adherence to bovine neutrophils and suppression of neutrophil chemiluminescence by Mycoplasma bovis. Vet. Immunol. Immunopathol. 27, 365-381 THOMAS, L. H., C. J. HOWARD, E. J. STOTT, K. R. PARSONS (1986) Mycoplasma bovis infection in gnotobiotic calves and combined infection with respiratory syncytial virus. Vet. Pathol. 23, 571-578 THOMAS, L. H., C. J. HOWARD, K. R. PARSONS, H. S. ANGER (1987) Growth of Mycoplasma bovis in organ cultures of bovine foetal trachea and comparison with Mycoplasma dispar. Vet. Microbiol. 13, 189-200 THOMAS, L. H., C. J. HOWARD, R. N. GOURLAY (1975) Isolation of Mycoplasma agalactiae var bovis from a calf pneumonia outbreak in the south of England. Vet. Rec. 97, 55-56 Literaturverzeichnis 105 THOMASMEYER, A. (2006) Histologische und immunhistologische Untersuchung zur Entwicklung des Schleimhaut assoziierten Immunsystems im bovinem Respirationstrakt und zum Vorkommen von dendritischen Zellen im Respirationstrakt von Kälbern mit respiratorischer Mycoplasma bovis Infektion. Hannover, Tierärztliche Hochschule, Diss. (eingereicht) TULLY, J. G., J. M. BOVÉ, F. LAIGRET, R. F. WHITCOMB (1993) Revised taxonomy of the class Mollicutes: proposed elevation of a monophyletic cluster of arthropod-associated Mollicutes to ordinal rank (Entomoplasmatales ord. nov.), with provision for familial rank to separate species with nonhelical morphology (Entomoplasmaceae fam. nov.) from helical species (Spiroplasmaceae), and emended descriptions of the order Mycoplasmatales, family Mycoplasmataceae. Int. J. Syst. Bacteriol. 43, 378-85 UHAA, I. J., H. P. RIEMANN, M. C. THURMOND, C. E. FRANTI (1990a) A cross-sectional study of bluetongue virus and Mycoplasma bovis infections in dairy cattle: I. The association between a positive antibody response and production efficiency. Vet. Res. Commun. 14, 461-470 UHAA, I. J., H. P. RIEMANN, M. C. THURMOND, C. E. FRANTI (1990b) A cross-sectional study of bluetongue virus and Mycoplasma bovis infections in dairy cattle: II. The association between a positive antibody response and reproduction performance. Vet. Res. Commun. 14, 471-480 VANDEN BUSH, T. J. u. R. F. ROSENBUSCH (2004) Characterization of lympho-inhibitory peptide produced by Mycoplasma bovis. Biochem. Biophys. Res. Com. 315, 336-341 VANDEN BUSH, T. J. u. R. F. ROSENBUSCH (2003) Characterization of the immune response to Mycoplasma bovis lung infection. Vet. Immunol. Immunopathol. 94, 23-33 VISSER, I. J., E. A. TER LAAK, H. B. JANSEN (1999) Failure of antibiotics gentamycin, tylosin, lincomycin and spectinomycin to eliminate Mycoplasma bovis in artificially infected frozen bovine semen. Theriogenology 51, 689-697 VOGEL, G., J. NICOLET, J. MARTIG, P. TSCHUDI, M. MEYLAN (2001) Kälberpneumonie: Aktualisierung des bakteriellen Erregerspektrums und der Resistenzlage gegenüber antimikrobiellen Wirkstoffen Schweiz. Arch. Tierheilkd. 143, 341-350 106 Literaturverzeichnis WALZ, P. H., T. P. MULLANEY, J. A. RENDER, R. D. WALKER, T. MOSSER, J. C. BAKER (1997) Otitis media in preweaned Holstein dairy calves in Michigan due to Mycoplasma bovis. J. Vet. Diagn. Invest. 9, 250-254 WEHNERT, C., G. TEICHMANN, H. HAUKE, D. SCHIMMEL, C. LEUTZSCH (1977) Bericht über den Verlauf einer Mykoplasmeninfektion des Euters. Monatsh. Veterinärmed. 32, 55-59 WILKINSON, D. G. (1999) In situ-hybridization – A pratical approach. 2. Auflg., Oxford University Press, Oxford, S. 1-21 WOESE, C. R. (1987) Bacterial evolution. Microbiol. Rev. 51, 221-71 Anhang 107 9 Anhang 9.1 Ergebnisse der Gruppen 1 bis 4 in tabellarischer Form Tabelle 6: Ergebnisse der Kälber aus Gruppe 1 (Kontrollgruppe) Katarrhalisch-eitrige Bronchopneumonie Nekrosen Lfd. Nr. E-Nr. ISH IHC Anzahl positiv positiv ISH IHC positiv positiv Obliterierende Bronchiolitis ISH IHC positiv positiv n n 1 2934/00 18 0 0 0 0 0 0 0 0 0 0 2 2935/00 18 0 0 0 0 0 0 0 0 0 0 3 1504/99 12 0 0 0 0 1 0 0 0 0 0 4 1505/99 12 1 1 0 1 8 0 0 1 0 0 5 1650/99 12 0 0 0 0 4 0 0 0 0 0 n n Lfd. Nr.: laufende Nummer; E-Nr.: Einsendungsnummer; n: Anzahl der Blöcke, ISH: in situ-Hybridisierung; IHC: Immunhistochemie mit MAB970 Tabelle 7: Ergebnisse der Kälber aus Gruppe 2 Katarrhalisch-eitrige Bronchopneumonie Nekrosen Obliterierende Bronchiolitis Lfd. Nr. E-Nr. n n 6 2 12 0 0 0 0 4 0 0 0 0 0 7 5 10 5 9 0 0 6 0 0 0 0 0 8 7 12 0 0 0 0 0 0 0 0 0 0 9 8 12 0 0 0 0 0 0 0 0 0 0 10 9 12 0 0 0 0 0 0 0 0 0 0 11 10 12 0 0 0 0 6 0 0 0 0 0 12 12 12 0 0 0 0 1 0 0 0 0 0 13 13 12 0 0 0 0 9 0 0 0 0 0 ISH IHC Anzahl positiv positiv n ISH IHC positiv positiv n ISH IHC positiv positiv Lfd. Nr.: laufende Nummer; E-Nr.: Einsendungsnummer; n: Anzahl der Blöcke, ISH: in situ-Hybridisierung; IHC: Immunhistochemie mit MAB970 108 Anhang Tabelle 8: Ergebnisse der Kälber aus Gruppe 3 Katarrhalisch-eitrige Bronchopneumonie Nekrosen Lfd. Nr. E-Nr. ISH IHC Anzahl positiv positiv ISH IHC positiv positiv Obliterierende Bronchiolitis ISH IHC positiv positiv n n 14 2936/00 18 10 84 84 60 14 8 5 13 2 9 15 2937/00 18 0 0 0 0 2 2 1 0 0 0 16 2938/00 18 0 0 0 0 1 0 0 0 0 0 17 2939/00 18 0 0 0 0 17 3 5 3 0 1 18 1506/99 12 0 0 0 0 3 0 0 0 0 0 19 1507/99 12 4 16 9 6 8 2 6 4 0 0 20 1508/99 12 0 0 0 0 4 0 0 0 0 0 21 1509/99 12 0 0 0 0 3 0 0 1 0 0 22 1510/99 12 0 0 0 0 7 2 2 2 0 0 23 1511/99 12 1 2 0 2 7 0 0 0 0 0 24 1512/99 12 7 33 31 29 11 6 7 8 0 0 25 1513/99 12 0 0 0 0 3 0 0 0 0 0 n n Lfd. Nr.: laufende Nummer; E-Nr.: Einsendungsnummer; n: Anzahl der Blöcke, ISH: in situ-Hybridisierung; IHC: Immunhistochemie mit MAB970 Anhang Tabelle 9: 109 Ergebnisse der Kälber aus Gruppe 4 Katarrhalisch-eitrige Bronchopneumonie Nekrosen Lfd. Nr. E-Nr. ISH IHC Anzahl positiv positiv ISH IHC positiv positiv Obliterierende Bronchiolitis ISH IHC positiv positiv n n 26 2940/00 18 0 0 0 0 13 3 1 1 0 0 27 2941/00 18 3 9 9 9 17 13 4 8 1 2 28 2942/00 18 0 0 0 0 15 5 2 0 0 0 29 2943/00 18 0 0 0 0 15 2 0 0 0 0 30 2944/00 18 1 5 5 2 10 2 1 1 0 0 31 2945/00 18 1 3 3 3 5 2 2 2 0 0 32 2946/00 18 4 10 10 8 13 2 3 3 0 0 33 2947/00 18 2 3 3 3 13 2 2 2 0 0 34 2948/00 18 1 1 1 1 10 3 3 1 0 0 35 2949/00 18 0 0 0 0 17 9 8 0 0 0 n n Lfd. Nr.: laufende Nummer; E-Nr.: Einsendungsnummer; n: Anzahl der Blöcke, ISH: in situ-Hybridisierung; IHC: Immunhistochemie mit MAB970 9.2 Lösungen für die Azanfärbung nach Heidenhain Azokarminlösung: 0,1 g Azokarmin G in 100 ml Aqua dest. kurz aufkochen abkühlen lassen 1 ml Eisessig dazugeben Anilinblau-Orange-Essigsäure-Stammlösung: 0,5 g wasserlösliches Anilinblau 2 g Orange G 100 ml Aqua dest. zusammengeben und erkalten lassen 8 ml Eisessig dazugeben und filtrieren Anilinblau-Orange-Essigsäure-Gebrauchslösung: Stammlösung mit der doppelten Menge Aqua dest. verdünnen Alkoholische Anilinlösung (Vorratslösung): 1 ml Anilinöl ad 1000 ml 96%iger Alkohol 110 Anhang Essigsaurer Alkohol (Vorratslösung): 10 ml Eisessig ad 1000 ml 96%iger Alkohol 9.3 Siriusrot-Farblösung 1. 0,5 g Siriusrot F3B in 45 ml Aqua bidest. lösen; 2. 50 ml Ethanol hinzufügen; 3. 1 ml 1%ige NaOH (1 g NaOH ad 100 ml Aqua dest.) hinzufügen; 4. 20%ige NaCl-Lösung (20 g ad 100 ml Aqua dest.) tropfenweise hinzufügen, bis es zu einer leichten Präzipitation kommt, die auch nach wiederholtem Schwenken nicht mehr auflösbar ist (ca. 1,5 bis 3,5 ml); 5. Lagerung der Lösung bei Raumtemperatur über 24 Stunden mit anschließender Filtrierung 9.4 Lösungen für die Sondensynthese und- spezifizierung Church Puffer: 500 ml Natrium-Phosphat-Puffer (0,5 M pH 7.2) 2 ml EDTA (0,5 M) 10 g Bovine Serum Albumine Fraction V 70 g SDS ad 1000 ml Aqua bidest. Phosphat Puffer (0,5 M pH 7,2): Lösung A: 177,9 g Na2HPO4, 2H2O ad 1000 ml Aqua bidest. Lösung B: 137,99 g NaH2PO4, H2O ad 1000 ml Aqua bidest. Zur Herstellung von 1000 ml Natrium-Phosphat-Puffer (0,5 M pH 7,2): 342 ml Lösung A 158 ml Lösung B ad 1000 ml Aqua bidest. Kontrolle des pH-Wertes (pH 7,2) Anhang 111 9.5 Lösungen für die in situ-Hybridisierung Aqua bidest. DEPC (Diethylpyrokarbonat): 1 ml DEPC-Reinsubstanz ad 1000 ml Aqua bidest. autoklavieren TRIS HCl (Trishydroxymethylammoniumethan): MW 121,14, 1 M, pH 8,0 12,11 g/100ml Aqua bidest. pH 8,0 mit konzentrierter HCL einstellen CaCl2 (CaCl2 x H2O): MW 147,02 für Proteinase K: 0,1 M = 1,47 g/100 ml Aqua bidest. MgCl2 (MgCl2 x H2O): MW 203,30 für PBS/5 mM MgCl2: 1 M = 20,33 g/100 ml Aqua bidest. NaCl: MW 58,44 für Hybridisierungssalze: 5 M = 29,22 g/100 ml Aqua bidest. 2 N (= 2 M) HCl: für 0,2 N HCl: 50 ml 2 N HCl ad 500 ml Aqua bidest. 5 N (= 5 M) NaOH: MW 40,0 für EDTA-Na2-Lösung: 20 g NaOH-Plätzchen/100 ml Aqua bidest. EDTA: MW 372,3 Für 0,5 M EDTA, pH 8,0: 18,6 g di-Natrium-EDTA-di-Hydrat (= 14,6 g EDTA) 60 ml Aqua bidest. DEPC pH mit 5 M NaOH (ca. 10 ml) auf 8,0 einstellen ad 100 ml Aqua bidest. DPEC auffüllen und autoklavieren 112 Anhang PIPES (Piperazin-N,N´bis[2-ethansulfat]-Säure): MW 346,3 für Hybridisierungssalze: 0,5 M = 17,315 g/100 ml Aqua bidest. 10 x PBS (Phosphate buffered saline = Phosphat gepuffertes Natrium): 80,0 g NaCl 2,0 g KCl 14,4 g Na2HPO4 2,4 g KH2PO4 ad 1000 ml Aqua bidest., autoklavieren 1 x PBS: 16,0 g NaCl 0,4 g KCl 2,88 g Na2HPO4 0,48 g KH2PO4 ad 2000 ml Aqua bidest. pH 7,4 einstellen mit NaOH, autoklavieren 20 x SSC (standard saline citrate): 175,3 g NaCl 88,2 g Na-Citrat ad 800 ml Aqua bidest. pH mit 1 N HCl auf 7,0 einstellen auf 1000 ml mit Aqua bidest. auffüllen, autoklavieren Puffer 1: 12,11 g TRIS (wird 100 mM, MW 121,14) 8,77 g NaCl (wird 150 mM, MW 58,44) ad 1000 ml Aqua bidest. pH 7,5 einstellen mit konzentrierter HCl (37%ig), Feineinstellung mit 1 N HCl Anhang Puffer 3: 12,11 g TRIS (wird 100 mM, MW 121,14) 5,84 g NaCl (wird 100 mM, MW 58,44) ad 1000 ml Aqua bidest. pH 9,5 mit 1 N HCl einstellen, autoklavieren vor Gebrauch Zugabe von MgCl2+6H2O (MW 203,3) 1,2204 g/120 ml (wird 50 mM) Puffer 4: 1,21 g TRIS (wird 10 mM) 0,37 g EDTA (wird 1 mM, MW 372,3) ad 1000 ml Aqua bidest. pH 8,0 mit 2 N HCl einstellen, autoklavieren 1 x PBS + 5 mM MgCl2: 100 ml 10 x PBS 5 ml 1 M MgCl2 ad 1000 ml Aqua bidest. frisch zum Gebrauch ansetzten 2 x SSC + 5 mM EDTA-Na2: 200 ml Aqua bidest. Vorlegen 5 ml 0,5 M EDTA-Na2 50 ml 20 x SSC ad 500 ml Aqua bidest. 0,2%iges Glycin in 1 x PBS: 1 g Glycin 500 ml 1 x PBS pH 7,4 autoklavieren 4%iges Paraformaldehyd (PFA): 20 g Paraformaldehyd zunächst in 400 ml 1 x PBS lösen bei 60°C auf dem Magnetrührer pH auf 7,35-7,40 einstellen mit 1 N HCl auffüllen mit 1 x PBS auf 500 ml 113 114 Anhang 50 x Denhardts: 5 g Ficoll 5 g Polyvinylpyrolidone 5 g BSA ad 500 ml Aqua bidest./steril 50 ml Aliquots lagern bei –20°C 20 x Hybridisierungssalze: 10 ml 0,5 M EDTA pH 8,0 (wird 0,1 M) 10 ml 0,5 M PIPES pH 7,0 (wird 0,1 M) 30 ml 5 M NaCl lagern bei –20°C Prähybridisierungs-Mix: 450 ml 20 x SSC 675 ml 100%iges Formamid, deionisiert 150 ml 50 x Denhardts 210 ml Aqua bidest. DEPC macht 1485 ml = 30 Aliquots á 49,5 ml, lagern bei –20°C Hybridisierungs-Mix: 16 ml 100%iges Formamid, deionisiert 8 ml Hybridisierungssalze 3,2 ml 50 x Denhardts 320 µl Heparin 320 µl 10%iges Triton-X-100 (autoklaviert und verdünnt!) macht 27,84 ml = 40 Aliquots á 696 µl, lagern bei –20°C ssDNA: lösen in Puffer 4, pH 8,0 auf 10 mg/ml Endkonzentration Proteinase K: Lösen in 10 mM TRIS-HCl, pH 7,5 (Konzentration je Stocklösung 14 bis 22 mg/ml) RNA: Stammlösung mit Aqua bidest. DEPC herstellen: 10 mg/ml Anhang 115 Farblösung: Nitroblautetrazoliumchlorid (NBT): 1 g NBT ad 13,3 ml 70%iges Dimethylformamid (Stammlösung mit 75 mg/ml Endkonzentration 5-Brom-4-Chlor-3-Indolyl-Phosphat (X-Phosphat, BCIP): 500 mg X-Phosphat ad 10 ml 100%iges Dimethylformamid (Stammlösung) Dimethylformamid (DMF): 70%ig: 14 ml DMF plus 6 ml Aqua bidest. 9.6 Lösungen für die Immunhistochemie 1 x PBS (Phosphate buffered saline = Phosphat gepuffertes Natrium): 40,0 g NaCl 7,8 g NaH2PO4 ad 5000 ml Aqua dest. pH 7,1 einstellen mt NaOH ABC-Gebrauchslösung: 1 ml 1 x PBS 20 µl Lösung A, gut mischen 20 µl Lösung B, gut mischen 30 Min. vor Gebrauch ansetzen DAB-Stammlösung: 100 mg DAB in 50 ml 1 x PBS Lagerung bei -20°C vor Gebrauch im Dunkeln auftauen lassen DAB-Gebrauchslösung: 50 ml Stammlösung in 150 ml 1 x PBS Lösung filtrieren Zugabe von 3 ml 3%gem H2O2 9.7 Bezugsquellen für Chemikalien Biologo, Kronshagen Aszitesflüssigkeit von nicht-immunisierten Balb/C Mäusen, Best. Nr. CL8100 116 Anhang Chemicon international, Temecula (California, USA) Maus anti-Mycoplasma bovis monoklonaler Antikörper MAB970, Best. Nr. 23040988 Merck KGaA, Darmstadt CaCl2 (CaCl2 x 2H2O) (Calciumchloriddihydrat) p. a., Best. Nr. 1-0 2382.0500 Dimethylformamid (DMF), Best. Nr. 1.03034.1000 Eisessig, Best. Nr. 1.00056.2500 Eosin (gelblich), Best. Nr. 1.15935.0100 Foramid p. a., Best. Nr. 1.09684.2500 Formaldehydlösung, mind. 37%., Best. Nr. 1.03999.2500 Glycin p. a., Best. Nr. 1.04201.1000 2 N HCl (Salzsäure), Best. Nr. 1.09970.1000 Isopropanol reinst., Best. Nr. 1.00995 KCl (Kaliumchlorid), Best. Nr. 1.04936.0500 KH2PO4 (Kaliumhydrogenphosphat), Best. Nr. 1.04873.0250 MgCl2 (MgCl2 x 6H2O) (Magnesiumchlorid-Hexahydrat) p.a., Best. Nr. 1.05833.0250 N,N-Dimethylformamid, Best. Nr. 3034 NaCl (Natriumchlorid), Best. Nr. 1.06400.2500 NaOH (Natriumhydroxidplätzchen) p.a., Best. Nr. 1.06498.0500 Orange G, Best. Nr. 1.15925.0025 Pyridin p.a., Best. Nr. 1.09728.0500 Salzsäure (HCl) 25%ig reinst., Best. Nr. 1.00312.2500 Triethanolamin (TEA) p. a., Best. Nr. 1.08379.0250 TRIS HCl (Trishydroxymethylamoniumethan), Best. Nr. 1.08386.1000 Triton X 100 p. a., Best. Nr. 1.08603.1000 Wasserstoffperoxid 30% H2O2 (Perhydrol®) p.a., Best. Nr. 1.07209.0250 MADI Dyes and Indicators, Dülmen Siriusrot F3B, Best. Nr. 10-280 QBIOgene, Heidelberg Formamid deionisiert, Best. Nr. FORMID003 Anhang 117 Roche Diagnostics GmbH, Mannheim Anti-DIG-AK-AP: Anti-Digoxigenin-Antikörper, konjugiert mit Alkalischer Phosphatase, Best. Nr. 1 093 277 Heparin: Liquemin N 25.000, Best. Nr. G-067 741 Proteinase K, Best. Nr. 1 373 196 Roth C. GmbH & Co. KG, Karlsruhe Essigsäurebutylester (EBE), Best. Nr. 4600.7 Ethanol, vergällt, Best. Nr. K928.2 Hämalaunlösung sauer nach Mayer, Best. Nr. T865.2 Natriumchlorid (NaCl), Best. Nr. P029.2 Na2HPO4, Best. Best. Nr. 4984.1 2-Propanol (Isopropanol), Best. Nr. 9866.4 Roti®-Histol, Best. Nr. 6640.01 Roti®-Plast, Gewebeeinbettungsmedium, Best. Nr. 6642.6 Rotiprotect®-Nitrilhandschuhe, Best. Nr. P777.1 Salzsäure Rotipuran® 25% p.a., Best. Nr. 6331.3 SDS, Best. Nr. 4360,1 Tri-Natrium-Di-Hydrat p. a., Best. Nr. 3580 Tris-(hydroxymethyl)-aminomethan, TRIS Ultra Qualität, Best. Nr. 5429.3 Serva Feinbiochemica GmbH und Co Kg, Heidelberg Bovine Serum Albumine Fraction V, Best. Nr. 11927 EDTA (Etylendiamintetraessigsäure-Disodium) p. a., Best. Nr. 11280 Glycin p. a., Best. Nr. 23390 Sigma-Aldrich Chemie GmbH (ehemals Sigma, Fluka, Riedel de Haën), Taufkirchen Acetanhydrid, Best. Nr. 45830 Anilinblau, Best. Nr. 61335 5-Brom-4-Chlor-3-Indolyl-Phosphat (X-Phosphat, BCIP), Best. Nr. B-6777 BSA (bovines Serum-Albumin), Best. Nr. A-2153 3,3’-Diaminobenzidin-tetrahydrochlorid Dihydrat purum (DAB) p.a., Best. Nr. 32750 118 Anhang Diethylpyrokarbonat (DEPC-Reinsubstanz), Best. Nr. 32490 Dextransulfat, Best. Nr. 31403 Ficoll, Best. Nr. F-2637 Levamisol, Best. Nr. L-9756 Na2HPO4, Best. Nr. 71642 Neutrales Schafserum (NSS), Sheep Serum steril filtered, Best. Nr. S-2263 Nitroblau-Tetrazoliumchlorid (NBT), Best. Nr. N-6639 Paraformaldehyd, Best. Nr. 76240 PIPES (Piperazin-N,N´bis[2-ethansulfat]-Säure), Best. Nr. P-3768 Polyvinylpyrolidone, Best. Nr. P-5288 RNA, „ribonucleic acid type IV from calf liver“, Best. Nr. R-7250 ssDNA (Deoxyribonucleic acid Sodium Salt Type XIV from Herring Testes), Best. Nr. D-6898 TRIS HCl (Trishydroxymethylammoniumethan), Best. Nr. 93352Azokarmin G, Best. Nr. S-581305 Vector Laboratories Inc., Burlingame, CA, USA, über Biologo, Kronshagen Vectastain Elite ABC-Kit, Best. Nr. PK-6100 9.8 Bezugsquellen für Geräte und Einmalartikel Gerhard Menzel Glasbearbeitungswerk GmbH & Co. KG, Braunschweig SuperFrost®Plus Objektträger, Best. Nr. 041300 Carl Zeiss AG, Oberkochen Standard-Binokular-Lichtmikroskops Mikroskop Axiophot DakoCytomation GmbH (ehemals Dako® Diagnostika GmbH), Hamburg Glycergel, Eindeckmedium, Best. Nr. C 0563 DAKOPATTS DakoCytomation Pen, Best. Nr. S2002 FMC® bioproducts, Göttingen Gel-Bond®-Film, Best. Nr. 53748 Hecht, Kiel-Hassee Corbit-Balsam, Eukitt® Anhang Heraeus Sepatech GmbH, Osterode Zentrifuge Labofuge®A, 2500 Wärmeschrank ST 6200 Kodak GmbH, Stuttgart Elite Chrome 160 T Diafilmen Leica Microsystems Nussloch GmbH, Nussloch Färbegerät Leica ST 4040 Marabuwerke GmbH & Co KG, Tamm Fix-O-Gum®, Best. Nr. 290117000 Medite Medizintechnik, Burgdorf Objektträger-Eindeckautomat Promounter RCM 2000 Memmert GmbH & Co. KG, Braunschweig Wasserbad WB 22 Wasserbad WB 45 Microm International GmbH, Walldorf Schlittenmikrotom HM 400 Olympus Deutschland GmbH, Hamburg Mikroskop IX 70 Polaroid, Massachusetts, USA Kamera MP 4 Sartorius AG, Göttingen Elektronische Präzisionswaage L310, WL-6006-m88091 Papierfaltenfilter 270 mm Durchmesser, FT-4-303-270 Systec GmbH, Wettenberg Autoklav 3850 ELC Thermo Electron GmbH, Dreieich Shandon CoverplatesTM, 72110013 Shandon Sequenza® Slide Racks (Einsätze für Coverplates), 7331017 Pathcentre (Gewebeeinbettungsapparat) Vogel GmbH & Co. Kg, Gießen Tissue-Tec® TECTM 5, Einbettsystem 119 120 Anhang W. Knittel Glasbearbeitungs GmbH, Braunschweig Deckgläser (24 x 50 mm) Ziegra-Eismaschinen GmbH, Isernhagen Eismaschine ZBE 70-35 Zu guter letzt bedanke ich mich bei …Frau Prof. Dr. Marion Hewicker-Trautwein für die Überlassung des Themas und die jederzeit gewährte Hilfe und Unterstützung bei der Durchführung und Ausarbeitung dieser Arbeit, sowie die zügige und kooperative Durchsicht des Manuskriptes. …der Arbeitsgruppe von Frau Prof. Dr. Renate Rosengarten aus dem Institut für Bakteriologie, Mykologie und Hygiene der Veterinärmedizinischen Universität in Wien, namentlich Dr. Wolfgang Jechlinger, Dr. Joachim Spergser und Martina Zimmermann, für die Zusammenarbeit bei der Synthese und Spezifizierung der Sonden. …Frau Danuta Waschke für die Einweisung in die Geheimnisse der in situHybridisierung. …Herrn Klaus-Peter Kuhlmann für die Unterstützung bei der Beschaffung aller Materialien sowie die Einarbeitung in die Immunhistochemie. …meinen alten und neuen Mitbewohnern und Nachbarn im „Großraumbüro“ Dirk, Doris, Evi, Frauke, Katharina und Verena für den notwendigen Spaß bei der Arbeit. …Frauke für die kritische Durchsicht des Manuskripts. …der Arbeitsgruppe Immunpathologie für das unkomplizierte Miteinander. …allen weiteren Mitarbeitern des Instituts für Pathologie für das angenehme Zusammenarbeiten. …der Friedrich-Ebert-Stiftung für die finanzielle Unterstützung im Rahmen eines Promotionsstipendiums und die interessanten Seminare auf dem Venusberg. …meinen Eltern und Frank, die mich doch immer wieder alles tun lassen, was ich mir so überlege, und ich trotzdem mit ihrer Unterstützung rechnen darf. M. bovis ISH Aus dem Institut für Pathologie der Tierärztlichen Hochschule Hannover ISBN 3-939902-10-1 Verlag: DVG-Service GmbH Frankfurter Straße 89 · 35392 Gießen Telefon (06 41) 2 44 66 · Telefax (06 41) 2 53 75 · E-mail: [email protected] · http://www.dvg.net Björn Jacobsen 2006 Nachweis von Mycoplasma bovis in der Lunge von experimentell infizierten Kälbern mittels in situ-Hybridisierung INAUGURAL-DISSERTATION zur Erlangung des Grades eines Doktors der Veterinärmedizin Björn Jacobsen Hannover 2006