03.07.2012: Zusammenfassung: 1. Hauptsatz der
Werbung

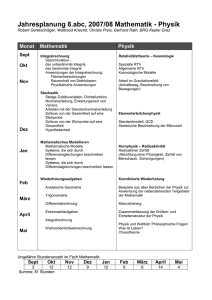
Physik II - Ergänzungen 29. Juni 2012 Experimentalphysik IV 1. Hauptsatz der Thermodynamik Innere Energie U kann sich nur durch den Transport von Energie in Form von Arbeit W oder Wärme Q über die Grenzen des Systems ändern. Innere Energie ≡ Gesamtenergie des Systems: Energie: Ein Maß für die Arbeit, die ein System verrichten kann 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 2 1. Hauptsatz der Thermodynamik Änderung der Inneren Energie: Wärme: chaotische, statistische Teilchenbewegung Arbeit: Gerichtete Teilchenbewegung Zustandsgröße: Nur vom Systemzustand abhängig extensiv: Systemumfang: Masse, Volumen, Energie intensiv: Lokal: Druck, Temperatur, Dichte Phase: Homogenes Teilsystem, intensive ZG‘s sind gleich 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 3 Beispiel: Phasendiagramm Wasser 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 4 Wärmekapazität Kalorische Zustandsgleichung: Änderung der Inneren Energie: Allgemeine Beschreibung der Wärmekapazität: Es gibt unterschiedliche Bedingungen, bei denen Wärme zuoder abgeführt werden kann: isochor oder isobar 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 5 Joule‘s Experiment Gas Vakuum Wasserbad Expansion Gas Gas Wasserbad 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 6 Joule‘s Experiment: Folgen Kein Wärmeaustausch mit der Umgebung, da Gas leistet keine Arbeit an seiner Umgebung Resultiert aus dem 1. Hauptsatz der Thermodynamik Zwei Zustände identischer Temperatur aber unterschiedlichen Volumina haben die gleiche Innere Energie U. Da U eine Zustandsfunktion ist und T, V voneinander unabhängige Variablen sind folgt, dass die Innere Energie eines idealen Gases nur von der Temperatur abhängt, d.h.: 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 7 Wärmekapazität Differentielle Änderung der Inneren Energie: Erster Hauptsatz der Thermodynamik: Allgemeiner Ausdruck: 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 8 Wärmekapazität Für ein konstantes Volumen wird der 2. Term null, es folgt: Für das Differential vom Volumen gilt allgemein: V=V(p,T) Daraus folgt: 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 9 Wärmekapazität Für konstanten Druck folgt: Vergleiche Joule‘s Experiment Folgt aus der idealen Gasgleichung Eingesetzt folgt somit für die Wärmekapazität: 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 10 Isotherme Zustandsänderung Keine Änderung der Inneren Energie: Aus dem 1. Hauptsatz folgt somit: Unter Berücksichtigung der idealen Gasgleichung: 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 11 Isochore Zustandsänderung Keine Volumenarbeit, es folgt aus dem 1. Hauptsatz:: 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 12 Adiabatische Zustandsänderung Kein Austausch von Wärme mit der Umgebung: Aus dem 1. Hauptsatz folgt somit: 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 13 Adiabatische Zustandsänderung Einführung des Adiabatenexponenten Gamma: Es resultiert die Adiabatengleichung: 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 14 Zusammenfassung: ZS-Änderungen Isochor Konstantes Volumen Isotherm Konstante Temperatur adiabatisch Kein Wärmeaustausch („nicht hindurchgehen“) Eigenschaft Wärmemenge 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 15 Literatur K. Huang, Statistical Mechanics 2nd. Edition, WILEY 1963 P. Atkins, J. de Paula, Physical Chemistry 8th Edition, Oxford 2006 Vorlesungsskript: K.-H. Kampert, Experimentalphysik für Bauingenieure SoSe 2001 2012-06-29 Dennis Holzinger – Physik II - Ergänzung 16